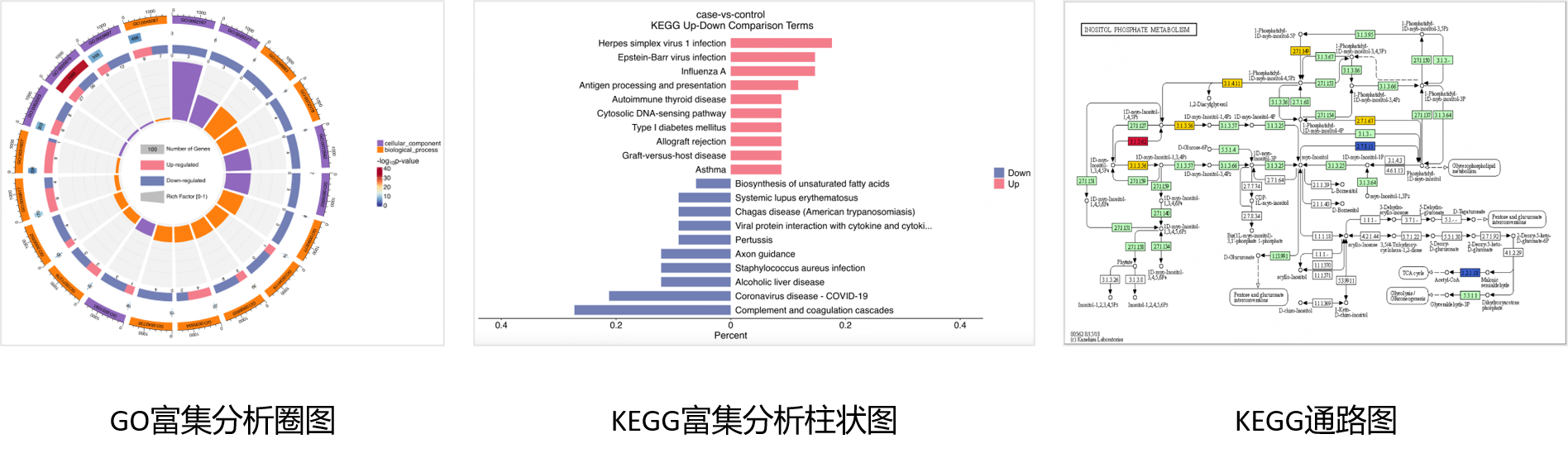
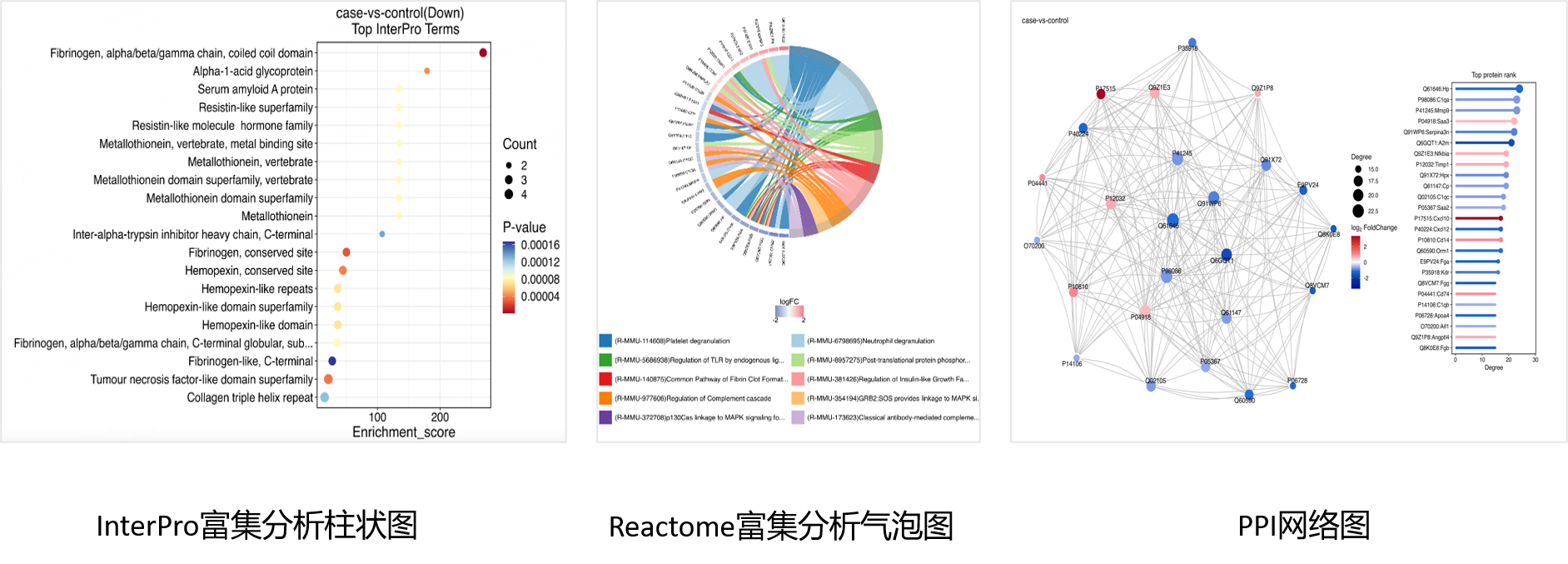
「案例分享」
Lysyl hydroxylase LH1 promotes confined migration and metastasis of cancer cells by stabilizing Septin2 to enhance actin network
赖氨酰羟化酶LH1通过稳定Septin2增强肌动蛋白网络,促进癌细胞的受限迁移和转移
发表期刊: Molecular Cancer | IF:37.3 | 实验材料: 人类肝癌和胰腺癌细胞系
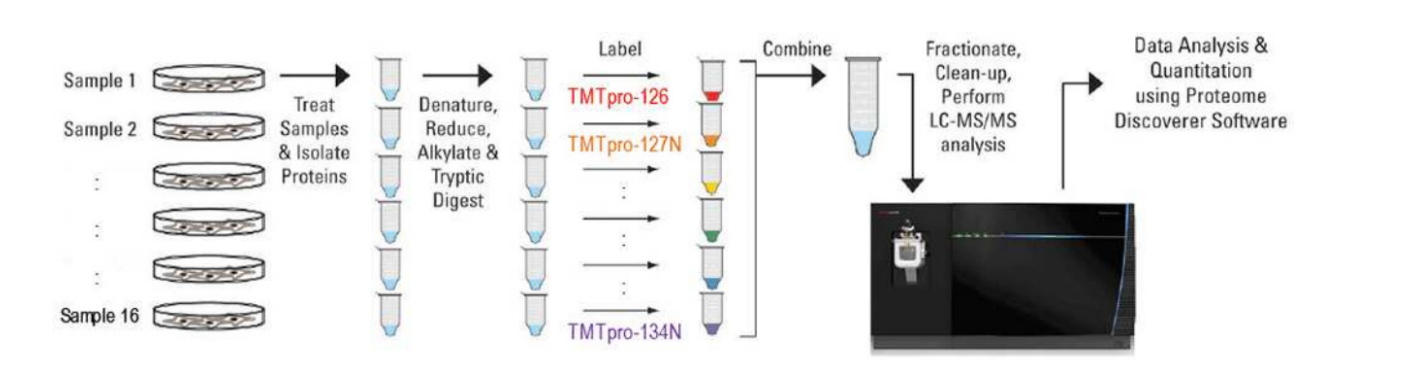
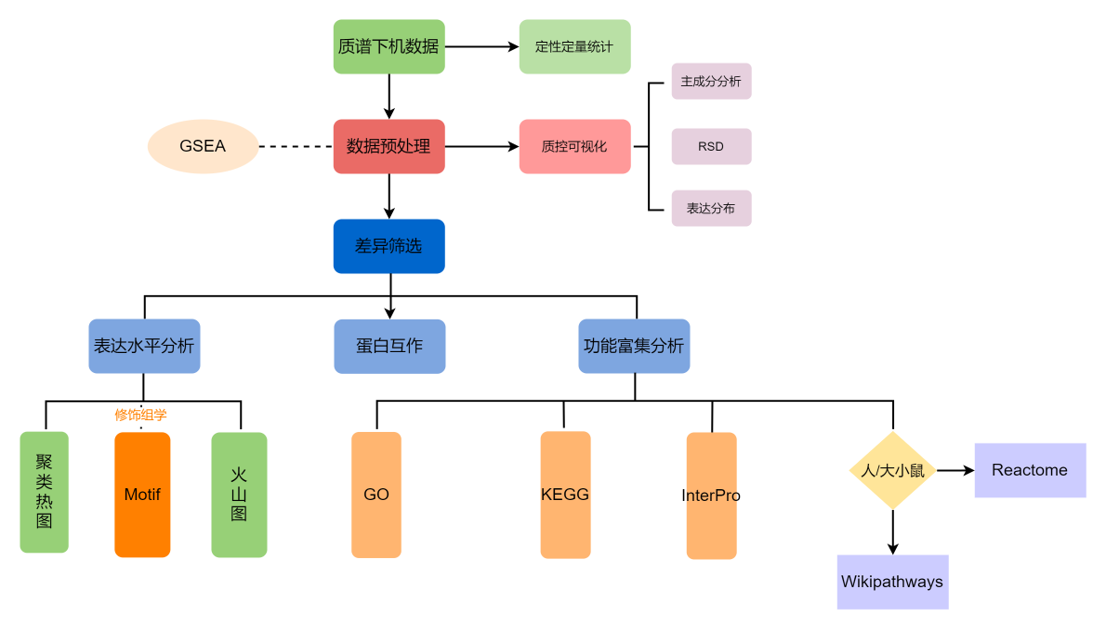
研究流程
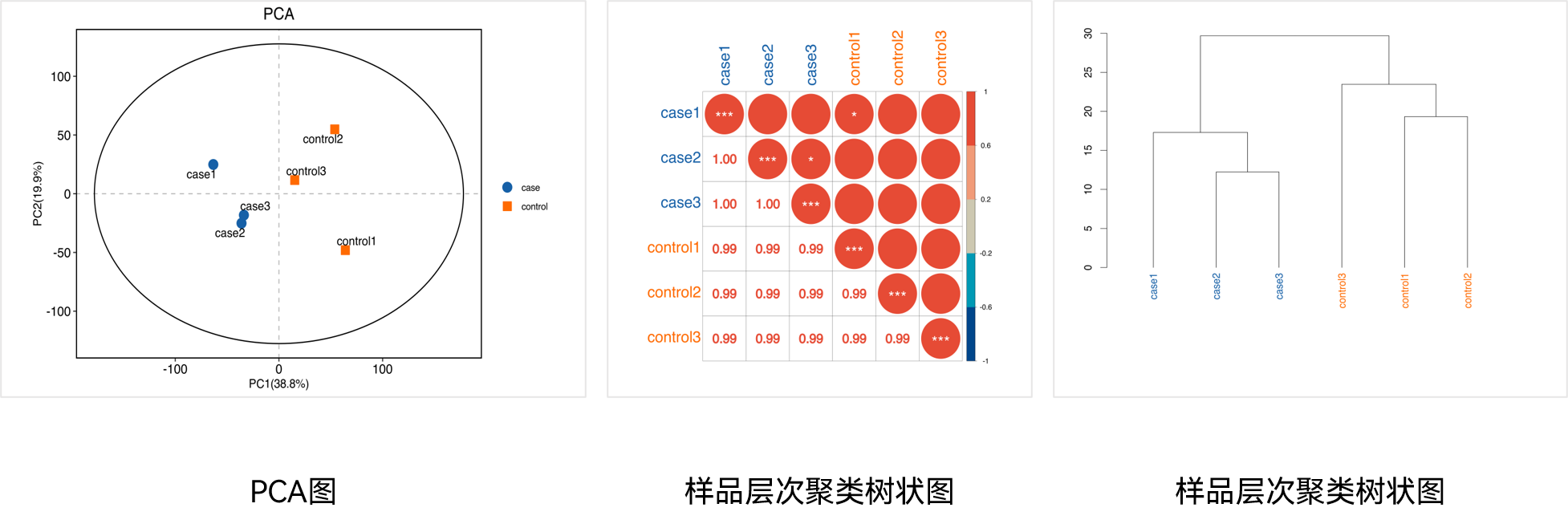
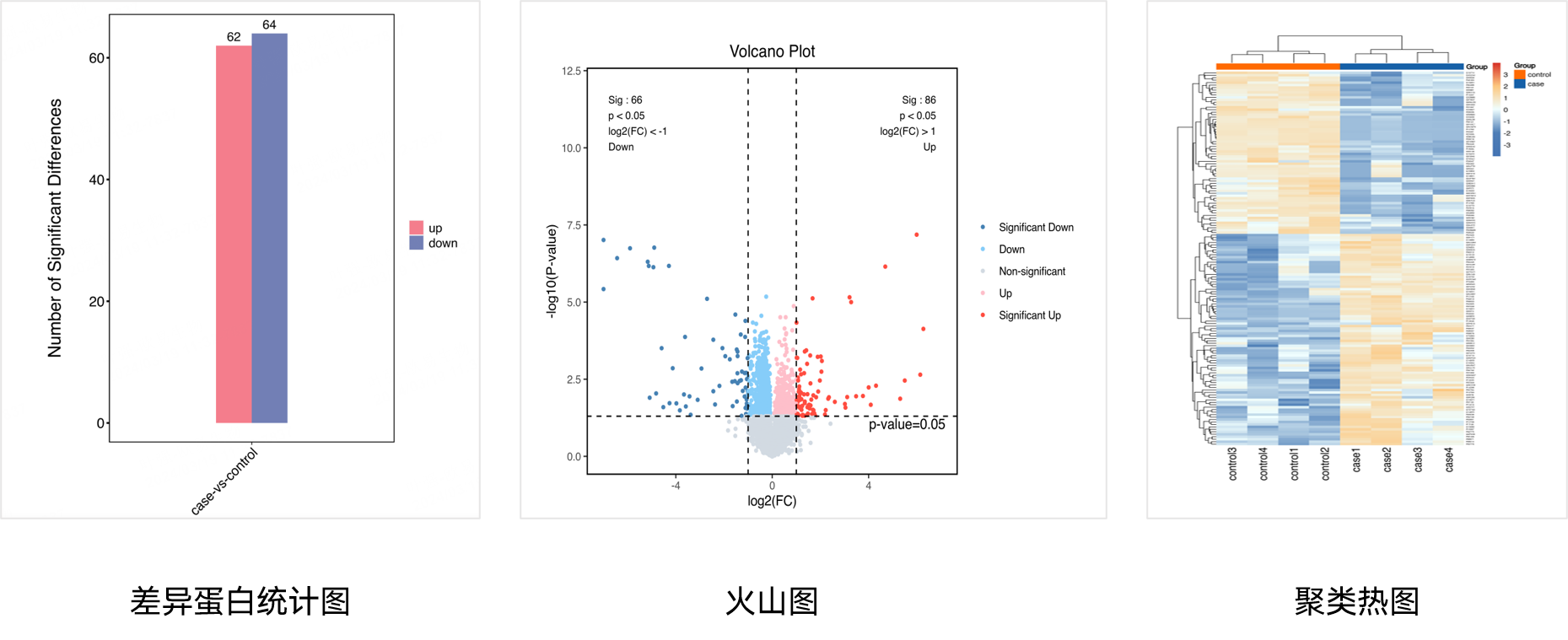
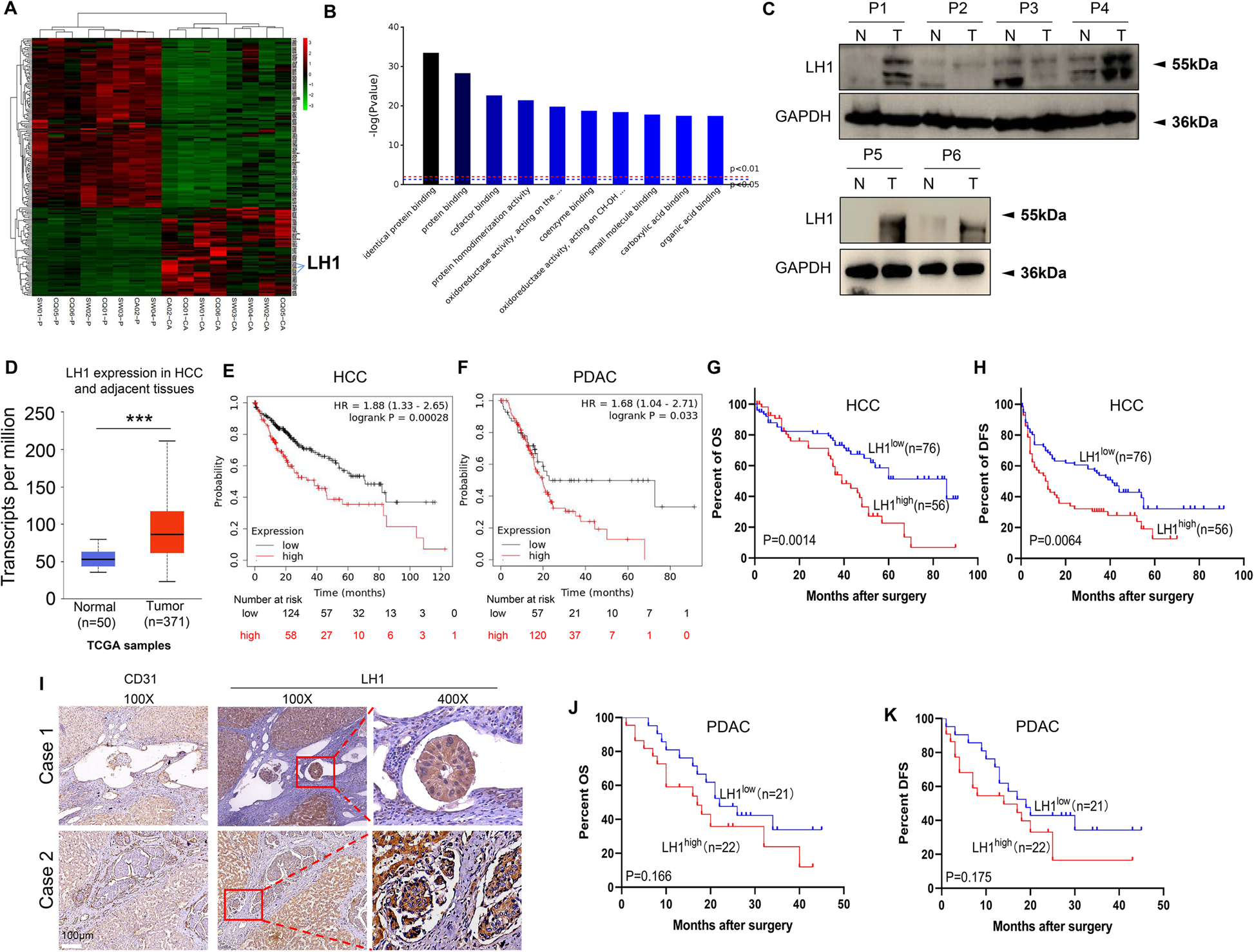
该研究通过对8个HCC组织及相应癌旁组织的蛋白组学分析,发现LH1是HCC组织中过表达最显著的蛋白之一,通过Western blot证实了LH1在HCC组织中高表达。此外,根据癌症基因组图谱(TCGA)数据,LH1似乎在HCC肿瘤中高表达(n = 371)。KM-plotter分析显示,LH1高表达与HCC、PDAC、胃腺癌和肺腺癌患者预后不良有关。上述研究结果揭示了LH1的表达水平与HCC和PDAC患者的大血管侵犯和预后不良有关。
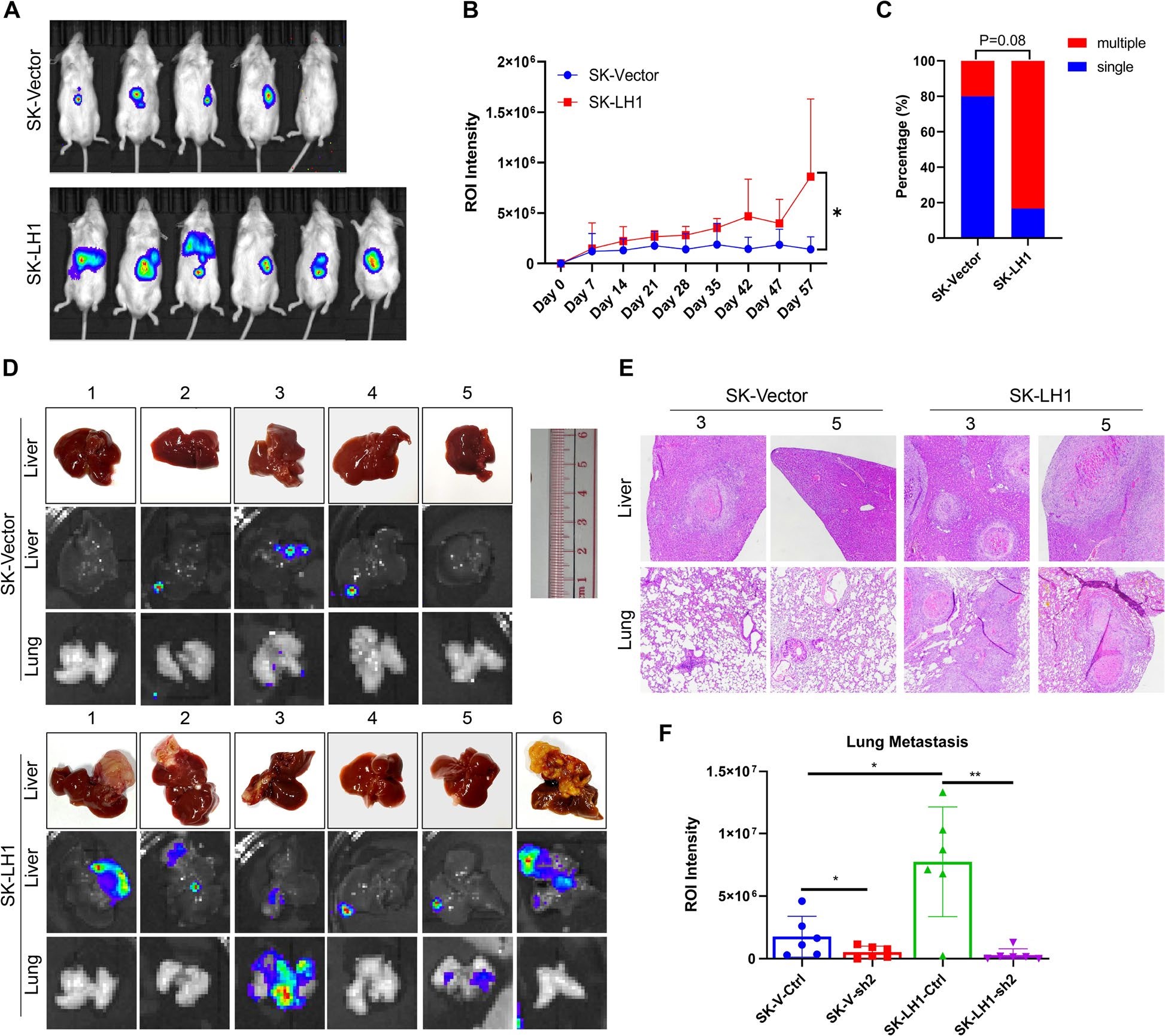
研究采用肝原位注射模型,将LH1过表达和载体SK-Hep1细胞注射到非肥胖严重糖尿病合并免疫缺陷(NOD-SCID)小鼠的肝脏。研究结果发现过表达LH1的细胞可以形成更大的肿瘤块。来源于LH1过表达细胞的肿瘤大多形成了多个结节,且发生肺转移灶。HE染色证实,过表达LH1组形成肝脏肿瘤和肺转移更多。最后,IHC染色显示LH1和SEPT2在原发肿瘤和转移灶中均高表达。上述研究结果证明了LH1能够促进HCC细胞的体内转移。
研究结论
这项研究通过蛋白质组学分析发现LH1在HCC组织中过表达,LH1高表达与HCC和PDAC患者预后不良均相关,发现LH1在三维仿生模型中可以增强细胞的侵袭,在更硬的环境中形成球体和体内转移。证明LH1增加了SEPT2的稳定性,从而促进了Septin与F-actin网络的形成,以及HCC和PDAC细胞的受限迁移,这为癌症治疗带来新方向。
文章解读
https://mp.weixin.qq.com/s/BbdXKG_D5By_i8hIH2ARdg