子宫腺肌症(AM)是常见的良性慢性妇科疾病,目前对于这种疾病的确切发病机制尚不清楚。单细胞 RNA 测序(scRNA-seq)技术可以揭示罕见的亚群,探索遗传和功能的异质性,并揭示每个细胞的独特性。因此,本文作者利用单细胞转录组测序技术在单细胞水平上识别异位病变和正位子宫内膜之间的基因表达模式的变化,并探索一种潜在的新的 AM 发病机制。本文单细胞测序和分析部分由欧易生物提供技术支持。

基本信息
样本类型:子宫内膜样本(正常、正位、异位),2 患者 3 样本
发表期刊:Cell & Bioscience
影响因子:5.026
主要结果
1. AM 样本正位内膜和异位内膜的 scRNA-seq 分析
作者分别对 AM 患者正常的子宫内膜(AM-Ctrl)、正位内膜(AM-EM)和异位内膜(AM-EC)组织进行单细胞转录组测序,质控完成后,最终保留 36781 个细胞用于后续分析。t-distributed stochastic neighbour embedding (t-SNE) 得到 17 个 clusters,并最终通过 marker 基因确定细胞类型(Fig1 b-f)。
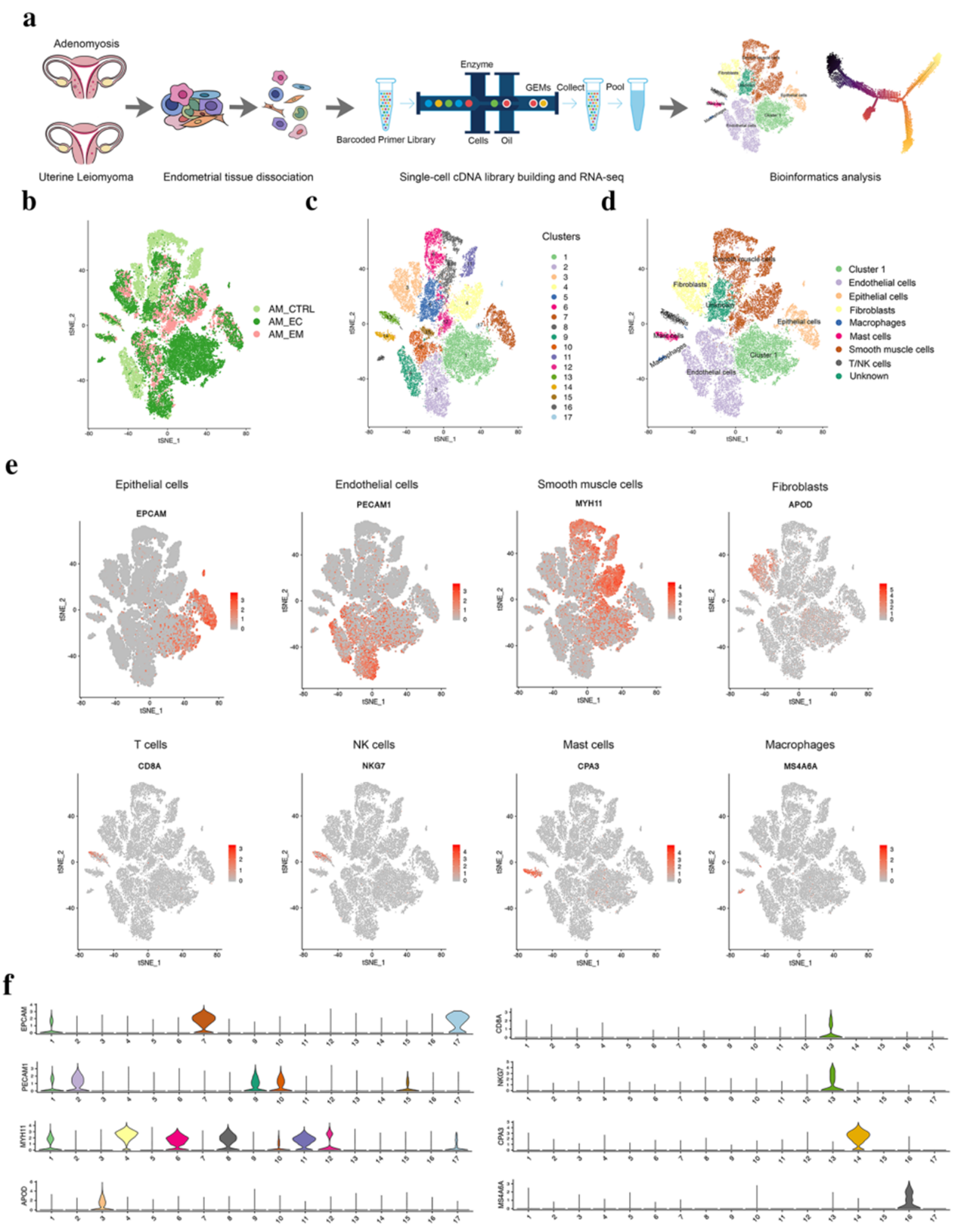
Fig1:单细胞转录组测序鉴定子宫内膜细胞类型
2. Cluster1 具有上皮和内皮共定位和高 CNV 水平的特点
通过对各细胞类型分析,发现 cluster1 在三个组之间分布存在显著差异,且在 AM_EC 中占比最高(Fig2 a, b),提示 cluster 1 可能与 AM 密切相关。此外通过标志基因的表达(EPCAM、PECAM1)发现 cluster1 中两种细胞共定位,且 AM_EC 组的共定位细胞数量大于 AM_CTRL 和 AM_EM 组(Fig2 c-f)。GO 和 KEGG 分析发现,cluster1 主要富集 cancer-、cell motility-、inflammation-associated terms,提示 cluster1 具有恶性特征,并通过 CNV 证实了这一点(Fig2 g-i)。
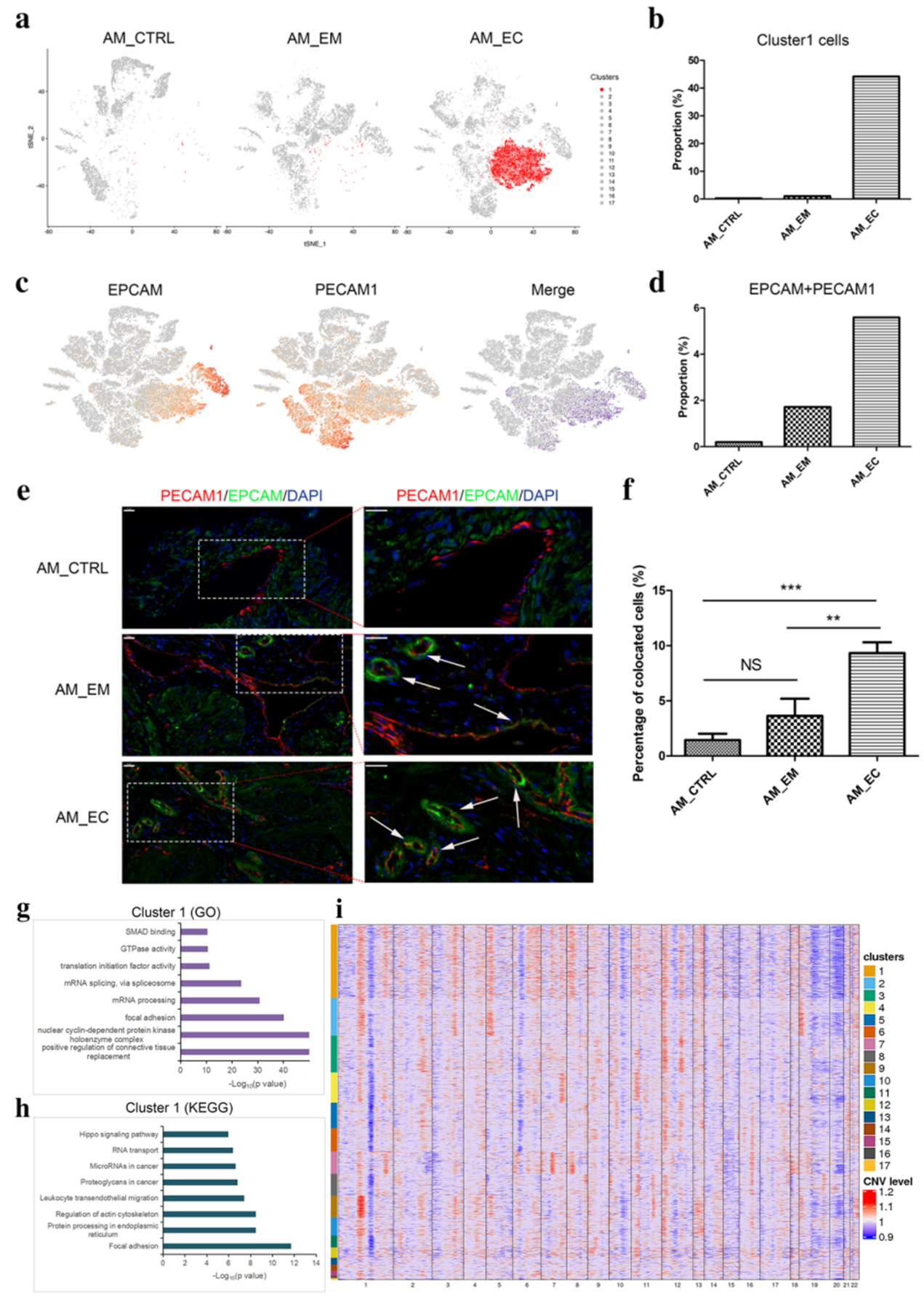
Fig2:以高 CNV 水平为特征的 EPCAM+ 和 PECAM1+ 细胞在 cluster 1 中共定位
3. AM_CTRL、AM_EM 和 AM_EC 基因表达特征分析
这部分作者主要聚焦在正位和异位内膜的差异,发现 AM_EC 中 MMP1,ESM1,ANGPT2,CYP1B1 等表达上调(Fig3 a),通过对内皮细胞组间差异基因的 GO 和 KEGG 的分析,发现 AM_EC 组富集炎性、细胞迁移和血管生成相关的 term 或 pathway,提示 AM_EC 中的内皮细胞具有恶性特征(Fig3 b, c)。
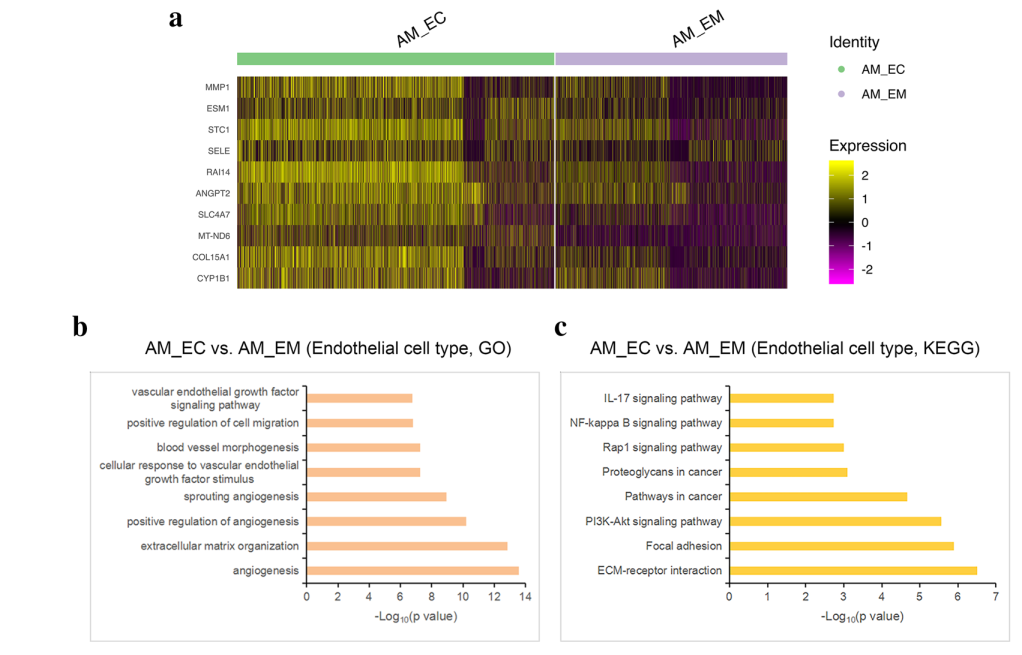
Fig3:AM_EM 和 AM_EC 基因表达特征分析
4. 上皮细胞亚群的特征分析
在上皮细胞群中,与 AM_EM 组相比,AM_EC 主要高表达细胞迁移相关的基因 (Fig4 a-c),表明来自 AM 的上皮细胞具有较高的运动性。此外通过对上皮细胞进行 subcluster 的分析,发现 subcluster1 高表达迁移相关基因,且这群细胞主要富集在 AM_EC 中,提示上皮细胞中存在一种高迁移能里的细胞,以此促进疾病的发展(Fig4 d-h)。
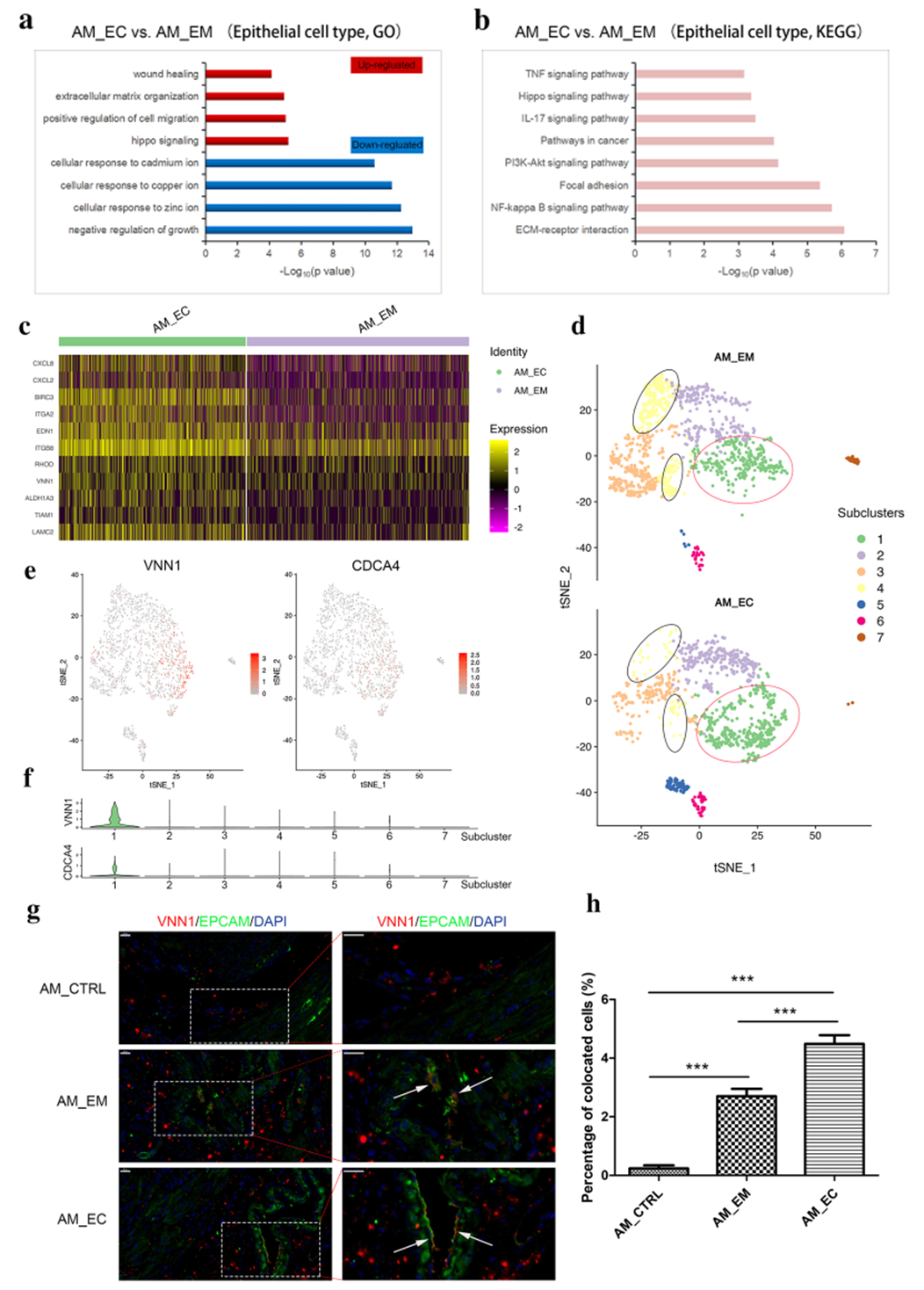
Fig4:上皮亚型的特征分析
5. 拟时序分析揭示上皮向内皮细胞的转变
为了更好地探究上皮和内皮之间的过渡特征,作者用上皮细胞,cluster1(上皮内皮共定位细胞)和内皮细胞进行拟时序分析,发现 AM_EC 中确实存在上皮细胞和内皮细胞的转变(Fig5 a, b),并发现这一过程中血管生成和 vasculogenic mimicry(VM)相关基因的波动表达(Fig5 e)。
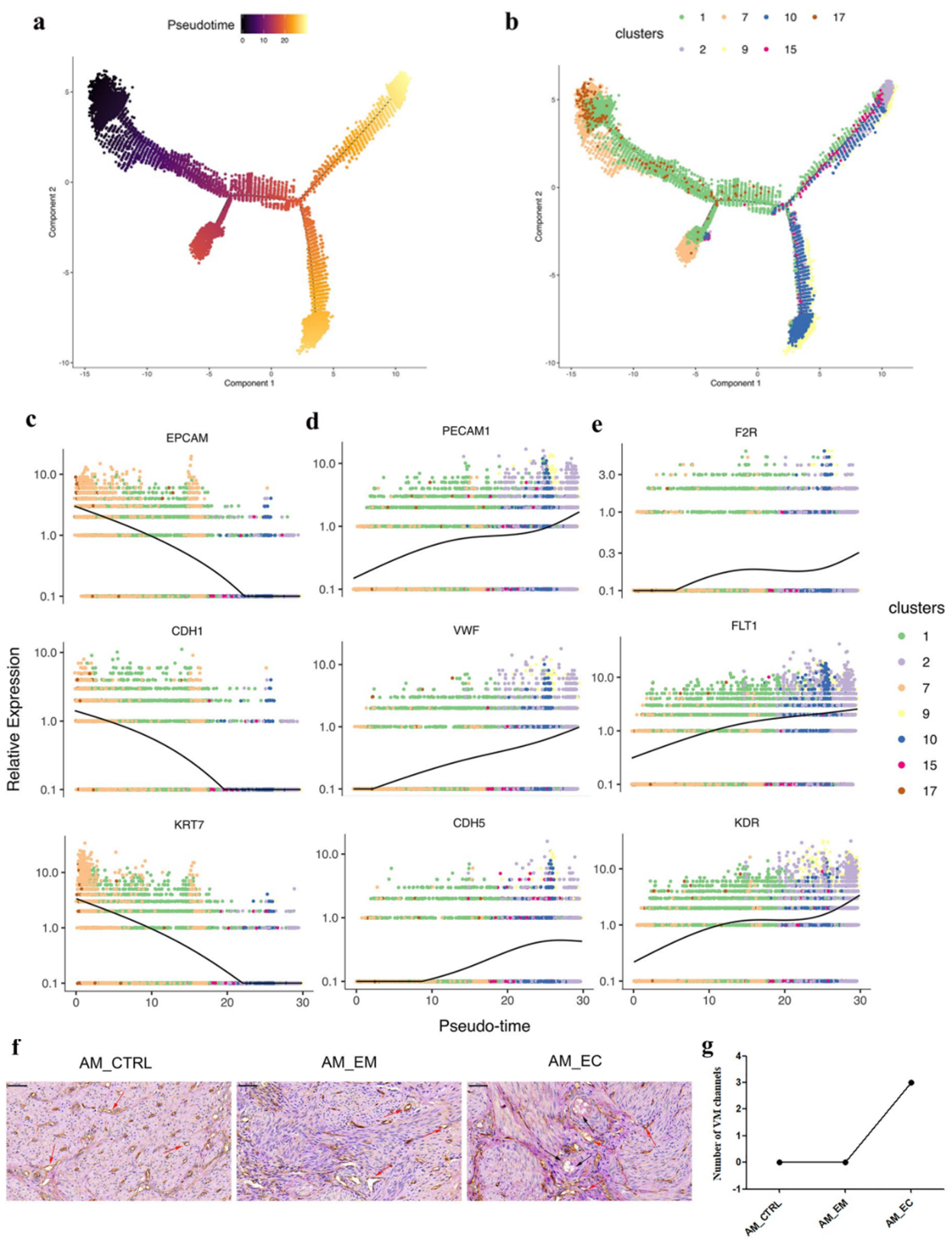
Fig5:拟时序分析重建 EET 分化轨迹
文章结论
本文支持了子宫腺肌症来源于子宫内膜的侵袭和迁移的理论。发现了具有高 CNV 水平和肿瘤相关特征的细胞亚簇。此外,肿瘤中上皮-内皮细胞转变(EET)和 VM 的形成也在 AM 中被实,其中 VM 促进血液供应,在维持细胞生长中发挥重要作用。综上,抑制 EET 和 VM 形成可能是一种潜在的预防 AM 的策略。本文为后人对 AM 的探究提供重要参考价值。
参考文献
Liu Z, Sun Z, Liu H, Niu W, Wang X, Liang N, Wang X, Wang Y, Shi Y, Xu L, Shi W. Single-cell transcriptomic analysis of eutopic endometrium and ectopic lesions of adenomyosis. Cell Biosci. 2021 Mar 8;11(1):51. doi: 10.1186/s13578-021-00562-z. PMID: 33685511; PMCID: PMC7938473.






