单细胞样本悬液的制备一直是很多老师进行样本制备的难题之一。在本篇文章中,小欧针对人胰腺样本不同状态的组织制备单细胞悬液的方法进行了汇总及详细描述,各位老师不要错过~
状态一、整个组织中大比例颜色偏白,紧致
这一类外观的胰腺组织通常能以常规的解离方法制成单细胞悬液。
解离方法:组织剪碎成2-3mm的大小,选择0.1%胶原酶1,37℃消化30分钟后,luna镜检可发现视野中大比例为正常形态细胞。经过筛和差速离心洗涤后,可以获得正常的细胞沉淀(细胞量的多少取决于组织自身的细胞量及状态),后续可根据细胞悬液的各项数值,通过相应的处理方法尽量调整至10x油包水上机标准。
1、多个组织图片
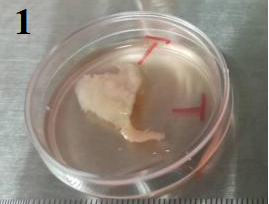
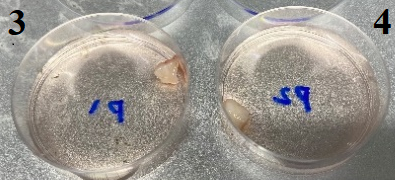

2、初步消化后镜检图片
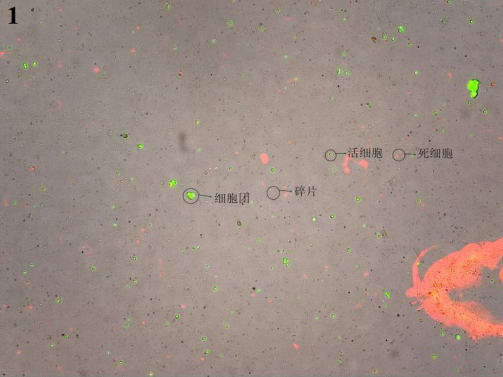




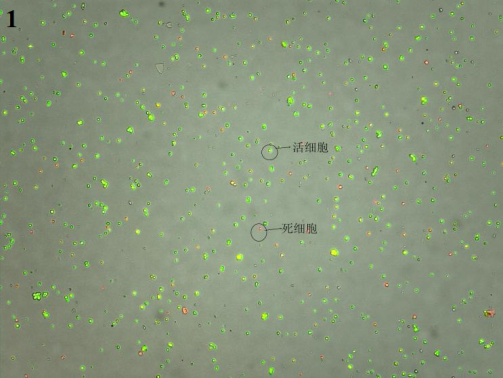
3、最终细胞悬液镜检图片

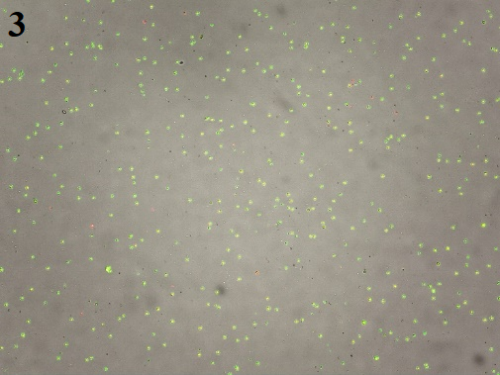
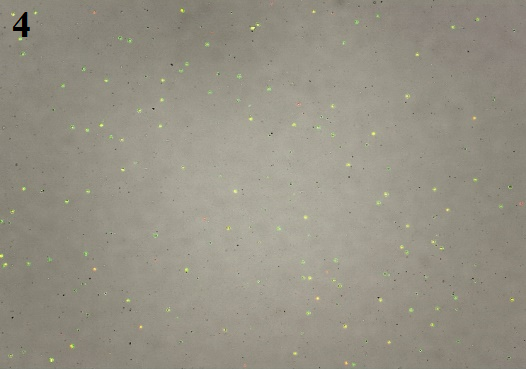
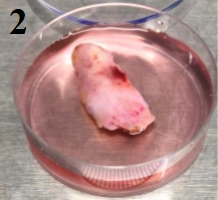
状态二、整个组织颜色偏红,松软
这类型的胰腺组织在消化时也通常能以常规的解离方法制备单细胞悬液。
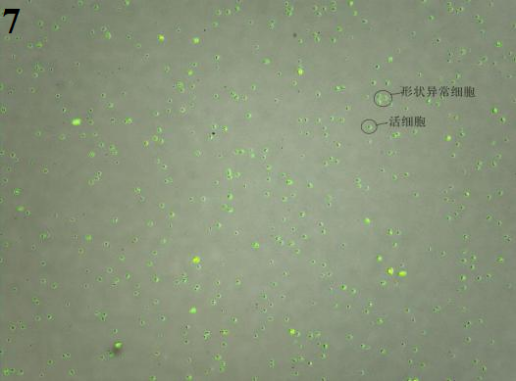
解离方法:组织剪碎成2-3mm大小,选择0.1%胶原酶1,37℃消化30分钟后,细胞形态正常。需要注意的是,过筛后该外观组织一般存在大量的红细胞,需要将红细胞去除。在裂解红细胞时缩短裂红时间,且该步骤需在冰上进行,以减少裂红液对于胰腺细胞的损伤。
1、多个组织图片
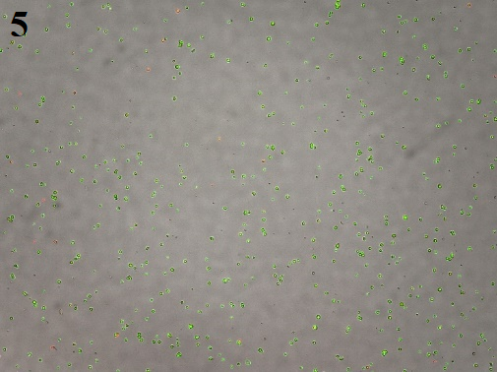
2、初步消化后镜检图片



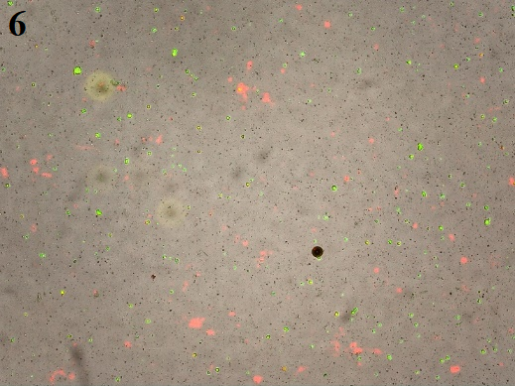
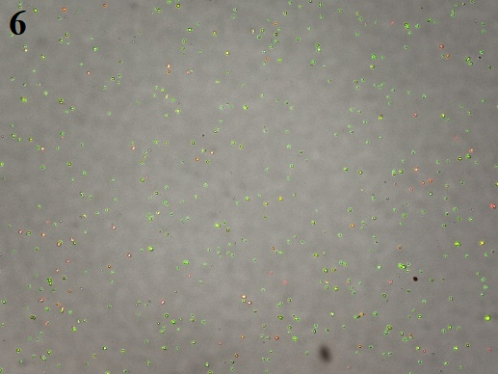
3、最终细胞悬液图片(裂红时间不适而导致的结果:图7最终的细胞悬液中正常细胞少,大部分为细胞碎片;图8裂红时损失的细胞多,导致细胞量过少无法继续处理;图9背景较脏,细胞活率不好)


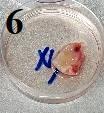
状态三、组织黄色带有很多脂肪、经过手术处理后带有焦黑部分
这类组织中的脂肪附着在组织上,使得相应的组织消化酶无法充分的与组织接触,严重的降低消化效率。
解离方法:尽量去除肉眼能分辨的脂肪层,将组织剪碎至2-3mm大小,使用培养基将剪碎组织清洗两到三遍,每次吹打清洗后静置2-3min,弃取漂浮的脂肪层。清洗结束后,加入0.1%胶原酶1消化30分钟后进行镜检,若大比例为油滴类似物及非正常细胞则可弃去上清,再加入0.1%胶原酶1消化三到四次。后续每次消化20分钟,消化后自然沉降,取上清液保留(可以吸到部分组织,不过筛,使用干净的离心管将上清液保存,放于4度冰箱),三到四次保留的上清的细胞总数能够达到50万细胞时,可以进行合并过筛处理。过筛后500G离心5分钟,将上清液去除后重悬镜检,通常可以得到形态正常的细胞。
1、多个组织图片
2、常规方法解离
①组织消化30-40min(luna镜检显示大占比不正常的荧光着色的细胞形态,几乎无正常形态的细胞)

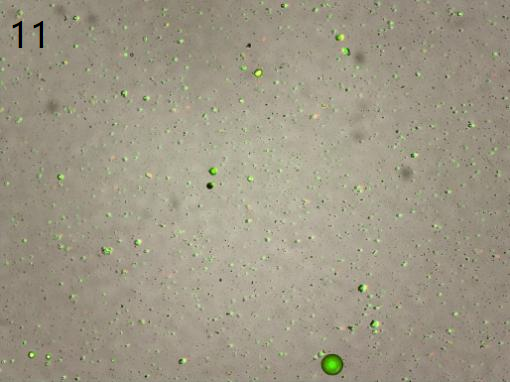
采用去死细胞和不去死细胞处理


(去死细胞处理细胞基本丢失) (不去死细胞,多次洗涤处理形态正常的细胞占比约5%)
②组织消化完全(长时间的消化导致已游离出的细胞死亡,悬液中的细胞死亡速度大于组织中分离出的活细胞速度)

组织消化完全的初次镜检图(基本无正常形态的细胞)

组织消化完全的最终图(背景极脏,几乎无细胞)
③只进行差速离心洗涤操作的的最终图


(最终几乎无形态正常的细胞)
采用分批消化的方式
①直接剪碎后镜检
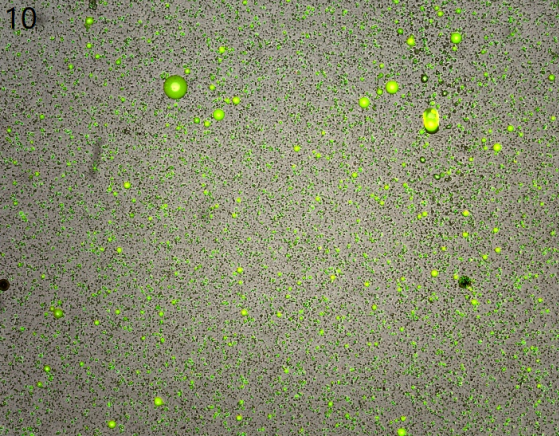
(几乎无形态正常的细胞,油脂多)
②第一次消化后图片

(几乎无形态正常的细胞,油脂减少)
③第二次消化后图片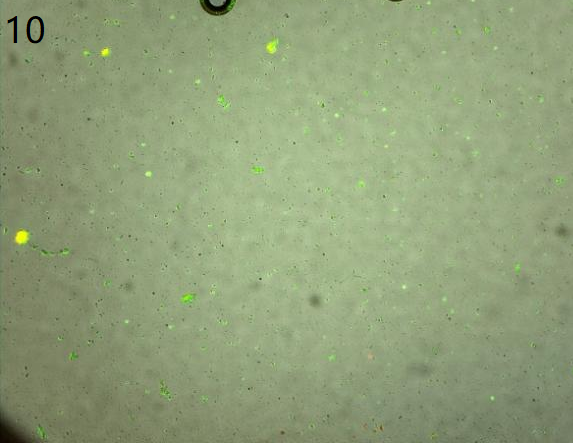
(背景开始干净,拥有较多正常形态细胞)

(背景开始干净,拥有较多正常形态细胞)
最终细胞悬液图片
①去死细胞后的最终图
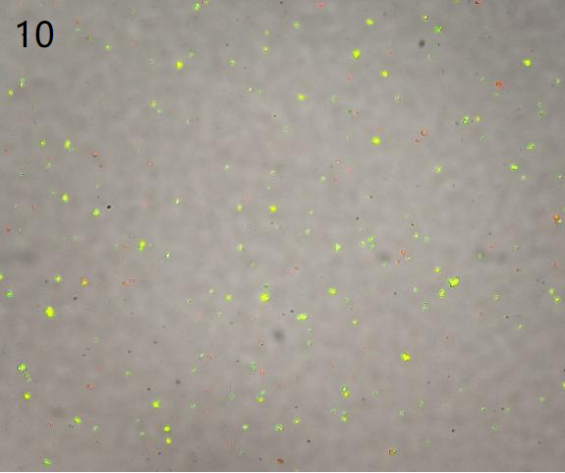
(杂质少且细胞形态正常)
②只进行差速离心洗涤的最终图
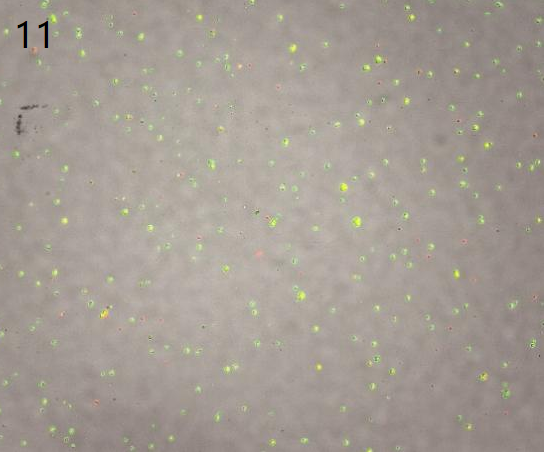
(杂质少且细胞形态正常)
综上所述:胰腺样本制备单细胞悬液的难度较大,同时不同状态的胰腺样本处理方法也不相同,但是采用分批处理的胰腺样本,最终获取的单细胞悬液质量有明显提高。
精彩回顾

2021 单细胞与空间多组学技术应用主题学术研讨会圆满落幕,线上高达5000位观众同步观看~
公众号【欧易生物】后台回复【单细胞链接】,即可获取精彩回放视频链接!






