欧易BD平台单细胞客户文章来了!单细胞测序持续发力!近日,复旦大学周祥、吴小华教授为共同通讯作者,在Clinical and Translational Medicine (IF: 11.492)期刊发表了关于高级别浆液性卵巢癌的单细胞转录组测序相关成果,揭示了高级别浆液性卵巢癌的异质性和潜在治疗靶点。欧易生物提供了该项目单细胞转录组测序和分析相关工作,下面我们一起学习这篇文章的具体内容。

基本信息
材料: 2个病人原发和转移配对的HGSOC样本
期刊:Clinical and Translational Medicine
发表时间:2021年7月30日
方法:欧易生物BD Rhapsody scRNA-seq
研究背景和研究目的
高级别浆液性卵巢癌 (HGSOC) 是最常见的上皮性卵巢癌,对该疾病的异质性和分子基础仍然不完全了解。HGSOC是最具侵袭性的妇科恶性肿瘤,也是全球女性癌症死亡的主要原因之一。探究HGSOC的异质性和分子特征,有助于更好地理解卵巢癌发生、转移和耐药性的机制,发现潜在治疗靶点。
内容概述
总共获得13,571个细胞,分为六种不同的细胞类型,包括:上皮细胞、成纤维细胞、T细胞、B细胞、巨噬细胞和内皮细胞。作者鉴定出一种具有高增殖和耐药性潜力的上皮细胞亚群,进一步实验证实了它们在卵巢癌细胞生长和迁移中的作用。通过拟时序分析,发现包括翻译机制在内的多种信号通路的失调与卵巢癌转移有关。此外,SCENIC分析揭示了基因调控网络的相互作用,并通过JUN/AP-1抑制剂T-5224验证,表明JUN可作为潜在的卵巢癌治疗靶点。
研究结果
1. scRNA-seq图谱揭示HGSOC中的不同细胞类型与CNV分析
对两个患者的4个原发性和转移性HGSOC样本进行单细胞测序 (Figure 1A),聚类为9个cluster (Figure 1B),利用marker基因鉴定为6种细胞类型 (Figure 1B, C, D)。CNV分析发现,上皮细胞的CNV水平显著高于其他细胞类型 (Figure 1E, F)。
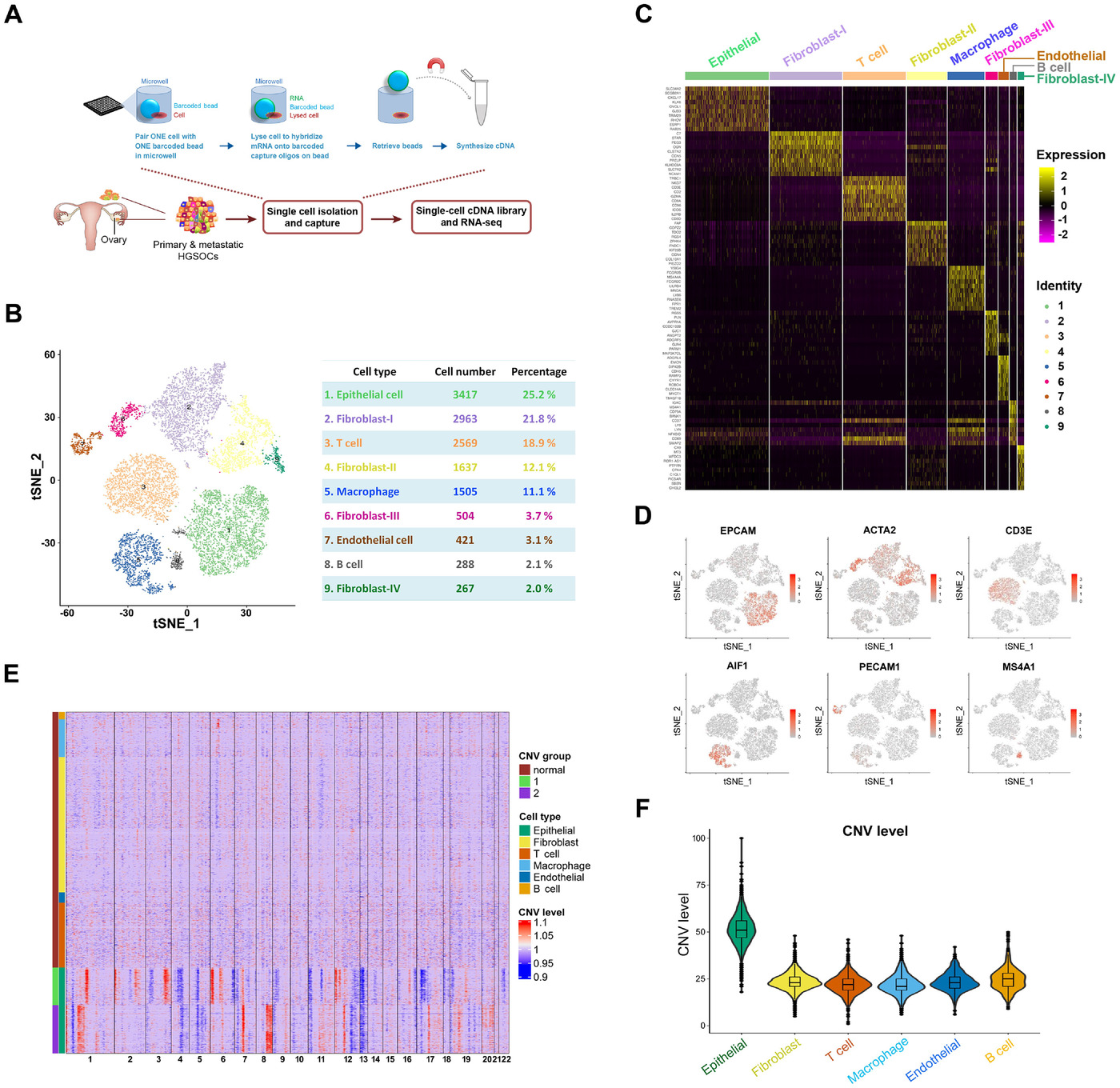
Figure 1. 单细胞转录组学描述HGSOC中不同的细胞类型
2. HGSOC中上皮细胞的独特分子特征
为了进一步研究上皮细胞功能特征,作者对上皮细胞进一步分亚群 (Figure 2A, B)后进行GSVA分析 (Figure 2C)。不同亚群表现出了不同的功能性,EC1富集了糖酵解/糖异生、柠檬酸循环等相关信号通路 (Figure 2C, D),EC2富集了细胞因子间受体相互作用以及神经活性相关信号通路 (Figure 2C, E)。而EC3富集了核苷酸和氨基酸代谢相关信号通路,并且上调了参与范科尼贫血途径和ABC转运蛋白相关基因的表达,表明该亚群可能具有耐药性 (Figure 2C, F)。EC4富集了免疫应答、补体和凝血级联反应的信号通路,并且上调了MHC-II相关基因 (Figure 2C, G),表明这组细胞在抗原处理和免疫反应中能力较强。EC5富集了细胞周期、DNA复制、损伤修复和药物代谢相关的信号通路,并且增殖相关基因MKI67和耐药相关基因与同源重组基因的表达上调 (Figure 2C, H),表明这些细胞可能对化疗和PARP抑制剂具有抗性。同时细胞周期分析发现EC5主要由S期和G2/ M期癌细胞组成 (Figure 2I),也表明EC5具有较强的增殖潜能。
作者在五个亚群TOP25 SDE(significantly differentially expressed)基因中发现了一些可能与卵巢癌有关的新marker。为了进一步验证marker的功能,使用细胞活力实验检测了ANPEP (EC2)、CASP14和CLEC2B (EC3)、CADM3和NRBP2 (EC4)、SPC25和ESCO2和GTSE1 (EC5) 与卵巢癌细胞增殖的关系,结果表明抑制8个基因的表达,均会导致卵巢癌细胞的增殖能力下降 (Figure 3A)。细胞侵袭实验 (Transwell) 表明抑制8个基因中的任何一个基因的表达都会显著降低OVCA420细胞的侵袭能力 (Figure 3B)。
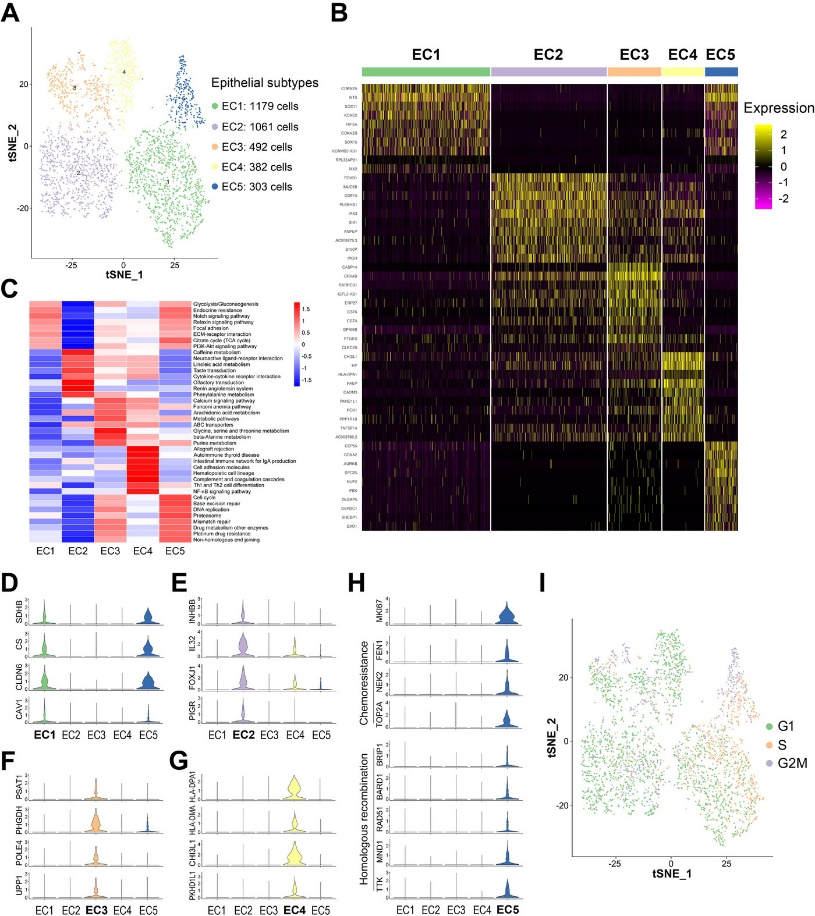
Figure 2. 上皮细胞亚型具有显著的分子特征
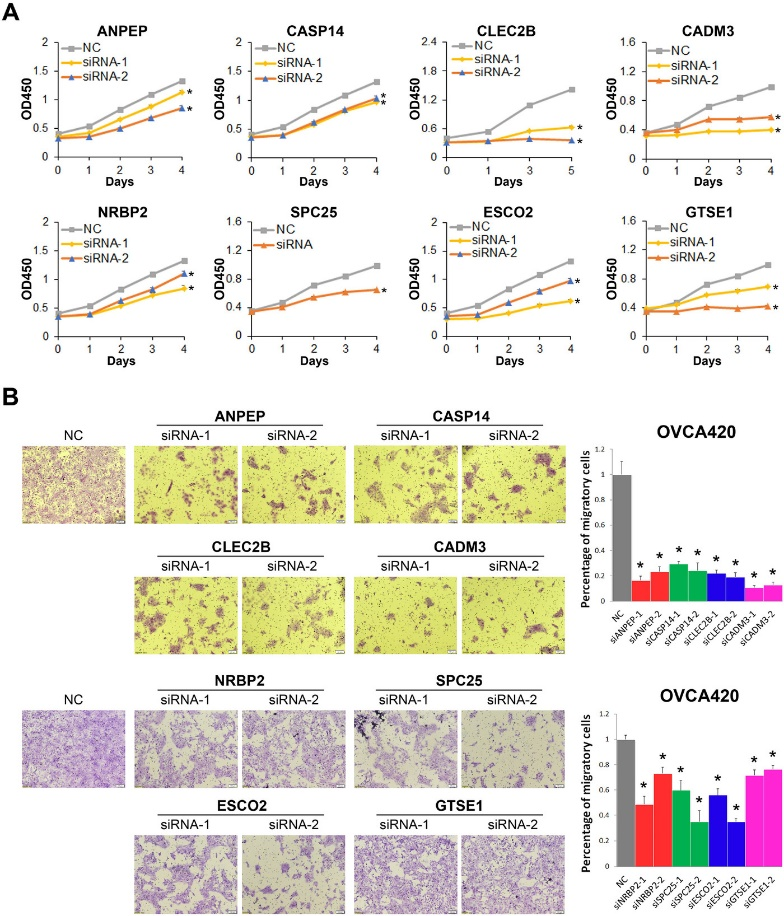
Figure 3. 上皮细胞marker功能验证
3. HGSOC发展过程中的动态基因表达谱
为探究HGSOC发育过程中基因变化情况,作者通过拟时序分析发现随着时间增加转移性上皮细胞占比逐渐增高 (Figure 4A, B, E, F),并通过分析基因变化情况发现细胞周期和分裂、DNA修复、炎症和代谢途径,特别是糖酵解和柠檬酸循环在卵巢癌发展过程中明显失调 (Figure 4C, D, G, H)。其中许多核糖体生物合成和翻译相关基因在肿瘤细胞进化过程中上调 (Figure 4D),验证发现核糖体生物合成相关基因的高表达与卵巢癌的不良预后显著相关 (Figure 4I)。而纤毛上皮marker (FOXJ1、PIGR、CAPS和GDF15) 在肿瘤发展过程中表现出下降趋势 (Figure 4D),同时这些marker的低表达导致了预后效果较差 (Figure 4J)。此外,作者发现卵巢癌的进展伴随着免疫应答相关基因的表达下调 (Figure 4H),其下调与不良预后显著相关 (Figure 4K)。以上结果表明卵巢癌转移过程中几个关键信号通路的失调与卵巢癌的预后显著相关。
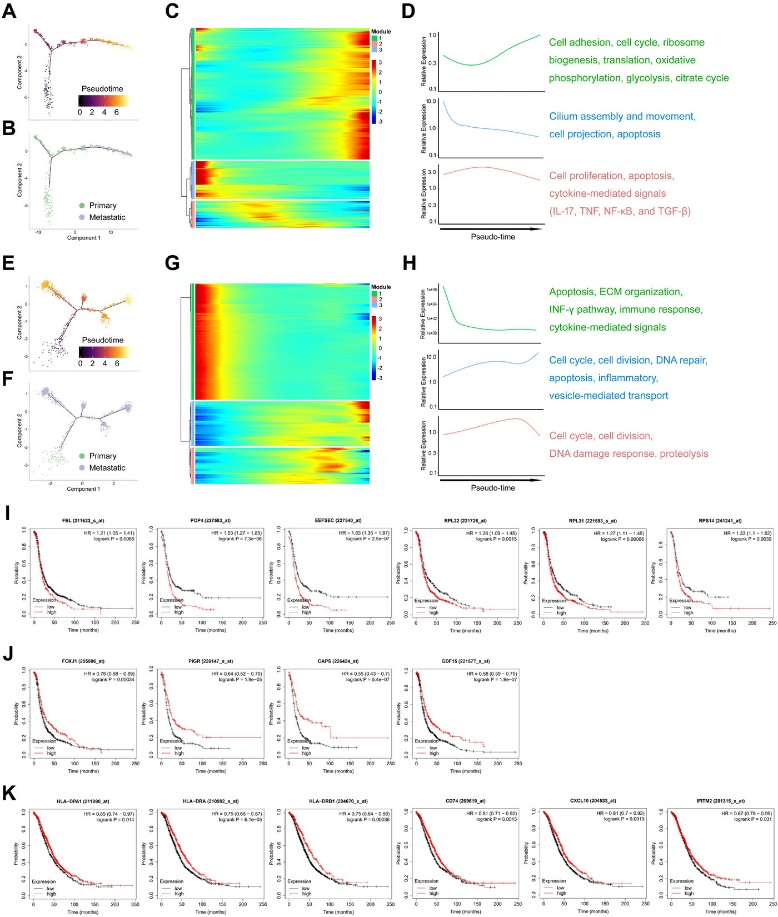
Figure 4. HGSOC转移过程中的基因表达谱
4. HGSOC中成纤维细胞特征分析
成纤维细胞被认为是肿瘤中高度丰富和异质性的细胞类群,因此作者对HGSOC中的成纤维细胞进一步做亚群分析 (Figure 5A, B)。为进一步研究不同亚型间的功能差异,通过GSVA分析对成纤维细胞亚群进行功能注释 (Figure 5C),结果表明FC1富集了脂质和类固醇代谢的相关通路 (Figure 5C, D),FC2富集了糖代谢(糖酵解与糖异生、柠檬酸循环和氧化磷酸化)以及多种DNA修复途径相关通路 (Figure 5C, E),表明FC2可能具有肿瘤样恶性潜能。FC3中免疫应答和感染性疾病相关基因上调,表明它们可能与肿瘤免疫相关 (Figure 5C, F)。而FC4富集了大量血管发生相关信号通路 (Figure 5G),表明该亚群在血管发育和血管生成中具有重要作用。在FC5中发现脂质代谢途径和细胞外基质信号通路大量富集 (Figure 5C),并上调了与发育、组织再生相关的基因表达 (Figure 5H)。这些结果揭示了HGSOC成纤维细胞的异质性,可以在诱发耐药性、免疫抑制、血管生成和肿瘤细胞迁移方面来推动卵巢癌的进展。
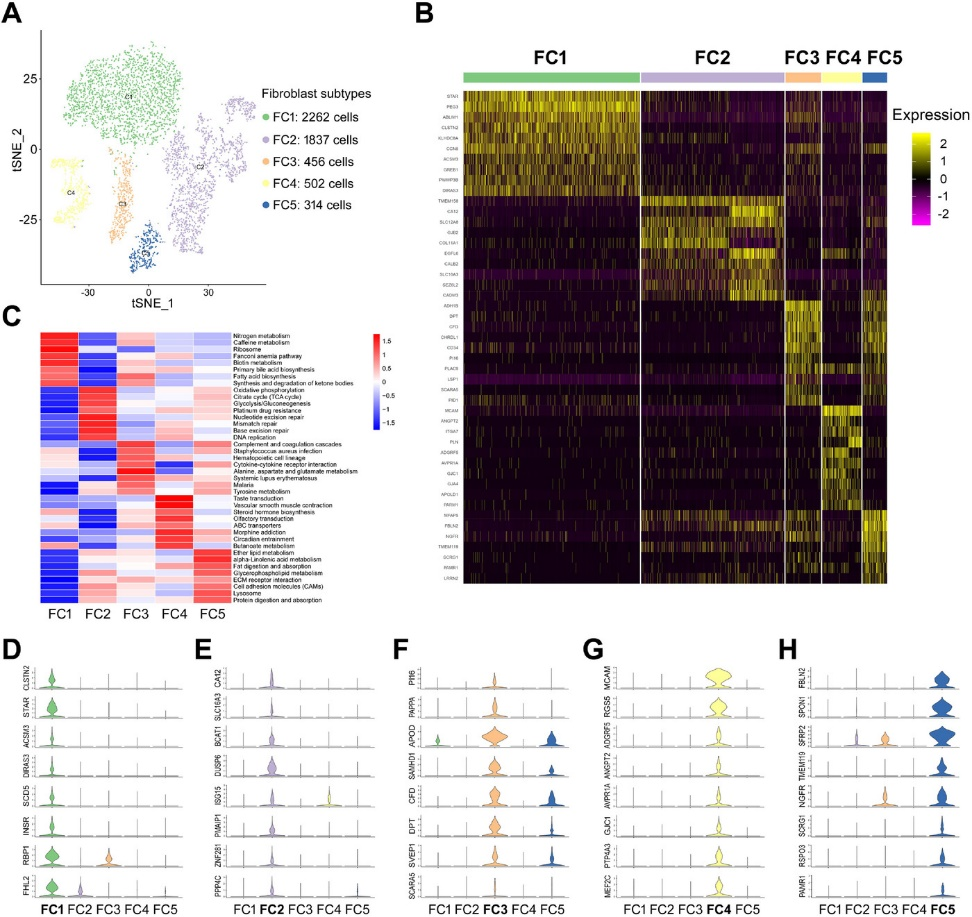
Figure 5. 成纤维细胞亚型特征分析
5. 基因调控网络确定JUN通路是HGSOC的驱动因子
接下来,作者对上皮细胞和成纤维细胞进行SCENIC分析 (Figure 6A-D),结果表明JUN在3组高调控模块中调控活性较高 (Figure 6A-F)。为进一步探究JUN蛋白在卵巢癌进展中的作用,作者使用JUN/AP-1抑制剂T-5224对卵巢癌细胞进行活力实验,结果表明T-5224显著抑制了OVCA420和ES-2细胞的增殖 (Figure 6D, H)。同时作者通过Transwell实验表明T-5224可以有效的抑制卵巢癌细胞的侵袭能力 (Figure 6I, J)。以上结果表明JUN可以作为卵巢癌潜在的治疗靶点。

Figure 6. HDSOC基因调控网络
6. HGSOC中上皮细胞-成纤维细胞间的通讯网络
为进一步了解上皮细胞和成纤维细胞之间的通讯作用关系,作者使用cellphoneDB对上皮细胞和成纤维之间进行通讯分析 (Figure 7A, B),结果发现在上皮细胞中表达较高的EGFR、FGFR1和FGFR2,其相应配体如CopA、GRN、HBEGF、FGF2、FGF7和FGF18等在成纤维细胞中广泛表达 (Figure 7C, E)。FGFR2-TIMP1和HLA-DRB1-OGN在上皮细胞和成纤维细胞之间表现出最活跃的受体-配体相互作用。另一方面在比较原发性与转移性肿瘤时发现EGFR-COPA/GRN/HBEGF受体-配体相互作用对的表达水平明显不同,在转移性肿瘤中显著高表达,表明其可能在卵巢癌转移过程中发挥重要作用。此外,尽管成纤维细胞也表达EGFR和FGFR1等受体,但是它们更多地表达高水平受体如LRP1、PDGFRs、PLXND1等,而上皮细胞则表达相应配体 (LGALS9/MDK、PDGFs、Semas) (Figure 7D, F)。总之,这些结果表明上皮细胞和成纤维细胞之间的细胞通讯可能会影响卵巢癌的发生和转移。
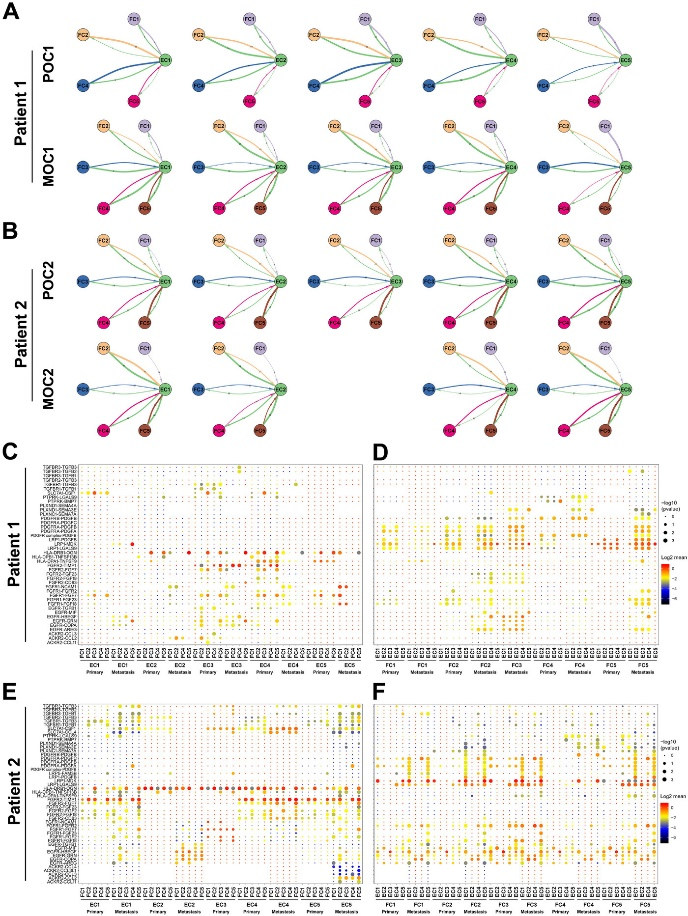
Figure 7. HGSOC中上皮细胞-成纤维细胞的通讯网络
结论
1. HGSOC样本的单细胞转录组学分析揭示了六种不同的细胞类型,鉴定了HGSOC中上皮细胞的新marker,并进一步证实了它们在卵巢癌细胞增殖和侵袭中的作用;
2. 发现上皮细胞多种信号通路的失调与卵巢癌转移及预后有关;
3. 探究了成纤维细胞亚型的功能异质性;
4. 揭示了JUN可作为HGSOC潜在治疗靶点;
5. 描述细胞通讯网络的关系,揭示卵巢癌的关键受体-配体相互作用。
特别致谢
致谢欧易生物巴永兵和董娇阳在生物信息分析中提供的帮助。
参考文献
Hao Q, Li J, Zhang Q, et al. Single-cell transcriptomes reveal heterogeneity of high-grade serous ovarian carcinoma. Clin Transl Med. 2021;11:e500.






