前言
光是调控植物生长发育的重要环境因子,植物通过不同的光受体感知不同波长的光从而调节植物的光形态建成、开花时间和昼夜节律等生理生化过程。CRY1通过调节蛋白质稳定性、转录活性或转录因子的DNA结合活性来抑制蓝光激发下的下胚轴伸长,这反过来又调节了下游光反应基因的转录和表达。m6A修饰在调节植物生长发育中同样起着重要作用,然而,人们对其潜在的机制却知之甚少,并且m6A是否以及如何调节光控制的光形态建成目前尚不清楚。

2022年10月28日,湖南大学生命学院赵小英/何崇圣团队在New Phytologist期刊(IF:10.323)发表了题为“The blue light receptor CRY1 interacts with FIP37 to promote N6-methyladenosine RNA modification and photomorphogenesis in ”的研究论文,报道了CRY1( Cryptochrome 1,隐花素1)可通过与FIP37(甲基转移酶)互作,在蓝光激发下增强FIP37与RNA的结合能力,从而增加光形态建成相关基因的m6A修饰,降低这些RNA的稳定性,进而促进光形态建成,为CRY1在调控植物生长的分子作用机制提供新的见解。
研究内容
本研究通过Dot blotting实验发现蓝光能诱导RNA m6A修饰水平升高,而cry1突变体中的m6A修饰降低,表明CRY1参与调控蓝光诱导m6A修饰过程。进一步研究发现蓝光可部分通过CRY1调节甲基转移酶复合体成员FIP37基因的表达;在蓝光下,突变体幼苗下胚轴伸长对蓝光的敏感性减弱,幼苗下胚轴变长,表明FIP37正调节蓝光介导的光形态建成。进一步探究该现象背后的机制发现,CRY1与FIP37直接互作,在蓝光激发下,CRY1能够增强FIP37与RNA的结合能力。已有研究报道发现突变体中光形态建成负调节子PIF3、PIF4和PIF5的mRNA水平升高,m6A修饰水平下降。
在本研究中,作者通过m6A测序比较了和突变体中m6A修饰的差异基因,同时通过实验发现在蓝光激发下,CRY1与FIP37能够提高和 mRNA的m6A修饰水平,进而影响这些基因的mRNA的稳定性。因此,该研究提出了一种新的机制,即CRY1可通过与FIP37互作,在蓝光激发下增强FIP37与RNA结合的能力,从而增加光形态建成相关基因的m6A修饰,降低这些RNA的稳定性,进而促进光形态建成。
技术路线
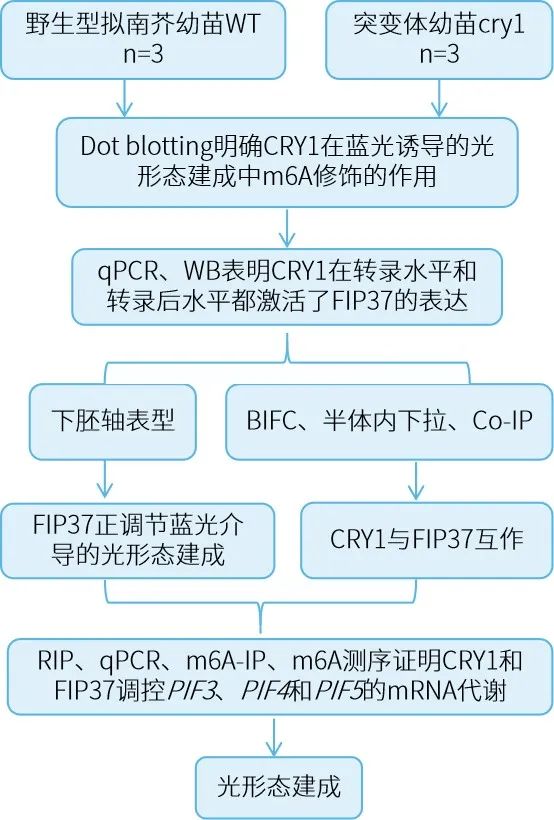
研究结果
1. CRY1介导了蓝光诱导的光形态建成中m6A修饰积累和m6A甲基化转移酶(Writers)FIP37的表达
Dot blotting实验验证了蓝光诱导下的拟南芥幼苗总RNA m6A水平显著高于红光或远红光诱导的幼苗(图1a),而在突变株中m6A水平降低(图1b),在蓝光长时间处理后立即升高(图1c),并随着蓝光强度的升高而升高(图1d),但突变株的升高水平仍低于野生型,表明蓝光诱导的m6A修饰需要CRY1的参与,但这种过程可能也有其它如CRY2蓝光受体的参与。为验证蓝光诱导的这种m6A积累是否是m6A Writers的表达调控所导致,作者通过qPCR发现在连续蓝光下生长的幼苗中,野生型中m6A Writers基因和的表达水平均高于黄化幼苗,突变株中的表达水平稍高于黄化幼苗但显著低于野生型(图1e)。此外,在蓝光诱导3h内,野生型和突变株中的表达量分别增加2.6倍和1.6倍,但突变株的表达量也明显低于野生型(图1f),最后作者发现在蓝光下,FIP37蛋白水平升高,在黑暗下,FIP37蛋白水平降低(图1g-i),表明蓝光在转录水平和转录后水平都激活了的表达。

图1 I CRY1介导蓝光诱导的m6A甲基化和m6A Writer基因FIP37的表达
2. FIP37参与了蓝光介导的对下胚轴伸长的抑制
为确定m6A修饰在光形态建成中的功能作用,作者分析了突变体在不同光照条件下的下胚轴表型,与野生型植株相比,突变体在蓝光激发下表现出更长的下胚轴,但在红光、远红光或黑暗条件下表现出正常细长的下胚轴(图2a-b),提示FIP37参与了蓝光对下胚轴伸长的抑制;此外,在相对较高强度的蓝光处理下,突变体的下胚轴伸长对蓝光的敏感性降低,表现出更长的下胚轴长度(图2c-d),并且通过使用恢复株系进行下胚轴实验证明这种表型在互补后可得到挽救,表明FIP37参与了蓝光介导的下胚轴伸长。
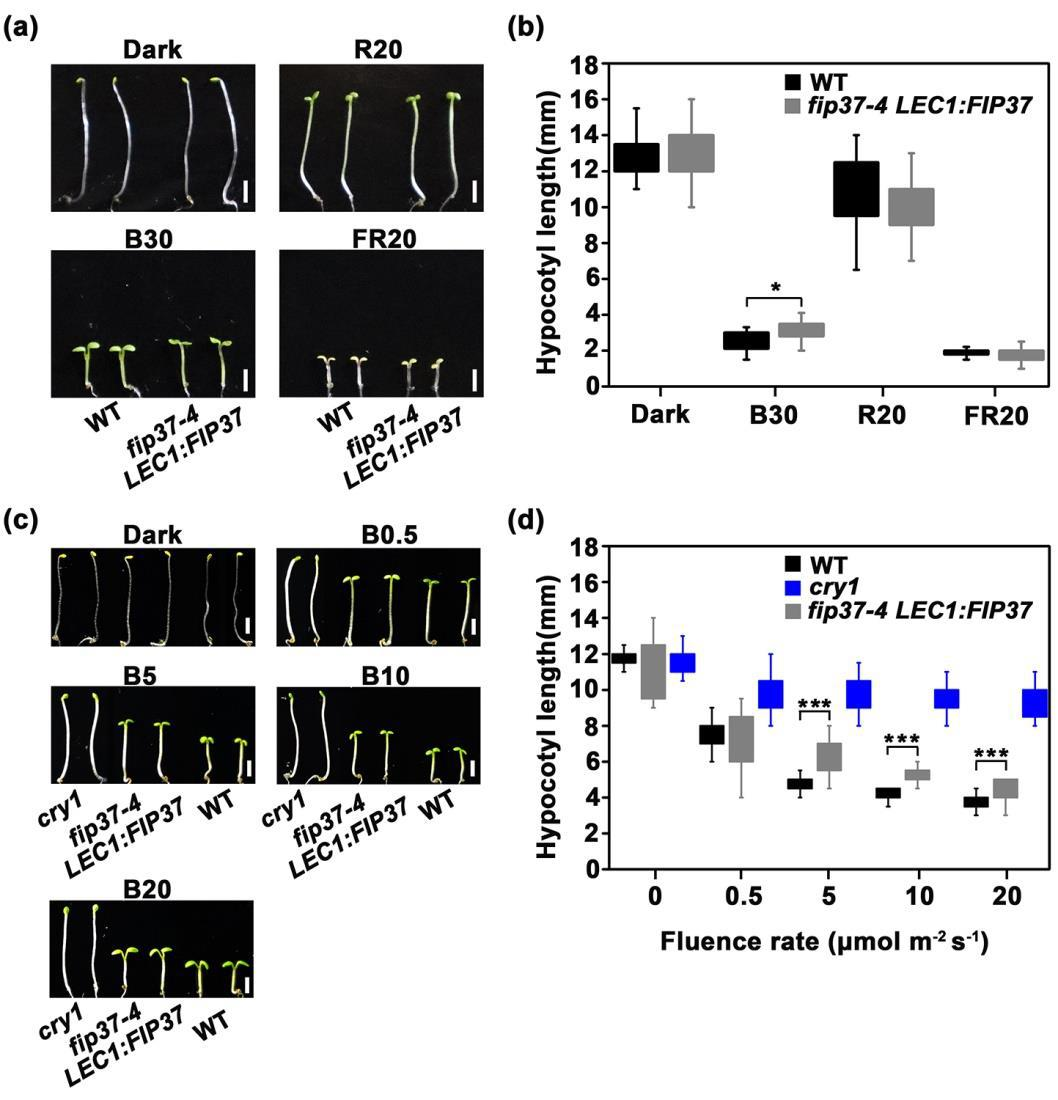
图2 | fip37突变体的下胚轴伸长对蓝光的敏感性降低
3.CRY1与FIP37相互作用
BiFC、pull down和Co-IP实验分别从体内体外证实CRY1与FIP37以不依赖蓝光的方式发生相互作用(图3a-d),其中,pull down结果表明CRY1的CNT1和CCT1结构域均可与FIP37 N端发生相互作用,而非C端(图3e-g),表明FIP37的N端非结构域是介导其与CRY1相互作用的主要区域。
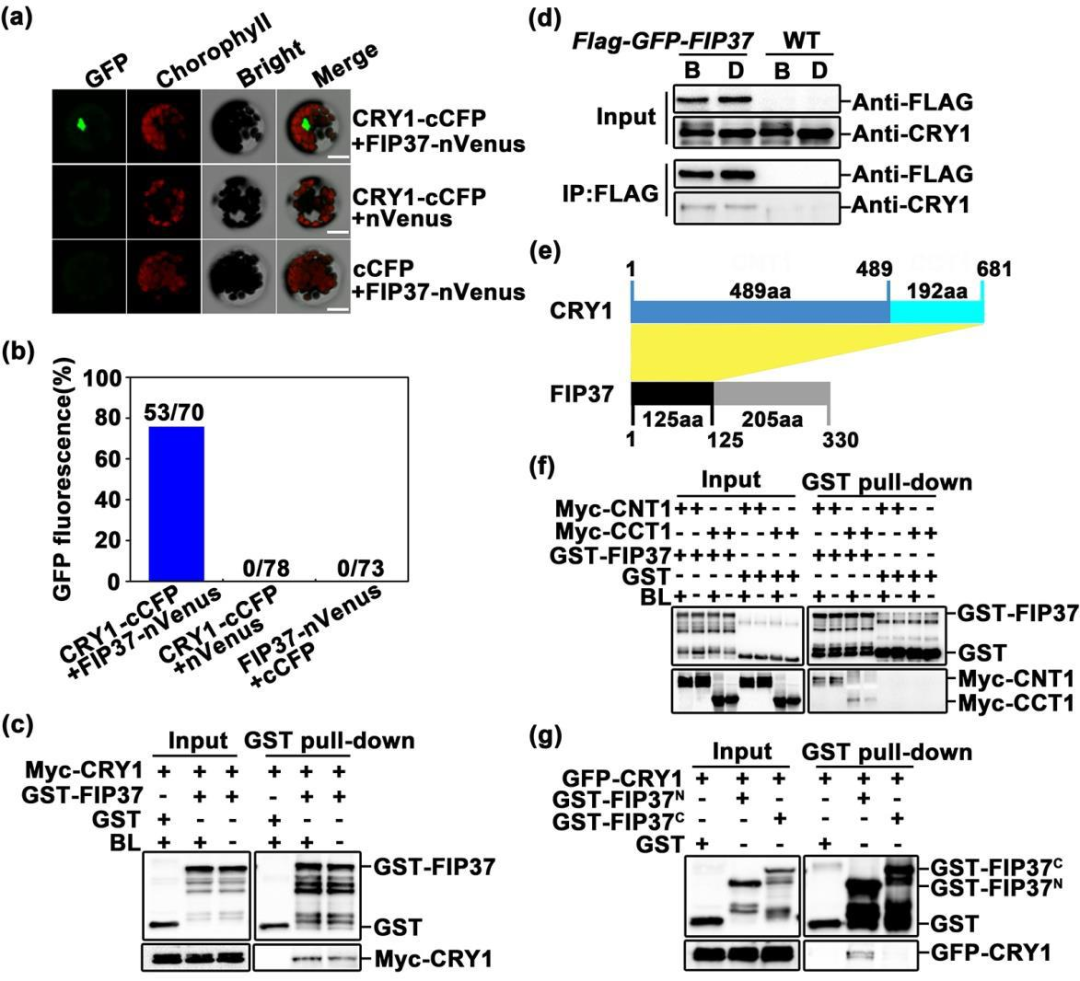
图3 | CRY1与FIP37相互作用
4. 蓝光增强了FIP37与RNA的结合能力
据报道,FIP37在体内可与mRNA结合,作者通过RIP实验发现FIP37蛋白可以结合RNA,并且在蓝光处理下FIP37蛋白能结合更多的RNA(图4a-b),表明在体内和体外蓝光均增强了FIP37与RNA的直接或间接结合。进一步探究CRY1在此过程中的作用时发现,与野生型相比,GST-FIP37与突变体结合的RNA较少,而GST-FIP37与GFP-CRY1结合的RNA更多(图4c),表明CRY1参与了蓝光诱导的FIP37-RNA相互作用。
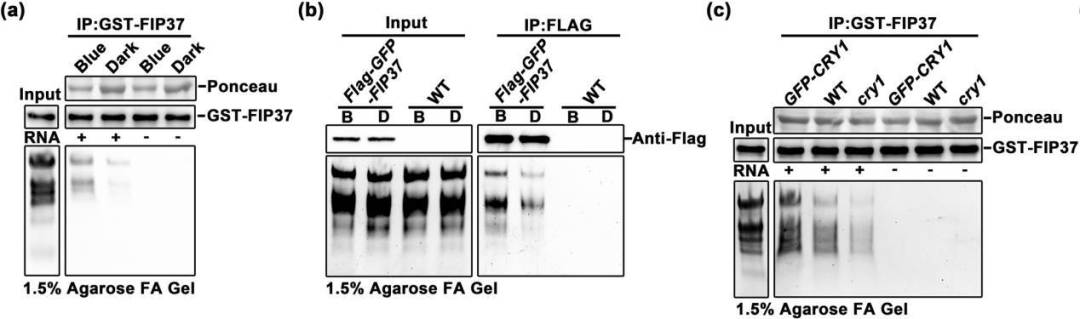
图4 I CRY1是FIP37在蓝光下与RNA结合所必需的
5. CRY1和FIP37调控PIF3、PIF4和PIF5的表达和m6A修饰
为了探究FIP37是否可以与任何光形态建成相关的转录本直接结合,作者选择了表达量和m6A修饰均受蓝光和CRYs调控的转录因子和,发现它们在和突变体中转录本的表达均有所增加(图5a),表明CRY1和FIP37抑制了和的表达。通过RIP-qPCR实验发现FIP37在体内可与和转录本结合,并且在蓝光生长的幼苗富集到和转录本比在黑暗中生长的黄化幼苗多(图5b)。进一步通过m6A-IP-qPCR检测了FIP37和CRY1对和的影响,结果显示在和突变体中,和转录本的m6A修饰均减少(图5c),表明CRY1和FIP37调控了和的m6A修饰。测量在蓝光下和 转录本的衰减率发现,与野生型相比,在和突变体中,和转录本的衰减速度延迟(图5d),表明CRY1和FIP37在蓝光诱导下介导的m6A修饰作用加速了和转录本的衰减,使得这些转录本的表达量下调。
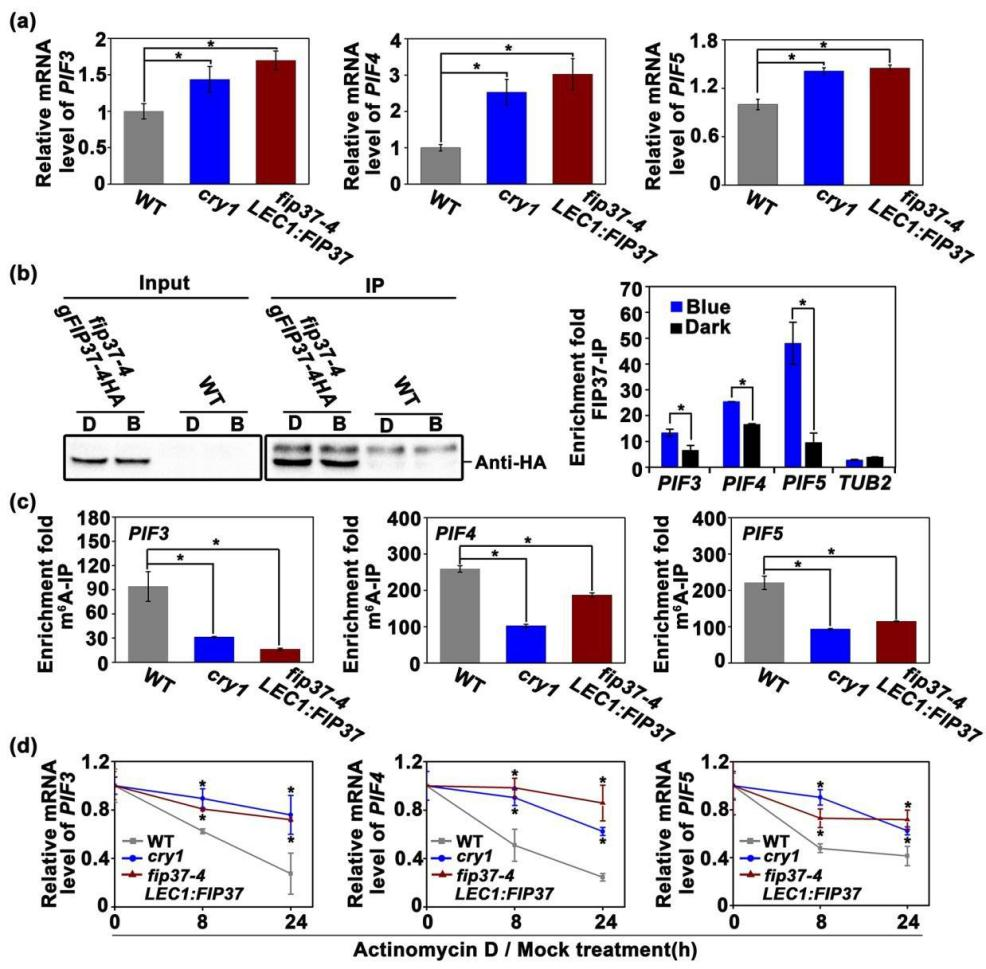
图5 | CRY1和FIP37调控PIF3、PIF4和PIF5的mRNA衰减
6.FIP37位于CRY1的下游
通过进一步比较CRY1过表达植株和FIP37突变体植株在不同强度蓝光下的下胚轴长度发现:过表达的植株的下胚轴比野生型的植株要短,幼苗比过表达植株长,但在低强度蓝光和和高强度蓝光条件下比野生型短(图6),表明突变可以部分挽救Myc-CRY1过表达植株的短下胚轴表型。因此推测FIP37很可能在蓝光抑制下胚轴伸长的过程中作用于CRY1的下游。
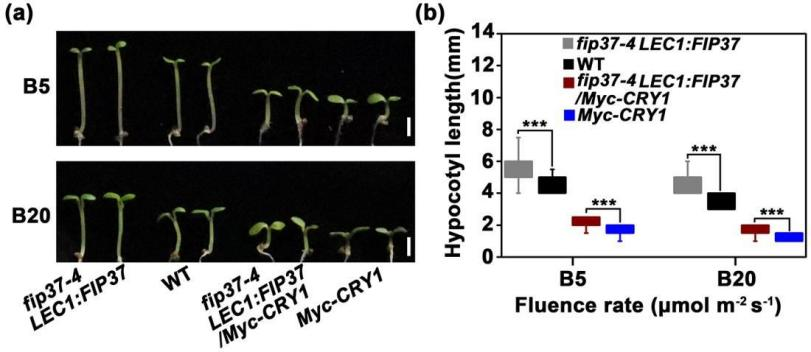
图6 | fip37突变可以部分挽救cry1过表达幼苗的短下胚轴表型
研究总结
本研究首次发现FIP37调控与蓝光相关的光形态建成,证明CRY1可通过与FIP37发生相互作用,在蓝光激发下增强FIP37与RNA结合的能力,从而增加光形态建成相关基因如和的m6A修饰,降低这些RNA的稳定性促进其转录本衰减,进而促进光形态建成。
欧易生物在本研究中承担了RNA甲基化测序(m6A-Seq)和生信分析工作。
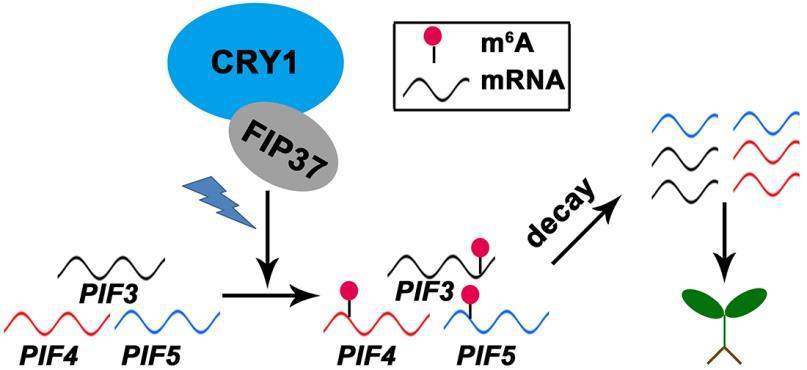
图7 | 在拟南芥中调控蓝光相关光形态建成的CRY1-FIP37模型
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.18583
DOI:10.1111/nph.18583
详细技术请访问欧易生物官网
⬇
百度搜索欧易生物(oebiotech)
⬇
了解更多多组学技术
(RNA甲基化测序(m6A-Seq)
长按扫码
咨询欧易生物技术工程师






