2022年12月6日,同济大学附属第十人民医院彭文辉教授团队在Nature Communications(IF:17.694)在线发表了题为Extracellular traps from activated vascular smooth muscle cells drive the progression of atherosclerosis的研究论文。该研究为与动脉粥样硬化相关的细胞外捕捉途径填补了空白,研究结论揭示了血管平滑肌细胞重编程后发挥的相关功能,为精准化靶向干预血管平滑肌细胞转化方向从而治疗动脉粥样硬化疾病提供了理论依据。

期刊:Nature Communications
影响因子:17.694
发表年月:2022-12-06
材料:分别取自B6-G/R Myh11Pad4小鼠和B6-G/R Myh11小鼠(每组6只)的主动脉
方法:10x Genomics单细胞3端测序
研究背景
细胞外捕捉现象(ETs)是一种先天免疫反应,细胞将DNA释放到细胞外空间,形成由解聚染色质、瓜氨酸化组蛋白和细胞蛋白组成的网状结构。ETs的形成最早是由Brinkmann等人在中性粒细胞中发现的,被认为是一种消灭微生物的有效防御反应。
近年来发现细胞外捕捉在非传染性和无菌性疾病中也有重要作用,如系统性红斑狼疮、血管炎等,并且除中性粒细胞外,巨噬细胞等免疫细胞也可以产生细胞外捕捉。但目前对于细胞外捕捉在动脉粥样硬化中的研究显示其影响了动脉粥样硬化,但动脉粥硬化并非依赖中性粒细胞来源的途径,因此探索是否存在其他细胞来源的细胞外捕捉途径对动脉粥硬化的进展研究有相当意义。
研究结果
Result1 巨噬细胞是晚期斑块中细胞外捕捉的重要来源
作者比较了小鼠主动脉根部中性粒细胞(NETs)和巨噬细胞(METs)产生的ETs ,发现所有METs或NETs的释放都与动脉粥样硬化斑块的演变密切相关。重要的是,在晚期斑块中,ETs主要与巨噬细胞相关,而并非中性粒细胞(图1)。这表明在晚期斑块中,由血管平滑肌细胞(VSMCs)转化而来的巨噬细胞是细胞外捕捉的重要来源。
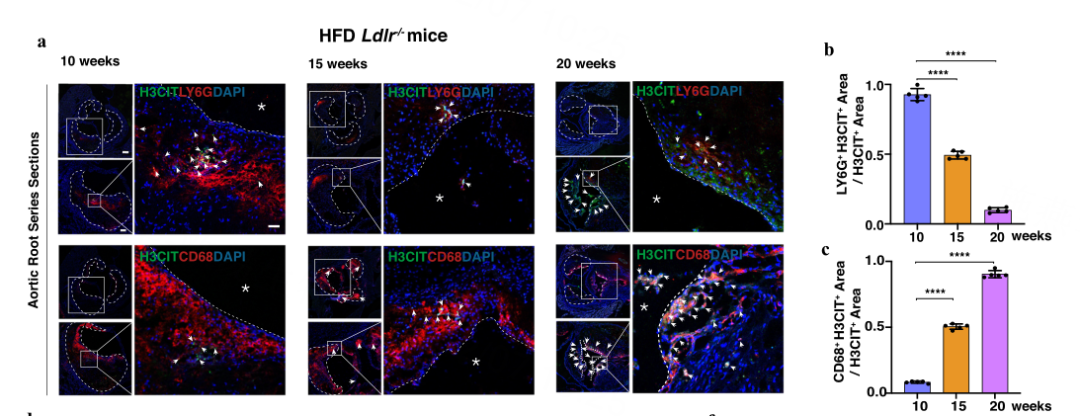
图1
Result2 VSMCs谱系追踪技术显示CD68+ VSMCs产生ETs
为了追踪ETs+ CD68+ VSMCs的起源,作者建立了VSMCs谱系追踪小鼠模型B6-G/R Myh11Cre,发现斑块内的Tdtomato+ VSMCs比正常主动脉内侧层的Tdtomato+ VSMCs表达更高水平的PAD4 ,说明VSMCs在动脉粥样硬化条件下可能产生ETs。
Result3 Ox-LDL可刺激CD68+ VSMCs体外产生ETs
油红O染色和CCK8结果显示72 h时阳性细胞比例最高,存活率最高(图2a-c)。与对照组相比,胆固醇负载的大鼠主动脉血管平滑肌细胞(RASMCs)巨噬细胞标志物的mRNA表达水平更高,VSMCs收缩标志物表达水平降低(图2d),WB也证实了α-SMA和CD68蛋白水平的变化(图2e-g)。同时,与对照组相比,装载胆固醇的RASMCs具有更多的吞噬生物颗粒和更高的吞噬基因表达。
随后作者分别比较了PDGF诱导的RASMCs、转分化RASMCs和去分化RASMCs中PADs家族mRNA的表达水平,发现PAD家族成员中PAD4大多升高。通过WB和IF(图2k),发现胆固醇负载后,PAD4在RASMCs中的表达大幅上调。氧化修饰低密度脂蛋白(ox-LDL)被广泛研究为动脉粥样硬化发展的危险因素,作者发现ox-LDL可以诱导CD68+ VSMCs体外生成ETs。
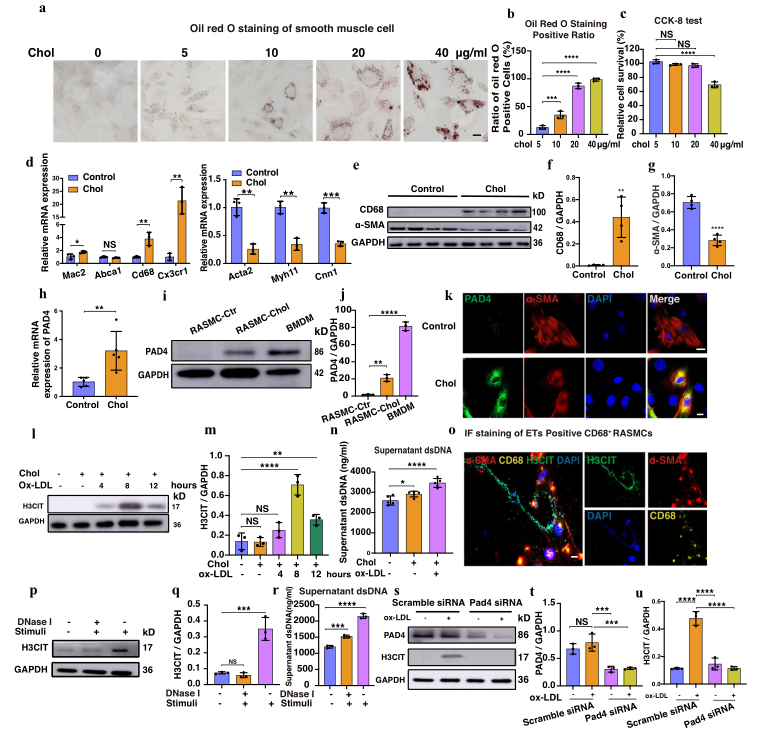
图2
Result4 VSMCs缺乏PAD4会减少脂肪条纹的形成和不稳定性
为了进一步明确血管平滑肌细胞来源巨噬细胞外捕捉对斑块进展的影响,作者构建了三基因敲除小鼠(Myh11/B6G/Pad4)并制成动脉粥样硬化模型,发现VSMCs中仅缺失PAD4导致病变尺寸在24周时显著减小了(图3b-f),Myh11Pad4小鼠血浆dsDNA浓度也降低了(图3g),α-SMA、CD68和H3CIT的IF染色显示,VSMCs中PAD4的抑制抑制了Myh11Pad4中CD68+VSMCs释放的ETs,而不改变头臂动脉(BCA)损伤或主动脉根部损伤中髓系巨噬细胞产生的ETs(图3h–l )。α-SMA、CD68和H3CIT的IF染色显示,VSMCs中PAD4的抑制抑制了Myh11Pad4中CD68+VSMCs释放的ETs(P<0.01),而不改变头臂动脉(BCA)损伤或主动脉根部损伤中髓系巨噬细胞产生的ETs(图3h–l )。这种变化确实降低了CD68+细胞总数中CD68+VSMCs的比例。
与对照组小鼠相比,作者观察到坏死面积减少(图3m,n),纤维面积增加(图3o,p),CD68+面积减少(见图3q,r),Myh11Pad4小鼠的BCA损伤或主动脉根部损伤中MMP9+面积减少(图3s、t)。此外,作者还发现,在来自人吸入性动脉粥样硬化斑块的三个样本中,ETs由CD68+VSMCs产生,ETs阳性CD68+VSMCs的区域与一系列相邻切片中的MMP9阳性区域相关。这些发现强调了CD68+VSMCs对于晚期斑块中ETs的产生至关重要,这在加速斑块的不稳定性和动脉粥样硬化进展中发挥了关键作用。
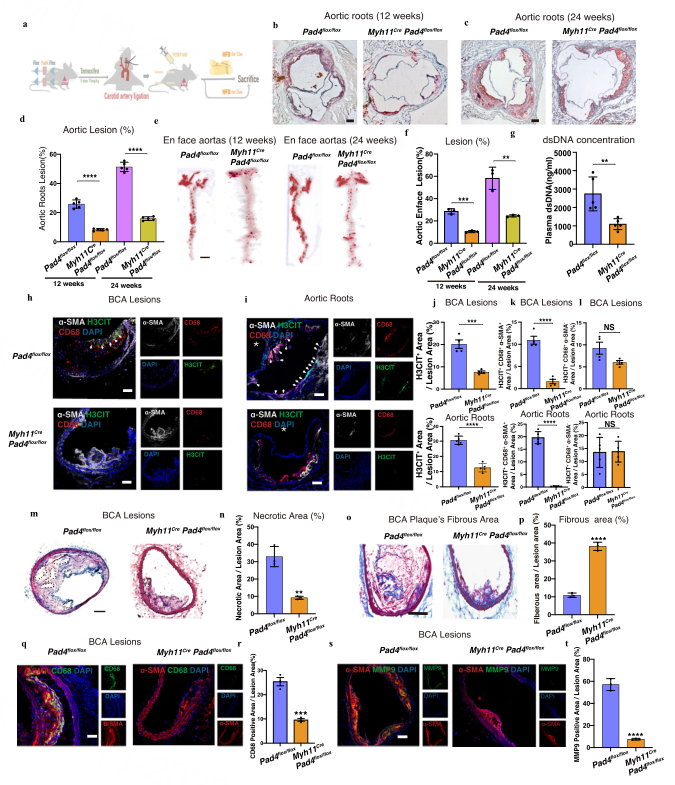
图3
Result5 VSMCs的特异性PAD4缺乏会减少ETs的产生,并影响VSMCs的转分化
Myh11Pad4小鼠中CD68+ VSMCs的比例低于Pad4小鼠,作者推测,巨噬细胞总数的降低可能与ETs减少导致CD68+ VSMCs减少有关。因此,作者以B6-G/R Myh11小鼠作为对照,生成VSMCs谱系追踪小鼠B6-G/R Myh11Pad4 (图4a)。在B6-G/R Myh11CrePad4flox/flox小鼠中,抑制斑块大小和脂质含量也得到了类似的结果(图4b, c)。此外,与对照组相比,B6-G/R Myh11CrePad4flox/flox组血浆中dsDNA浓度也较低(图4d)。由此可见,ETs是由CD68+ VSMCs释放的,而非去分化的VSMCs释放的,并且ETs在VSMCs向CD68+ VSMCs转分化中起着至关重要的作用,从而影响斑块负担和稳定性。
Result6 ScRNA-seq结合vsmcs谱系追踪技术揭示了抑制ETs释放后细胞映射的变化
为了深入了解PAD4缺失对VSMCs转分化的影响,作者对混合的Tdtomato+细胞和ZsGreen+细胞进行了scRNA-seq。质控后,共获得35,511个细胞,降维聚类后得到10个Cluster。scRNA-seq结果显示,在VSMCs PAD4缺陷时,Tdtomato+细胞表达格局发生了巨大变化,而ZsGreen+细胞映射的演变则微乎其微(图4h-j)。
Result7 CD68+ VSMCs产生的ETs影响VSMCs由有益样细胞向有害样细胞的转化方向
作者对Tdtomato+细胞进行亚聚类获得了10个cluster(图4K、L),敲除PAD4后,衰老VSMCs的比例显著减少(图4m)。衰老VSMCs聚类显示Vcam1和Ccl2高表达,GO富集分析结果为SMC凋亡进展,SMCs标记基因在平滑肌细胞分化中富集,纤维肌细胞和纤维软骨细胞(有益细胞)的标记基因在肌肉结构发育中富集,参与斑块稳定过程。此外,PAD4 (hi) CD68+ SMC、CD68+ SMC和衰老SMC簇的标记基因在炎症反应到损伤(图5a所示)中富集,产生炎症和不稳定。根据一系列发现作者得出结论,抑制cd68阳性VSMCs的ETs促进了B6-G/R Myh11Pad4小鼠斑块发展过程中VSMCs向有益细胞的转分化。
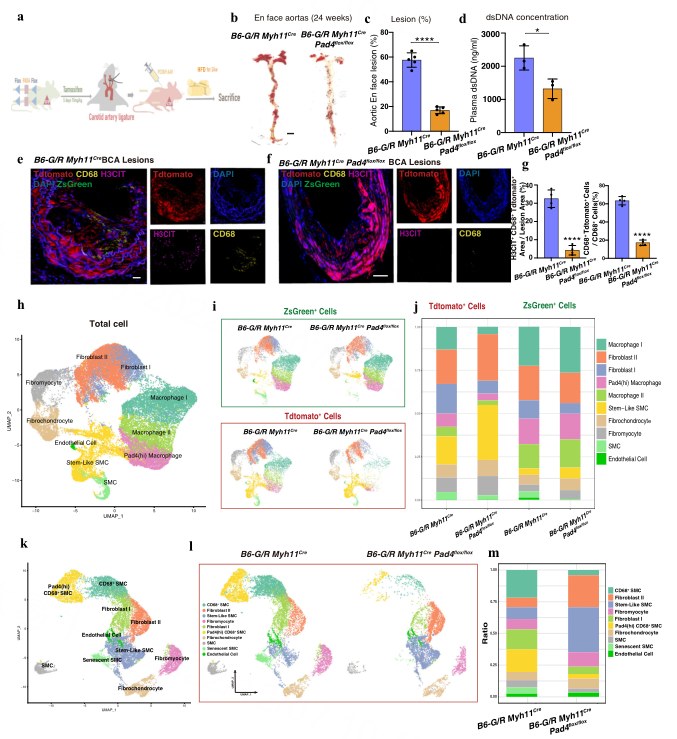
图四
Result8 PAD4 (hi) CD68+ VSMCs通过释放ETs和激活STING-SOCS1或TLR4信号通路影响周围VSMCs
作者筛选了从B6-G/R Myh11Pad4小鼠(Pad4 Tdtomato+细胞)中获得的Tdtomato+细胞与从B6-G/R Myh11小鼠(Pad4+/+ Tdtomato+细胞)中获得的Tdtomato+细胞的不同表达基因(DEGs)(图5b)。GSEA显示B6-G/R Myh11 Tdtomato+细胞中,“toll样受体信号通路”、“STING信号通路”和“TNF信号通路”产生了富集。
随后,作者对H3CIT + dsDNA组和bsa处理对照组的rasmc进行了批量RNA测序分析。图5c, d显示了两组细胞之间不同的基因表达模式。作者在oxLDL刺激的不同时间点用H3CIT和dsDNA处理RASMCs,发现H3CIT中STAT3的磷酸化被抑制,而dsDNA与对照组相比,STING上调(图5e-g)。接着作者发现Socs1是STING信号通路激活后抑制STAT3磷酸化的关键调控因子。IF染色显示Ki67+ Tdtomato+ SMCs比例降低。此外,抑制ETs释放后,体内Socs1表达的IF染色显著降低(图5l, m)。
RASMCs中TLR4- myd88信号通路也被激活(图5h-j), B6-G/R Myh11Pad4小鼠斑块抑制ETs释放后,TLR4调控的下游蛋白GSDMD减少(图5k, n, o, ),在B6-G/R Myh11小鼠的VSMCs中,tlr4诱导SMCs增殖,这与之前的scRNA-seq结果一致。
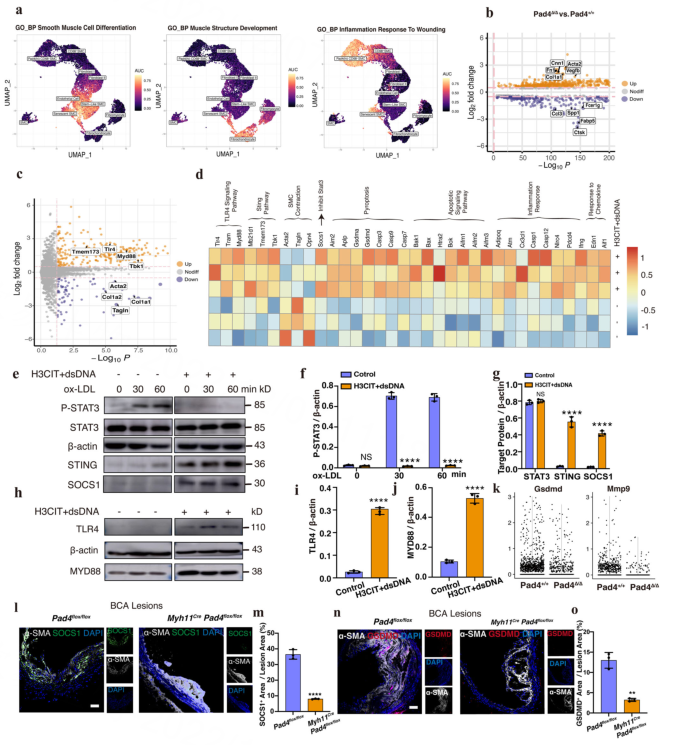
图五
文章总结
作者研究表明,CD68+ VSMCs产生的ETs不利于斑块的进展,并强调了它们在斑块稳定中的意外作用。这些发现也为VSMCs转分化为不同的中间有害和有益亚型提供了见解,这些亚型可能影响斑块的组成,并可作为预防斑块的新治疗靶点。
DOI:https://doi.org/10.1038/s41467-022-35330-1
详细技术请访问欧易生物官网
⬇
百度搜索欧易生物(oebiotech)
⬇
了解更多多组学技术
(10x Genomics单细胞3端测序)
长按扫码
咨询欧易生物技术工程师






