农历9月也称菊月,今天小欧带大家分享的这篇项目文章作者单位是拥有世界最大的菊花种质基因库的南京农业大学。南农的菊花研究始于20世纪40年代,现保存5000多份菊花资源、3000多个品种,其中由团队自主培育的优质、高抗、新奇特系列菊花新品种400多个。
近日,南京农业大学菊花遗传与种质创新团队在Plant Physiology上发表了题为“Transcription factor CmHSFA4–CmMYBS3 complex enhances salt tolerance in chrysanthemum by repressing CmMYB121 expression”的研究论文,该研究发现CmHSFA4-CmMYBS3-CmTPL复合体通过降低CmMYB121的组蛋白H3和H4的乙酰化水平来调节其表达,从而增强菊花对盐胁迫的耐受性。
本项目中所用的菊花酵母cDNA文库由欧易生物构建。

酵母文库:菊花酵母cDNA文库
诱饵蛋白:CmHSFA4-ΔAHA
筛选方法:酵母双杂交(GAL4系统)
验证方法:Y2H assay/BiFC/LUC/Pull-down
技术路线
研究结果
1.CmMYB121是一种具有核定位的盐诱导转录激活因子
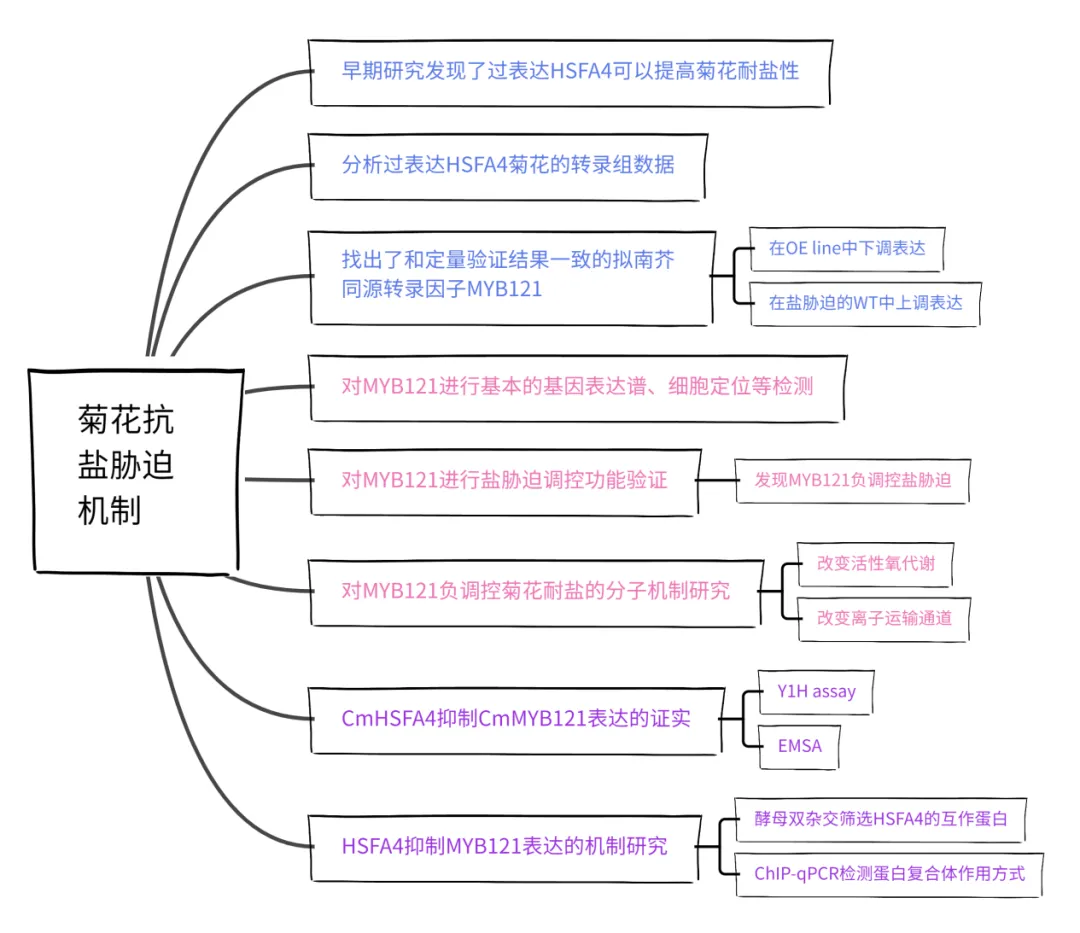
为了研究之前发现的基因CmHSFA4提高菊花抗盐胁迫能力的分子机制,研究者首先对CmHSFA4过表达菊花进行了转录组测序。在差异基因中,发现有8个转录因子相比WT呈下调表达,并经过RT-qPCR验证,其中Unigense68526-All在盐胁迫处理组中呈上调表达;推测该基因受盐胁迫诱导表达,并且其表达受HSFA4的抑制(图1A)。该基因编码一个MYB转录因子,广泛参与植物盐胁迫响应,并通过遗传进化分析,发现其与AtMYB121同源性最高,因此将其命名为CmMYB121。接着研究者对CmMYB121进行了组织表达谱、亚细胞定位、自激活活性等检测分析(图1B-F)。结果发现MYB121是一种具有核定位的盐诱导转录激活因子。
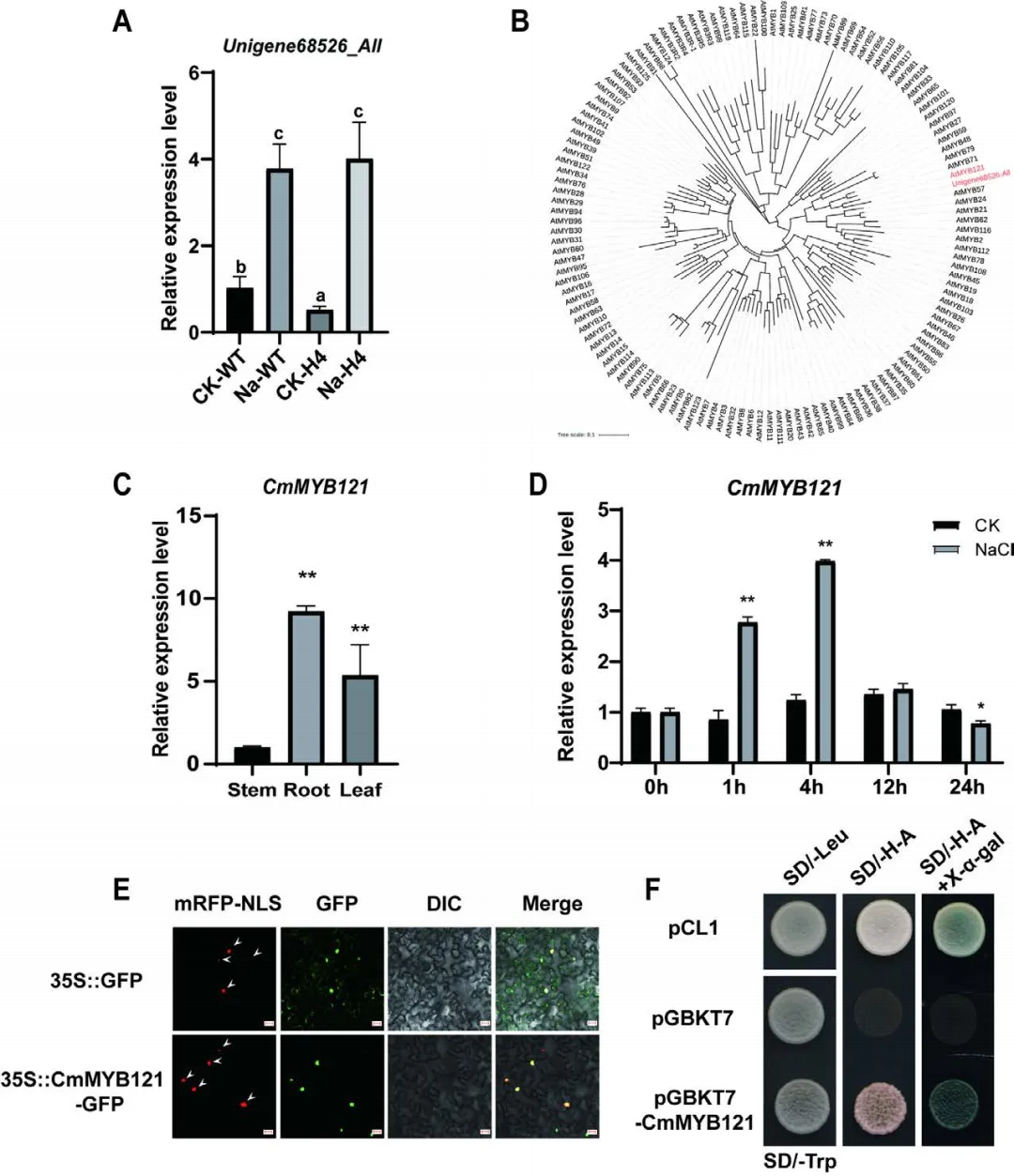
图1 CmMYB121系统发育树,表达模式,转录激活和亚细胞定位分析
2. CmMYB121负调控菊花的耐盐性
为检测CmMYB121在菊花对盐胁迫响应中的作用,研究者构建了过表达株系(CmMYB121-OE)和嵌合体显性抑制株系(CmMYB121-SRDX)。通过观察菊花幼苗在盐胁迫条件下及恢复条件下的生存率,发现CmMYB121对菊花的耐盐性具有负调控作用(图2)。
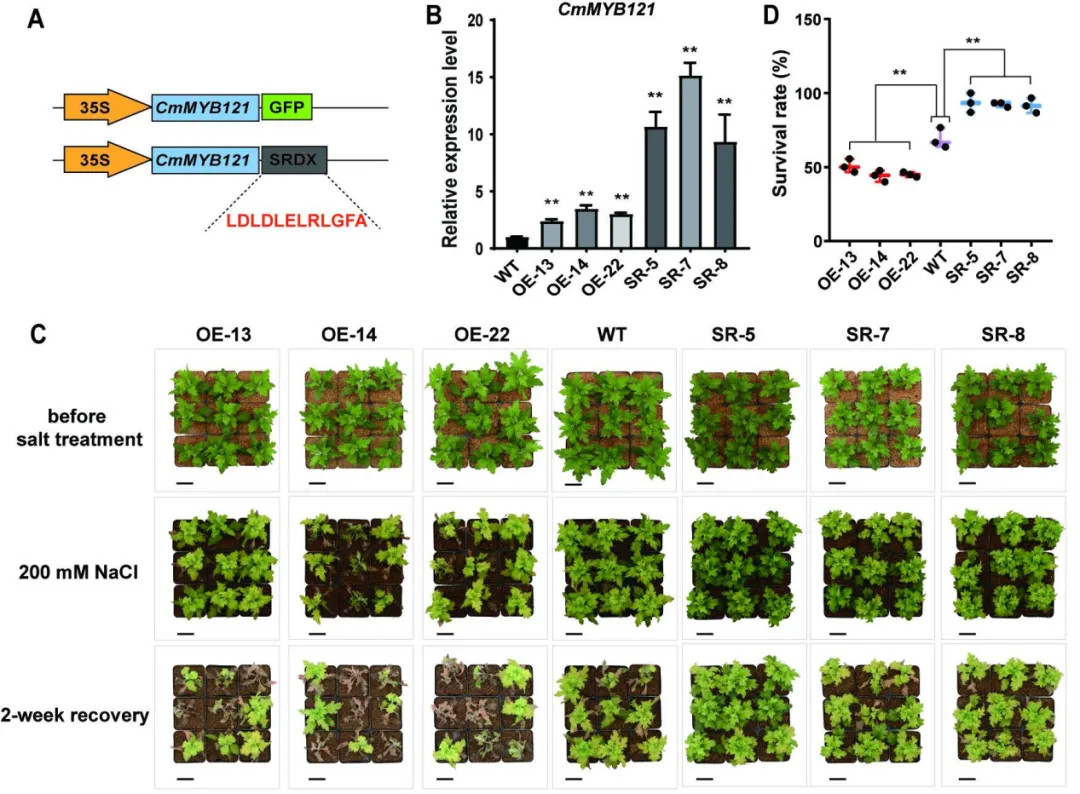
图2 CmMYB121负调控菊花的耐盐性
3.CmMYB121通过调控ROS代谢及离子运输抑制菊花耐盐性
先前的研究发现CmHSFA4是通过调控抗氧化及离子转运增强菊花耐盐胁迫的,本研究结果显示CmMYB121可能作用于CmHSFA4下游,由此推测CmMYB121是否也通过作用于ROS代谢及离子转运来抑制菊花耐盐性?为了验证该推测,研究者对转基因菊花中ROS代谢及离子转运相关基因表达、过氧化酶活性及Na+、K+含量等进行了定量检测,检测结果验证了该推测。
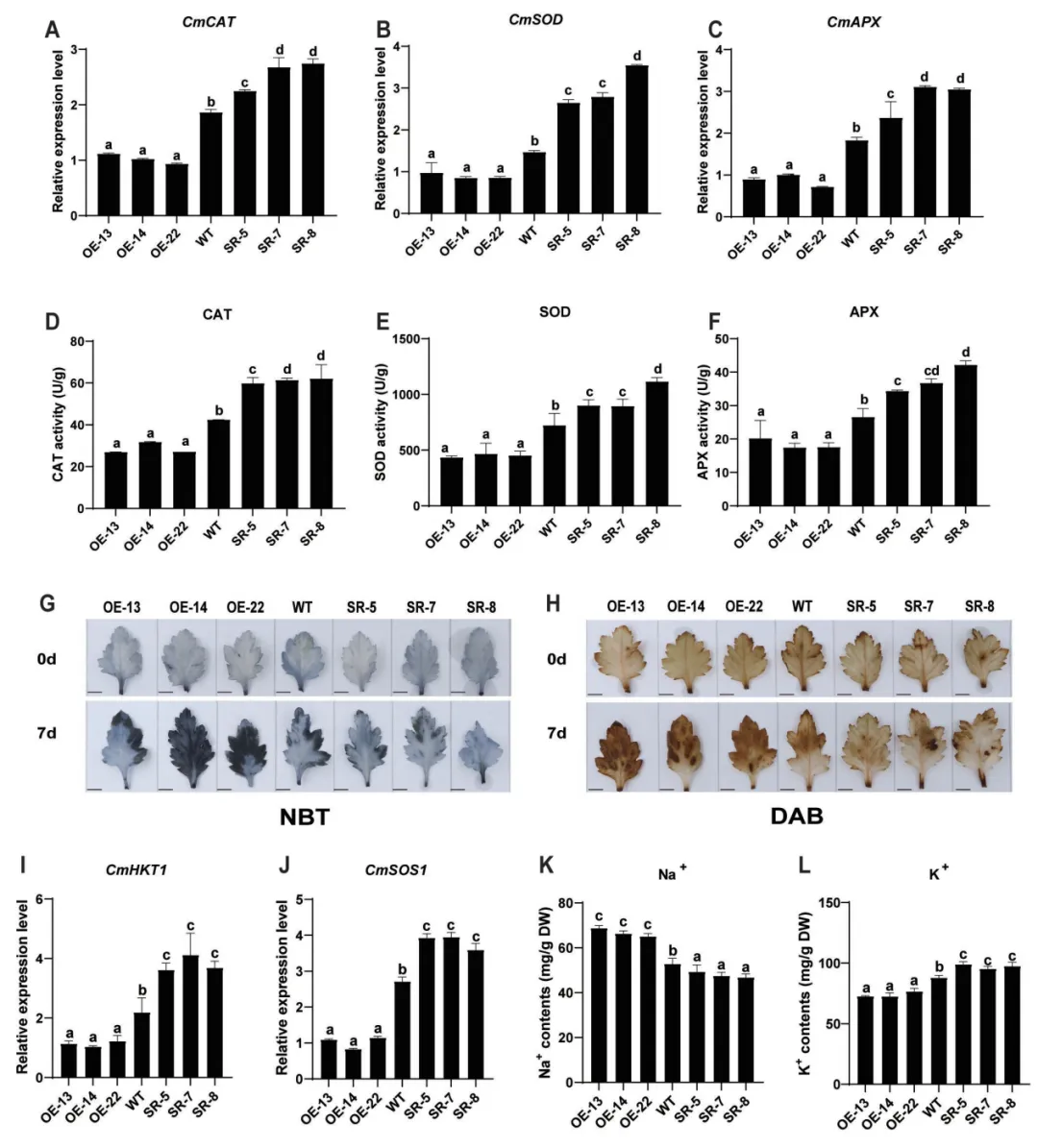
图3 盐胁迫下CmMYB121转基因菊花中ROS和Na+ /K+的含量及相关基因的表达水平
4. CmHSFA4抑制CmMYB121的表达
由于CmMYB121在CmHSFA4-OE(H4)株系中被下调表达,并且CmMYB121启动子上存在2个HSE顺式作用元件,因此推测CmMYB121可能是CmHSFA4的直接靶基因。研究者通过酵母单杂交、EMSA及Chip-qPCR对此进行了验证(图4A-D),发现CmHSFA4确实可以特异结合CmMYB121启动子上的2个HSE元件。瞬时沉默CmHSFA4后,CmMYB121表达量显著增加(图4E),说明CmHSFA4通过直接靶向CmMYB121抑制其表达。
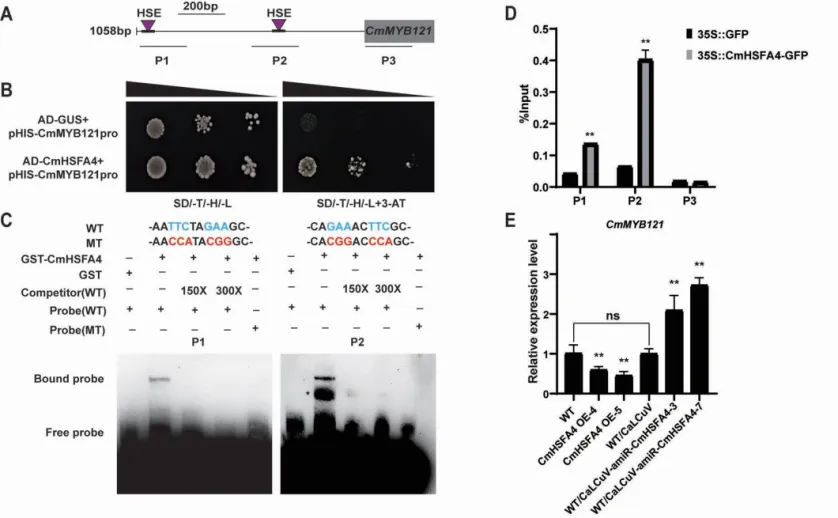
图4 CmHSFA4直接抑制CmMYB121的表达
5. CmHSFA4与CmMYBS3互作及CmMYBS3的功能验证
为了更好地阐明CmHSFA4介导的CmMYB121表达抑制机制,研究者使用CmHSFA4-ΔAHA(去除了激活域)作为诱饵进行了酵母双杂交文库筛选,旨在识别与CmHSFA4相互作用的蛋白,从而深入理解其在调控CmMYB121表达中的作用。在筛选到的互作蛋白中,CmMYBS3,一个典型的转录抑制因子引起了研究者的注意。通过Y2H assay、LCI、BiFC及pull-down对互作进行了验证确认,发现CmHSFA4在体内和体外均与CmMYBS3发生物理相互作用(图5)。
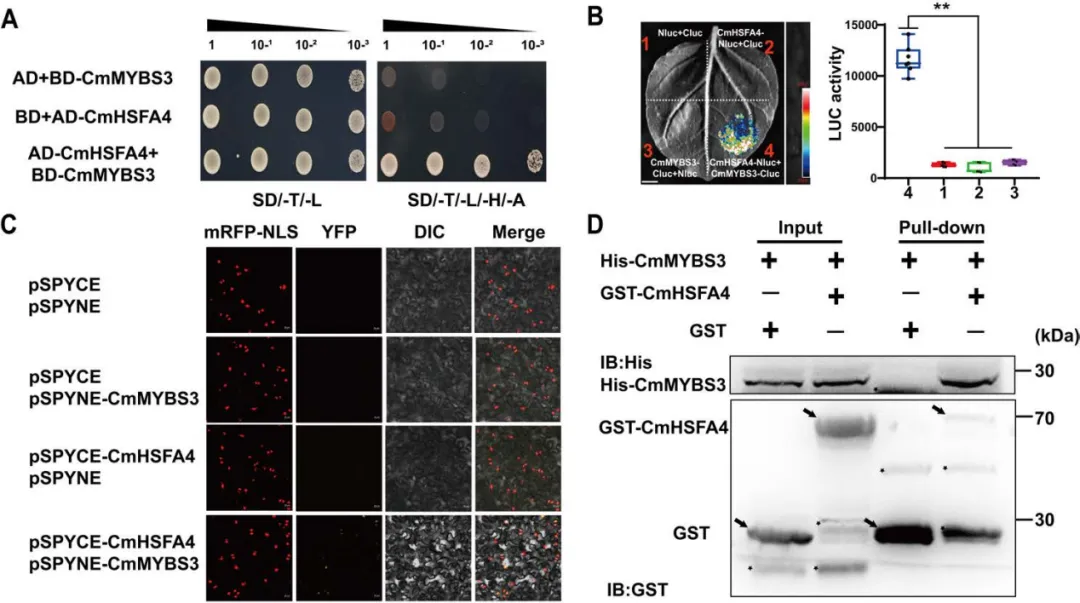
图5 CmHSFA4与CmMYBS3互作
接着研究者对CmMYB3进行了一系列的基因结构及功能检测和转基因功能验证,发现CmMYB3可以正向调控菊花耐盐胁迫(图6)。
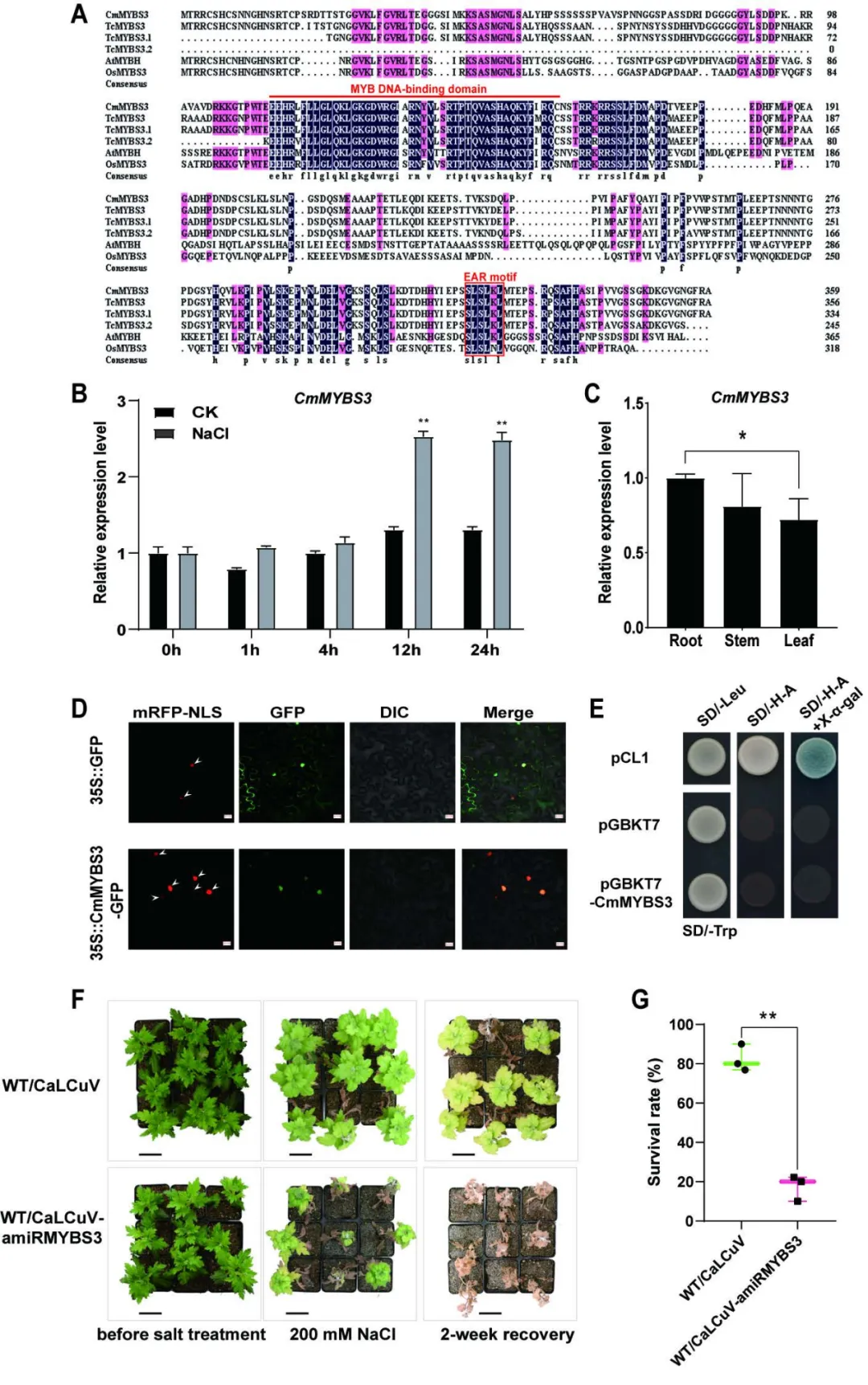
图6 CmMYBS3的基因特征及其对菊花耐盐胁迫的作用
6. CmHSFA4-CmMYBS3复合物招募CmTPL降低CmMYB121启动子区H3、H4乙酰化水平
已有研究表明含有EAR结构域的转录因子,可能会通过招募TPL或TPR家族蛋白,影响靶基因的组蛋白乙酰化水平,抑制靶基因表达。本研究中,通过对CmMYB121启动子区组蛋白乙酰化水平检测以及其他更深入的研究揭示,CmMYBS3确实通过其C端EAR基序招募CmTPL形成CmHSFA4-CmMYBS3-CmTPL蛋白复合体,影响CmMYB121启动子区H3、H4乙酰化水平抑制了其表达,进而正调控菊花耐盐性。
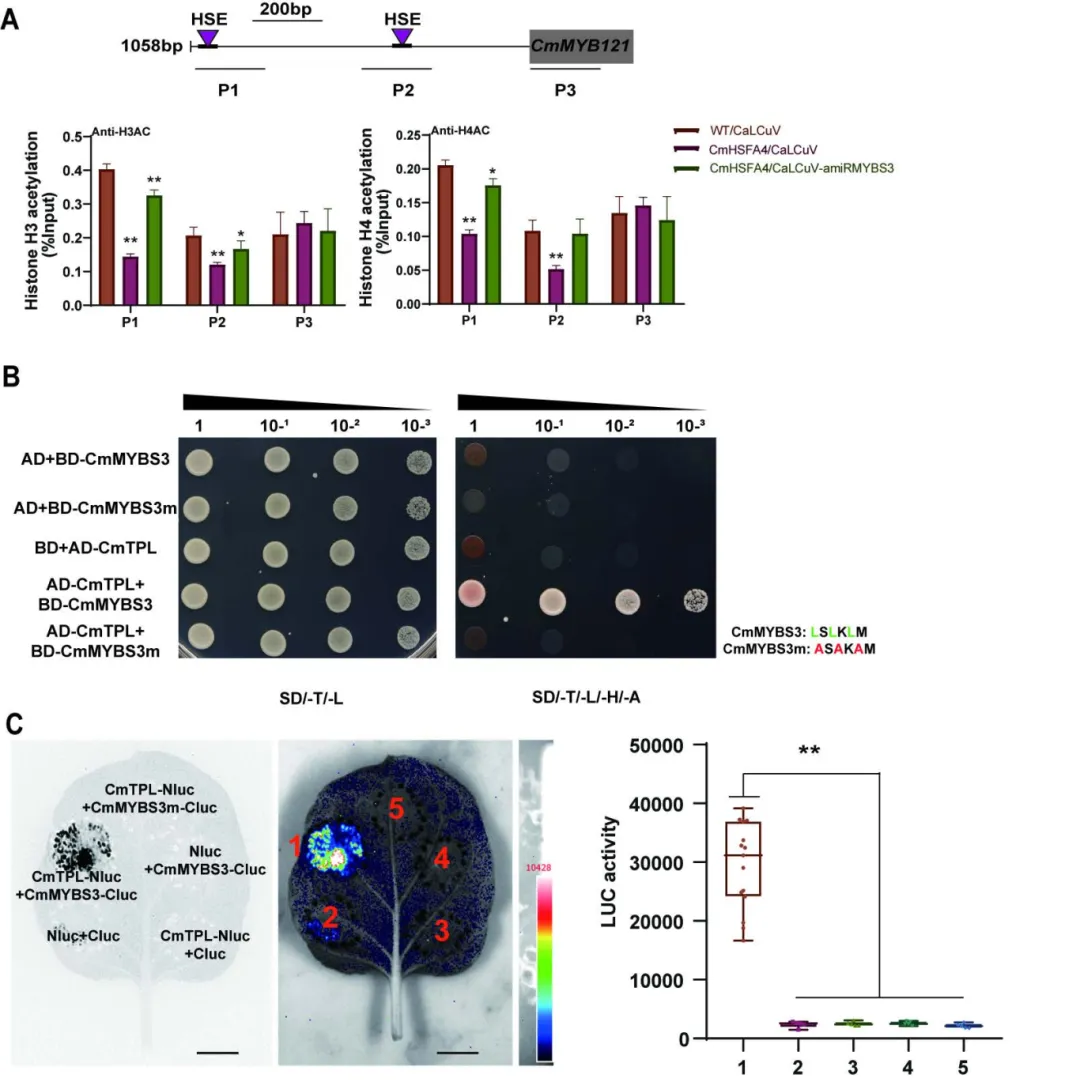
图7 CmMYBS3-CmTPL复合体减弱了CmMYB121组蛋白乙酰化水平
研究结论
本研究鉴定到了CmHSFA4下游的一个MYB转录因子CmMYB121,并通过酵母杂交筛选等一系列互作检测及转基因功能验证等实验,证明了CmHSFA4-CmMYBS3-CmTPL复合体通过降低CmMYB121启动子区H3、H4的乙酰化水平来调节其表达,从而增强了菊花对盐胁迫的耐受性。这些发现为解析盐胁迫基因调控网络提供了新见解,为培育耐盐菊花提供了基因资源。
南京农业大学园艺学院陈素梅教授为该论文的通讯作者,钟山青年研究员王新慧博士为本文第一作者,硕士生王悦、蒋雨含、王晗,已毕业博士生李菲,本团队陈发棣教授、蒋甲福教授、王利凯教授和周李杰老师参与了部分研究工作。该研究得到了国家重点研发计划、国家自然科学基金、江苏省重点研发计划和海南省自然科学基金等项目的资助。






