单细胞转录组检测技术以及时空多组学检测技术是近年来在植物研究领域迅速崛起的前沿技术,凭借其高分辨率、高通量、多维度的优势,为解析植物生物学过程中的复杂性提供了更加清晰的视角。这一结合的核心优势在于能够同时捕获基因表达以及代谢物水平的全景图谱,结合空间信息,绘制高分辨的植物细胞以及相关分子功能的大型图谱,推动植物科学研究的边界。虽然单细胞时空多组学在植物领域的应用潜力巨大,但任何技术的发展都会遇到些许瓶颈,目前单细胞时空多组学的主要难点有以下几个方面[1][2][3]。
植物细胞有细胞壁,想要提取原生质体,细胞壁的消化是一道无法跨越的门槛,但不同植物根据其发育时间的不同,对酶的响应也截然不同,导致实验方法的保真度和实用度无法得到广泛验证,是一个极其个性化的流程。
植物细胞的解离会引起细胞的应激反应,激活抗逆性基因,引入误差。且解离会存在一定的细胞偏好性以及细胞器基因污染。相较之下,对植物细胞进行提核并通过流式过滤碎片似乎成为一个较为理想的替换方案,但也需要考虑提核势必会丢失一部分转录表达信息。
在空间实验中,由于不同植物种类的组织差异显著,标准化的实验流程往往缺乏普遍的参考价值。此外,植物细胞本身的复杂结构也为冰冻切片这一实验操作带来了诸多挑战。例如,植物的木质化程度、淀粉含量、细胞壁的坚硬程度、是否存在气孔以及是否含有特殊的次生代谢物等因素,都会增加切片的难度以及脱片的风险,从而提升后续实验的复杂性。
目前,空间平台的迭代更新速度非常快,但应用上还是更加贴合哺乳动物组织,例如10x Genomics开发的空间转录组平台,分辨率已从一开始的100μm提升至2μm,但2μm的分辨率只适用于人、鼠物种,针对植物样本的空间平台分辨率仍有待进一步提升。
分析方面,单细胞空间多组学技术在植物物种上的应用规模有限,非模式物种会存在缺乏明确的标记基因、基因组注释不完整以及数据库不完善等情况。
10x Chromium平台通过将微流控技术和条形码技术相结合,能够高通量的鉴定每一个细胞中的基因表达谱,实现对细胞异质性的解析。
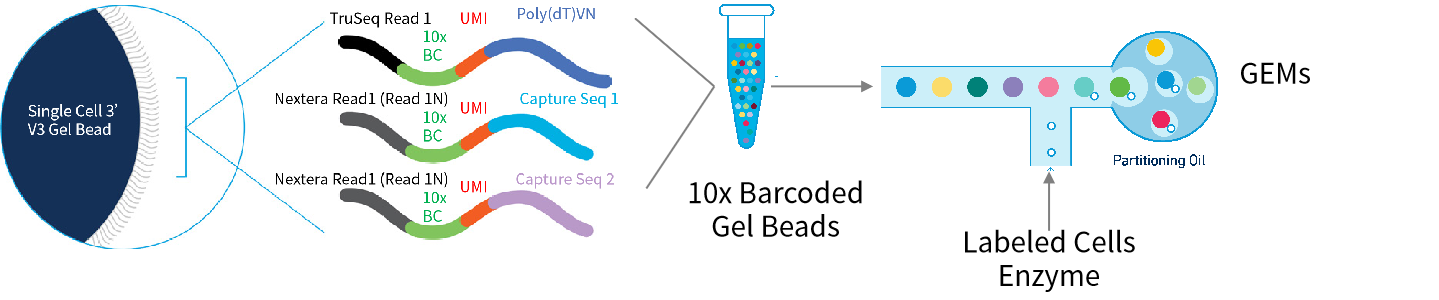
图1 | 10x Chromium凝胶珠结构以及油包水(GEMs)形成过程
(来源:10x Genomics)
10x Visium空间转录组采用了和单细胞平台类似的实验设计,在每一个spot中加入空间条形码来溯源基因的空间位置,UMI则用来定量基因表达信息。通过这个方法,既能从组织切片中得到不同基因的表达情况,又可以判断基因的表达是否有分布差异。
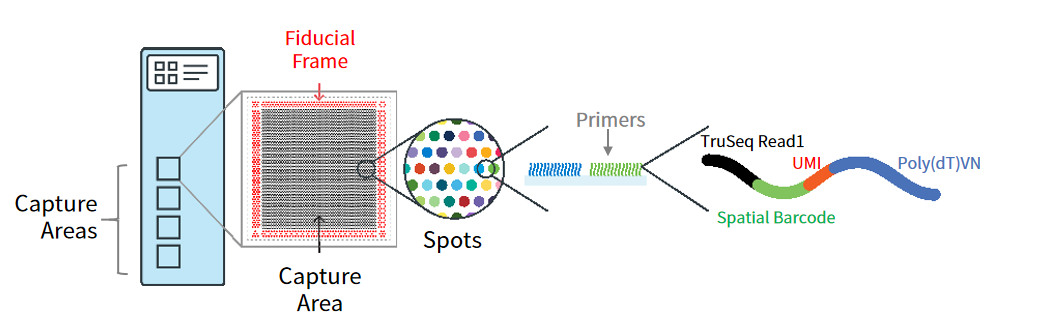
图2 | 10x Visium芯片捕获区域结构示意
(来源:10x Genomics)
欧易生物质谱空间代谢组采用DESI离子源的原位质谱成像技术,无需喷涂基质,可直接对冰冻切片、干燥的中药饮、新鲜且平整的花瓣/叶片等进行检测,以高通量的方式获得样本中70-1200Da之间的小分子物质进行定性、定量、定位信息,实现对样本中不同功能结构区域的代谢物分析。
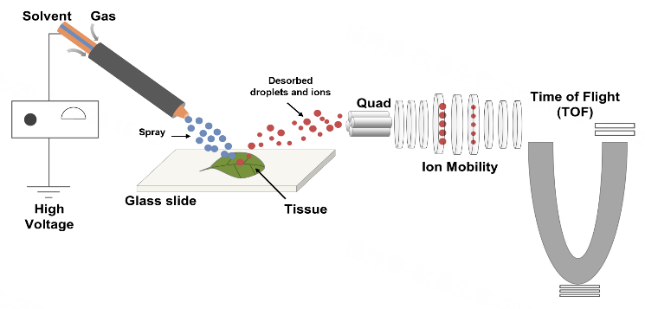
图3 | 基于DESI体系的空间代谢组成像流程
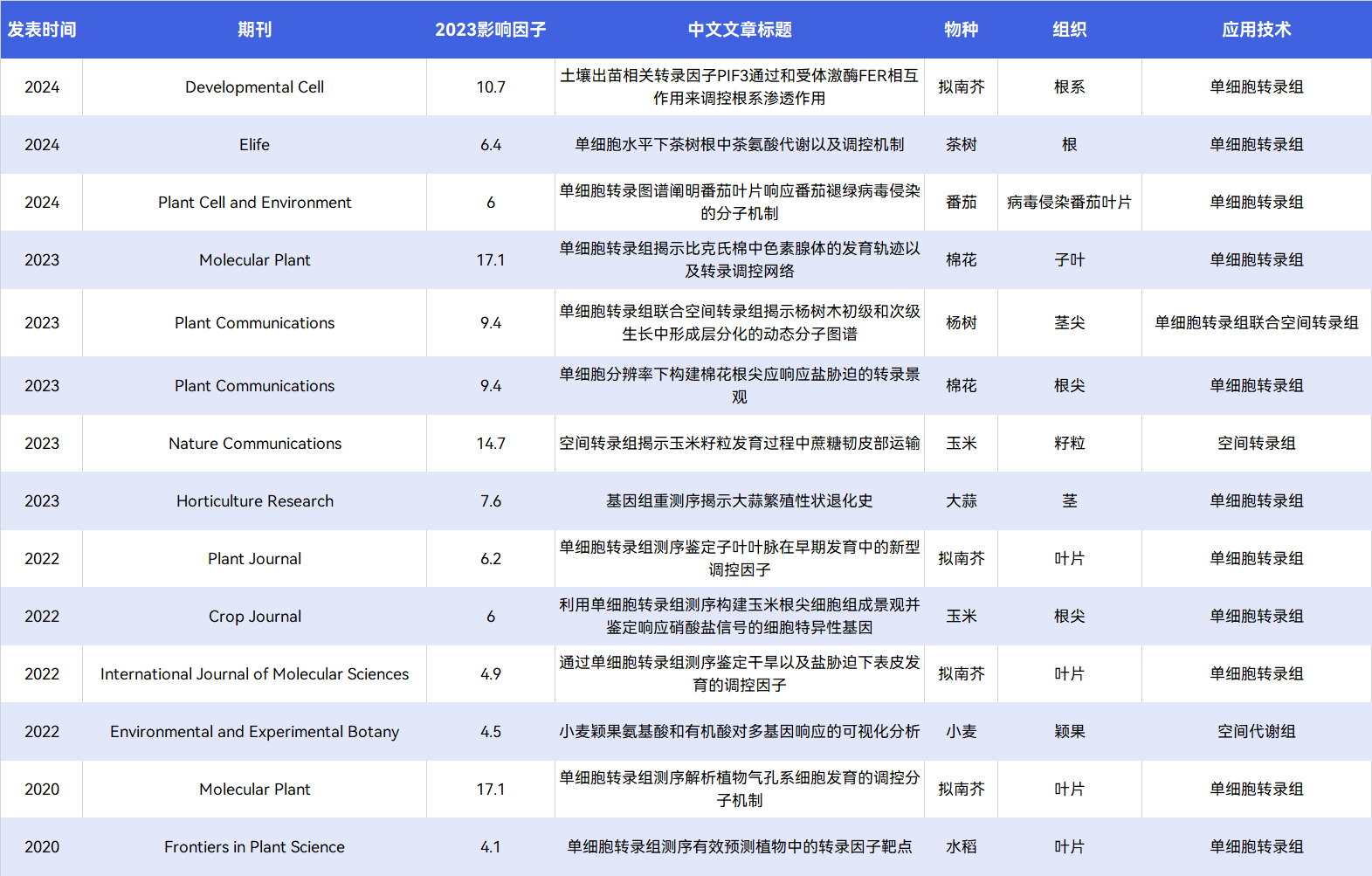
表1 | 欧易生物2020-2024年单细胞时空多组学植物领域客户文章汇总
单细胞转录组联合空间转录组案例文章
文章标题:单细胞转录组联合空间转录组揭示杨树木初级和次级生长中形成层分化的动态分子图谱[6]
发表期刊:Plant Communications
影响因子:9.4
发表时间:2023年7月
材料:栽培两个月的欧洲山杨变种'Nanlin895'
方法:10x Genomics 单细胞转录组测序以及10x Visium 空间转录组测序
原文解读:点击查看→
研究背景
研究结论
这篇文章通过将单细胞转录组测序与空间转录组测序结果相结合,揭示了杨树茎初级和次级生长组织的细胞类型以及转录景观。通过对数据进行拟时序轨迹的构建,解析了形成层的分化轨迹,揭示了其到木质部前体和韧皮部前体这一分化过程中所涉及的不同的基因调控网络。此外,研究还讨论了一些潜在的能够调控次生细胞壁形成的标记物,并且暗示了部分调控次生细胞壁形成的基因是具有细胞特异性的。对于导管和纤维细胞亚群的探究也明确了纤维以及导管相关基因的表达是遵循着渐进的模式。
本研究通过构建和比较杨树木材形成组织的细胞发育轨迹来描述木材形成的细胞图谱和调控网络,为了解树木茎干生长过程中的细胞分化过程提供了新的视角。
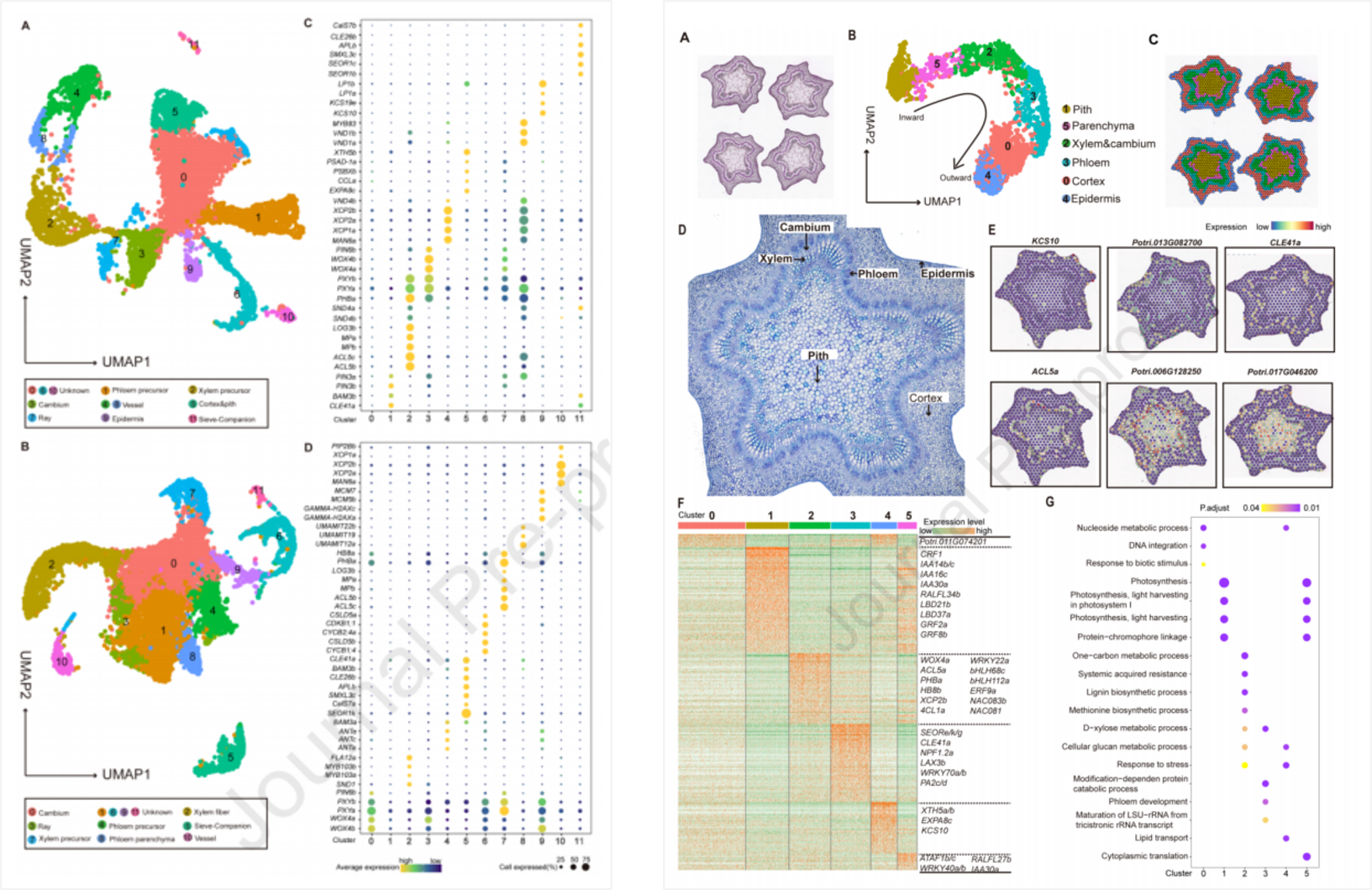
图4 | 初级和次级生长的杨树组织单细胞转录景观以及杨树茎第四节组织空间转录景观重构
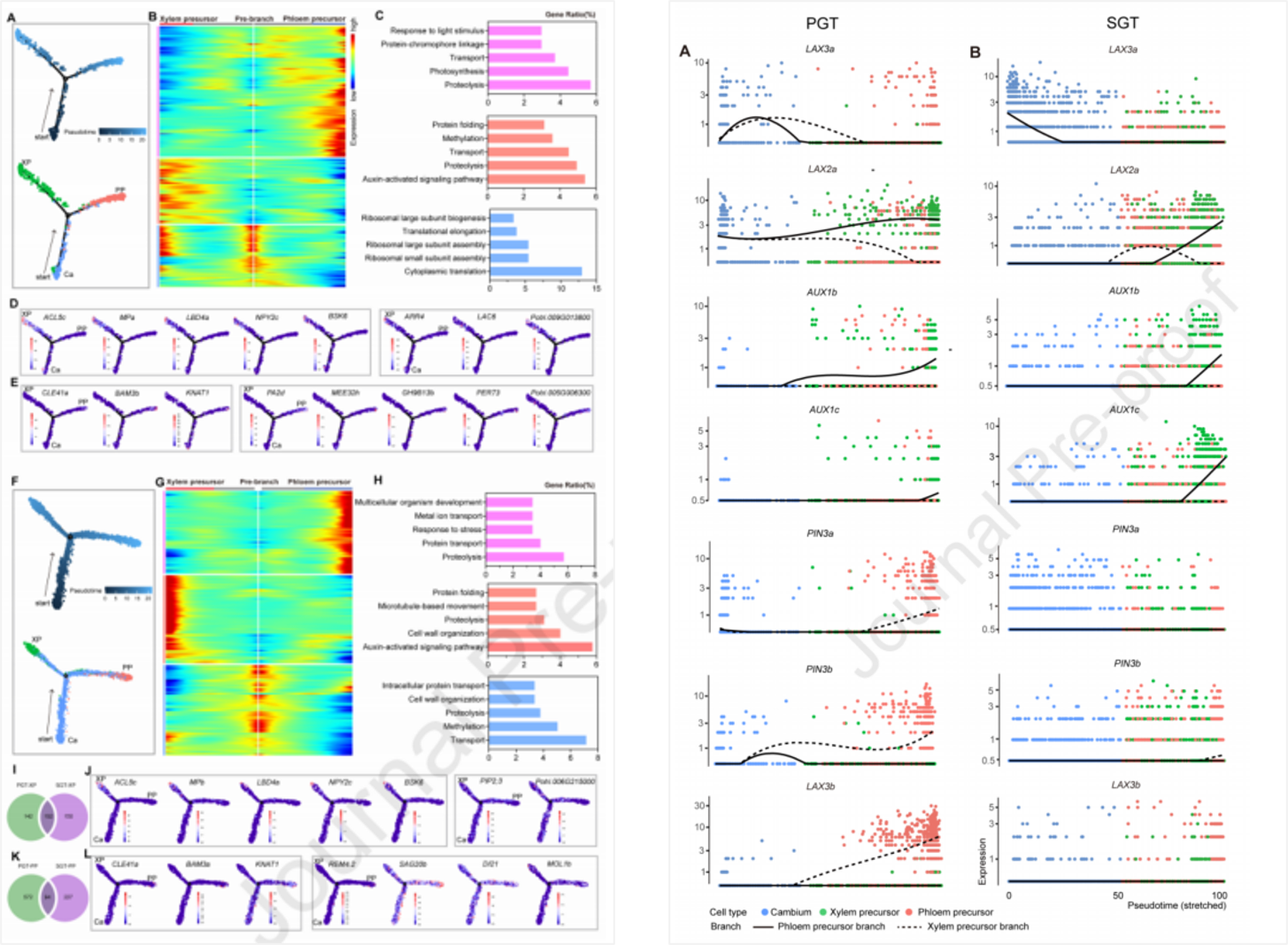
图5 | 初级生长组织和次级生长组织的形成层分化轨迹以及参与其中的植物生长素转运体的表达动态
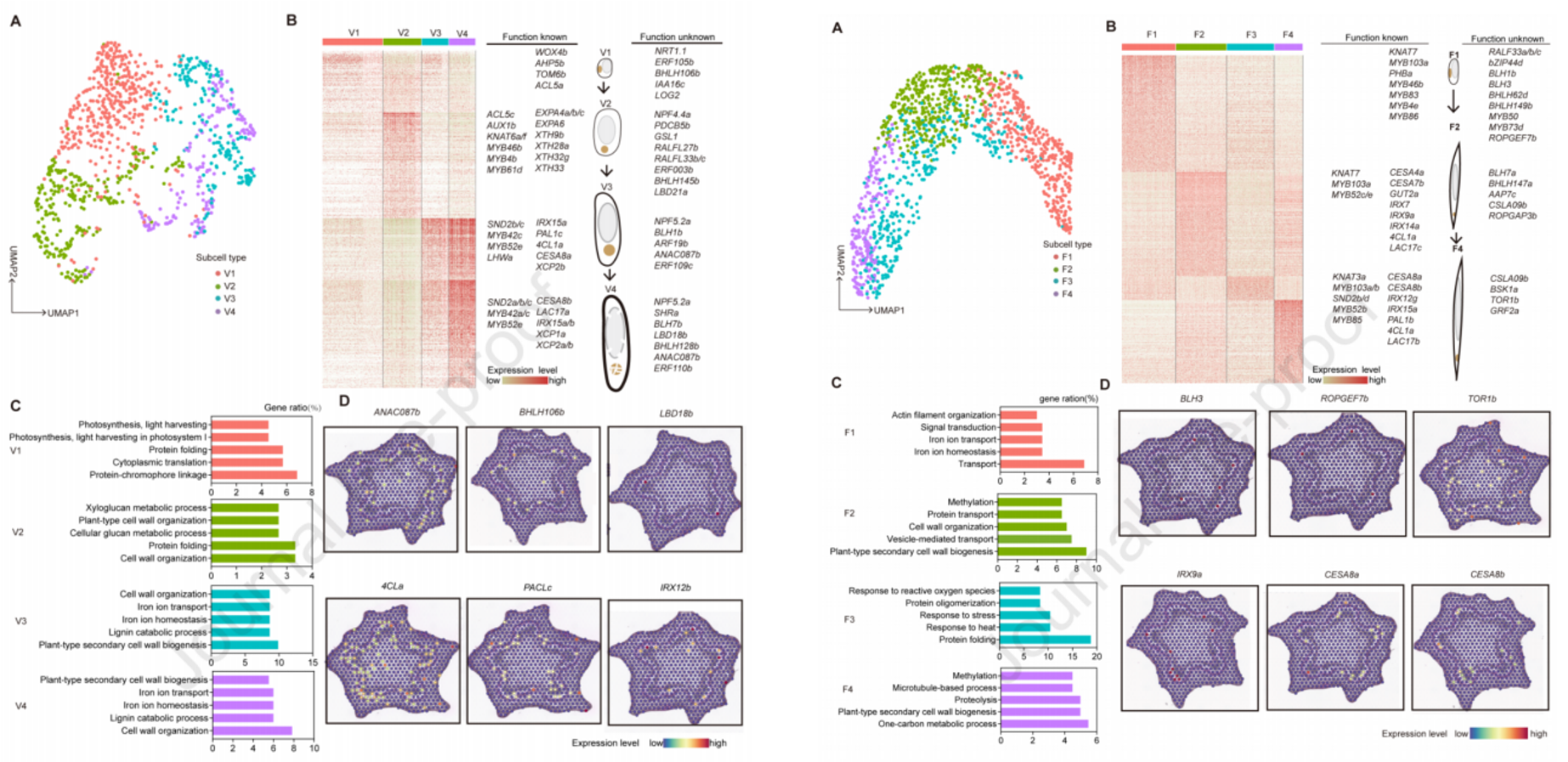
图6 | 导管以及纤维亚群分析
单细胞转录组
如果采用提取原生质体的方案,可直接运送完整植株。植株的承装容器需要固定好,必要时可用泡沫板填充空隙处以及用固定架包裹,避免因运输导致样本受损,常温运输即可。
如果采用提核的方法,则需采集目标样本部位(最好为淀粉含量低的新鲜幼嫩组织),如果是从培养基或土壤中采集的根部组织,应用流水洗掉培养基或泥土、用吸水纸吸取多余水分后立即液氮速冻并-80°C保存或足量干冰运输至公司。
空间转录组
取目标植物部位并修剪至目标大小,用镊子将其放入底部有OCT包埋胶的包埋盒中,确认样本摆放无误后补加包埋剂并使其完全浸没在包埋胶中。针对含水量大、表面不光滑且组织内部连接不紧密的植物样本,可以进行抽真空的处理。处理完毕后,将包埋盒转移至干冰上进行速冻,30min后-80°C保存或足量干冰运输至公司。
空间代谢组
取目标植物部位并修剪至目标大小,用镊子将其放入底部有Leica包埋胶的包埋盒中,确认样本摆放无误后补加包埋剂并使其完全浸没在包埋胶中。处理完毕后,将包埋盒转移至干冰上进行速冻,30min后-80°C保存或足量干冰运输至公司。
多组学联合
如需同时进行空间转录组以及空间代谢组的研究,需要用Leica胶进行包埋,且遵循空间代谢组的样本处理流程。单细胞转录组联合空间转录组需按照各自的样本处理流程进行样本的处理工作。
[6] Li R, Wang Z, Wang JW, Li L. Combining single-cell RNA sequencing with spatial transcriptome analysis reveals dynamic molecular maps of cambium differentiation in the primary and secondary growth of trees. Plant communications. 2023;4(5):100665-100665.
doi:https://doi.org/10.1016/j.xplc.2023.100665.







