2025年8月5日,哈尔滨医科大学附属第二医院心血管病医院院长、心内科主任于波教授、张毛毛教授团队和哈尔滨医科大学校长季勇教授团队合作,在Circulation (IF=38.6)上发表题为“Single-Cell Multi-Omics Identifies Specialized Cytotoxic and Migratory CD8+Effector T Cells in Acute Myocarditis”的论文,首次结合多种高通量技术对急性心肌炎进行免疫表型分析,鉴定了一类具有高细胞毒性和迁移潜能的CD57+CD8+效应T细胞,揭示其分化由促炎单核细胞分泌的IL-18驱动,并通过CCR5介导的心脏招募加剧心肌损伤的机制,该研究结果为理解急性心肌炎的发病机制提供了新的见解和潜在的治疗策略。欧易生物为单细胞转录组测序及分析提供了技术支持。

发表期刊:Circulation
影响因子:38.6
涉及的欧易生物服务产品:单细胞转录组测序
急性心肌炎(AM)是一种危及生命的炎症性心脏病,暴发性心肌炎(FM)是AM的一种致命形式,起病突然,心脏功能迅速恶化,诊断具有挑战性。当前治疗依赖广谱免疫调节疗法,但因对疾病机制理解不足而存在特异性差和副作用大的局限。尽管免疫介导的心肌损伤(尤其是过度活化的免疫反应)被公认为AM(特别是FM进展)的关键驱动因素,但具体致病性免疫细胞亚群(如T细胞)的身份、功能及其调控机制仍不明确。单细胞组学技术的发展为高分辨率解析免疫异质性提供了可能,此前缺乏在严格临床分型的成人AM(尤其是FM)患者中进行的整合多组学研究,阻碍了对疾病特异性免疫特征和干预靶点的发现。因此,深入阐明AM(特别是FM)的免疫细胞图谱、识别关键致病亚群及其上游调控信号,是开发精准有效疗法的迫切需求。
本研究通过单细胞多组学技术分析了15例AM患者(12名轻型,3名暴发性)和7名无症状对照者的PBMC和血浆。研究发现,一类特殊的CD57+CD8+效应T细胞在AM患者中显著扩增,这类细胞具有高细胞毒性和迁移潜能,且FM中富集程度更高,其表面自然杀伤样受体(如KLRC2)的表达增强与病理严重性相关。循环中升高IL-18由促炎性CXCL8+CD14+单核细胞分泌,可驱动CD57+CD8+效应T细胞的分化,进而诱导心肌细胞凋亡。在柯萨奇病毒B3诱导的FM小鼠模型中,研究者观察到类似的CD57+CD8+效应T细胞和CXCL2+LY6C+单核细胞扩增,并证实阻断IL-18信号、CCR5介导的免疫细胞心脏募集或清除促炎单核细胞,可显著减轻心肌损伤并改善心脏功能。这些发现揭示了AM(尤其是FM)中免疫介导心肌损伤的新机制,为靶向治疗提供了潜在策略。
Result 1 AM患者外周血单个核细胞的单细胞转录组图谱
为阐明急性心肌炎(AM),特别是暴发性心肌炎(FM)中的免疫反应和分子改变,作者选取了15名AM患者(12名轻型,3名暴发性)和7名对照者作为多组学子集,使用单细胞RNA测序(scRNA-seq)、单细胞TCR测序、CyTOF和Olink蛋白质组学分析了他们在急性期和恢复期的PBMC和血浆(图1A)。作者从scRNA-seq中获得了309,177个高质量的PBMC细胞。基于谱系特异性基因鉴定了七种主要细胞类型:CD8+ T细胞、CD4+ T细胞、γδ T细胞、NK细胞、髓系细胞、B细胞和巨核细胞(图1B和1C)。在不同疾病状态(心肌炎 vs 对照)、严重程度(暴发性 vs 轻型)、采样时间(急性期 vs 恢复期)或个体样本之间未观察到聚类偏差(图1D)。细胞密度显示心肌炎中CD8+效应T细胞显著扩增(图1E)。差异基因分析显示,CD8+ T细胞经历了最显著的转录变化,其次是CD4+ T细胞,其他细胞类型表现出中度的基因调控(图1F)。上调基因的功能富集显示其参与白细胞趋化和迁移(图1G)。与细胞毒性和迁移相关的基因在心肌炎发病后CD8+ T细胞中显著增加(图1H)。综上,CD8+ T细胞在心肌炎发病后表现出最显著的细胞密度和转录谱变化,显示出增加的免疫激活和募集能力,提示其可能是驱动心肌组织损伤和炎症的核心免疫亚群。
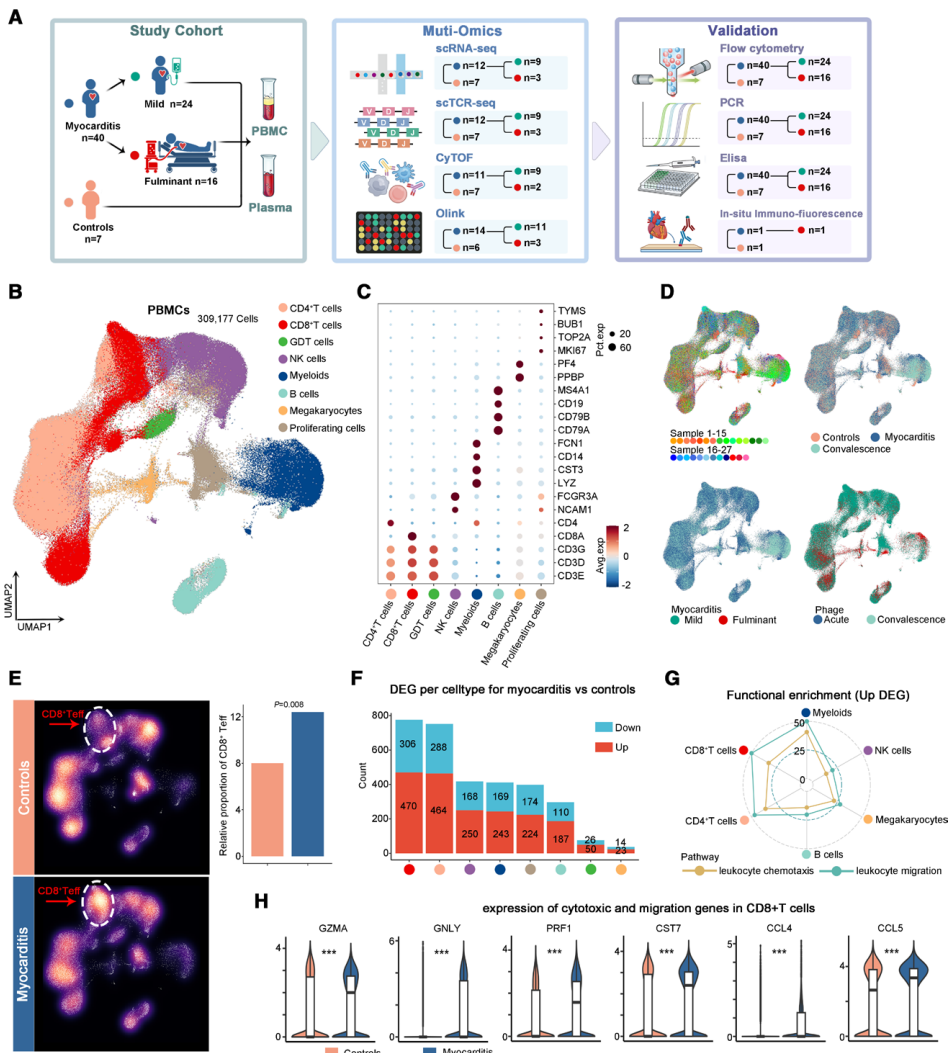
图1 对心肌炎患者队列的循环外周血单个核细胞(PBMC)进行单细胞RNA测序
Result 2 单细胞转录组学揭示AM中CD57+CD8+ T细胞向高细胞毒性和迁移潜能转变
为探索CD8+ T细胞在AM中的作用,作者通过亚群分析,并基于差异表达基因、经典标志物和精选特征谱鉴定了16个CD8⁺T细胞亚群(图2A-2C)。CD8+ T细胞的状态和组成在对照组和AM之间差异显著(图2C和2E)。大多数效应T细胞亚群(T03/T07/T10/T11/T12/T16)主要或仅分布在AM中,其中T16_Teff_KLRC2独特地分布在FM中,并在病毒性心肌炎通路中显著富集(图2F),表明这些细胞是心肌炎相关的CD8+效应T细胞。轨迹分析揭示了从初始T细胞出发的两条不同转变路径:轨迹1朝向心肌炎相关效应T细胞并伴随细胞毒性和迁移基因的上调,轨迹2朝向对照组富集的T09_Teff_CMC1,以抗原呈递和耗竭特征为标志(图2G和2H)。标志物筛选发现,B3GAT1(编码CD57糖蛋白)是唯一一个与所有心肌损伤标志物显著相关的基因(图2I和2J)。基于B3GAT1表达将CD8+ T细胞分为CD57-和CD57+亚群,CD57+细胞进一步分为轻型和FM富集亚群(图2K)。与CD57-亚群相比,CD57+亚群高表达细胞毒性基因(GZMB, NKG7, GNLY)、脱颗粒标志物(PRF1, LAMP1)、黏附分子(ITGAL, ITGB1, ITGB2)、趋化因子(CCL4, CCL4L2, CCL5)和STAT3(图2L)。且FM富集亚群较轻型亚群具有更强的细胞毒性/迁移特征及更低的耗竭评分(图2M)。综上,作者鉴定了一个与急性心肌炎相关,并具有高细胞毒性与迁移潜能的CD57⁺CD8⁺效应T细胞亚群。
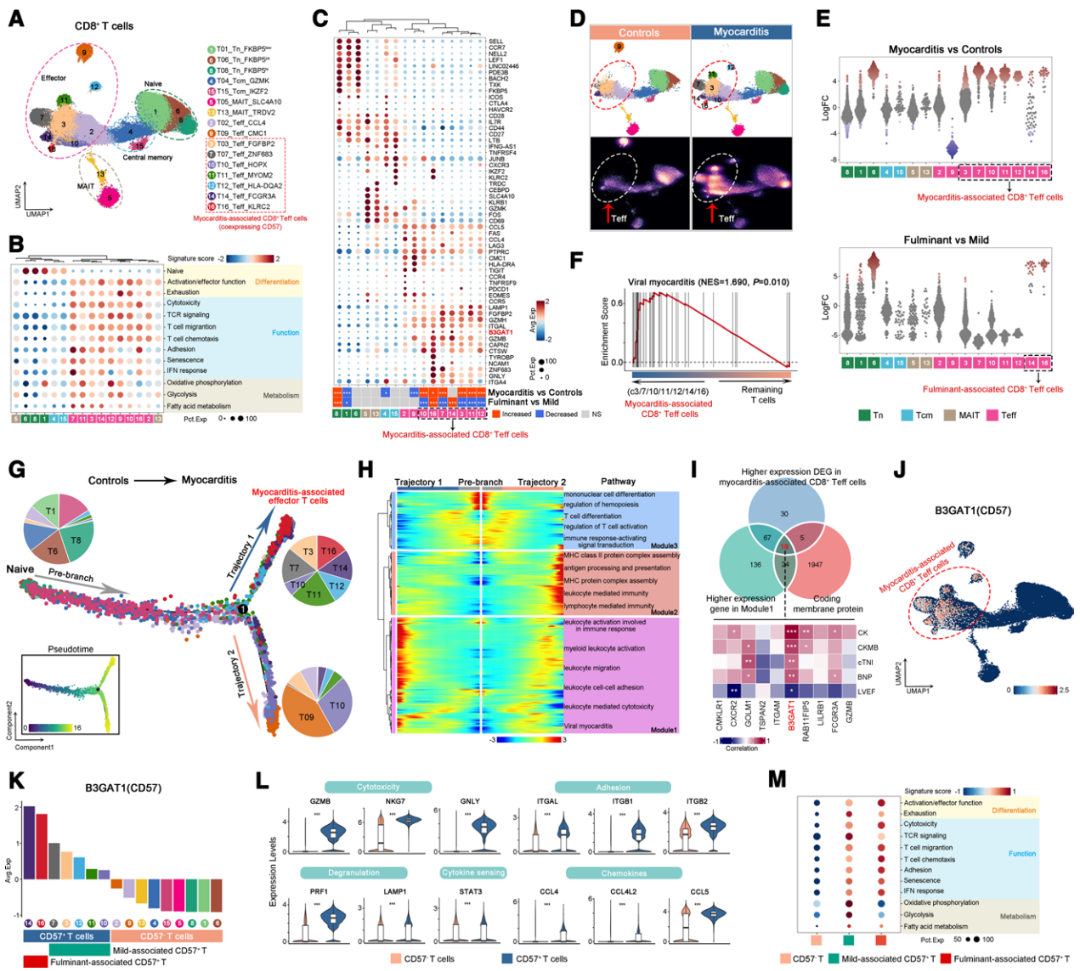
图2 心肌炎相关的CD57+CD8+T细胞的鉴定
Result 3 NK样受体表达升高与FM中CD57+CD8+效应T细胞的细胞毒性和迁移潜能增强相关
为阐明轻型和FM中CD57+CD8+效应T细胞的功能状态和转变,作者通过轨迹分析,揭示了一个从CD57+ T细胞向轻型相关的CD57+效应细胞,随后向暴发性相关的CD57+亚群的连续体,在此过程中细胞毒性与迁移基因持续上调(图3B),提示免疫激活和募集随疾病严重程度升级。差异基因分析显示,相较于轻型相关的CD57+亚群暴发性相关的CD57+亚群中NK样受体基因显著上调,特别是KLRC2(图3C)。基因集富集分析(GSEA)证实,NK相关通路和NK样特征谱的富集与细胞毒性和迁移程序呈正相关(图3D和3E)。具有高NK样特征谱的FM相关CD57+亚群更高表达细胞毒性以及多个KLRC家族基因(图3F和3G)。表明NK样受体的表达可能增强效应功能并驱动FM中的组织损伤。为了研究心肌炎中的克隆性T细胞扩增,作者分析了VDJ序列数据。发现与CD57-亚群相比,CD57+亚群显示出大规模的克隆扩增(克隆大小>100)(图3H)。克隆性CD8+ T细胞与非克隆细胞相比,B3GAT1、细胞毒性和NK样受体基因的表达升高(图3I)。FM富集的CD57+克隆性CD8+ T细胞表现出更强的细胞毒性/迁移特征和更低耗竭评分(图3J)。综上,CD57+CD8+效应T细胞在心肌炎发病后经历了实质性的克隆扩增并获得强效的效应程序,可能加剧免疫介导的心肌损伤。
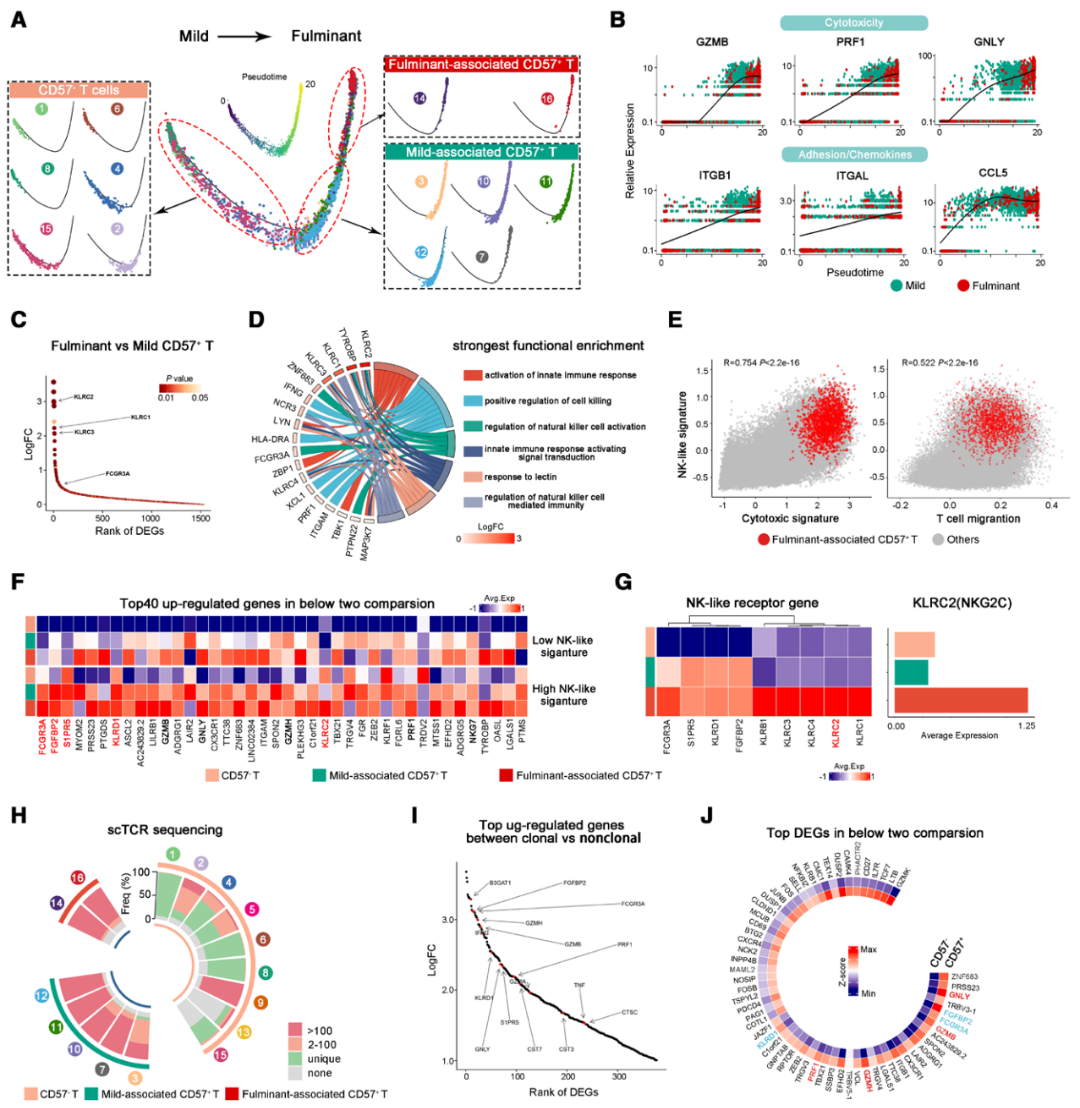
图3 暴发性心肌炎患者体内CD57+CD8+效应T细胞中自然杀伤细胞(NK)受体的高表达
Result 4 具有高细胞毒性和迁移潜能的CD57+CD8+效应T细胞被证实可诱导心肌细胞凋亡
作者通过流式细胞术证实,心肌炎患者外周血中CD57+CD8+ T细胞增加,其中FM患者显著性更高表达KLRC2、GZMB和CD107a(图4A-4D)。FM患者CD57+CD8+ T细胞在细胞毒性和NK样受体(GNLY, LAMP1, PRF1, KLRC2)以及趋化性(CCL4, CCL5)基因的表达水平最高,而耗竭相关基因(PDCD1, LAG3)表达较低(图4E)。为探究CD57+CD8+效应T细胞迁移至心脏的能力,作者对FM心脏活检组织和非心肌炎移植对照进行了CD3、CD8和CD57的共染色。发现FM组织CD57+CD8+ T细胞和CD68+单核细胞/巨噬细胞浸润增加(图4F)。CellChat分析显示,心脏损伤组织中CD8+ T细胞与心肌细胞或平滑肌细胞的相互作用增强,涉及趋化因子轴(CCL4或CCL5和CCR5;CXCL12和CXCR4)以及细胞毒性或凋亡通路(TNFSF10和TNFRSF10B;GZMA和PARD3;GZMA和F2R)。作者进一步将来自对照组或心肌炎患者的CD8+ T细胞与AC16心肌细胞共培养以探究CD57+CD8+效应T细胞对心肌细胞的直接细胞毒性作用,发现心肌炎患者的CD57+CD8+T细胞可诱导AC16心肌细胞凋亡增加、活性氧水平升高,并上调凋亡标志物BAX和PUMA(图4G-4J)。综上,在心肌炎中CCL4/CCL5-CCR5轴可能驱动致病性CD57+CD8+效应T细胞向心脏浸润,通过GZMB驱动心肌损伤。
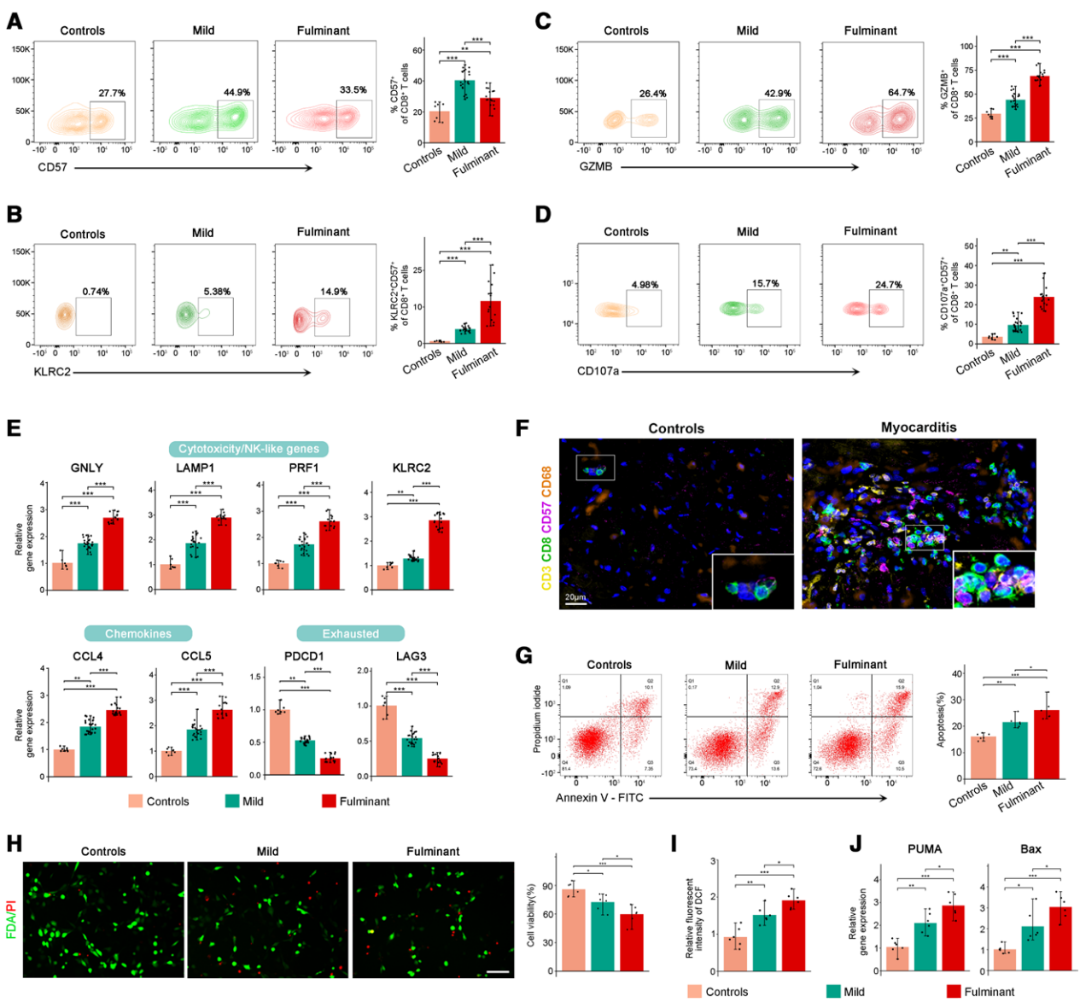
图4 心肌炎相关的CD57+CD8+效应T细胞可诱导心肌细胞凋亡,并具备向心脏趋化的能力
Result 5 循环IL-18促进具有高细胞毒性和迁移潜能的CD57+CD8+效应T细胞的分化
为探索影响CD57+CD8+ T细胞分化和迁移的系统性信号,作者通过Olink炎症因子面板检测血浆92种蛋白。主成分分析(PCA)显示,心肌炎与对照组相比存在独特的炎症谱(图5A)。其中60种蛋白在FM中表达最高(图5B和5C),提示存在系统性高炎症状态。ELISA进一步证实经典的促炎因子(如IL-6、CXCL8)随疾病严重程度升高(图5D)。ClueGO分析显示,这60种细胞因子显著富集于JAK-STAT信号通路(图5E),且IL-18是该信号通路中潜在的核心蛋白(图5F)。使用CytoSig(细胞因子信号)数据库预测以及交集分析,发现IL-18与CD57+CD8+T细胞呈正相关且能诱导B3GAT1表达(图5G),提示其驱动该亚群分化。作者进一步将从健康个体分离的CD3+ T细胞与对照组或心肌炎血清一起培养,发现心肌炎血清显著促进了CD57+CD8+ T细胞的分化,而IL-18中和抗体可消除这种效应(图5H和5I)。此外,重组IL-18增强了CD57+CD8+ T细胞的生成,并增加了它们的细胞毒性和迁移能力,而IL-18阻断剂逆转了这些效应(图5J和5K)。综上,循环IL-18是驱动CD57⁺CD8⁺效应T细胞分化的关键上游信号。
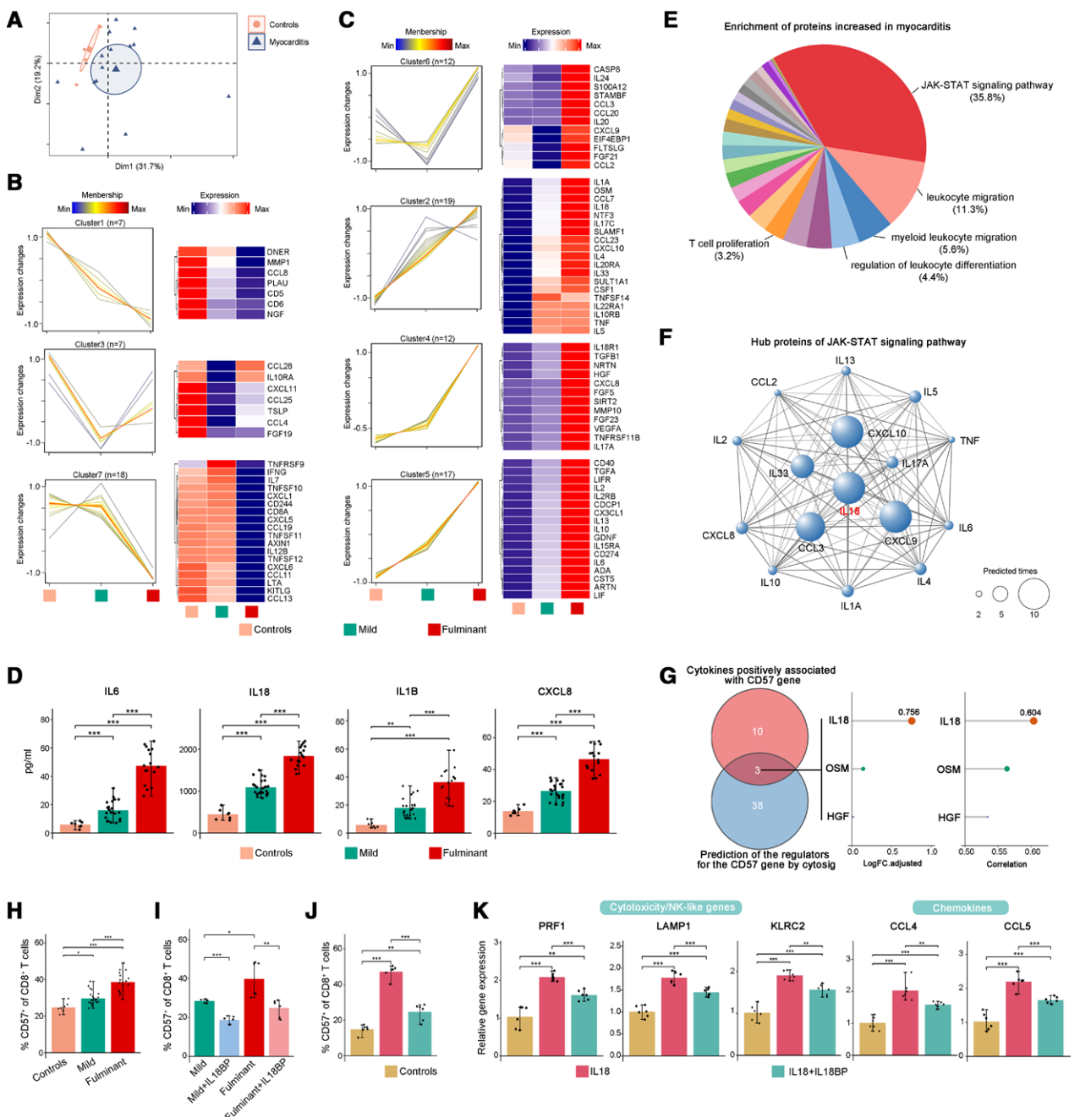
图5 循环中的IL-18促使分化形成具有高细胞毒性和高迁移潜能的CD57+CD8+效应T细胞
Result 6 循环IL-18升高主要由心肌炎特异性的CXCL8+CD14+促炎单核细胞贡献
为了探索细胞因子的来源,作者基于相关基因表达计算了细胞因子和炎症评分。FM表现出显著升高的炎症和细胞因子评分,提示系统性高炎症状态。髓系细胞是主要贡献者,其细胞因子评分在FM中显著升高,近半数细胞因子编码基因在该群体高表达(图6A)。基于经典marker将髓系细胞被分类为Mon_C1_CD16-IFITM1、Mon_C2_CD14-LGALS2、Mon_C3_CD14-CXCL8和DC_C4_TCF4。其中,Mon_C3_CD14-CXCL8表现出最强的炎症特征谱,并且是唯一在FM中显著扩增的亚群(图6B-6D)。流式细胞术进一步证实FM患者循环CXCL8+CD14+单核细胞比例显著增加(图6E)。且该亚群频率与Olink检测到的炎症细胞因子表达呈正相关(图6F-6H),表明其为循环细胞因子的核心来源。SCENIC分析显示,CXCL8+CD14+单核细胞优先表现出NF-κB相关调节子的活性,伴随NFkB1及其下游基因表达升高(图6I和6J),提示NF-κB信号驱动其活化,进而促进FM中的细胞因子风暴。
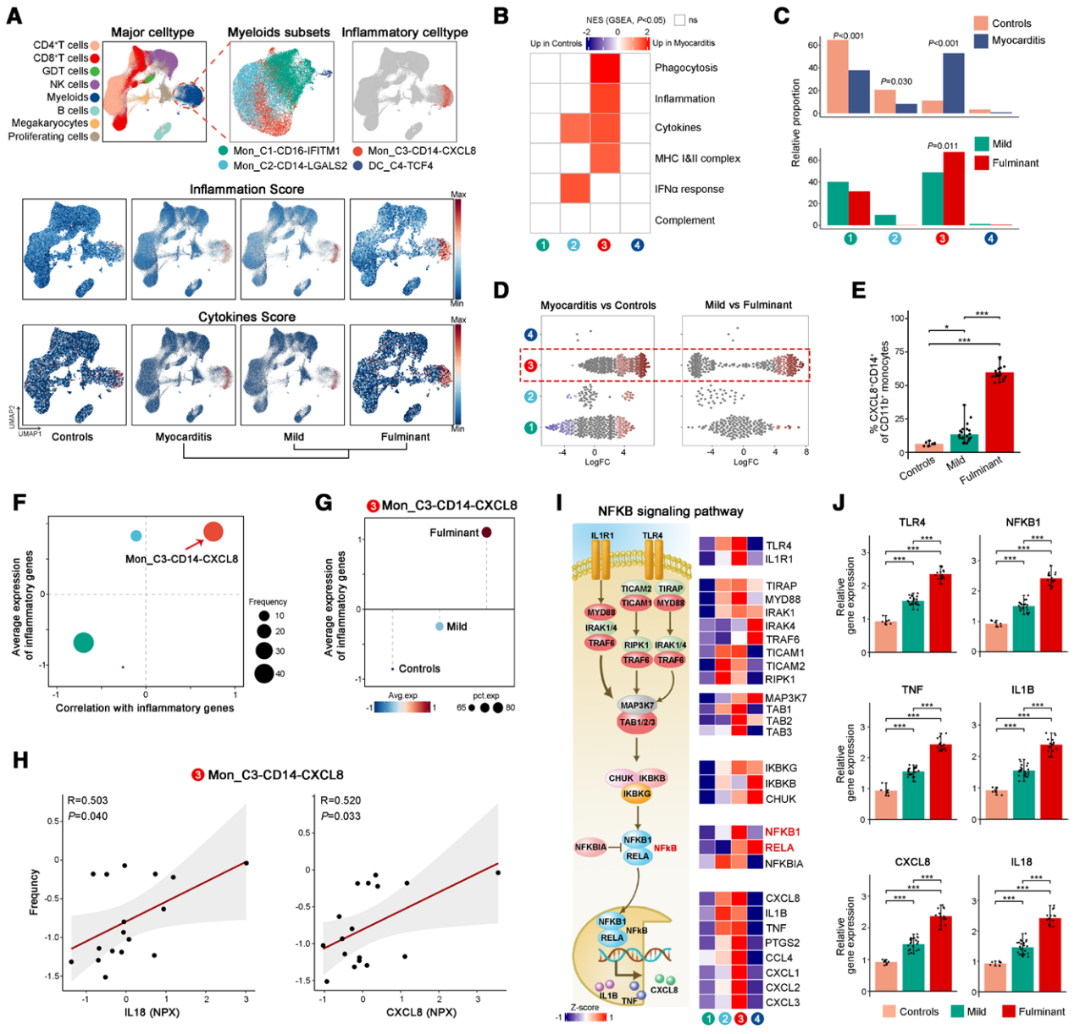
图6 循环中的促炎性CXCL8+CD14+单核细胞表现为炎症细胞因子风暴的主要来源
Result 7 CD57+CD8+效应T细胞和CXCL2+经典单核细胞在柯萨奇病毒B3诱导的FM小鼠中扩增
为验证人类研究中CD57⁺CD8⁺T细胞与促炎单核细胞在心肌炎中的作用,作者在A/J小鼠中建立柯萨奇病毒B3(CVB3)诱导的暴发性心肌炎(FM)模型(图7A)。使用CyTOF,在感染后7天使用2个抗体染色组合(T细胞和髓系细胞组合)分析了来自血液和心脏的免疫细胞,观察到心脏浸润的CD57+ CD8+ T细胞增加(图7B-7E),并高表达细胞毒性标志物(GZMB、PRF1、CD107a)、趋化因子受体(CX3CR1、CCR4)及活化标志CD69(图7F)。免疫荧光染色和流式细胞术进一步证实其心脏浸润(图7G和7H)。此外,细胞毒性(Prf1, Lamp1, Klrc2)和趋化因子(Ccl4, Ccl5)表达在CVB3感染的心脏中显著更高(图7I),并且CD57+CD8+ T细胞比FM小鼠中的CD57-CD8+ T细胞表达更高水平的Gzmb, Prf1和Lamp1(图7J)。血浆IL-18浓度在CVB3感染小鼠中也升高(图7K),支持其在致病性CD57+ T细胞分化中的保守作用。单核/巨噬细胞亚群分析发现,CXCL2⁺LY6C⁺单核/巨噬细胞在FM小鼠心脏中扩增(图7L-7P)。其促炎因子和NF-κB通路基因表达上调,提示活化促炎表型(图7Q和7R)。综上,作者在FM小鼠模型中证实CD57⁺CD8⁺ T细胞与CXCL2⁺LY6C⁺单核/巨噬细胞在FM中的致病作用与人类多组学发现一致,为心肌炎机制提供跨物种证据。
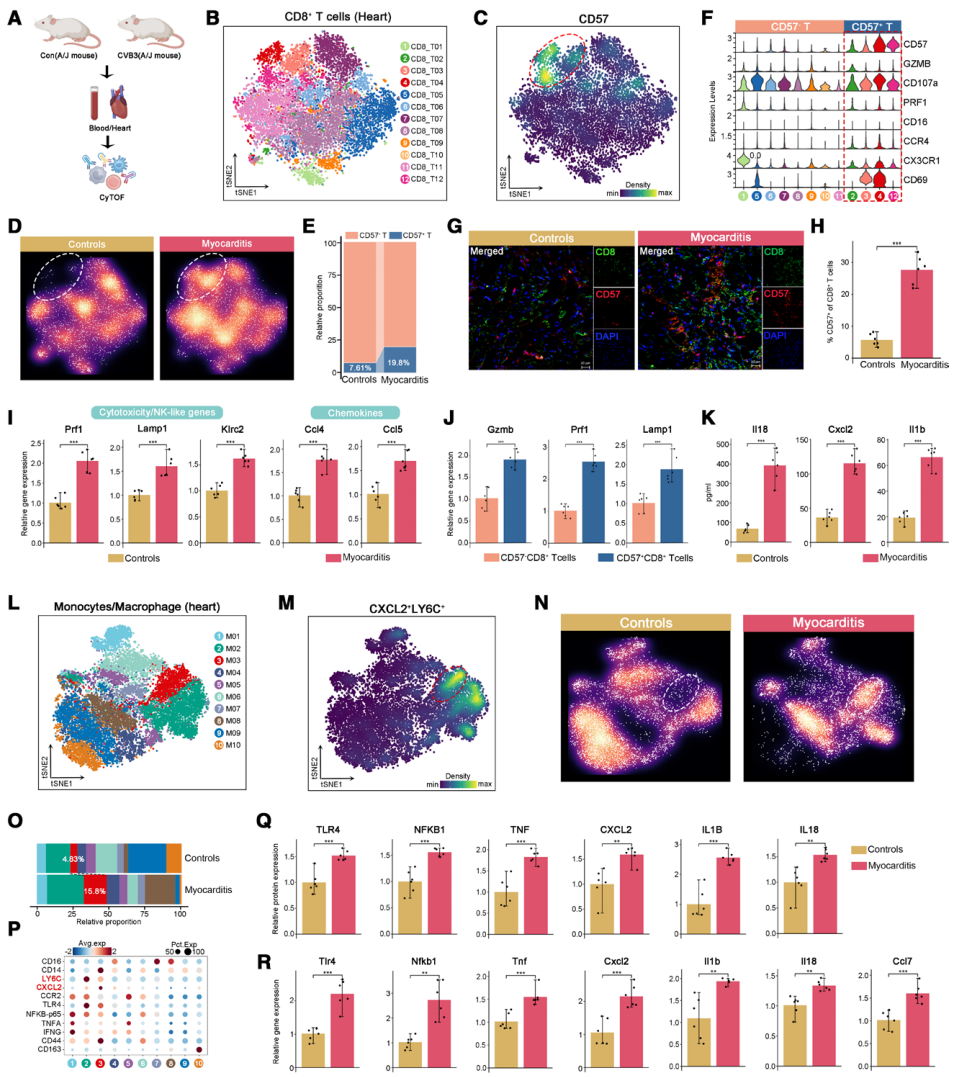
图7 小鼠暴发性心肌炎心脏组织中CD57+CD8+效应T细胞和CXCL2+LY6C+单核细胞的扩增
Result 8 靶向阻断IL-18信号传导、CCR5介导的募集和促炎单核细胞可改善心脏功能
为验证CD57+CD8+效应T细胞的致病作用,作者通过IL-18BP阻断IL-18信号,治疗显著降低了FM小鼠的死亡率,改善了体重及心脏功能,并减少了炎症浸润(图8A-8F)。且CVB3病毒滴度保持不变(图8G),表明疗效独立于病毒复制。IL-18BP还减少了心脏CD57+CD8+ T细胞浸润,并抑制了细胞毒性(Prf1, Lamp1, Klrc2)和趋化因子(Ccl4, Ccl5)的基因表达(图8H和8I)。此外,为了研究CCL5/CCL4-CCR5介导的募集是否驱动CD57+CD8+ T细胞浸润,作者用CCR5抑制剂Maraviroc治疗,该干预同样改善生存率、体重及心脏功能(图8J-N),未影响病毒滴度(图8P),并减少了炎症细胞浸润,特别是CD57+CD8+ T细胞(图8O-8Q)。表明抑制CD57+CD8+效应T细胞的功能分化和心脏浸润可以有效降低心肌炎的死亡率和心脏恶化(图8R)。
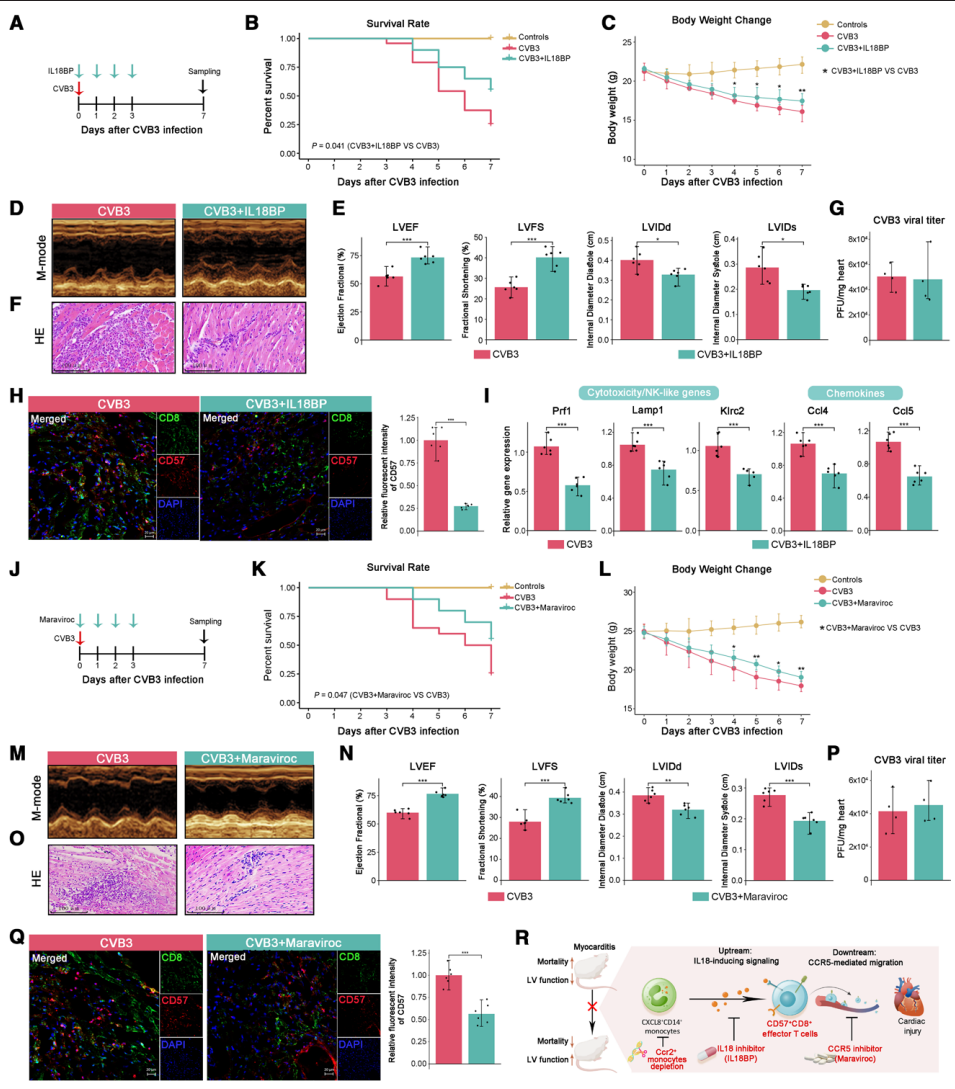
图8 阻断IL-18诱导的信号通路或CCL4/CCL5-CCR5介导的迁移作用,可减少暴发性心肌炎小鼠的心脏免疫细胞浸润并改善心功能
本研究首次通过多组学技术揭示,在AM(尤其是FM)中,克隆扩增的CD57⁺CD8⁺效应T细胞是核心致病亚群,其高细胞毒性、迁移潜能及NK样受体表达驱动心肌损伤。该亚群的分化由CXCL8⁺CD14⁺促炎单核细胞分泌的IL-18驱动,并通过CCR5介导心脏浸润。动物模型证实,阻断“单核细胞-IL-18-CCR5”轴可显著改善心脏功能,为靶向治疗提供新策略。
参考文献:
Tong Z, Yan X, Chen T, Song W, Su D, Wang N, Zhang Y, Kong Y, Wang D, Wang P, Chen Y, Wang X, Cui J, Sui J, Liu S, Li Y, Yang Q, Zheng Z, Jin Z, Li Y, Liu F, Li J, Qi L, Deng J, Li Z, Yang S, Jia H, Ji Y, Zhang M, Yu B. Single-Cell Multi-Omics Identifies Specialized Cytotoxic and Migratory CD8+ Effector T Cells in Acute Myocarditis. Circulation. 2025 Aug 5. doi: 10.1161/CIRCULATIONAHA.125.073836. Epub ahead of print. PMID: 40762079.






