欧易单细胞测序继续发力!近日,欧易生物合作客户复旦大学附属中山医院王群教授团队在Clinical and Translational Medicine(IF 11.492)发表早期和晚期肺腺癌肿瘤和免疫细胞图谱结果,欧易生物提供了该项目单细胞转录组测序相关工作,下面我们一起学习这篇文章的具体内容。

基本信息
材料:12例正常组织、11例早期肿瘤组织和6例晚期肿瘤组织;
期刊:Clinical and Translational Medicine
发表时间:2021年3月
方法:欧易生物10× Genomics scRNA-seq
研究背景和研究目的
肺癌是最常见的癌症,每年新增170多万例。目前的组织病理学分类表明,肺癌腺癌(LUAD)占所有肺癌的大多数。虽然LUAD的治疗有了显著的改善,但不同的LUAD患者表现出不同的特征和生存率,表明LUAD的复杂性。然而,对肿瘤的发生发展具有重要作用的肿瘤微环境(TME)和肿瘤内的异质性(ITH),在肺腺癌不同病变程度上仍未被详细研究。因此,这篇文章旨在利用单细胞转录组测序更加深入的检测肿瘤细胞的细胞多样性和分子复杂性,帮助我们全面理解LUAD的TME和ITH,为未来LUAD发病机制和治疗靶点的研究提供参考。
内容概述
作者从29个样本中共分离出204,157个单细胞进行测序,构建了一个基于正常肺细胞、早期LUAD细胞和晚期LUAD细胞的细胞和分子特征的单细胞网络。研究发现,与早期LUAD细胞相比,晚期LUAD细胞具有明显更为复杂的TME和更高的ITH水平。对免疫细胞的分析发现,CD8+/CTL T细胞、调节性T细胞和滤泡性B细胞的差异明显。细胞通讯分析表明在单细胞水平上,LUAD不同,病变程度之间的差异也巨大。最后,作者采用流式细胞术和qRT-PCR验证了以上结果。
研究结果
1. 正常、早期LUAD和晚期LUAD组织的单细胞转录组图谱特征
作者从来源于26个病人的12例正常组织、11例早期肿瘤组织和6例晚期肿瘤组织分离204,157个细胞进行后续分析(Figure 1A)。降维聚类后将所有细胞分为9个cluster,并鉴定为以下细胞类群:B细胞、T细胞、髓系细胞、成纤维细胞、内皮细胞和肥大细胞(Figure 1B)。通过数据集和marker基因区分出了正常上皮细胞、肿瘤细胞和肺泡细胞(Figure 1C)。CNV分析表明肿瘤细胞cluster具有明显的高CNV水平(Figure 1D),也证明了以上上皮细胞的细胞注释结果。对每个细胞群体进行了基于细胞类型基因标记的功能富集分析结果显示,成纤维细胞主要涉及在细胞外基质组织,内皮细胞主要涉及血管再生过程(Figure 1E)。
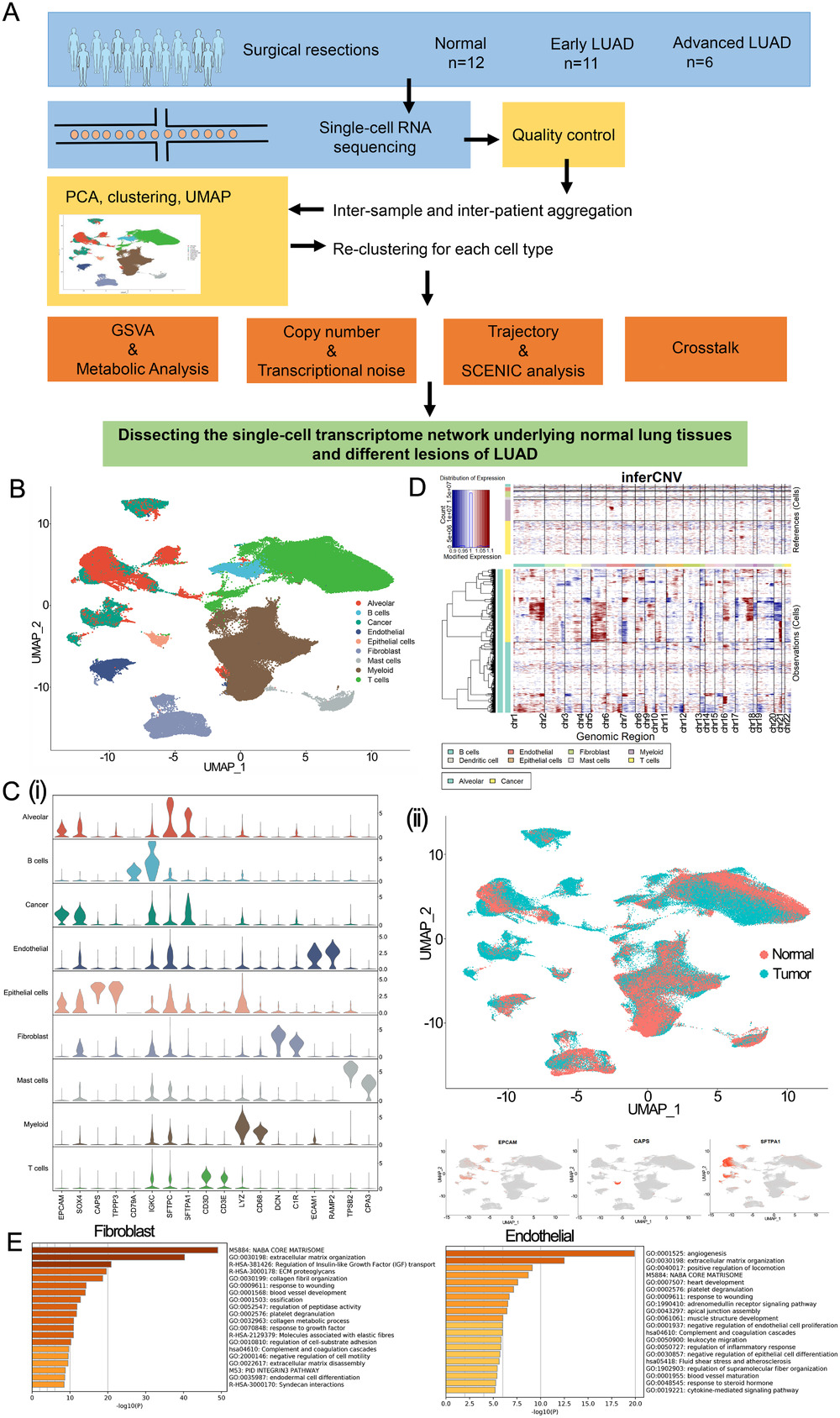
Figure 1. 正常、早期LUAD和晚期LUAD组织的单细胞转录组图谱特征
2. 正常及LUAD不同病变阶段组织中单细胞网络的构建
作者通过比较正常组织细胞和LUAD细胞类群,发现髓系细胞在正常组织样本中占比增加,成纤维细胞在晚期LUAD占比增加(Figure 2A)。差异基因分析发现与抗炎和不良预后相关的基因主要集中在晚期LUAD样本中,而与炎症和肺泡功能正常相关的基因则主要集中在正常样本中(Figure 2B)。作者后续对肿瘤异质性起到重要功能的转录噪音进行分析,发现与早期LUAD相比,大多数晚期LUAD细胞具有更高的转录噪音,特别是B细胞和肺泡细胞(Figure 2C)。由于B细胞具有重要的先天免疫反应功能,作者针对先天免疫反应基因进行了分析,结果发现促炎基因在正常组织样本中高表达(Figure 2D)。
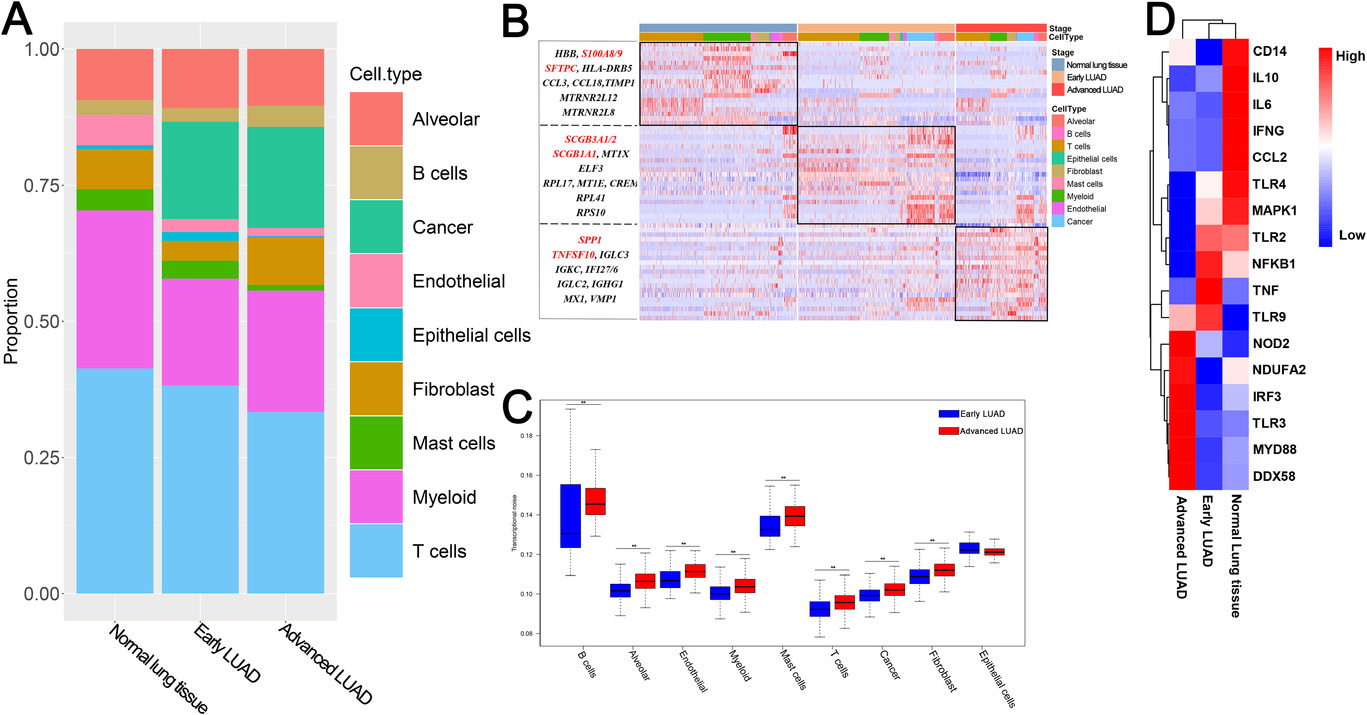
Figure 2. 正常肺组织和不同阶段LUAD的各细胞类型差异分析
为了更全面的了解正常肺组织到晚期LUAD的细胞和分子变化,作者通过分析正常肺组织和LUAD病变过程中每对细胞群之间的相关性,建立了一个单细胞转录组网络,同时也进行了蛋白互作(PPI)和代谢分析网络分析,结果发现不同阶段组织细胞间紧密的相互联系(Figure 3A)。代谢重编程分析结果表明,早期LUAD中主要是髓系和肿瘤细胞的代谢途径上调,而晚期LUAD中,上调的代谢途径主要出现在癌症、肺泡和上皮细胞中,这揭示了LUAD不同病变阶段的不同代谢重新编程模式(Figure 3B),表明肿瘤微环境中这些细胞类型的代谢重编程可能阻断免疫细胞的抗肿瘤效应。
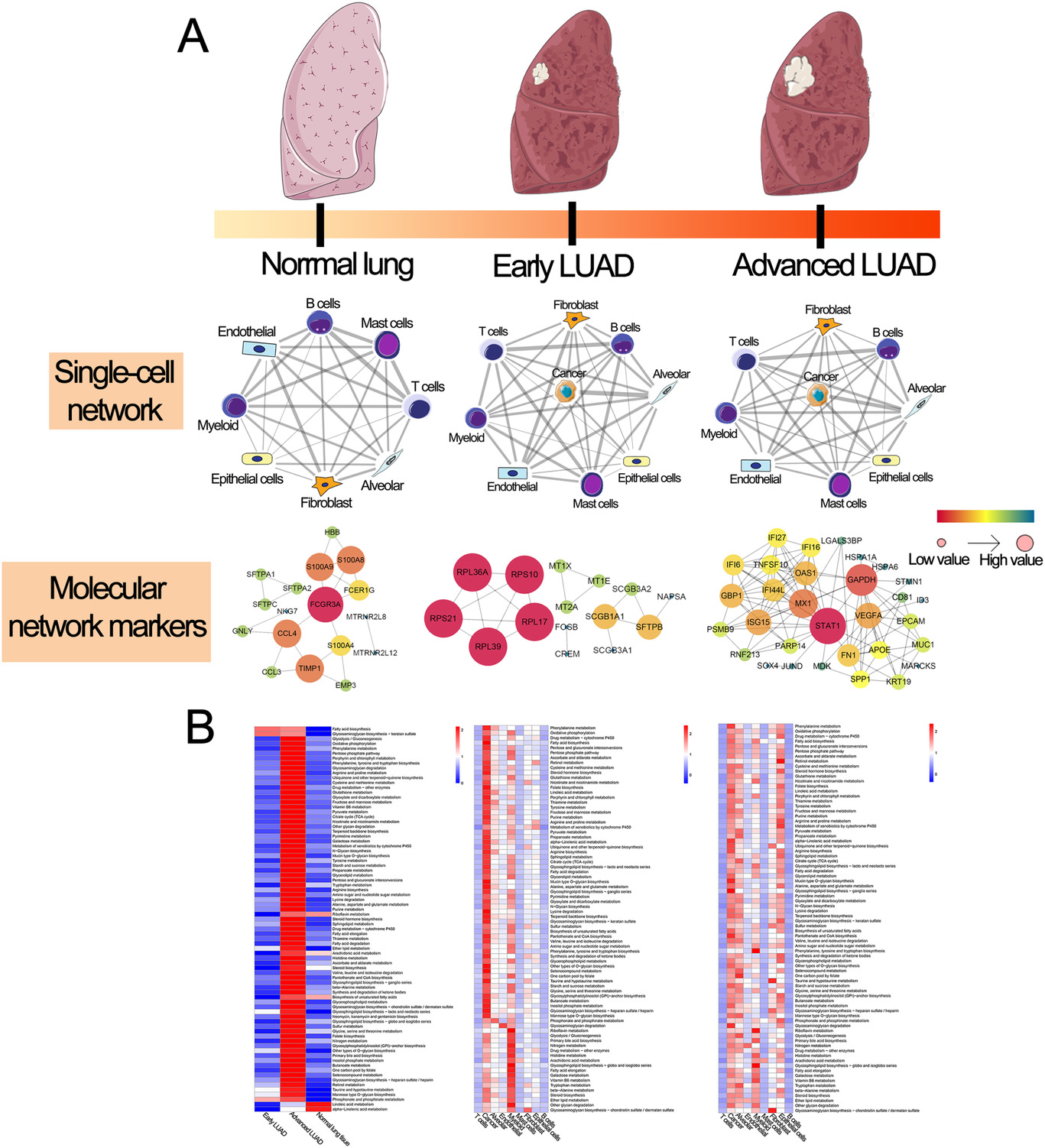
Figure 3. 正常肺组织和不同阶段LUAD的单细胞转录组网络
3. 不同病变阶段肿瘤细胞变化和异质性分析
针对肿瘤细胞,作者挑选了超过500个肿瘤细胞的病人样本进行下游分析(Figure 4A),发现21,861个肿瘤细胞具有病人特异性分群,表明每个病人都有显著的肿瘤异质性(Figure 4B)。进一步分析早期和晚期阶段的异质性差异发现,晚期LUAD具有更高的异质性评分(Figure 4C)。后续作者进行GSVA分析研究肿瘤异质性的生物学功能,发现与早期肿瘤细胞相比,晚期肿瘤细胞中信号途径、活性氧、炎症和血管再生等相关通路具有更高的表达水平(Figure 4D)。SCENIC分析发现由EHF_extended、BATF_extended和CD59_extended调控的基因在晚期肿瘤细胞中被高度上调,而由ATF3、JUNB_extended和FOSB_extended调控的基因在早期肿瘤细胞中被上调(Figure 4E)。通过对TCGA和GEO数据库里的病人数据进行LUAD患者的预后标记物筛选,发现CEACAM6、CTSE、SQSTM1和VEGFA为预后阶段相关基因,在与阶段相关基因进行对比的预后模型中,患者在TCGA和GEO数据库中都被分为高风险和低风险组,表明预后模型可以准确地预测LUAD患者的预后(Figure 4F)。
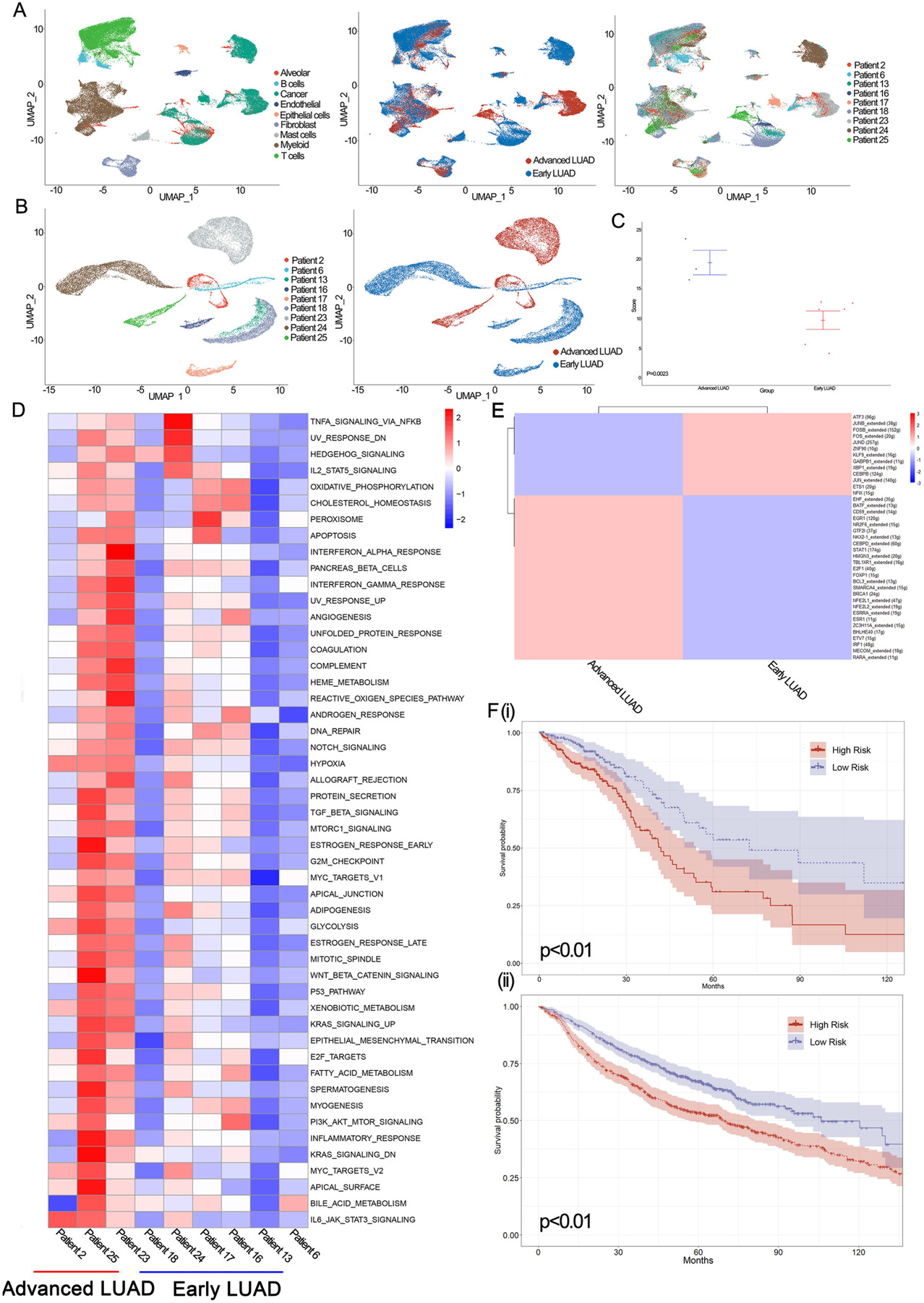
Figure 4. 早期和晚期LUAD肿瘤细胞的scRNA和bulk RNA表达图谱
4. 不同病变阶段免疫细胞的单细胞表达图谱
针对免疫细胞,作者对T细胞、B细胞和髓系细胞进行了亚型分析。T细胞被分为CD8+/CTLT细胞、CD4+T细胞、调节性T细胞和NK细胞;B细胞分为滤泡性B细胞、MALTB细胞和血浆B细胞;髓系细胞分为巨噬细胞、粒细胞、Langerhans细胞和DC(Figure 5A)。具体的marker基因详见Figure 5B。比较早期LUAD的细胞比例与晚期LUAD的细胞比例,发现CD8+/CTLT细胞、调节性T细胞和巨噬细胞在晚期LUAD中显著增加。相比之下,晚期LUAD细胞的滤泡性B细胞、Langerhans细胞和CD4+T细胞显著降低(Figure 5C)。
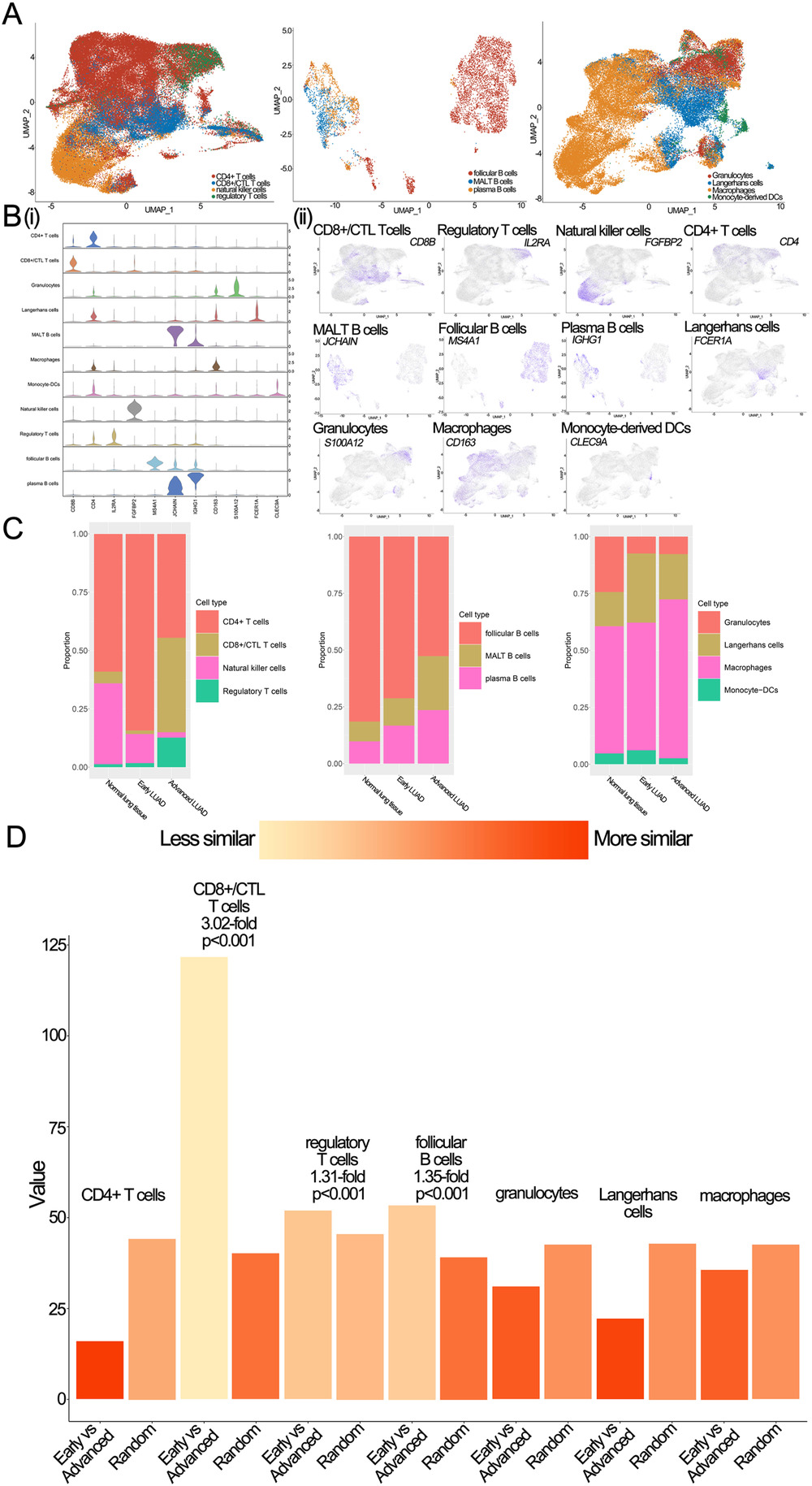
Figure 5. 不同病变阶段免疫细胞的单细胞表达图谱
作者后续对巨噬细胞进行了进一步亚型分析,共分为17个cluster(Figure 6A)。其中8个cluster细胞具有同一个状态,被定义为“domain”类群(Figure 6B)。随后作者对M1和M2极化及促炎抗炎进行分析,在晚期LUAD domain clusters鉴定出M2样和抗炎表型(Figure 6C)。随后,作者进行GSVA分析研究不同cluster的功能变化,发现与预后不良相关的炎症通路(如IL6/STAT3、Notch和IL2-STAT5信号通路)主要在晚期LUAD cluster中富集(Figure 6D)。这些结果表明在晚期LUAD中巨噬细胞表现为抗炎表型,从而促进LUAD生长。
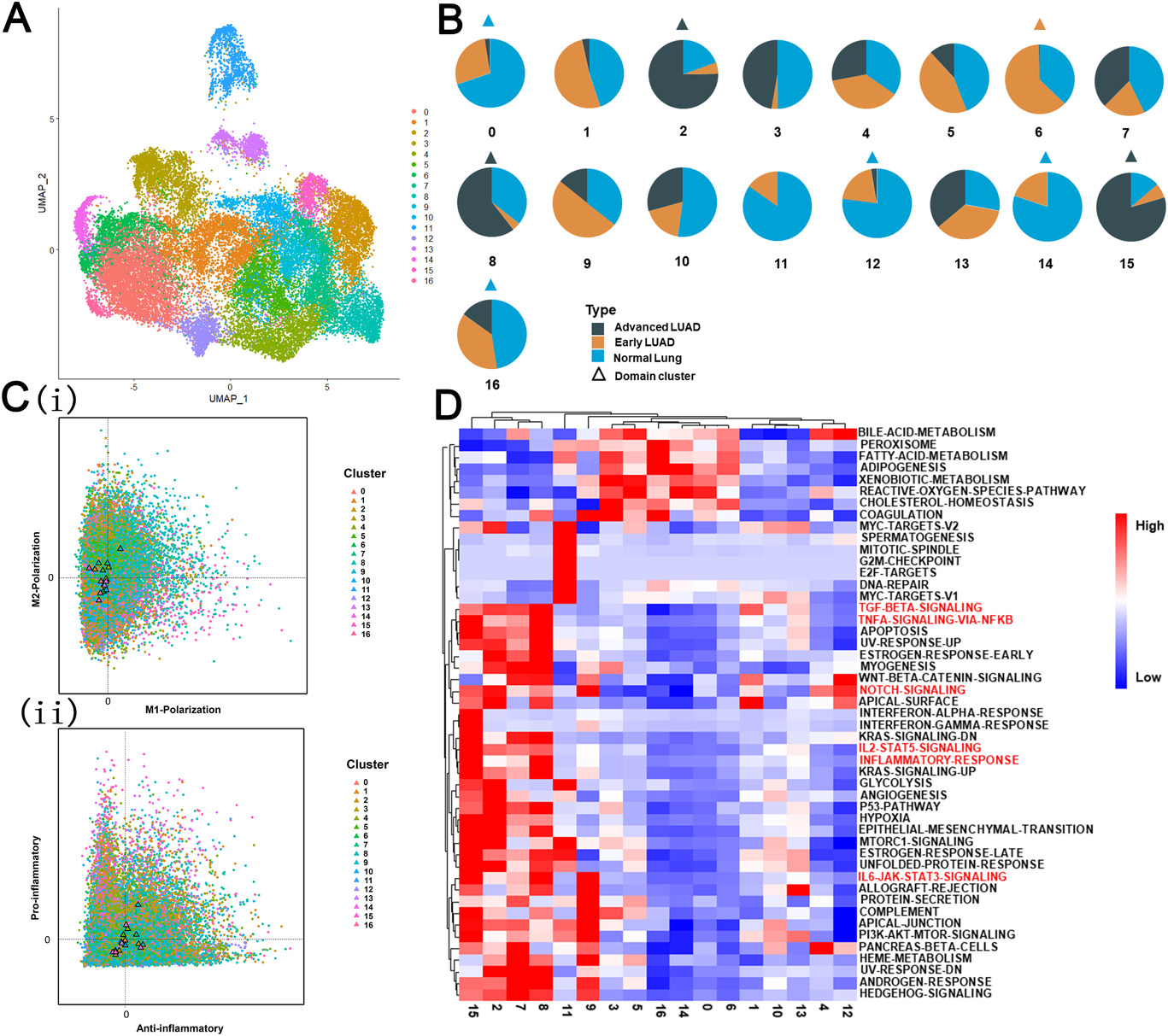
Figure 6. 不同病变阶段巨噬细胞的单细胞表达图谱
针对B细胞,作者进行了基因调控分析,结果表明JUND_extended、JUNB_extended和CREM调控的基因主要在早期滤泡性B细胞中富集,而XBP1、BHLHE40和JUN_extended调控的基因在晚期滤泡性B细胞中上调,同时INTERFERON_GAMMA_RESPONSE、KRAS_SIGNALING_DN和SPERMATOGENESIS信号途径也富集在晚期滤泡性B细胞中(Figure 7A)。为了研究T细胞的重编程过程,作者进行了拟时序分析,发现从正常的NK细胞到肿瘤来源的CD8+/CTLT细胞、肿瘤来源的CD4+T细胞和肿瘤来源的调节性T细胞的分化途径(Figure 7B)。SCENIC分析发现晚期CD8+/CTLT细胞具有更高的BHLHE40_extended和KLF6_extended活性,而晚期调节性T细胞具有更高的YBX1_extended和CHD2活性。此外,晚期CD8+/CTLT细胞与INFLAMMATORY_RESPONSE、APICAL_JUNCTION和KRAS_SIGNALING_DN通路的关系更为密切,而晚期调节性T细胞则上调KRAS_SIGNALING_DN、INTERFERON_ALPHA_RESPONSE和COMPLEMENT途径(Figure 7D)。总而言之,以上这些结果表明,在晚期LUAD中KRAS信号的激活可能是一个潜在的治疗靶点。
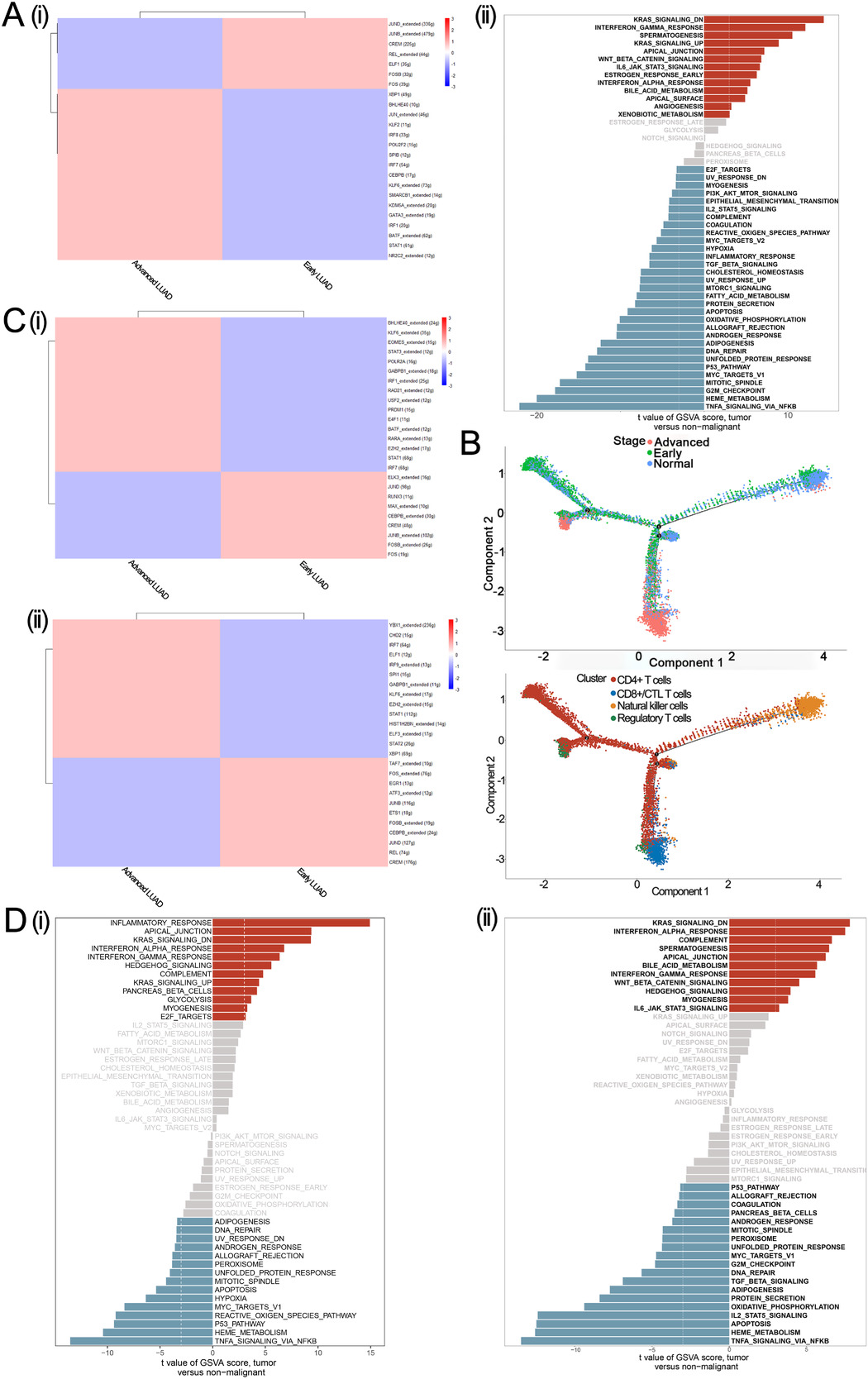
Figure 7. T细胞、B细胞和髓系细胞的拟时序分析、基因集变异分析和SCENIC分析
5. 免疫和肿瘤细胞的细胞通讯分析
作者后续针对免疫和肿瘤细胞进行了细胞通讯分析,将细胞通信分为共同的相互作用(存在于两个以上的肺样本条件下)和独特的相互作用(相互作用只发生在一个肺样本条件下),分别在正常肺、早期LUAD和晚期LUAD组织中发现了4、20和50个独特的相互作用。与正常肺和早期LUAD组织相比,晚期LUAD有一套更独特的细胞-细胞交流环境,这可能是晚期LUAD具有的独特特征的原因(Figure 8)。
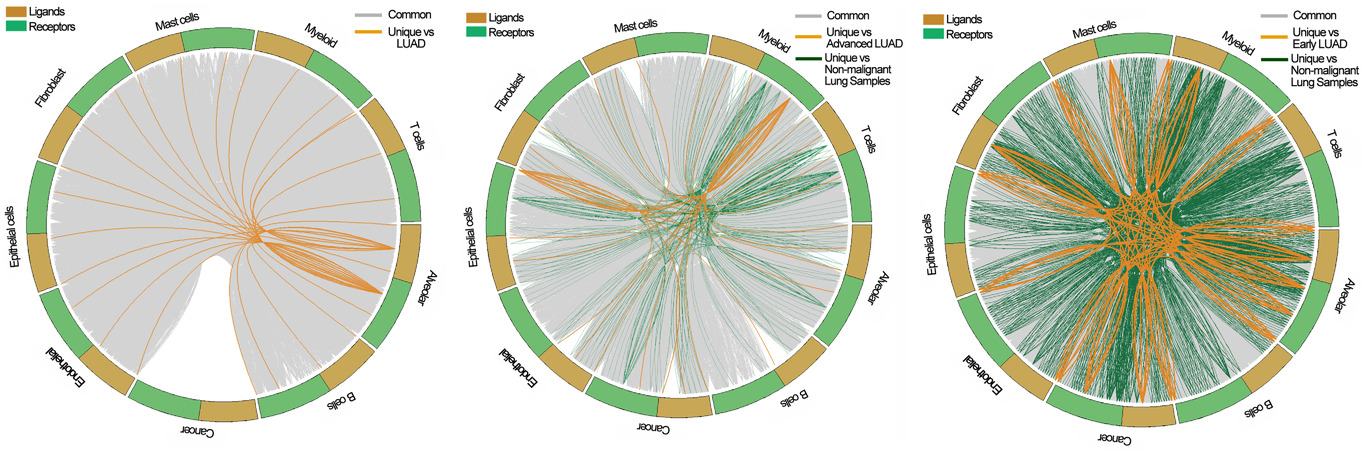
Figure 8. 免疫和肿瘤细胞的细胞通讯分析
结论
这篇文章作者通过整合scRNA-seq和bulk RNA-seq数据全面研究了LUAD不同病变阶段的肿瘤微环境肿瘤异质性,发现不同病变阶段LUAD细胞的多样性及分子复杂性,为未来探索LUAD的发病机制,确定新的治疗靶点提供重要的参考。
参考文献
Chen Z, Huang Y, Hu Z, Zhao M, Li M, Bi G, Zheng Y, Liang J, Lu T, Jiang W, Xu S, Zhan C, Xi J, Wang Q, Tan L. Landscape and dynamics of single tumor and immune cells in early and advanced-stage lung adenocarcinoma. Clin Transl Med. 2021 Mar;11(3):e350. doi: 10.1002/ctm2.350.






