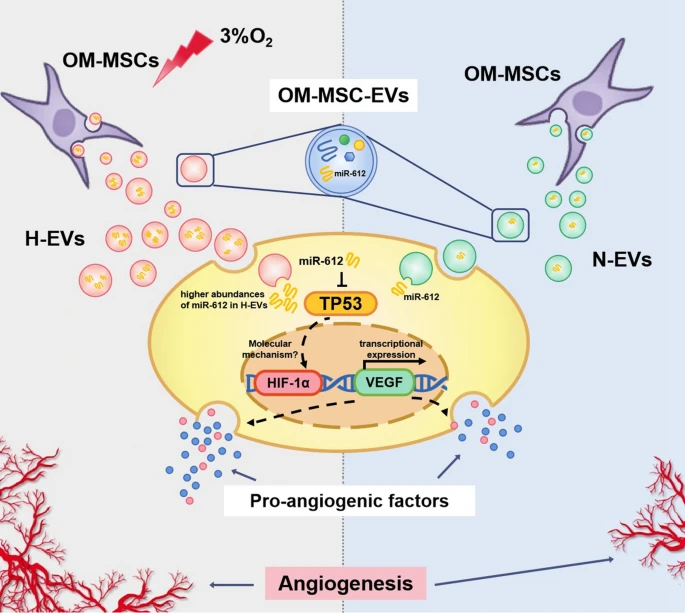
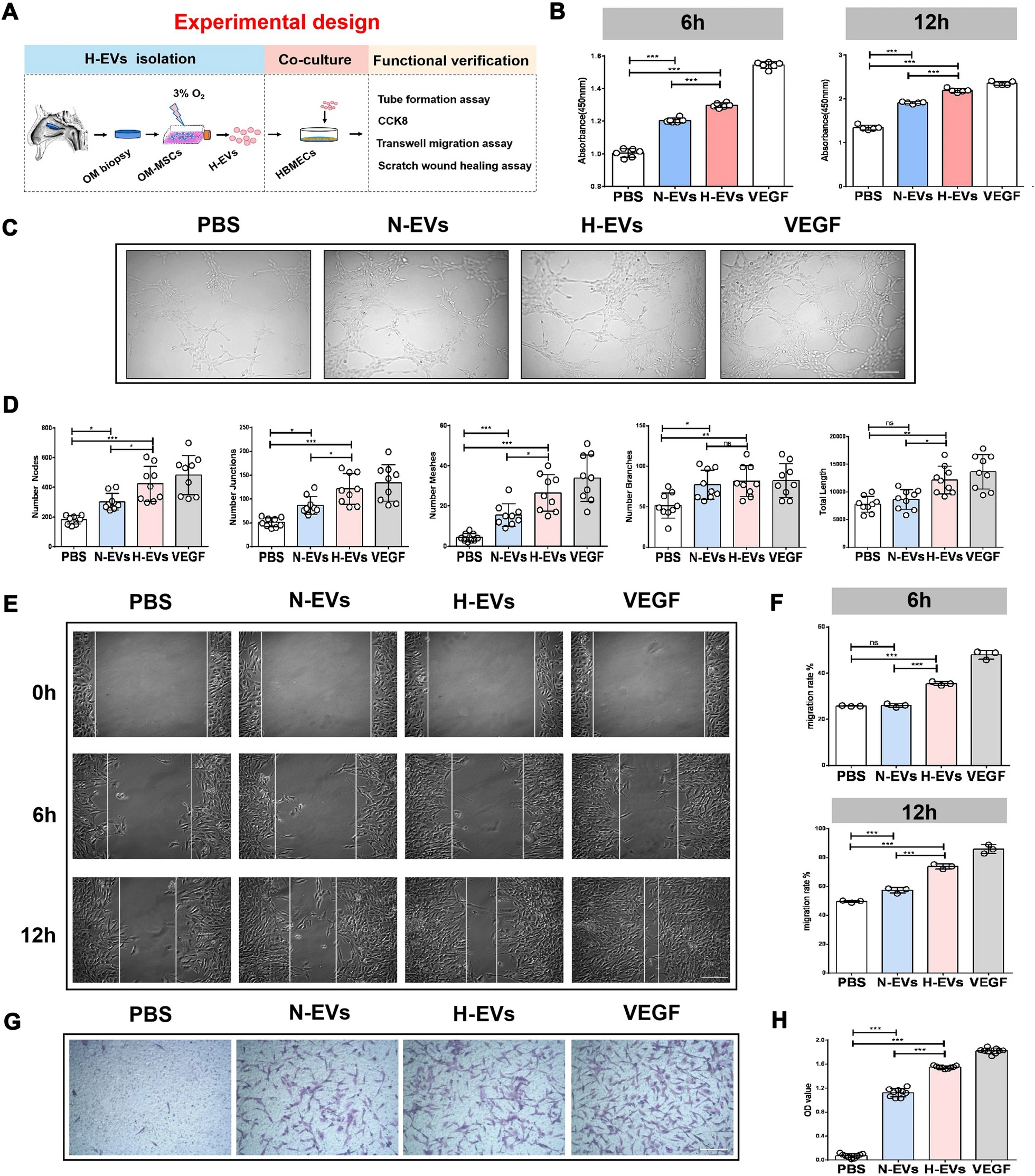
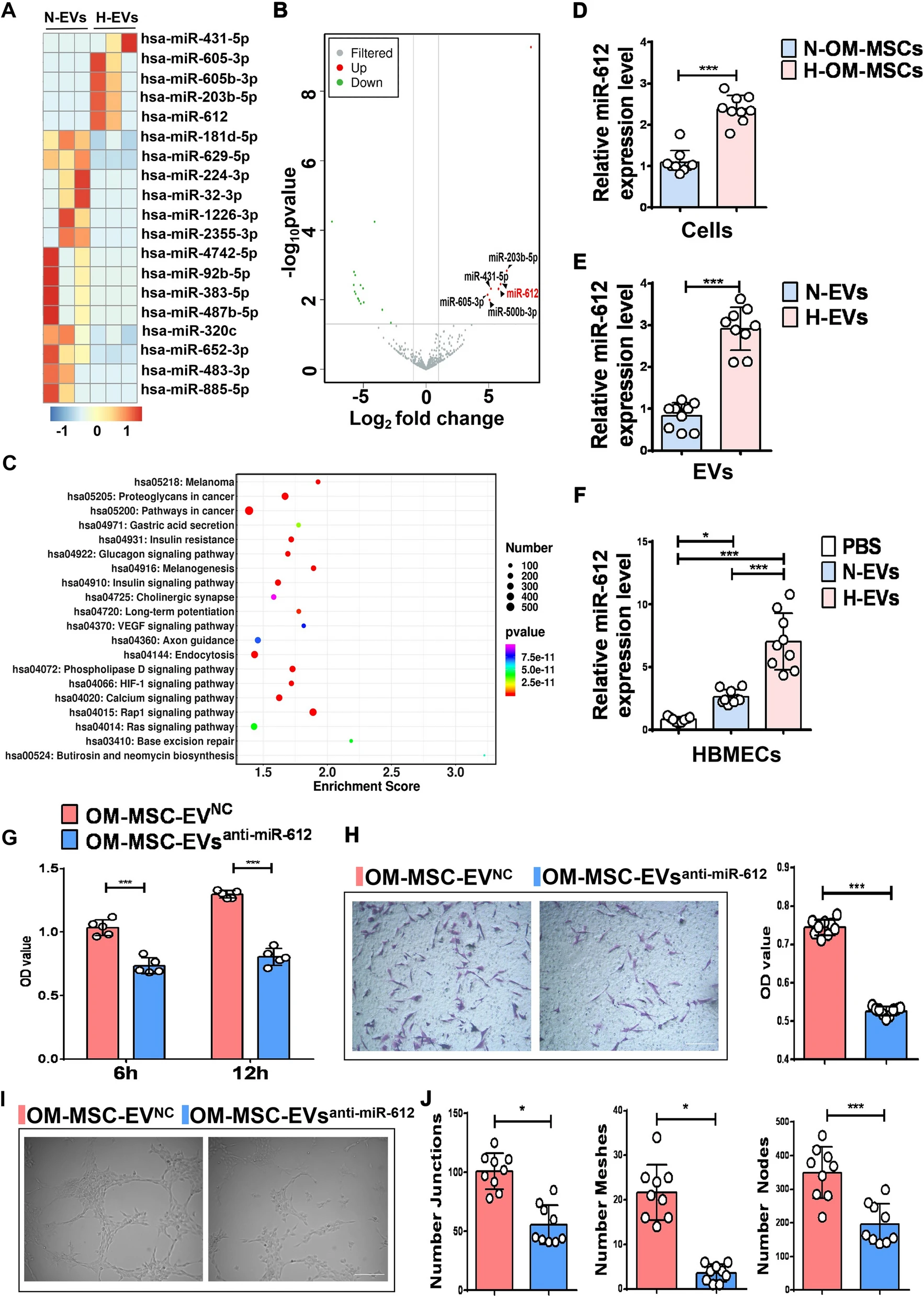
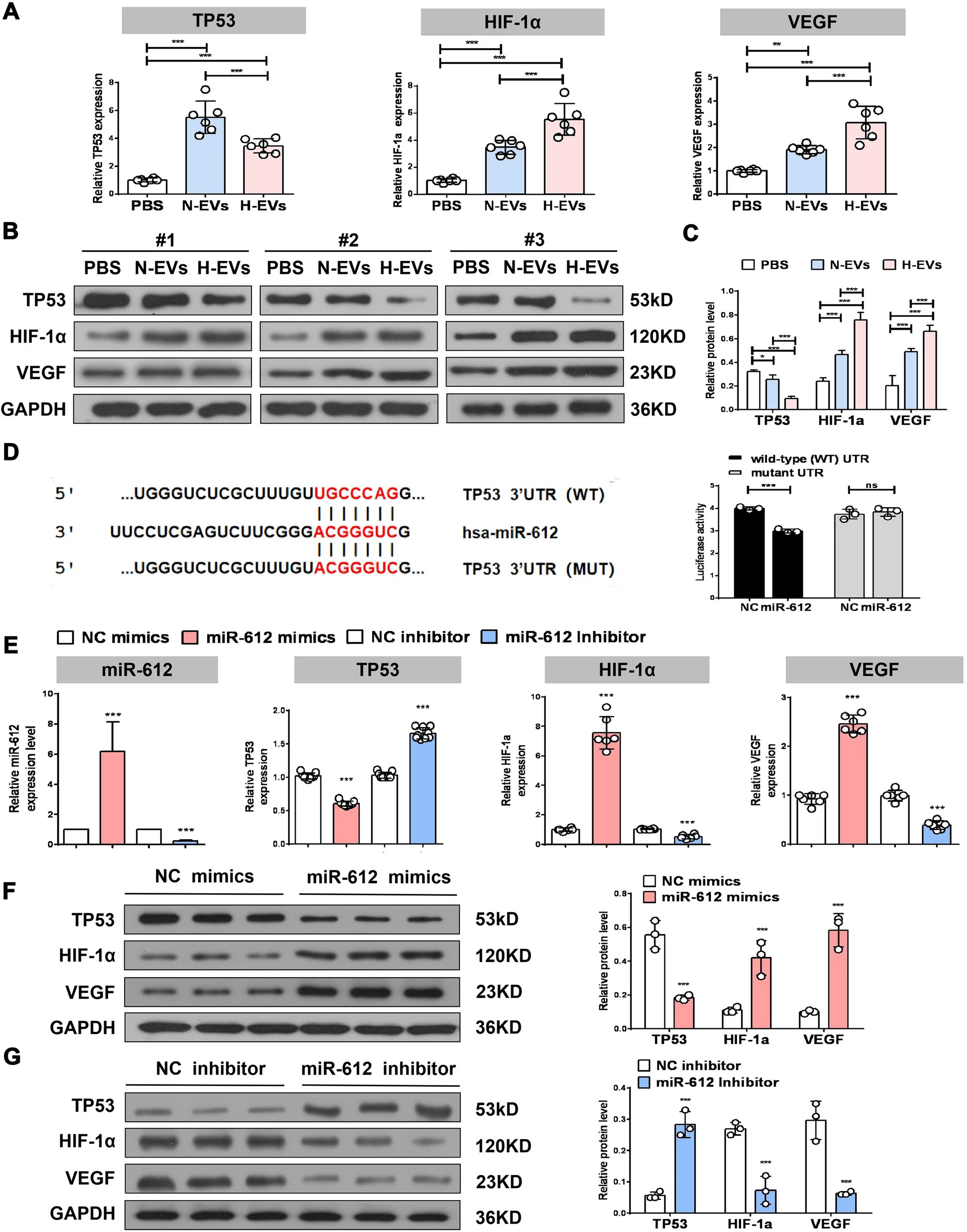
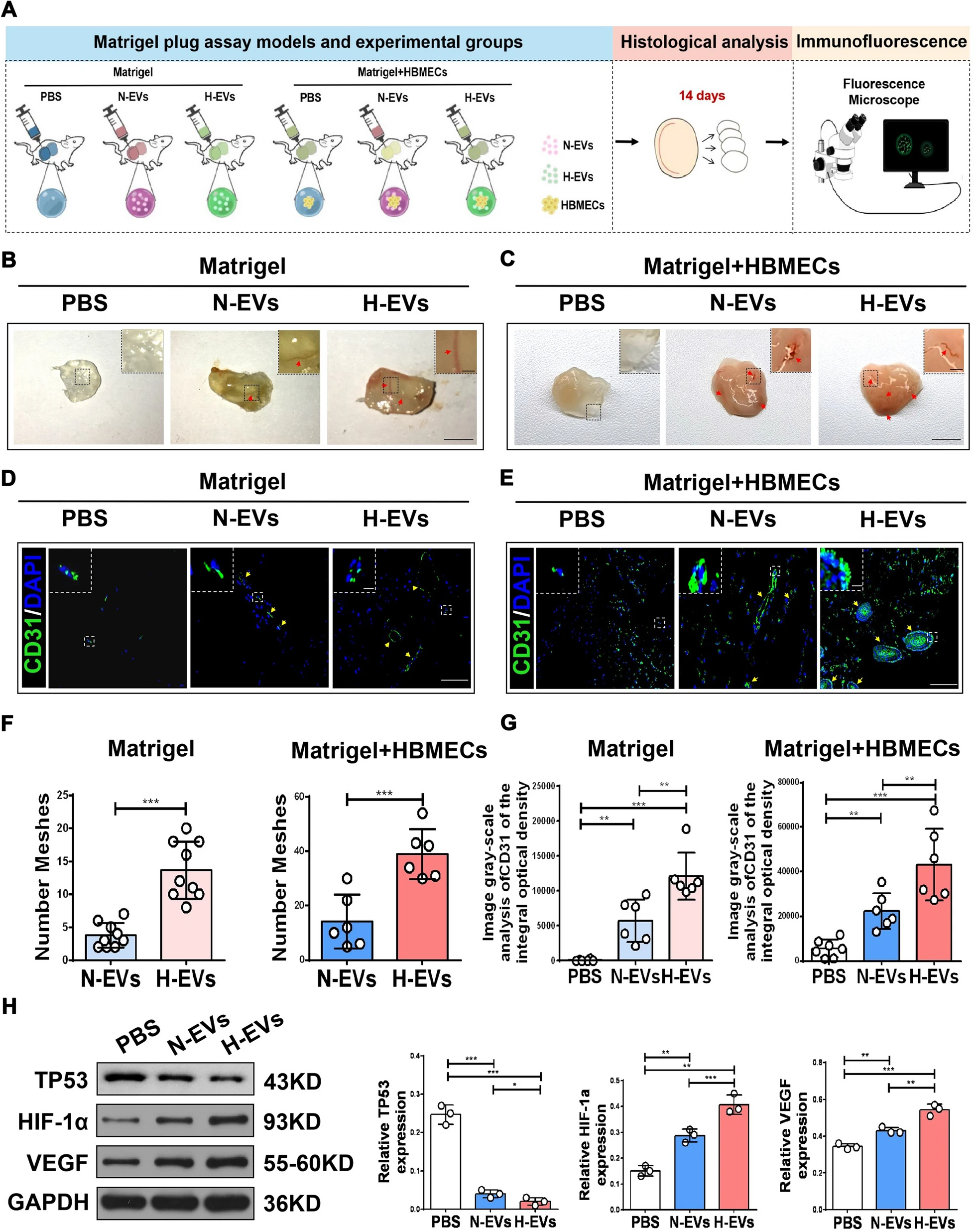
近日,由中南大学湘雅二医院胡治平教授和湖南师范大学卢明教授、陈平教授共为通讯作者,在 Journal of Nanobiotechnology (IF: 10.435) 发表了题为“Extracellular vesicles derived from hypoxia-preconditioned olfactory mucosa mesenchymal stem cells enhance angiogenesis via miR-612”的研究论文,报道了嗅黏膜间充质干细胞来源的胞外囊泡在缺氧条件下调控血管生成的分子机制。 中南大学湘雅二医院葛丽特博士后为第一作者。欧易生物在本研究中承担了 small RNA 测序及分析工作。 研究背景 间充质干细胞(mesenchymal stem cell, MSC)在组织修复和再生中发挥重要作用。已有研究表明,缺氧预处理的 MSCs 能显著提高体外细胞存活、增殖和血管生成相关的生长因子。 嗅黏膜间充质干细胞 (OM-MSCs) 是一种位于嗅觉固有层的新型常驻干细胞,具有高增殖率、自我更新和多能分化的能力。OM-MSCs 在缺血性脑卒中治疗中可以发挥积极的作用。但将干细胞直接应用于治疗仍存在可能形成肿瘤、血栓等诸多风险。 胞外囊泡是细胞主动分泌到胞外的有膜小泡(EV),可以携带 miRNA、mRNA 和蛋白质等物质,传递给受体细胞,起到细胞间通讯的作用。本研究重点关注 OM-MSC-EV 对血管生成的影响及其机制。 研究内容 本研究从常氧和缺氧 OM-MSC 细胞上清中分离的细胞外囊泡 H-EV 和 N-EV,经体外和体内实验表明,两种 OM-MSC-EV 都能促进人脑微血管内皮细胞 (HBMECs) 的增殖、迁移和血管生成活性。且与常氧组相比,低氧预处理后 OM-MSC-EVs 的血管生成刺激活性显著增强。从机制上讲,H-EV 携带 miR-612 至靶细胞,结合在靶细胞内 TP53 mRNA 的 3’-UTR 区域抑制其表达,进而通过促进 HIF-1α和 VEGF 表达,以调控内皮细胞血管生成。这项发现表明,低氧预处理的 OM-MSCs-EVs 可促进血管生成,为治疗如脑梗死等缺血性疾病提供新的治疗策略。 研究结果 1. 缺氧预处理的 OM-MSC-EV 增强了血管生成活性 从培养的常氧和缺氧 OM-MSC 细胞上清中分别分离了细胞外囊泡 H-EV 和 N-EV,并通过 WB、透射电子显微镜和 NTA 进行了鉴定。接下来研究 EV 对血管细胞内皮生成的影响,结果显示,N-EV 和 H-EV 都可以促进 HBMEC 细胞的增殖。并且对比 N-EV,H-EV 对血管生成的促进更为明显。 图 1 | H-EV 在体外增强了 HBMEC 血管生成活性 2. H-EV 运输 miR-612 到靶细胞中 miRNA 芯片检测显示,N-EV 和 H-EV 之间有 19 个 miRNA 存在表达差异,其中 miR-612 在 H-EV 中表达上调(图 A-B)。并且预测表明 miR-612 的靶基因主要参与 HIF-1α 和 VEGF 信号通路(图 C)。RT-PCR 实验显示,低氧条件下 OM-MSC 细胞中 miR-612 比常氧条件下 OM-MSC 表达高,并且对应的 EV 中 miR-612 含量也高(图 D-E)。 对经 N-EV 和 H-EV 处理的 HBMEC 细胞进行 RT-PCR,结果显示 H-EV 处理后 miR-612 含量显著升高(图 F),表明 miR-612 可能通过 EV 运输到靶细胞中。 为进一步证明 EV 中 miR-612 的作用,利用 OM-MSC-EVanti-miR-612(敲低了 miR-612 的 OM-MSC 产生的 EV)处理 HBMEC 细胞。结果显示,与对照相比,OM-MSC-EVanti-miR-612 处理的 HBMEC 细胞增、迁移和血管生成显著降低(图 G-J)。 在 HBMEC 细胞中直接进行 miR-612 敲降和过表达实验,同样表明 miR-612 可以促进内皮细胞的血管生成活性。 图 2 | miR-612介导 OM-MSC-EV 对 HBMEC 的促血管生成作用 3. OM-MSC-EV 转运的 miR-612 通过 TP53 调节 HBMEC 的血管生成 有研究表明,抑制 TP53 可上调 HIF-1α 和 VEGF 的表达。有趣的是,H-EV 和N-EV 处理 HBMEC 后,TP53 mRNA 和蛋白水平降低,且缺氧组 TP53 的降幅大于常氧组(图 A-C)。预测分析显示 TP53 是 miR-612 的靶基因(图 D)。荧光素酶报告实验证实,miR-612 可以特异性结合到 TP53 mRNA 的 3’-UTR(图 D)。 qRT-PCR 和 WB 实验显示,TP53 mRNA 和蛋白质水平在过表达了 miR-612 的 HBMEC 中显著下降,HIF-1α 和 VEGF mRNA 和蛋白质表达水平随之上升(图 E-F)。反之 TP53 mRNA 和蛋白质水平在敲降了 miR-612 的 HBMEC 中显著上升,HIF-1α 和 VEGF mRNA 和蛋白质表达水平随之下降(图 E, G)。 同时,在 HBMEC 细胞中直接进行 TP53 敲降和过表达实验,同样表明抑制 TP53 可以促进内皮细胞的血管生成活性。以上结果表明,靶向调控 TP53 表达是 miR-612 促进血管生成的部分原因。 图 3 | OM-MSC-EV 转运的 miR-612 通过 TP53 调节 HBMEC 的血管生成 4. H-EV 富集 miR-612 并在体内促进内皮细胞血管生成 接下来在裸鼠中研究 H-EV 在体内的作用。结果显示,H-EV 和 N-EV 都可以在体内诱导新血管形成,并且低氧 OM-MSC-EV 比常氧 OM-MSC-EV 诱导更大的血管形成。与体外实验结果一致:TP53 蛋白水平降低,并且 N-EV 处理中下降更为明显;HIF-1α 和 VEGF 表达水平升高,并且低氧组高于常氧组。 同时,将敲降/过表达 miR-612 的 OM-MSC-EV 注射到裸鼠体内,与体外实验一致:过表达 miR-612 可以促进血管生成,同时对应的 TP53 表达下降,HIF-1α 和 VEGF 表达上升;反之,敲降 mR-612 可以抑制血管生成。 综上表明,H-EV 富集的 miR-612 可以在体内通过 TP53 信号通路以调控血管生成。 图 4 | H-EVs 促进体内内皮细胞血管生成 研究结论 本研究表明 H-EV 显著促进血管生成。miR-612 可能在H-EV 依赖的血管生成调控过程中发挥重要作用。EV 是 OM-MSC 功能的重要介质,有望作为一种新纳米给药系统用于缺血性疾病治疗。因此,MSC-EV 的缺氧预处理为临床使用干细胞来源的产品治疗缺血性疾病提供了一种新策略。 原文链接 https://doi.org/10.1186/s12951-021-01126-6 END 郑小辫儿 撰文 本文系欧易生物原创 转载请注明文本转自欧易生物