欧易单细胞测序客户文章停不下来!今天为大家解读的是12月18日由天津大学海河医院基础医学实验部陈怀永主任课题组在Cellular and Molecular Life Sciences (IF 9.261) 期刊发表的关于LKB1缺失从而调控气道goblet cell化生的相关成果。李玉老师、张秋阳老师和李莉主任为文章的第一作者,文章特别致谢了欧易生物巴永兵和唐旋在单细胞测序分析中提供的相关支持。
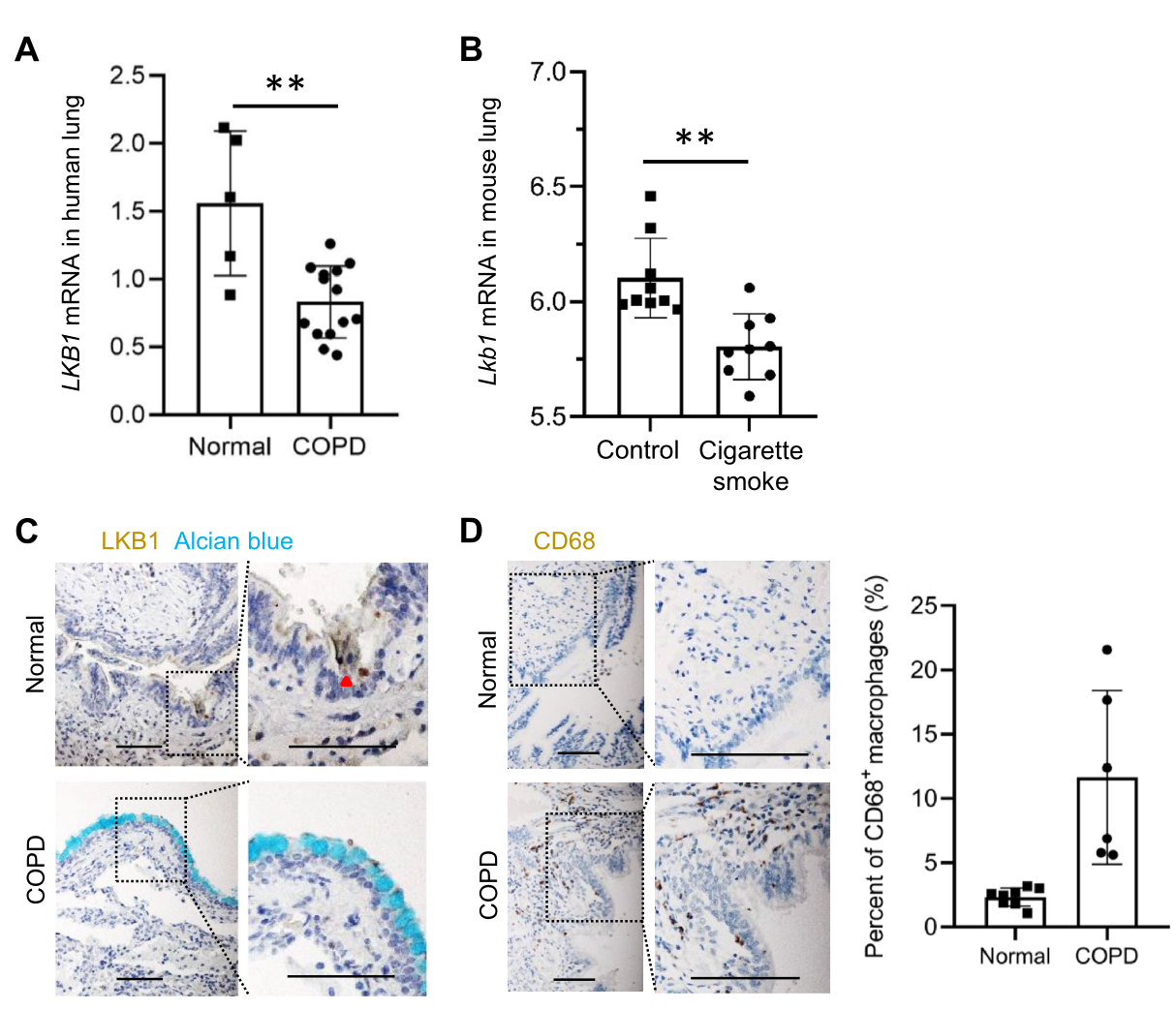
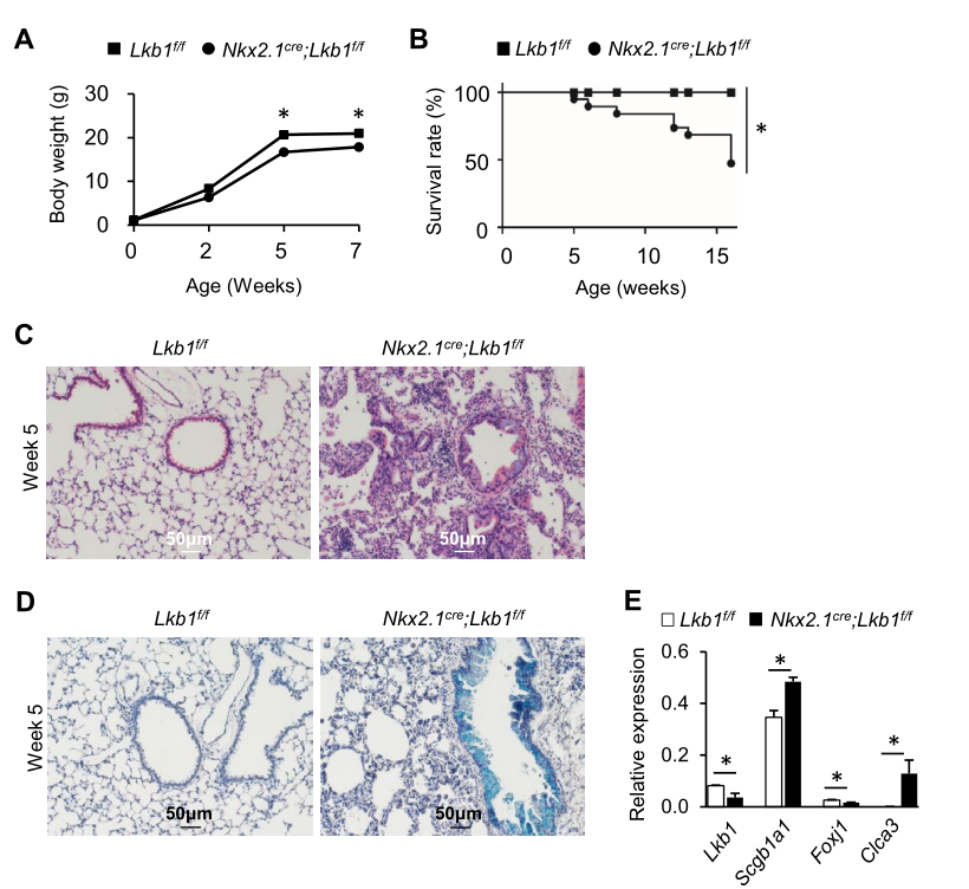
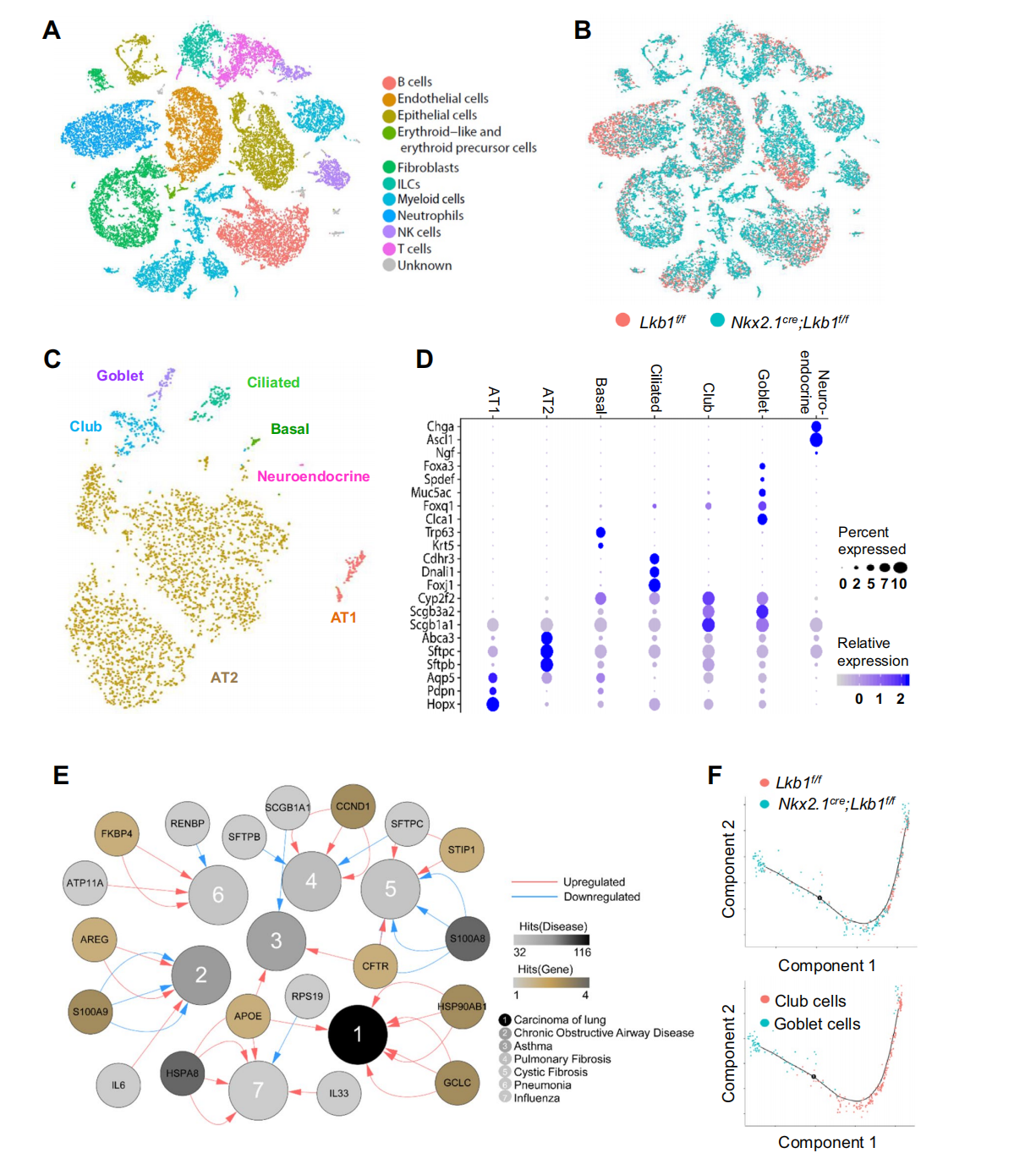
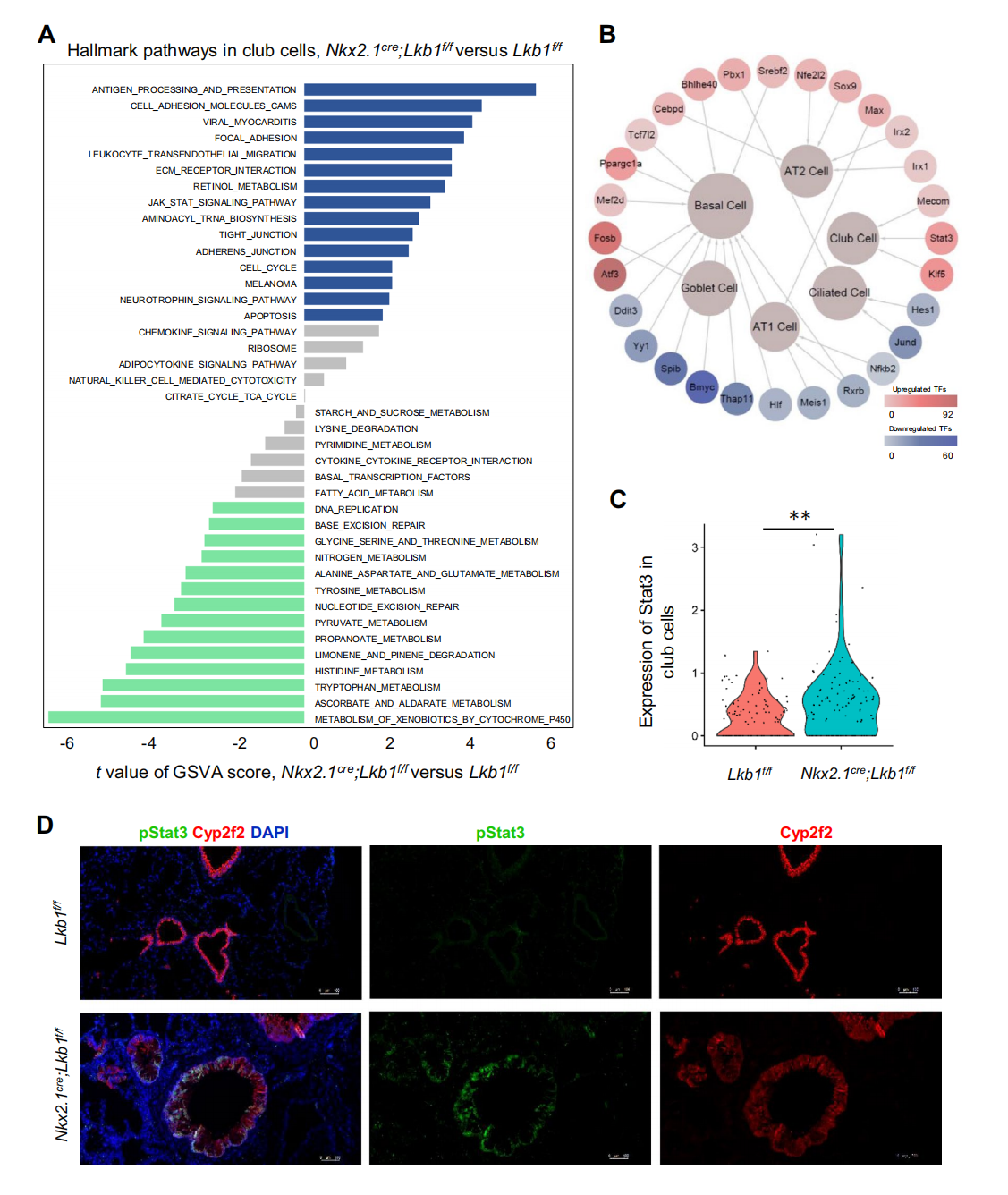
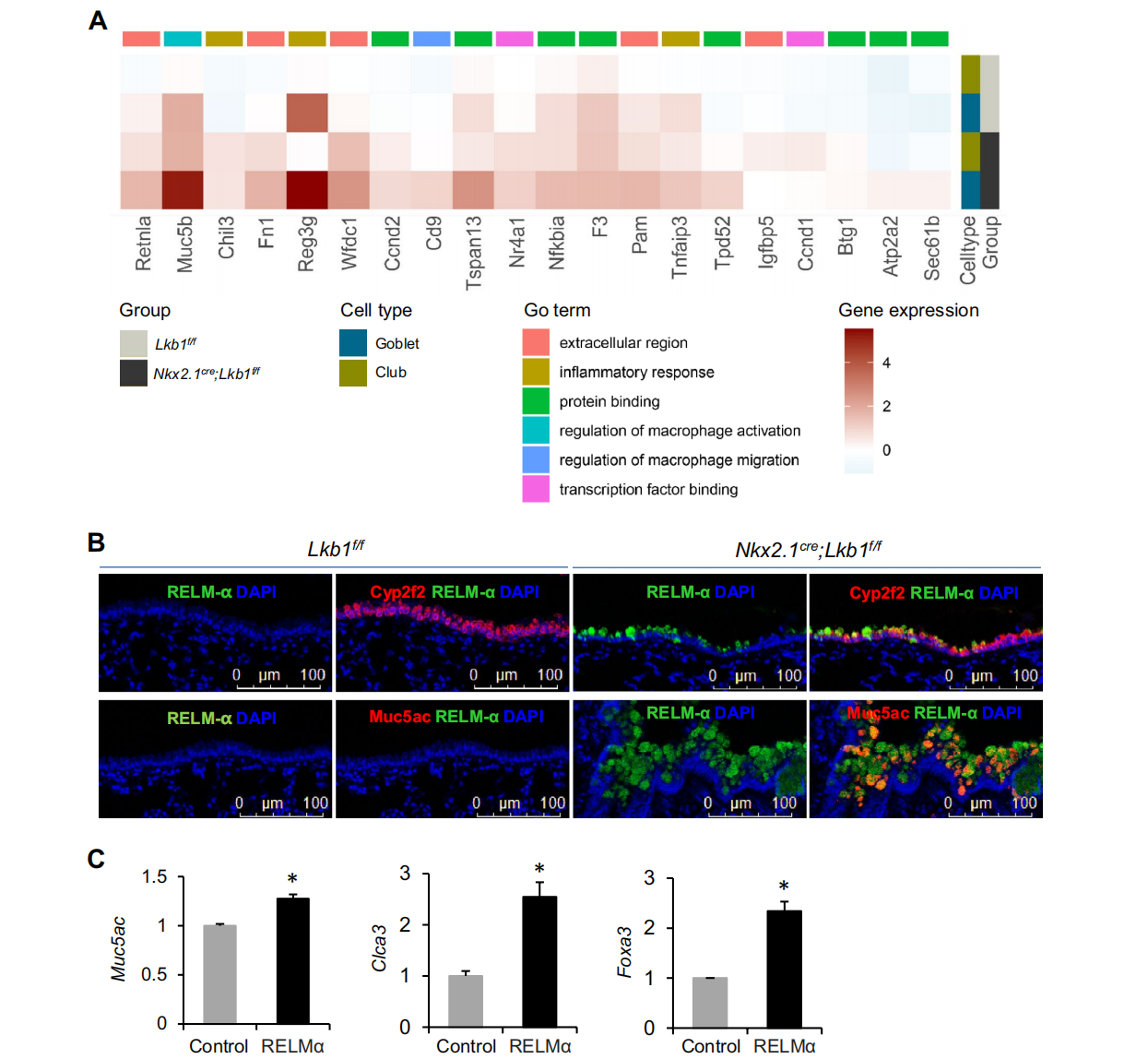
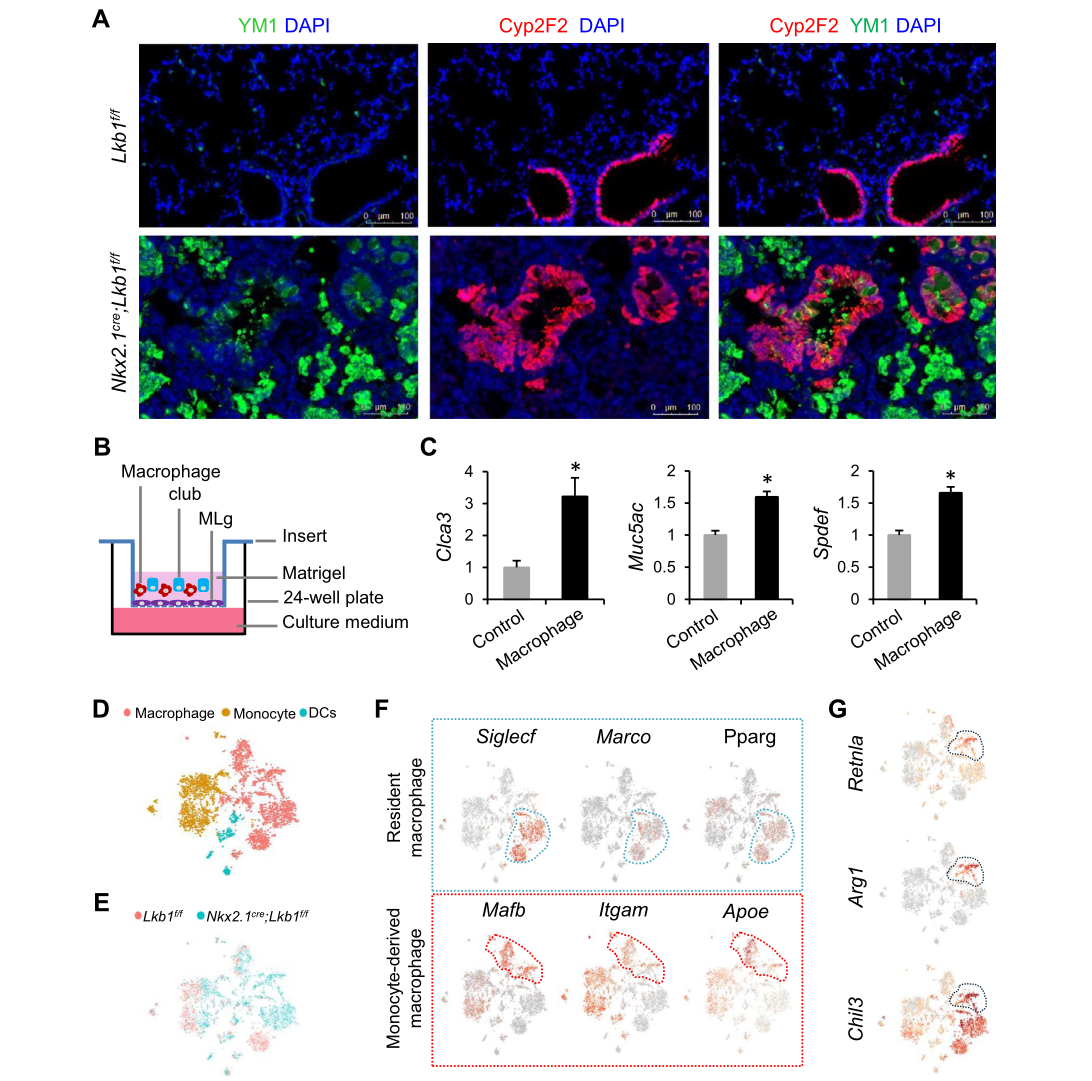
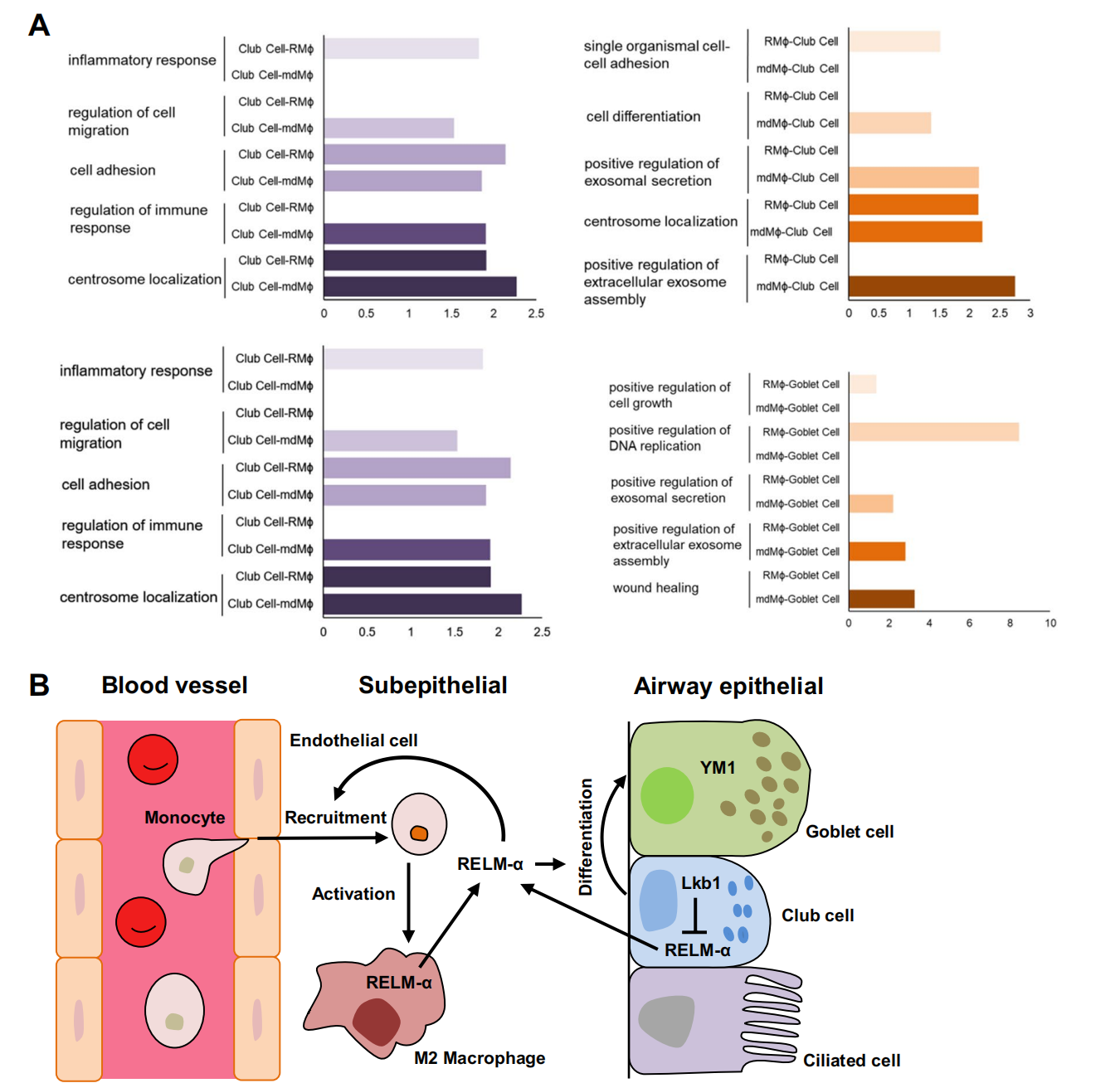
基本信息 材料:3只Nkx2.1Cre;Lkb1f/f和Lkb1f/f小鼠的肺组织 期刊:Cellular and Molecular Life Sciences 发表时间:2021年11月 方法:欧易生物10× Genomics scRNA-seq 研究背景和研究目的 goblet cell分化失控是许多呼吸系统疾病的显著特征,包括哮喘、囊性纤维化和慢性阻塞性肺病(COPD)。粘蛋白高分泌可阻止粘液纤毛清除并减少气体交换。但现有的COPD药物,包括支气管扩张剂和抗炎类固醇,都没有以goblet cell分化和粘液分泌为目标,这些药物只能抑制慢性阻塞性肺病症状而无法治疗病情。因此,靶向气道goblet cell化生是一种可能减少COPD症状的新策略。而肿瘤抑制肝激酶B1( LKB1)是一种重要的干细胞/祖细胞增殖和分化调控因子,本研究期望通过在气道祖细胞中恢复LKB1的表达从而限制goblet cell分化和粘液的高分泌来治疗COPD。 研究内容概述 在本研究中,作者首先表明了LKB1的表达量在COPD患者和暴露在香烟烟雾中的小鼠肺中均下调。Nkx2.1Cre;Lkb1f/f小鼠条件性Lkb1缺失的肺上皮表现出气道粘液高分泌和肺巨噬细胞浸润。随后,作者对Nkx2.1Cre;Lkb1f/f和Lkb1f/f小鼠的肺组织进行scRNA-seq分析,进一步发现LKB1缺失后气道goblet cell分化发生改变。此外,类器官培养研究表明,小鼠气道(棒状)祖细胞中Lkb1缺失可上调FIZZ1/RELM-α的表达,从而促进气道goblet cell分化和肺巨噬细胞招募。基于scRNA-seq分析,作者还发现Nkx2.1Cre;Lkb1f/f小鼠肺中单核来源的巨噬细胞表现出交替激活的M2表型,同时表达RELM-α,从而加剧气道goblet cell化生。细胞通讯分析结果显示LKB1介导的气道祖细胞和巨噬细胞之间的相互作用可调节气道goblet cell化生。综上所述,LKB1激动剂可能作为一种潜在的治疗选择,用于治疗与goblet cell化生相关的呼吸系统疾病。 具体研究内容解析 1.COPD患者气道上皮中LKB1的表达下调 Figure 1. COPD患者肺部LKB1表达下调 作者从公开的GEO数据集(GSE106986)中检索了14名COPD患者和5名健康对照者的转录组数据。分析显示,与正常对照组相比,COPD患者的肺匀浆中LKB1的表达显著降低(Figure 1A)。相应的,从数据集(GSE125521)中检索的暴露在香烟烟雾中的小鼠转录组数据也显示出类似的结果(Figure 1B)。免疫组化染色结果也显示,在COPD患者的肺上皮中LKB1水平明显降低(Figure 1C)。此外,在COPD患者中观察到goblet cell化生以及巨噬细胞积累(Figure 1C-D)。 2.肺上皮中敲除Lkb1促进goblet cell化生 Figure 2. 上皮细胞Lkb1缺失导致气道goblet cell化生和炎症反应 为了明确LKB1是否调控goblet cell的分化,作者将Lkb1f/f小鼠与Nkx2.1Cre小鼠进行杂交产生Nkx2.1Cre;Lkb1f/f小鼠,其中LKB1在胚胎和成年小鼠肺上皮中特异性缺失。研究结果表明,在出生后第2周,Nkx2.1Cre;Lkb1f/f小鼠比对照组体型更小且体重少增加10-25%(Figure 2A)。出生后第5周,Nkx2.1Cre;Lkb1f/f小鼠死亡(Figure 2B)。肺部组织学检查显示支气管周围结缔组织有大量炎症细胞浸润,气道上皮增厚(Figure 2C)。与对照组相比,Nkx2.1Cre支气管内黏液细胞数量明显增加,阿尔新蓝染色显示Nkx2.1Cre;Lkb1f/f小鼠支气管内黏液细胞数量明显增加(Figure 2D)。全肺RT-qPCR检测结果显示,与对照组相比,LKB1缺失时Foxj1表达降低,而Scgb1a1和ClCa3的表达则明显升高(Figure 2E)。这些数据表明Lkb1限制了肺部goblet cell的分化。 Figure 3. 单细胞RNA-seq分析显示刺激goblet cell分化 为了探究LKB1缺失诱发的肺病理机制,作者对5周龄Nkx2.1Cre;Lkb1f/f和Lkb1f/f小鼠肺进行了scRNA-seq分析,经质控后共获得30,408个肺细胞并基于已有的marker基因,鉴定了各cluster的细胞类型:包括上皮(Epcam);内皮(Cdh5,Myct1);成纤维细胞(Col1a2,Ogn);髓系细胞(Trem2);中性粒细胞(Retnlg,Mmp9);红系和红系前体细胞(Alas2);B细胞(CD19);ILC (Il1rl1),自然杀伤细胞(Ccl5,Klre1);T cells (CD3d)(Figure 3A-B)。 随后,作者着重研究了上皮细胞,首先利用各上皮亚型marekr基因将上皮细胞分为6个亚型:AT2细胞(Abca3,Sftpc);AT1细胞(Aqp5,Pdpn);基底细胞(Trp63,Krt5);club cell(Cyp2f2,Scgb1a1,Cdhr3,Foxj1);goblet cell(Foxa3, Spdef);神经内分泌细胞(Chga,Ascl1)(Figure 3C-D)。其次对Nkx2.1Cre;Lkb1f/f和同窝对照小鼠的肺上皮细胞做了组间差异表达基因网络分析,结合数据库,上皮源性LKB1相关肺疾病按所示疾病相关的基因数排序,证实了LKB1是肿瘤抑制因子(Figure 3E)。拟时序分析揭示了club cell向goblet cell的分化轨迹,分析显示几乎所有映射到club cell分化轨迹的goblet cell均来自Nkx2.1Cre;Lkb1f/f小鼠,证实了LKB1在goblet cell分化中的抑制作用(Figure 3F)。 Figure 4. club cell中敲低Lkb1的分子效应 KEGG富集分析和SCENIC分析显示,Janus激酶/信号转导器和转录激活因子(JAK/STAT)信号通路可能受Lkb1影响(Figure 4A-B)。随后作者发现与正常club cell相比,LKB1缺失的club cell中Stat3表达上调(Figure 4B-C)。而免疫荧光染色结果也表明LKB1缺失的club cell中磷酸化的STAT3表达上调(Figure 4D)。这些数据表明STAT3可能参与了Club细胞命运决定。 3.Club细胞中敲除Lkb1可上调RELM‑α的表达,该基因可调节goblet cell分化 Figure 5. Lkb1敲低可上调RELM-α的表达从而使club cell分化为goblet cell 为了研究LKB1调控club cell向goblet cell分化的分子机制,作者针对Nkx2.1Cre;Lkb1f/f和同窝对照小鼠的club cell进行了差异分析,结果显示,在LKB1缺失的情况下,club cell和goblet cell中的Retnla表达水平均增加,同时粘液分泌相关和炎症相关基因如Muc5b、Chil3、Cd9和Tnfaip3的表达上调 (FC > 1.5;p < 0.05)(Figure5A)。这些数据表明Retnla可能调节goblet cell的分化。共聚焦显微镜显示Retnla编码的RELM-α蛋白在正常小鼠的club cell和goblet cell中均未被检测到(Figure5B)。然而,在Nkx2.1Cre;Lkb1f/f小鼠的肺中,发现RELM-α上调并与Cyp2F2(club cell marker)和Muc5Ac(goblet cell marker)共定位(Figure5B)。综上表明LKB1抑制club cell中RELM-α的表达。 此外,为了明确RELM-α是否还调节goblet cell的分化,作者利用流式细胞术从C57BL/6小鼠中分离出具有CD31−CD34−CD45−EpCAM+ Sca1+CD24low表型特征的club cell,然后与支持性肺成纤维细胞进行类器官培养。结果发现,重组RELM-α存在时,club cell衍生类器官的大小和形成效率保持不变,表明RELM-α对club cell增殖作用不大。然而,基于qRT-PCR分析,在添加了重组RELM-α的类器官培养物中,goblet cell marker基因(Muc5Ac、ClCa3和Foxa3)的表达量上调(Figure5C)。综上所述,RELM-α可促进goblet cell分化。 4.上皮细胞敲除Lkb1诱导巨噬细胞积累和激活 Figure 6. Nkx2.1Cre;Lkb1f/f小鼠气道club cell周围巨噬细胞分离 有研究显示RELM-α可驱动单核细胞的招募,促进肺巨噬细胞的选择性激活。为了研究RELM-α的上调是否导致巨噬细胞的积累和激活,作者使用Chil3/Ym1、Muc5Ac和Cyp2F2抗体对肺切片进行免疫荧光染色,结果观察到Ym1+巨噬细胞聚集在气道Cyp2F2+细胞周围(Figure6A)。 为了进一步研究巨噬细胞是否影响club cell向goblet cell的分化,作者利用流式细胞仪从C57BL/6小鼠肺组织中分离出CD11b+巨噬细胞,并与club cell按1:2的比例共培养(Figure6B)。qPCR结果显示,在有巨噬细胞存在的类器官培养中,goblet cell marker基因Clca3、Muc5ac、Spdef的表达上调(Figure6C)。随后,基于scRNA-seq数据,作者首先将肺髓系细胞细分为:树突状细胞(Irf8,Clec9a);单核细胞(Adgre4);巨噬细胞(Mrc1,Hmox1)(Figure6D),并发现Nkx2.1Cre;Lkb1f/f小鼠肺中巨噬细胞数量比对照组小鼠多(Figure6E),这与上述结果一致。为了研究这些巨噬细胞的起源,作者又对巨噬细胞做了进一步划分:肺驻留巨噬细胞被鉴定为表达Siglecf、Marco和Pparg的亚群;单核细胞来源的巨噬细胞被鉴定为高表达Mafb、Itgam和Apoe的亚群(Figure6F)。一些单核细胞来源的巨噬细胞表达Retnla、Arg1和Chil3, 这表明他们的M2表型是交替激活的。此外,在Nkx2.1Cre;Lkb1f/f小鼠中可见M2巨噬细胞,而对照小鼠中则无(Figure6E)。总的来说,这些数据表明,上皮细胞LKB1的抑制诱导单核细胞招募到肺部,并促使其M2表型的激活。 为了进一步了解在Lkb1缺失的情况下,巨噬细胞的起源如何影响club cell的分化,作者针对巨噬细胞与club cell以及巨噬细胞与goblet cell之间做了细胞通讯分析。结果显示,club cell与单核细胞来源的巨噬细胞的通讯方式不同于其与驻留的巨噬细胞的通讯方式。例如,单核细胞来源的巨噬细胞对小鼠club cell的分化有较大的影响(Figure7A)。总之,这些数据表明LKB1是调节气道goblet cell分化的抑制因子,Lkb1缺失可上调气道祖细胞RELM-α的表达,从而促进气道goblet cell分化和肺巨噬细胞的浸润(Figure7B)。 欧易点评 本篇文章中,作者采用了scRNA-seq分析、类器官培养、转基因和免疫染色技术来研究LKB1对肺goblet cell化生的作用。本文亮点是利用scRNA-seq技术为探究LKB1缺失诱发的肺病理机制以及LKB1调控club cell向goblet cell分化的分子机制提供基础,并结合湿实验最终证实巨噬细胞来源的RELM-α有助于气道goblet cell化生的进一步发展。在分析手段上,本篇文章尤其在差异表达基因、拟时序、SCENIC和细胞通讯分析的运用上具有很好的参考意义。 文献链接 PMID: 34921639 DOI: 10.1007/s00018-021-04044-w 参考文献 Li, Y., Zhang, Q., Li, L. et al. LKB1 deficiency upregulates RELM-α to drive airway goblet cell metaplasia. Cell. Mol. Life Sci. (2021). END 单细胞事业部 撰文 本文系欧易生物原创 转载请注明文本转自欧易生物