欧易单细胞文章继续高分文章产出!2021年12月29日,重庆陆军军医大学第二附属医院张曦教授团队在Clinical and Translational Medicine(IF 11.492)发表关于单细胞图谱解析人间充质干细胞异质性的相关报道,该篇文章中,王峥老师为该篇文章的第一作者,欧易生物提供了该篇文章的单细胞转录组测序和分析工作。下面我们一起学习这篇文章的具体内容。
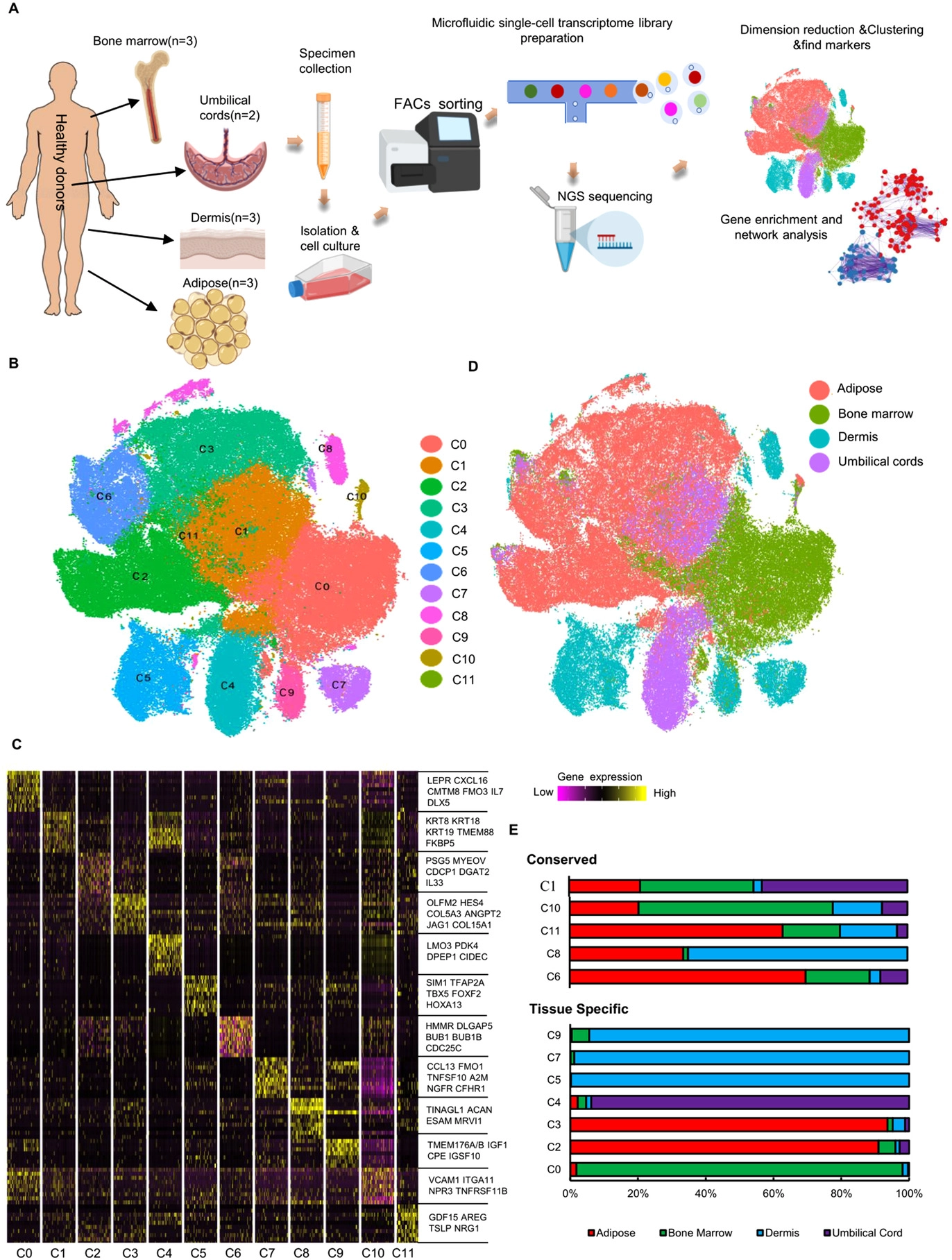
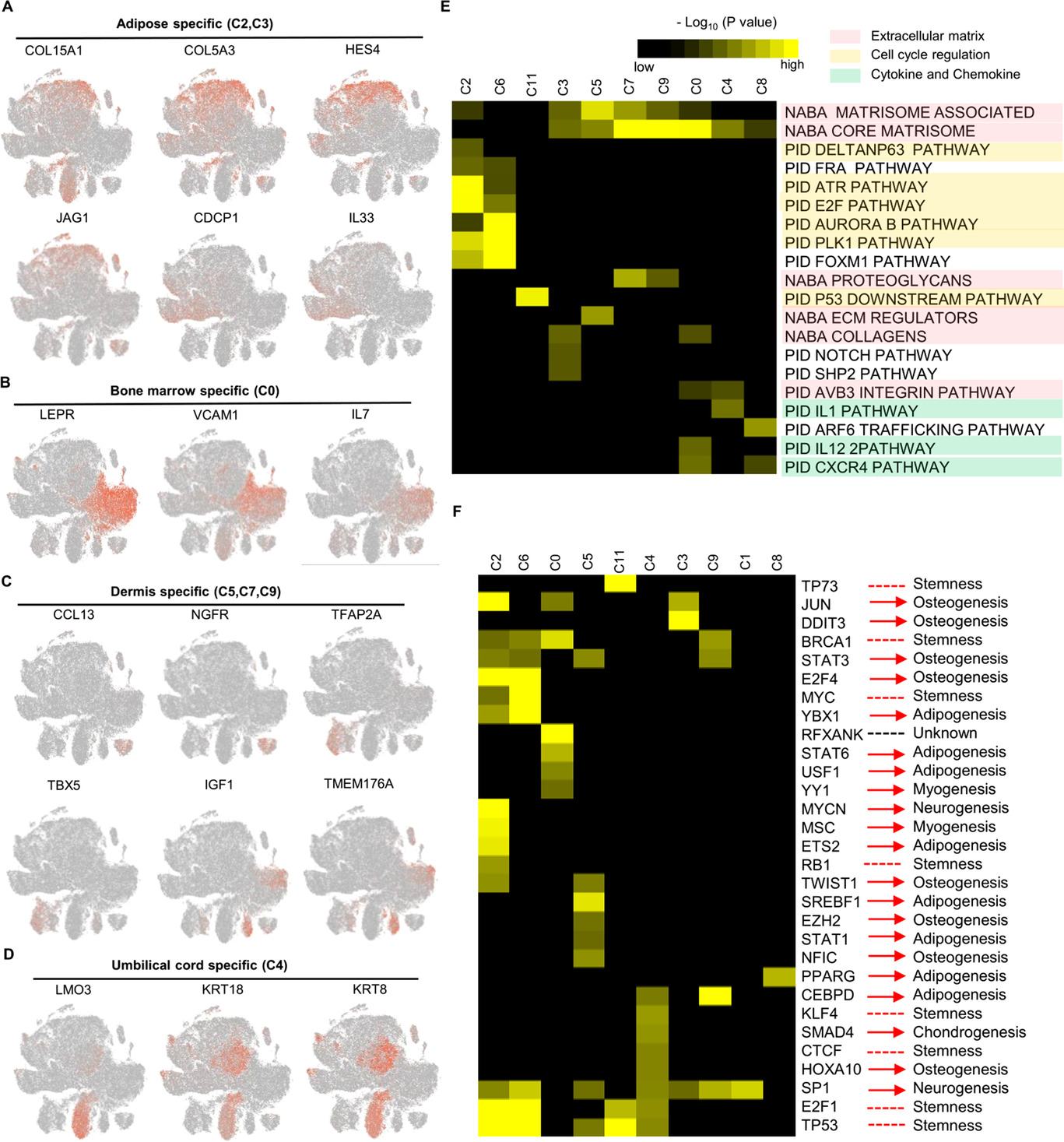
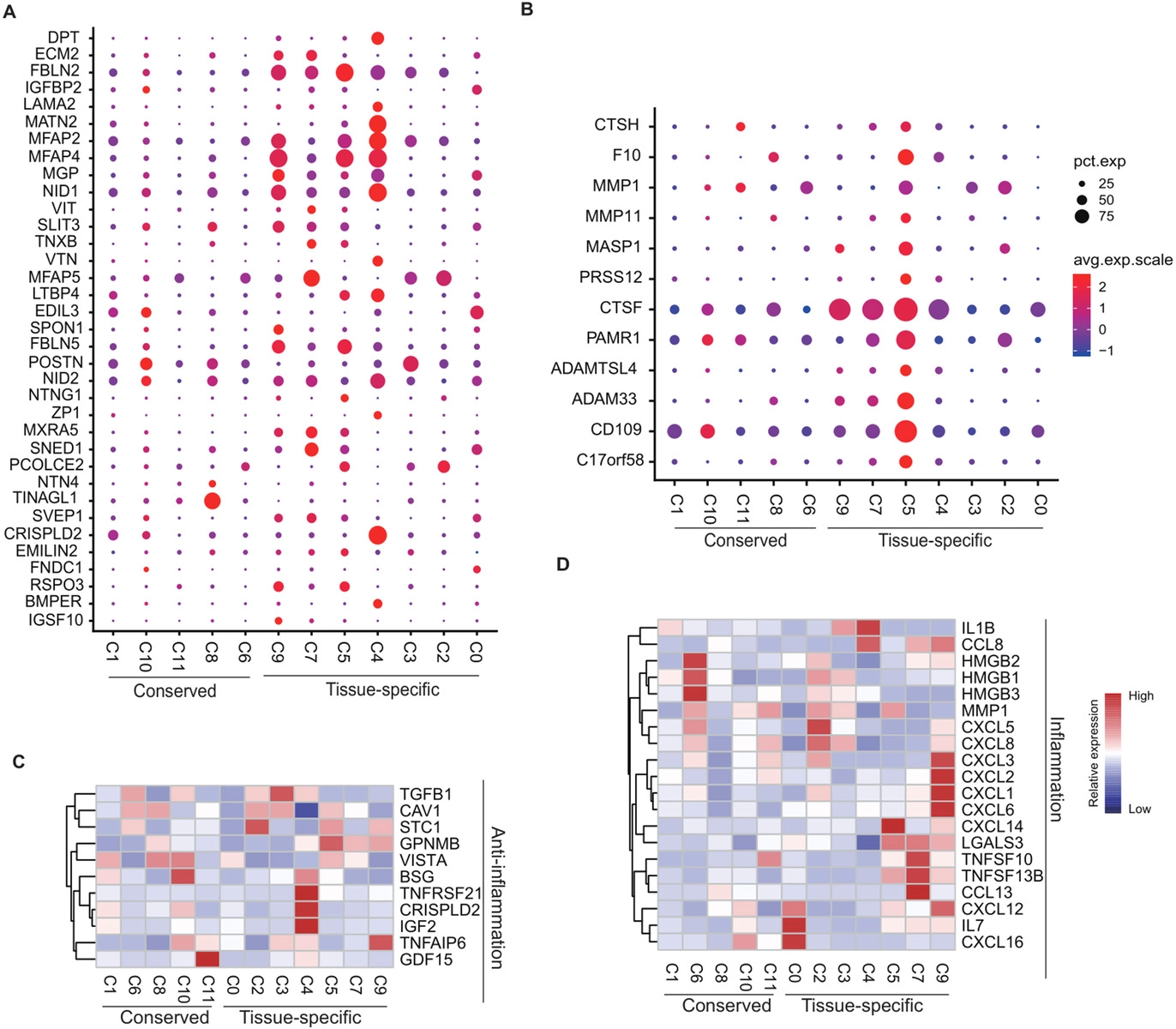
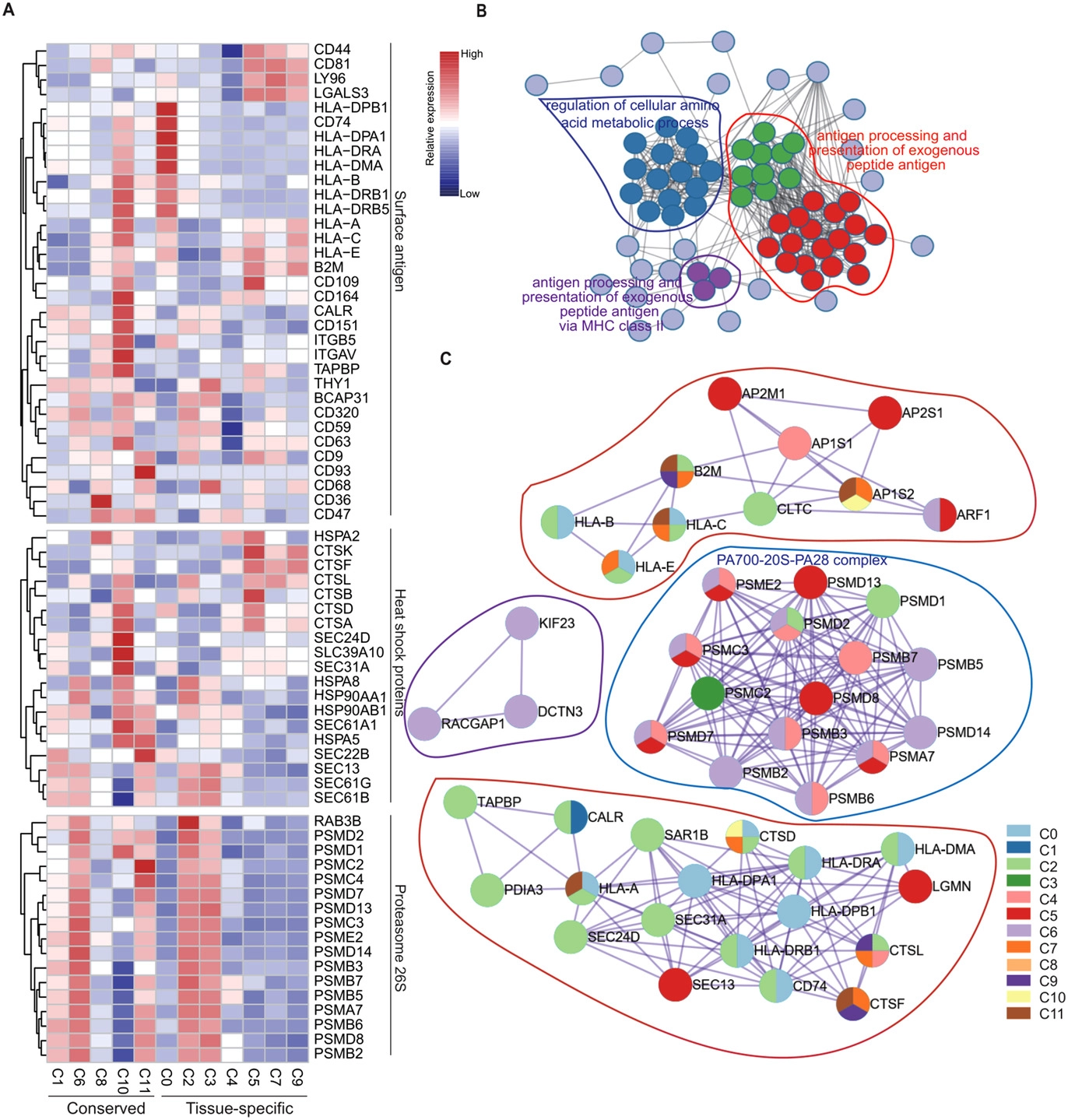
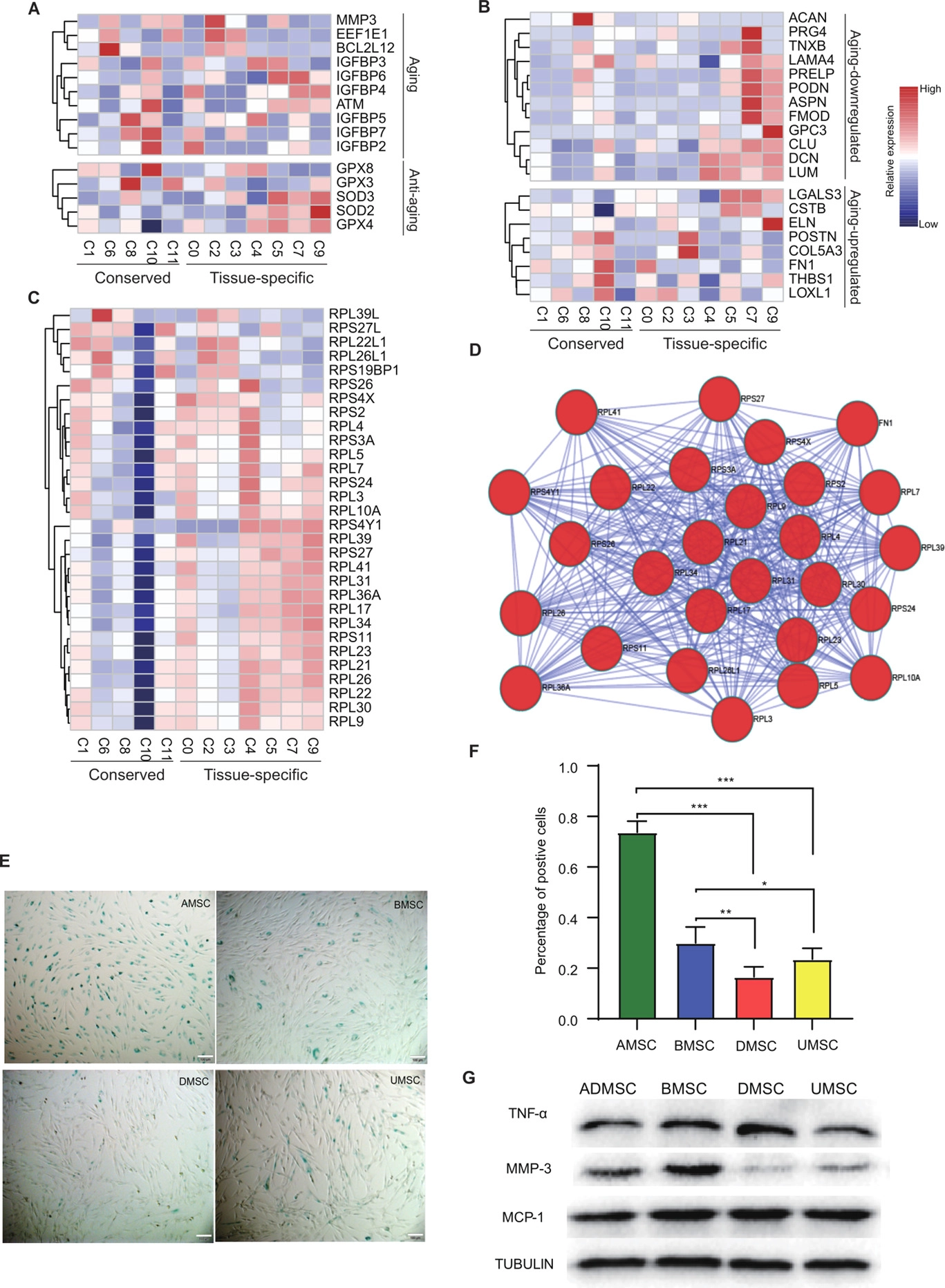
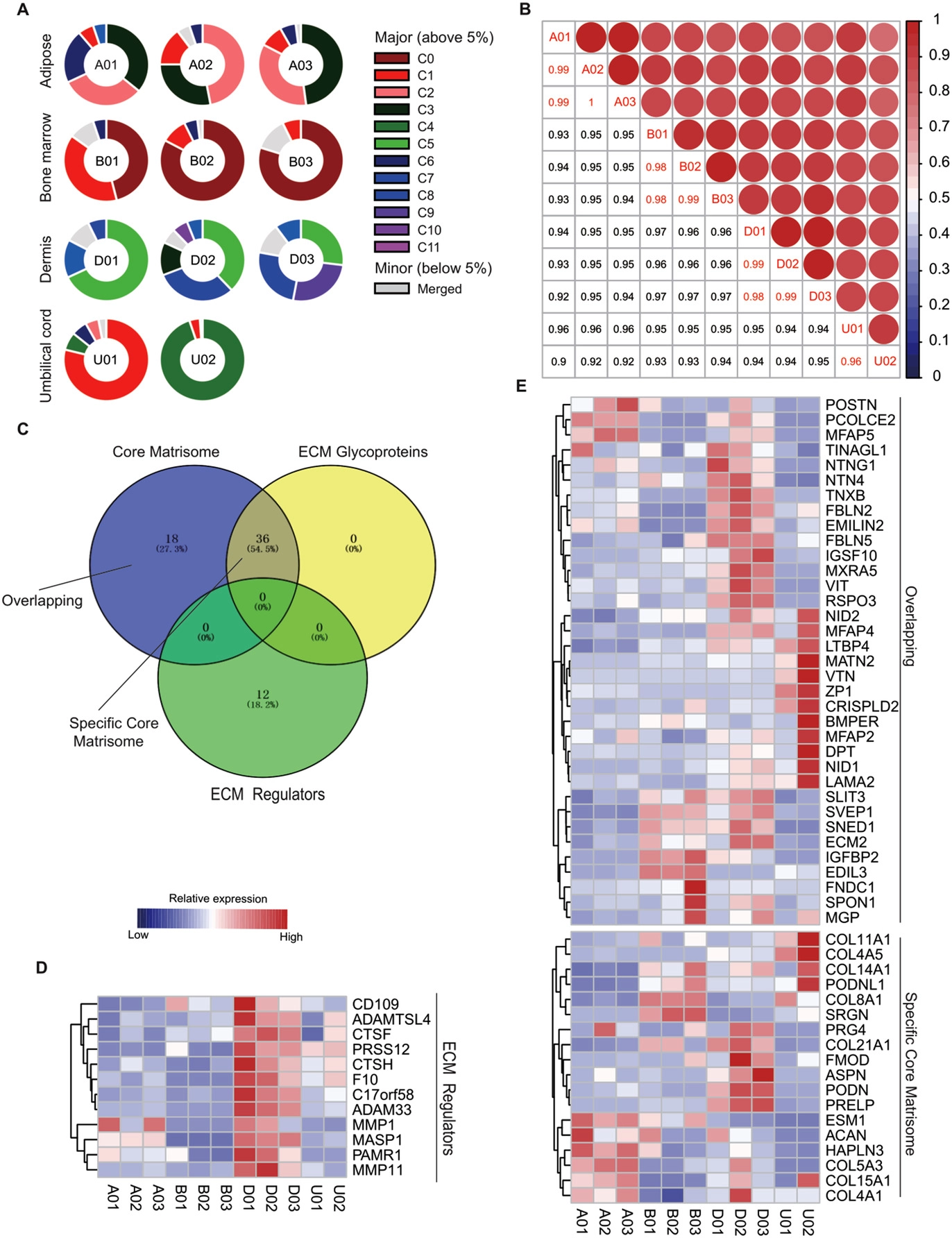
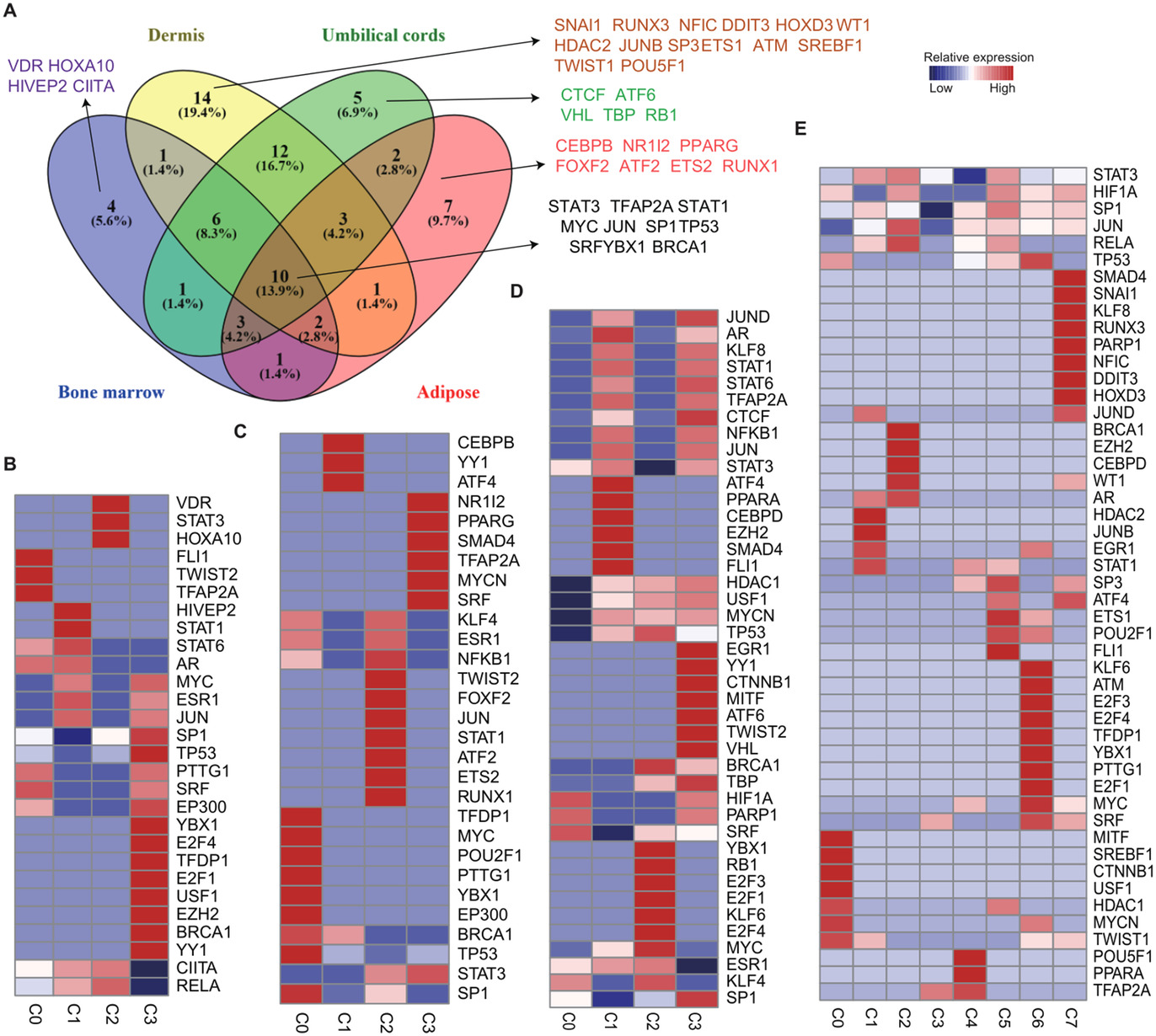
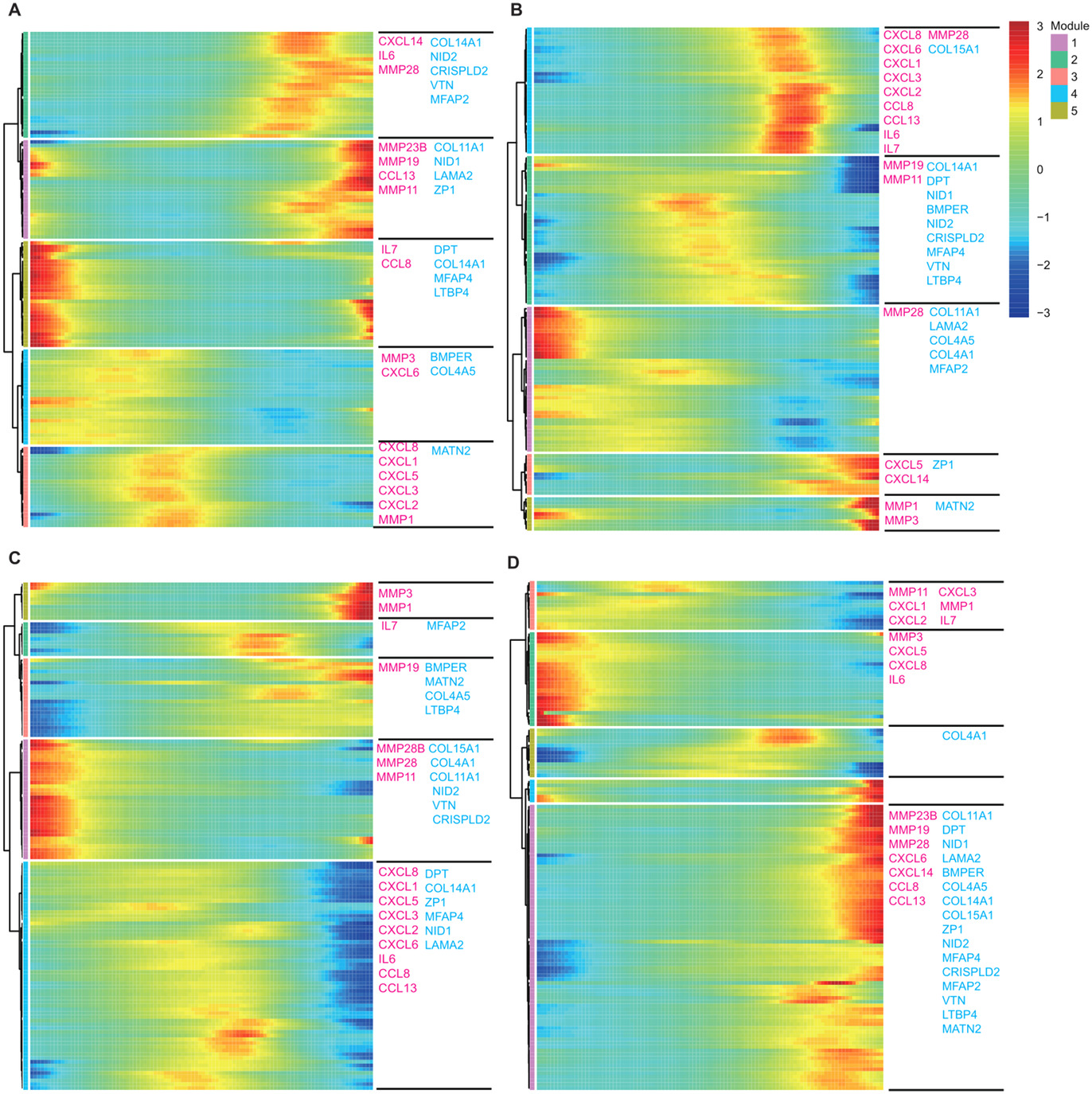
基本信息 材料:正常骨髓(3例),脂肪(3例),脐带(2例),真皮(3例) 期刊:Clinical and Translational Medicine 发表时间:2021年12月 方法:欧易生物10× Genomics scRNA-seq 研究背景和研究目的 间充质干细胞 (mesenchymal stem cells, MSCs) 在组织工程和再生医学中的应用具有广阔前景。然而,MSCs的异质性,包括来自供体、组织、亚群和单个细胞的差异,阻碍了MSCs在基础研究和临床中的应用。同时,MSCs的细胞外基质 (Extracellular matrix, ECM) 在支架结构、免疫调节等方面具有重要作用,但尚不清楚ECM对MSCs异质性的影响。因此,这篇文章旨在通过单细胞测序解析MSCs异质性以及ECM对其异质性的功能贡献,为促进MSCs的质量控制和治疗策略提供理论基础。 内容概述 作者从11个健康供体的样本中获得约130,000个细胞,构建了不同组织的MSCs单细胞图谱。对MSCs进一步分析研究,发现组织特异性以及具有保守性的MSCs亚群,ECM在MSCs异质性中起到决定作用。此外,ECM相关的炎症、衰老、抗原处理和呈递等功能在组织特异性亚群中也是高度异质性的。拟时序分析进一步说明MSCs组织内以及不同组织间的异质性。发育轨迹的构建也说明了MSCs组织间和组织内的异质性。 具体研究内容解析 1. 利用单细胞转录组测序分析组织特异性MSCs亚群及其基因表达特征 作者首先从四类组织中提取了MSCs,并利用三系分化和流式鉴定所提取细胞,之后利用流式分选MSCs进行单细胞测序,得到超过130,000个细胞,构建了一个来自11名健康捐赠者 (年龄22岁至46岁) 以及多个组织 (骨髓、脂肪、脐带和真皮) 的MSCs单细胞转录组图谱 (Figure 1A)。捕获到的MSCs降维聚类后得到12个cluster (Figure 1B),各个cluster具有转录异质性 (Figure 1C)。同时将样本信息映射到降维聚类结果中,发现MSCs亚群的多样性具有组织依赖性的特点 (Figure 1D)。为了更好地描述MSCs亚群的特性,作者定义组织特异性群 (其中一个组织的相对丰度在该群中占90%),其他群被定义为组织保守群。对组织特异性和组织保守性MSCs亚群进行统计分析,发现各个亚群各自具有组织特异性或较为保守的特点 (Figure 1E)。其中C0:BMSC特异性;C2, C3:AMSC特异性;C4:UMSC特异性;C5, C7, C9:DMSC特异性,各组织特异性亚群marker gene如图Figure 2A-D所示。 针对MSCs各亚群做差异基因的功能富集分析,富集到的GO条目主要分为三类:(1) ECM, (2) cell cycle regulation, (3) cytokine/chemokine (Figure 2E)。使用TRRUST对所有TFs进行调控活性分析,以解析每个亚群内的基因调控网络。此外,作者还根据文献报道人工注释TFs在免疫调节和谱系分化中的作用。不同MSCs亚群由不同的转录因子调控,例如C3亚群主要由JUN、SP1和DDIT3调控,这表明成骨分化可能优先,其他谱系分化可能受到抑制 (Figure 2F)。 Figure 1. 单细胞测序分析MSCs亚群组织特异性 Figure 2. MSCs组织特异性亚群的特征 2. ECM相关的免疫调节基因在组织特异性MSCs亚群中具有高度异质性 MSCs的ECM通过细胞因子分泌调节免疫细胞迁移和分化,从而调节免疫应答微环境。通过ECM相关的条目研究ECM异质性与细胞因子分泌之间的关联,结果发现,ECM相关蛋白和分泌因子在组织特异性亚群中的异质性明显高于保守亚群(Figure 3A-C)。除了趋化因子外,整合素和微纤丝相关蛋白(microfibrillar-associated proteins,MFAPs)在不同的亚群中功能也不同,以趋化剂或改变免疫细胞的行为起作用(Figure 3B)。除了免疫抑制特性外,MSCs还可以分泌炎症因子,增强其免疫刺激能力(Figure 3C-D)。所有组织特异性亚群均有异质性分泌较高的炎症蛋白,例如C0中分泌IL7、CXCL16;C2和C3中分泌HMGB1、HMGB3。 Figure 3.ECM相关通路和抗炎相关高表达基因 3. 抗原处理复合物在MSCs保守性亚群和组织特异性亚群中的异质性 免疫反应的启动是由抗原加工和呈递介导的,ECM重塑是其中一个关键步骤,例如,与抗原处理和呈递相关的MHC I类和II类介导ECM中的炎症信号转导。为了解ECM异质性如何影响抗原加工和呈递,作者首先研究了保守性和组织特异性MSCs亚群中与抗原加工和呈递相关的差异基因。研究表明,在抗原加工和呈递过程中,与表面抗原、热休克蛋白家族和蛋白酶体26S亚单位相关的三种功能模块在基因表达上表现出异质性(Figure 4A)。这些差异基因在外源性肽抗原加工和呈递等三个GO条目中富集(Figure 4B)。功能复合物,例如PA700-20S-PA28蛋白酶体复合物,在BMSC特异性C0亚群、AMSC特异性C2亚群和保守性C6亚群中富集,从而促进抗原加工(Figure 4C)。综合以上的分析结果来看,UMSC特异性C4亚群和保守性C8亚群具有较弱的抗原加工处理和呈递能力。 Figure 4. 深度分析转录组中与抗原加工和呈递相关的基因表达 4. 与衰老相关的ECM蛋白在组织特异性MSCs亚群中表现出异质性 表现出衰老相关分泌表型 (senescence associated secretory phenotype, SASP) 的衰老MSCs会过度分泌促炎因子,从而干扰其对免疫抑制能力的影响。研究发现,与衰老相关的基因表达呈现异质性。相对于其他保守性和组织特异性MSCs亚群来说,许多抗衰老基因在UMSC和DMSC的特异性亚群中高表达 (Fig. 5A)。此外,衰老下调的ECM基因在UMSC和DMSC特异性亚群中高表达,而衰老上调的ECM基因在几个亚群中表达相对较低,其中UMSC特异性C4亚群在衰老上调的ECM基因中表达最低 (Figure 5B)。有研究发现,核糖体基因的保护是防止细胞衰老的关键,在衰老过程中,启动子区域核糖体RNA基因的甲基化增加,从而降低基因表达。 作者在该研究中发现核糖体蛋白在UMSC和DMSC特异性亚群中高表达,尤其是在C4中 (Figure 5C)。PPI分析显示这些核糖体蛋白之间表现出高度的相互作用 (Figure 5D)。总的来说,这些结果表明UMSC和DMSC特异亚群 (C4、C5、C6和C7) 在抗老化方面具有优势。为了进一步证明这一分析结果,作者使用β-gal染色检测MSCs在P6的衰老程度,结果发现,与UMSC和DMSC相比,AMSC和BMSC中SA-β-gal-阳性MSCs的百分比显著增加 (Figure 5E, F)。作者同时利用western blotting对衰老相关基因进行检测,结果显示,MMP3在UMSC和DMSC中明显降低,TNFa在UMSC中明显降低 (Figure 5G)。以上研究表明,与AMSC和BMSC相比,UMSC和DMSC具有抗衰老的特性。 Figure 5. 单细胞转录组分析MSCs保守性亚群和组织特异性亚群与衰老相关的异质性 5. 解析来自多个组织的MSCs的不同供体差异 成人组织 (脂肪、骨髓和真皮) 的比例有轻微的供体差异,而来自脐带的MSCs在不同供体间表现出明显的异质性 (Figure 6A)。UMSC与其他MSCs的相关性分析表明,每个供体样本的UMSC与其他组织来源的MSCs相关性较低 (Figure 6B)。ECM相关通路主要控制MSCs亚群的异质性 (Figure 2D),通过对UMSC中各供体样本之间的ECM组分进行分析,发现ECM组分具有显著异质性,尤其是ECM糖蛋白组分,例如LAMA2, VTN, MFAP4和DPT (Figure 6C–E)。 Figure 6. Donor derived heterogeneity of mesenchymal stem cells (MSCs) across multiple tissues.不同组织MSCs不同供体来源的异质性 6. 不同组织间和组织内的转录组调控网络和PPI网络 使用TRRUST对各组织内的MSCs亚群进行调控活性分析,进一步探讨转录组调控的组织间和组织内的相似性和差异性。每个组织中的大多数组织内MSCs亚群都有其特定的转录调控因子 (Figure 7B-E)。采用Venn图进一步比较组织间差异,Venn图展示了各组织所有结合的转录因子,结果说明各组织除了MSCs保守的调控因子外,还有组织特异性的调控子 (Figure 7A)。例如,TWIST1、NFIC和DDIT3在DMSCs中特异性富集,而保守性调节因子与免疫抑制、增殖和干细胞更新等MSCs本身具有的功能特点相关。 Figure 7.转录因子调控网络解释组织间和组织内MSC的异质性 7. 多组织来源MSCs的异质性轨迹分析 作者进一步利用拟时序分析MSCs各组织来源细胞群的变化,并挑选ECM相关的高变基因来评估这些基因在拟时序轨迹中的表达是否具有组织特异性 (Figure 8)。值得注意的是,这些供体间变化的ECM基因主要在拟时序晚期的UMSCs中表达,并与其他来源的MSCs有所区别,这表明ECM的改变促进了UMSC的异质性,从而降低了UMSC的干性 (Figure 8D)。此外,许多炎症因子在每个组织中沿着一个轨迹共同表达,CXCL1、CXCL2和CXCL3在四种类型的MSCs中同步发生 (Figure 8)。 Figure 8.与供体间异质性相关的ECM和促炎基因动力学热图 结论 这篇文章首次在单细胞水平上系统地针对健康供体的MSCs绘制了转录图谱,并且系统探讨了组织间以及组织内的异质性,为理解MSCs的免疫抑制的一致性和异质性提供了深入的见解。此外,这些发现为探索MSCs的多种功能和潜在机制提供了基础,对MSCs的基础研究和临床应用具有广泛的意义。 参考文献 1. Wang Z, Chai C, Wang R, et al. Single-cell transcriptome atlas of human mesenchymal stem cells exploring cellular heterogeneity. Clin Transl Med. 2021;11(12):e650. doi:10.1002/ctm2.650 欧易单细胞事业部 单细胞事业部建立于2018年,已成为欧易生物的核心部门之一。先后引入多套10x Genomics和 BD RhapsodyTM主流的高通量单细胞分选平台,以及流式细胞仪等个性化单细胞分选平台,已获得10x Genomics公司授权的单细胞基因表达和空间转录组双平台服务提供商认证,并与北京、广州、成都等地协同科研院所分别成立联合实验室。 团队成员50余人,博士学历5人,硕士及以上学历人员比例达40%以上;拥有300m2独立实验室,可完成样本处理、细胞分选、文库构建和空间转录等的实验。 单细胞事业部成立至今,已完成1500+个项目、8000+例样本的单细胞解离与测序,参与或协助客户发表50篇高水平文章。欧易生物单细胞事业部致力于为广大科研工作者提供周到、贴心、专业的技术服务,专注于以客户的口碑铸就品牌形象。 END 单细胞事业部 撰文 本文系欧易生物原创 转载请注明文本转自欧易生物