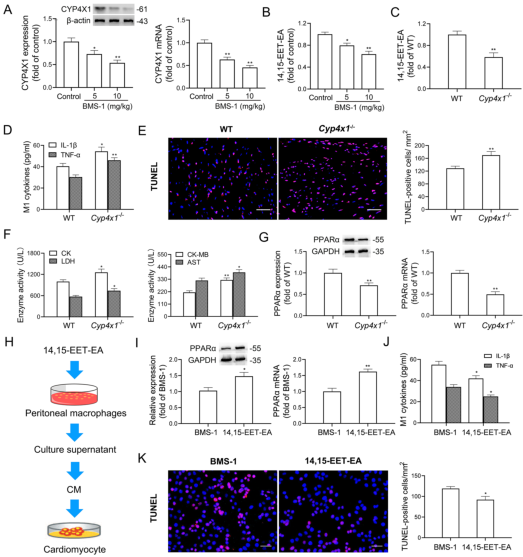
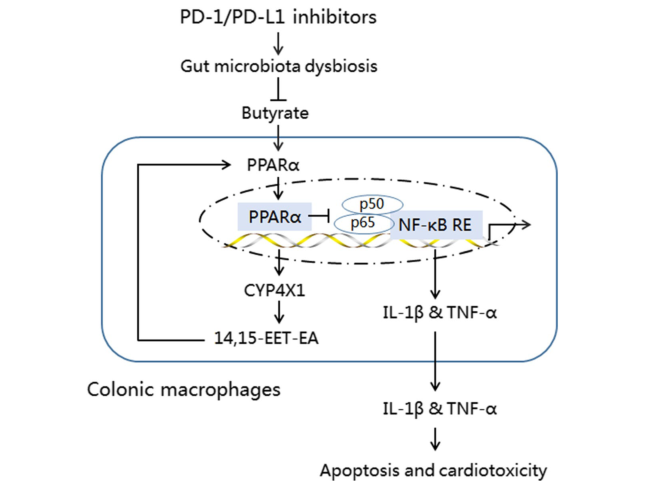
免疫检查点抑制剂引起的心脏毒性是最致命的不良反应之一,因此,潜在机制的研究对于制定治疗策略具有重要的临床意义。2022年1月,武汉大学人民医院杨静和周晓阳教授的研究团队在Journal of Experimental & Clinical Cancer Research期刊(IF:11.161)上发表了题为“Prevotellaceae produces butyrate to alleviate PD-1/PD-L1 inhibitor-related cardiotoxicity via PPARα-CYP4X1 axis in colonic macrophages”的研究论文,旨在研究微生物与宿主的相互作用是否有助于缓解PD-1/PD-L1抑制剂引起的心脏毒性。文章中的16S rRNA微生物多样性检测服务由欧易生物提供技术支持。
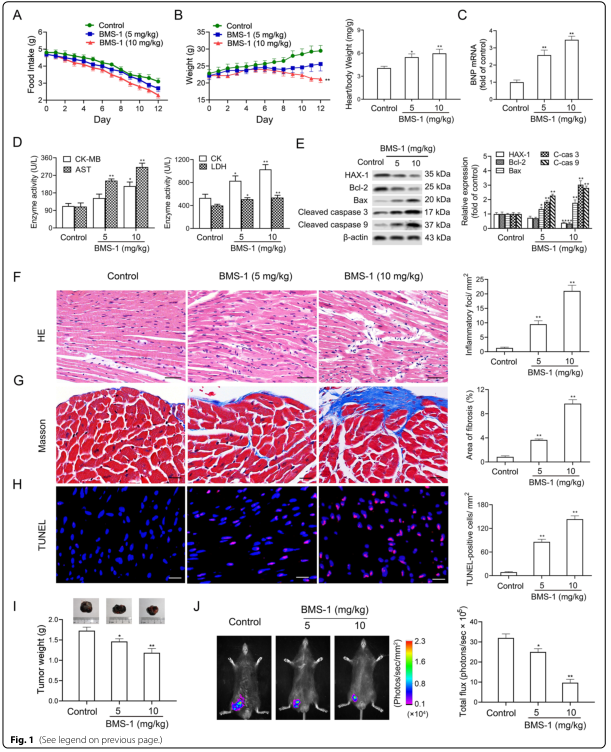
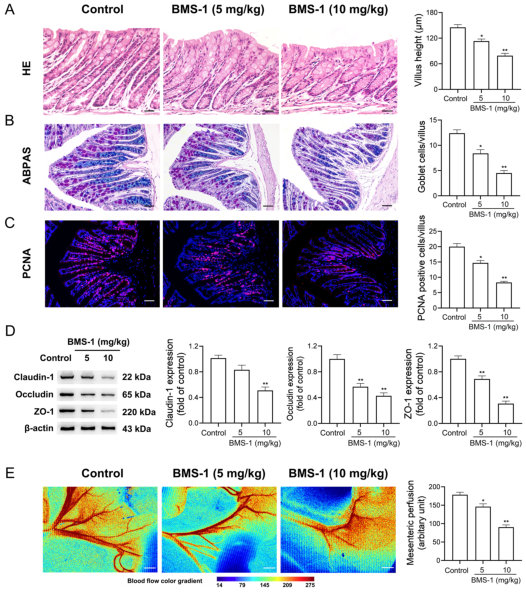
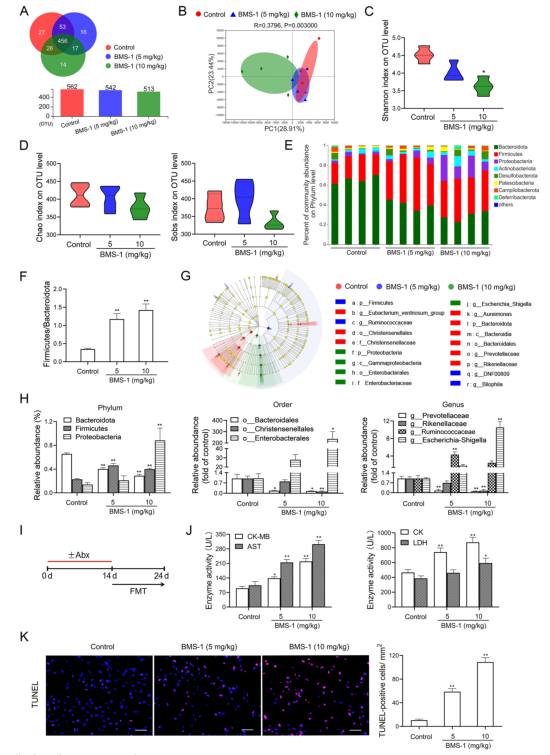
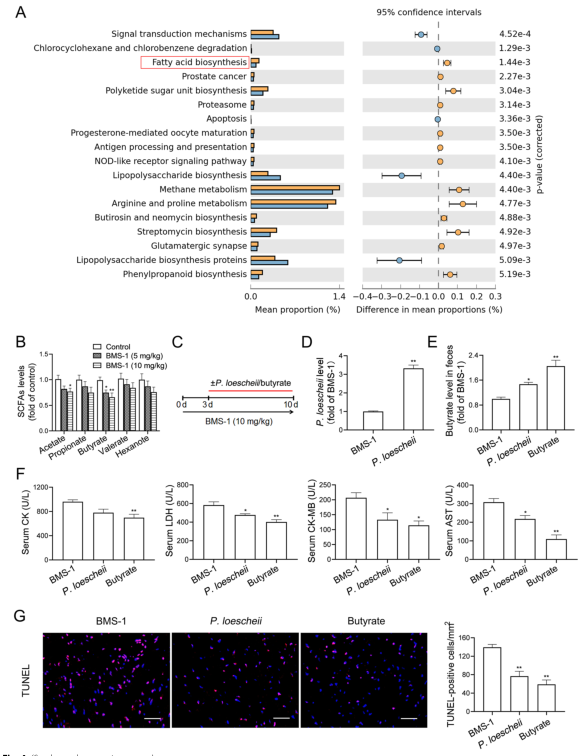
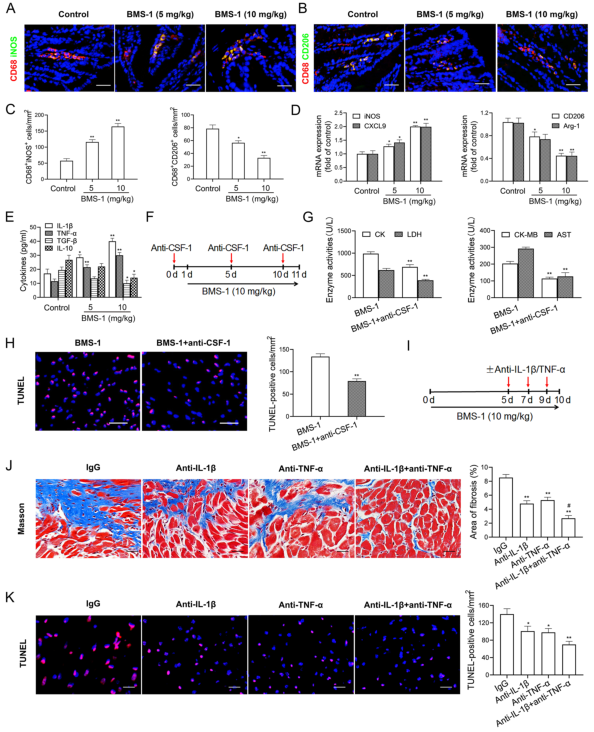
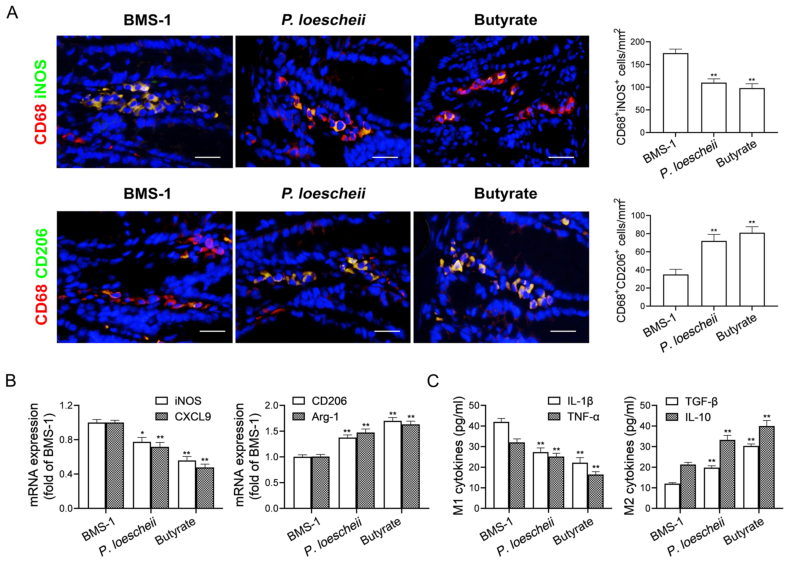
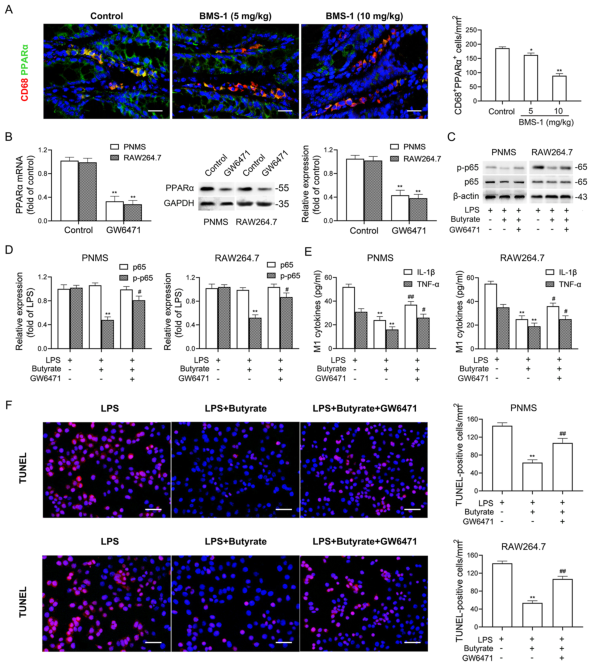
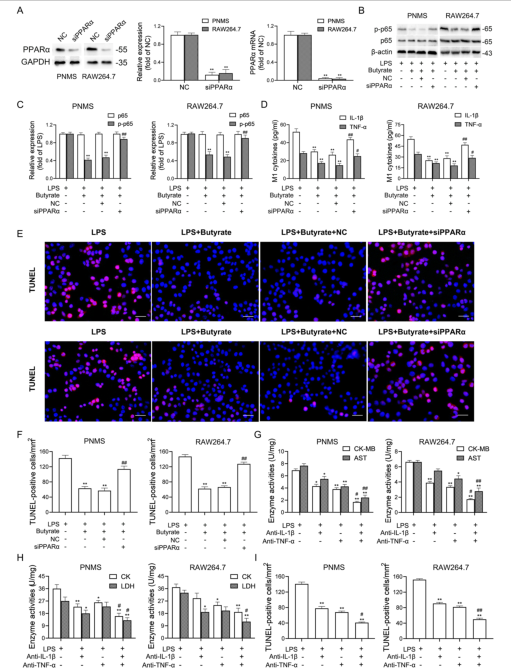
研究背景 靶向程序性细胞死亡1(PD-1)或其配体1(PD-L1)的免疫检查点抑制剂在抗肿瘤治疗中具有重要的临床意义,但会引起致命的免疫不良反应——心脏毒性。为了克服这一不良反应,必须尽量减少全身炎症。改变肠道微生物群落在心血管疾病的炎症反应中起着重要作用。肠道微生物代谢产物短链脂肪酸(SCFAs),如丁酸,具有抗炎特性。然而,控制肠道菌群及其代谢产物,是否能阻止PD-1/PD-L1抑制剂诱导的心肌细胞凋亡和心脏毒性尚不清楚。 巨噬细胞是自身免疫和自身炎症疾病中炎症介质的主要生产者。前期研究表明,抑制细胞色素P450 (CYP) 4X1【CYP4X1】使肿瘤相关巨噬细胞重新分化为M1表型,并上调M1样因子TNF-α和IL-1β。然而,CYP4X1和结肠巨噬细胞衍生的M1样因子TNF-α和IL-1β是否与PD-1/PD-L1抑制剂相关的心脏毒性有关尚不清楚。 研究内容 在本研究中,首次提供了PD-1/PD-L1抑制剂以肠道微生物群依赖的方式诱导心肌细胞凋亡和心脏毒性的直接证据。P.loescheii定植和补充丁酸对PD-1/PD-L1抑制剂引起的心脏毒性有保护作用。此外,还发现PD-1/PD-L1抑制剂诱导的肠道菌群失调可上调结肠巨噬细胞中促炎因子IL-1β和TNF-α的表达。这是首次证实肠道微生物群和结肠巨噬细胞在PD-1/PD-L1抑制剂引起心脏毒性中的相互作用。 研究结果 1. BMS-1诱导黑色素瘤小鼠心肌细胞凋亡和心脏毒性 PD-1/PD-L1抑制剂BMS-1(5和10 mg/kg)处理的小鼠的食物摄入量与对照组相比呈现下降趋势,但三组之间没有显著差异(图1A)。BMS-1(5和10 mg/kg)降低了小鼠的体重,但增加了心脏/体重的比值(图1B)。脑钠肽(BNP)是心脏功能失常的指标,BMS-1 (10 mg/kg)显著提高了BNP水平(图1C)。BMS-1处理小鼠外周血中CK-MB、AST、CK和LDH等心肌酶活性也得到了类似的结果(图1D)。此外,BMS-1 (10 mg/kg)显著降低了抗凋亡蛋白HAX-1和Bcl-2的水平,但增加了促凋亡蛋白Bax、cleaved caspase 3和cleaved caspase 9的水平(图1E)。与对照组相比,BMS-1(5和10 mg/kg)也增加了心肌组织中的炎症浸润、间质纤维化和末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)阳性心肌细胞的数量(图1F-H)。BMS-1(5和10 mg/kg)抑制黑色素瘤的生长,可以通过降低肿瘤重量和荧光素酶强度来证明(图1I和J)。这些结果表明,PD-1/ PD-L1抑制剂BMS-1诱导黑色素瘤小鼠心肌细胞凋亡和心脏毒性。 图1 BMS-1诱导黑色素瘤小鼠心肌细胞凋亡和心脏毒性 2. BMS-1诱导黑色素瘤小鼠肠道黏膜屏障损伤 肠屏障功能障碍包括机械屏障(肠黏膜上皮)和生物屏障(肠道微生物群)损伤导致心功能受损。对结肠黏膜完整性进行评估。如图2所示,BMS-1(5和10 mg/kg)降低了结肠组织绒毛高度和杯状细胞数量,并下调了紧密连接蛋白Claudin-1、Occludin和ZO-1的表达。测定肠系膜灌注评分,发现BMS-1(5和10 mg/kg)降低了肠系膜灌注(图2E)。这些结果表明BMS-1诱导黑色素瘤小鼠肠道黏膜屏障损伤。 图2 BMS-1诱导黑色素瘤小鼠肠道屏障损伤 3. 肠道微生物菌群失调有助于PD-1/PD-L1抑制剂引起的心脏毒性 对粪便中的细菌16S rRNA进行测序,以评估肠道生物屏障。虽然BMS-1(5和10 mg/kg)对粪便总菌量或种类没有显著影响(图3A),但beta分析显示肠道菌群构成存在明显差异,尤其是BMS-1 (10 mg/kg)组与对照组之间(图3B)。alpha多样性分析也表明,Shannon指数降低,但不影响Chao指数和Sobs指数(图3C和D)。图3E显示BMS-1显著改变了菌门的丰度。厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的比值(肠道失调的标志)在BMS-1作用下显著增加(5和10 mg/kg)(图3F)。通过LEfSe分析确定差异表达菌(图3G)。在门水平,BMS-1(5和10 mg/kg)处理显著降低了拟杆菌属的丰度。相反,与对照组相比,BMS-1 (10 mg/kg)处理小鼠的厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的丰度显著增加。 在属水平上,与对照组相比,在BMS-1 (10 mg/kg)处理的小鼠中观察到Prevotellaceae和Rikenellaceae属的缺失和Escherichia-Shigella的富集。与对照组相比,BMS-1 (5 mg/kg)处理的小鼠Ruminococcaceae属的丰度显著增加,BMS-1 (10 mg/kg)与对照组之间没有显著差异(图3H)。为了探究肠道菌群在BMS-1诱导的心脏毒性中的作用,进行了粪菌移植(FMT)实验,用BMS-1 (5,10 mg/kg)处理的小鼠的肠道菌群进行了肠道菌群的重建(图3I)。令人意外的是,BMS-1处理的小鼠FMT显著诱导了心肌酶(CK-MB、AST、CK和LDH)的泄露和心肌细胞的凋亡(图3J和K)。结果表明,肠道微生物菌群失调有助于PD-1/PD-L1抑制剂引起的心脏毒性。 图3 肠道微生物失调导致PD-1/PD-L1抑制剂引起的心脏毒性 4. P.loescheii定植和补充丁酸盐可减轻 PD-1/PD-L1 抑制剂引起的心脏毒性 通过KEGG通路分析,检测肠道菌群中功能基因的相对丰度。与对照组相比,BMS-1 (10 mg/kg)处理的小鼠的脂肪酸合成途径显著下调(图4A)。测定了BMS-1和对照组小鼠的粪便中SCFAs,发现BMS-1(5和10 mg/kg)显著降低了丁酸水平,而乙酸、丙酸、戊酸和己酸保持不变(图4B)。向BMS-1 (10 mg/kg)处理的小鼠提供P.loescheii或丁酸(图4C),粪便中P.loescheii(图4D)和丁酸盐水平的增加证实了P.loescheii定植的有效性(图4E)。P.loescheii定殖和添加丁酸盐可减弱BMS -1诱导的心肌酶泄露和心肌细胞凋亡(图4F和G)。这些数据表明,P.loescheii定殖和添加丁酸盐可减轻PD-1/PD-L1抑制剂引起的心脏毒性。 图4 P.loescheii定植及补充丁酸可减轻PD-1/PD-L1抑制剂引起的心脏毒性 5. M1样结肠巨噬细胞及其因子IL-1β和TNF-α有助于减轻PD-1/PD-L1抑制剂引起的心脏毒性 BMS-1(5和10 mg/kg)显著增加了M1样(CD68+iNOS+)细胞的数量,上调了M1基因(iNOS和CXCL9),但降低了M2样(CD68+CD206+)细胞的数量和下调了M2基因(CD206和Arg-1)(图5A-D)。此外,BMS-1显著提高了结肠巨噬细胞中IL-1β和TNF-α的水平,但没有提高TGF-β和IL-10的水平(图5E)。为了确定BMS-1是否通过改变结肠巨噬细胞表型诱导心脏毒性,用抗CSF-1抗体(IgG作为对照)清除结肠巨噬细胞(图5F)。如图5G和H所示,抗CSF-1抗体显著降低了BMS-1 (10 mg/kg)处理小鼠外周血心肌酶(CK、LDH、CK-MB和AST)水平和心肌组织中TUNEL阳性细胞数量。用IL-1β和TNF-α抗体来阻断它们的作用(图5I),发现抗IL-1β或抗TNF-α抗体部分消除了BMS-1诱导的心脏毒性。重要的是,IL-1β和TNF-α联合阻断比单独阻断更能减轻PD-1/PD-L1抑制剂引起的心脏毒性(图5J和K)。结果表明,结肠巨噬细胞来源的M1样因子IL-1β和TNF-α有助于减轻PD-1/PD-L1抑制剂诱导的心肌细胞凋亡和心脏毒性。 图5 M1样结肠巨噬细胞及其因子IL-1、β和TNF-α有助于减轻PD-1/PD-L1抑制剂引起的心脏毒性 6. P.loescheii定植以及添加丁酸可下调结肠巨噬细胞IL-1β和TNF–α P.loescheii定殖和丁酸的补充抑制了BMS-1诱导的结肠组织中M1样(CD68+iNOS+)细胞数量的增加和M2样(CD68+CD206+)细胞数量的减少(图6A)。P.loescheii定殖和添加丁酸可下调M1基因(iNOS和CXCL9)的mRNA表达,但上调M2基因(CD206和Arg-1)的表达(图6B)。还观察到结肠巨噬细胞M1样因子(IL-1β和TNF-α)和M2样因子(TGF-β和IL-10)水平的类似改变(图6C)。结果表明在PD-1/PD-L1抑制剂引起的心脏毒性反应中,P.loescheii定植和丁酸可以阻止结肠巨噬细胞M1样极化和促炎因子IL-1β和TNF-α的产生。 图6 P.loescheii定植及补充丁酸下调结肠巨噬细胞IL-1β和TNF-α的表达 7. 丁酸通过PPARα激活阻止NF-κB介导的M1样极化和心肌细胞凋亡 研究发现BMS-1(5和10 mg/kg)显著降低了结肠巨噬细胞PPARα的表达(图7A)。为了检测PPARα在结肠巨噬细胞极化和心肌细胞凋亡中的作用,通过western blot和qPCR检测GW6471抑制PPARα表达的效果(图7B)。图7C-F所示,丁酸能抑制LPS诱导的PNMS和RAW264.7细胞中p-p65、TNF-α和IL-1β的上调,并能减少TUNEL阳性的HL-1心肌细胞的数量。而PPARα拮抗剂GW6471则破坏了丁酸的保护作用。PPARα siRNA沉默实验的类似结果证实,丁酸可以通过PPARα依赖的方式阻止LPS诱导的M1样极化和心肌细胞凋亡(图8A-F)。此外,发现抗IL-1β或抗TNF-α抗体部分消除了LPS诱导的心脏毒性。心肌酶水平下降,TUNEL阳性心肌细胞数量减少。重要的是,IL-1β和TNF-α联合阻断比单独阻断效果更好(图8G-I)。这些结果表明,丁酸通过PPARα的激活,阻止NF-κB介导的M1样极化和心肌细胞凋亡。 图7 丁酸盐通过激活PPARα阻止NF-kB介导的M1样极化和心肌细胞凋亡 图8 丁酸盐通过激活PPARα阻止NF-kB介导的M1样极化和心肌细胞凋亡 8. 通过PD-1/PD-L1抑制剂下调CYP4X1可使PPARα失活,并在结肠巨噬细胞中形成正反馈环 检测了CYP4X1在结肠巨噬细胞中的表达。如图9A所示,BMS-1(5和10 mg/kg)显著降低了结肠巨噬细胞CYP4X1的表达。与对照组相比,BMS-1(5和10 mg/kg)处理的小鼠结肠巨噬细胞中来自CYP4X1的14,15-EET-EA的催化产量显著降低(图9B)。用BMS-1(10 mg/kg)处理WT和Cyp4x1−/−小鼠,图9C和D所示,与WT小鼠相比,Cyp4x1−/−小鼠结肠巨噬细胞中14,15-EET-EA产量减少,TNF-α和IL-1β的分泌增加。此外,在Cyp4x1−/−小鼠中观察到更多TUNEL阳性的心肌细胞和更高水平的血清心肌酶(CK、LDH、CK-MB和AST)(图9E和F)。PPARα siRNA下调了CYP4X1,反过来,CYP4X1敲除又下调了结肠巨噬细胞中PPARα mRNA和蛋白的表达(图9G)。外源性添加14,15-EET-EA显著降低PNMS中PPARα的表达,增加IL-1β和TNF-α的产生,从而逆转BMS-1诱导的心肌细胞凋亡(图9H-K)。这些结果表明,PD-1/PD-L1抑制剂下调CYP4X1可使PPARα失活,并在结肠巨噬细胞中形成正反馈环。 图9 PD-1/PD-L1抑制剂下调CYP4X1使结肠巨噬细胞PPARα失活并形成正反馈环 研究结论 本研究表明,肠道菌群失调通过下调结肠巨噬细胞PPARα-CYP4X1轴,诱导产生的少量丁酸有助于减轻PD-1/PD-L1抑制剂引起的心脏毒性。研究确认了肠道微生物群和结肠巨噬细胞之间在PD-1/PD-L1抑制剂引起的心脏毒性中的交流。提出了一种新的PD-1/PD-L1抑制剂相关心脏毒性的作用机制,并为通过控制肠道微生物群及其代谢产物丁酸酯使免疫治疗更安全、更有效提供了一个值得关注的靶点。 图10 P.loescheii通过上调结肠巨噬细胞PPARα-CYP4X1轴产生丁酸来缓解PD-1/PD-L1抑制剂引起的心脏毒性 原文链接 https://jeccr.biomedcentral.com/articles/10.1186/s13046-021-02201-4 欧易生物秉持着“以生物科技,成就他人,造福大众”的理念。为众多方向的研究学者提供持久可靠的科研助力。想要了解更多产品信息可拨打400-808-5350 或咨询驻地工程师,欢迎老师前来公司参观哦~ END Vivilla 撰文 本文系欧易生物原创 转载请注明文本转自欧易生物