2022 年 2 月 26 日,河南大学棉花生物学国家重点实验室孙旭武课题组在 Plant Journal (IF: 6.417) 发表了题为 Identification of Novel Regulators Required for Early Development of Vein Pattern in the Cotyledons by Single-cell RNA-seq 的研究论文,系统地分析了拟南芥幼苗生长初期子叶叶脉的单细胞转录组图谱,鉴定了关键的标记基因,并构建了特定细胞类型的转录调控网络。

欧易生物在本研究中承担了单细胞转录组测序及分析工作。
研究背景
植物的维管组织是由木质部和韧皮部组成的输导水分和营养物质,并有一定支持功能的植物组织[1]。在植物进化过程中,维管组织的分化和出现,对于植物适应陆生环境具有重大意义。水分在木质部向上运输,木质部由管胞和导管组成。有机溶质在韧皮部中双向运输,韧皮部含有缺乏细胞核的活性筛管元素和有细胞核的伴细胞。此外,维管系统通常被薄壁细胞束鞘包围[2]。
在发育上,茎顶端分生组织和根顶端分生组织产生的原形成层细胞在初生生长期间产生初生韧皮部和初生木质部[1]。气管分化抑制因子(TDIF),一种 CLAVATA3/ESR 相关(CLE)家族肽 CLE41/CEL42/CEL44,作为信号分子,既能抑制木质部细胞从原形成层细胞的分化,又能促进原形成层细胞增殖。响应生长素、细胞分裂素和TDIF信号,TDIF的受体 TDR/PXY 介导的转录调控网络通过调节靶基因的表达调控微管的发育[3-5]。在叶片和子叶中,叶脉模式的形成是通过将基础细胞逐渐招募到原形成层细胞中实现的[6]。种子萌发后,子叶快速发育产生叶绿体,并通过光合作用为幼苗的生长和存活提供能量。随着子叶的发育,在子叶中的叶脉快速出现。它们构成了幼苗中光合产物和矿物质运输的关键通道网络。尽管已有大量的研究试图解析在幼苗发育早期子叶中叶脉的发育调控机制,但由于组织分离技术的局限性,至今仍然难以完全理解。最近,single cell RNA-Seq(scRNA-seq)技术已经在解析植物气孔的发育和根系的发育中得到了快速的应用[7],并且在解析成熟叶片的韧皮薄壁组织的发育和功能中得到了应用[8]。但是关于幼苗生长初期,在单细胞转录组层面关于子叶中的叶脉的发育调控机制的研究还未见报道。
研究内容
为了分析子叶叶脉早期发育和分化的调控机制,该研究使用单细胞RNA测序分析了14117个来自3天龄子叶的单细胞。基于基因表达模式,共鉴定到了 10 个细胞簇。通过分析已知标记基因的表达模式,对所鉴定的细胞簇进行了细胞类型的注释(图 1)。
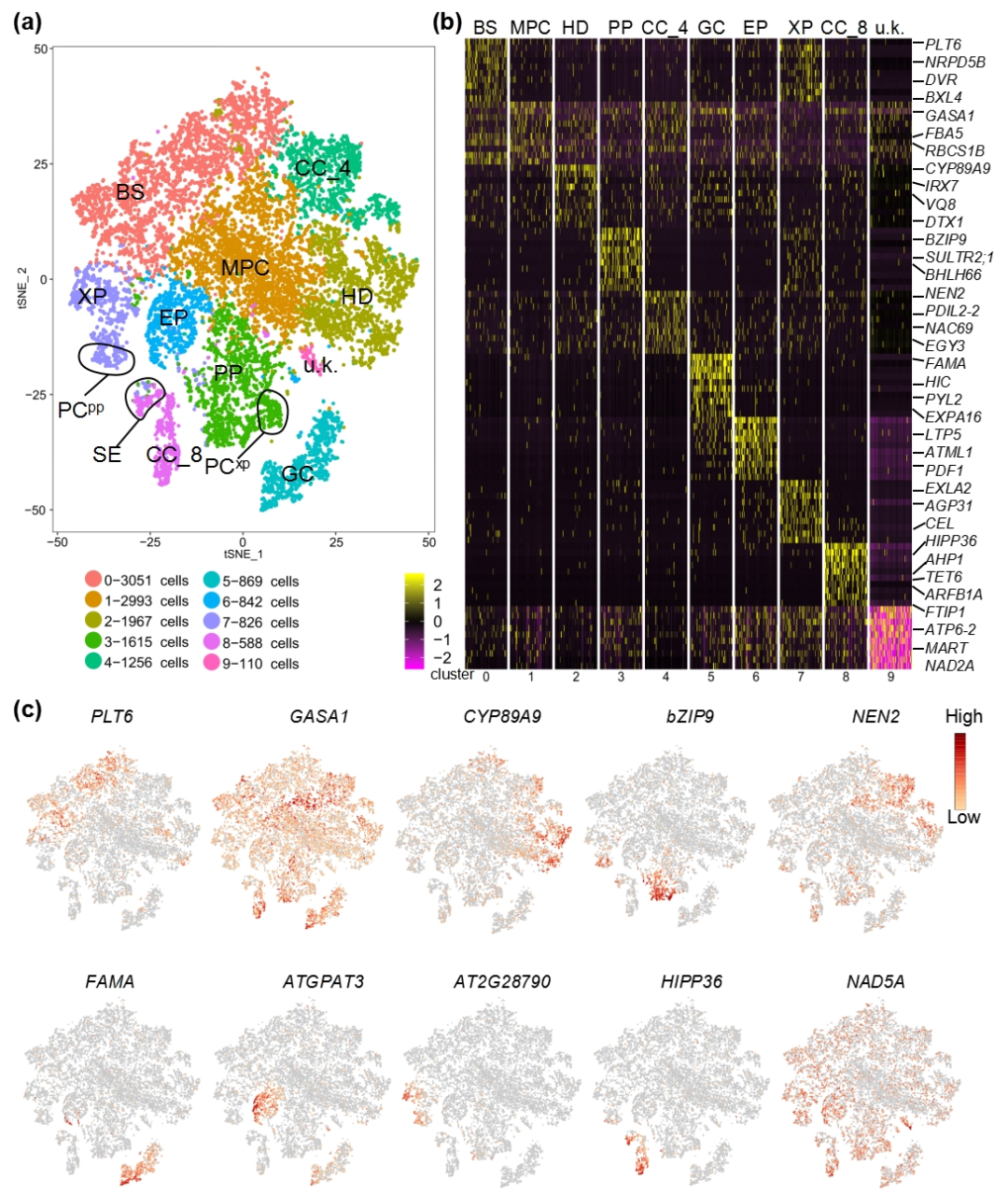
图 1 | 子叶叶脉细胞类型的鉴定。
(a)所有细胞的 tSNE 图。图上每个点代表一个细胞,不同的染色代表不同的细胞类型的细胞。BS:束鞘;MPC:叶肉细胞;PP:韧皮薄壁组织;HD:水孔;CC:伴细胞;GC:保卫细胞;EP:表皮;XP:木质部薄壁组织;PCxp:木质部薄壁组织细胞,具有与木质部分化有关的特征;PCpp:原形成层细胞,具有韧皮部分化的特征;SE:筛元;u.k.未知的细胞类型。
(b)tSNE 图中每个簇中特异表达的前10个基因的热图。
(c)每个细胞簇中代表性标记基因的特征图。
在确定了细胞类型的基础上,研究进一步筛选了一些在特定组织和细胞中表达的标记基因。通过分析部分标记基因的启动子驱动的GUS报告基因的表达模式证明,这些标记基因主要是在子叶的叶脉中表达(图 2)。这些标记基因的鉴定为将来进一步研究和分析鉴定微管组织细胞提供了重要的参考基因。
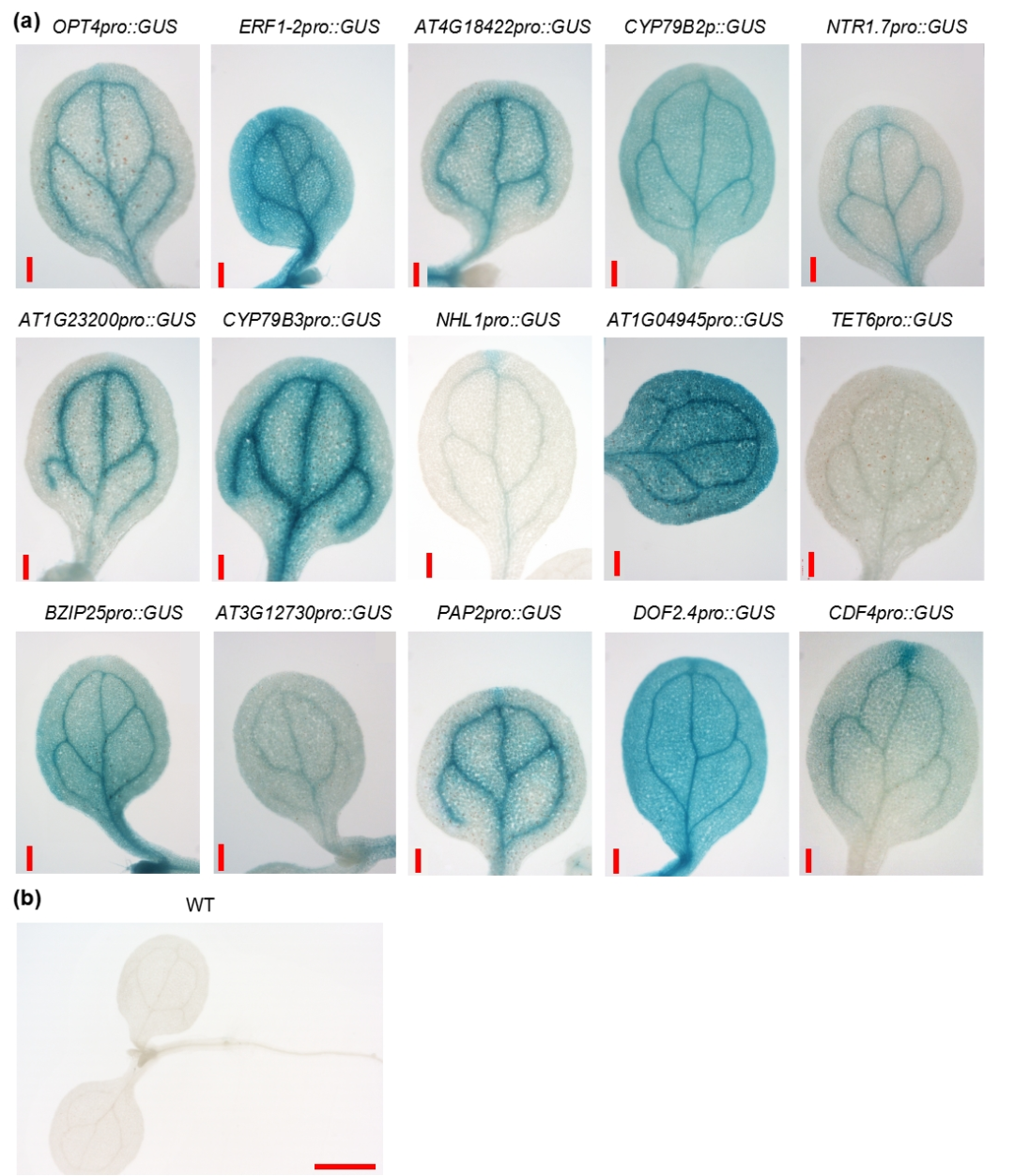
图 2 | 分析代表性静脉标记基因的表达。
(a)在子叶中检测到具有代表性的叶脉标记基因的GUS信号。比例尺:200微米。
(b)检测野生型(wild type: WT)3 天龄幼苗中的GUS活性。比例尺:1000微米。
为了进一步分析子叶叶脉的发育调控机制,研究进一步分析了特定组织细胞的转录因子调控网络(图 3)。如图 3a-c 所示,在 PP、CC_4 和 XP 中鉴定到的核心转录因子分别是CDF5、ERF15 和 RGA。进一步 DNA 亲和纯化测序(DAP-seq)分析表明,CDF5 在 BZIP9、SWEET12 和 SULTR2;1 的启动子区域以及 SWEET11 的编码序列(CDS)区域显著富集(图3e-g),表明这些基因的表达可由 CDF5 调节。对 CDF5 靶基因的 GO 分析表明,它们主要参与调解激素刺激、韧皮部或木质部组织发生和昼夜节律(图3h)。为了更好地理解CDF5在PP发育中的潜在作用,研究筛选了cdf5突变体。如图3i所示,cdf5 突变体中静脉的发育模式与WT相似。然而在cdf5突变体中,相比WT 而言,BZIP9、SWEET11、SWEET12 和 SULTR2;1的表达发生了不同程度地下降(图 3j),表明CDF5可能通过调节这四个靶基因的表达参与调节叶脉的功能。事实上,已有研究表明,这些基因主要参与调节叶脉的功能,而不是其发育[8-10]。
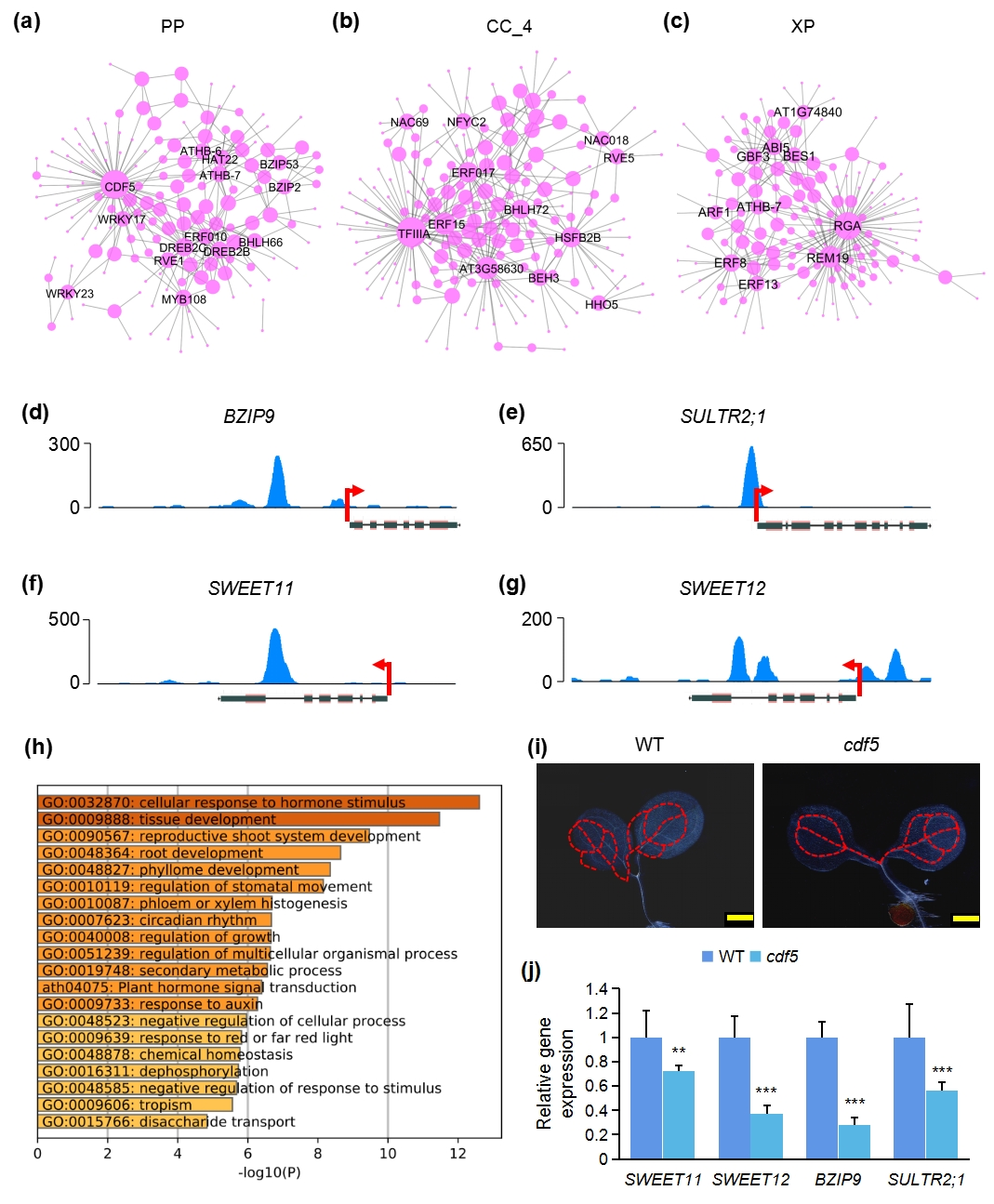
图 3 | 不同细胞类型中转录因子(TFs)调控网络的鉴定。
(a)–(c)显示PP、CC_4 和XP 细胞潜在核心转录调节因子的调控网络。圆点大小表示连接的数量。显示了排名靠前的节点(按连接数排序)的基因名称。
(d)–(g)在代表性基因的启动子区域富集CDF5的 DNA亲和纯化测序(DAP-seq)分析。(h)CDF5 靶基因的 GO 富集分析。
(i)检测 cdf5 突变体和野生型(WT)幼苗 3 天龄幼苗子叶维管系统的发育模式。比例尺:500 m.
(j)CDF5 突变体和WT中CDF5代表性靶基因相对表达的qPCR 分析。*: p<0.01,***: p<0.001,student t 检验与WT。
研究结论
综上所述,本研究所获得的结果为研究子叶叶脉的早期转录组图谱提供了新的见解,并有助于识别叶脉细胞的新标记基因。这些新标记基因的动态表达模式通过GUS报告融合进一步得到证实,为叶脉发育的机制提供了新的信息。在未来的研究中使用这些新标记,可以更完整地了解叶脉发育的机制。
河南大学农学院刘祉辛副教授和棉花生物学国家重点实验室孙旭武课题组的硕士生王佳静为论文的共同第一作者,孙旭武教授为通讯作者。上海欧易生物医学科技有限公司总经理肖云平,技术人员陆瑶在数据分析中给予了大力的支持。该研究得到了国家自然基金面上项目和河南大学高层次人才启动经费的支持。
孙旭武教授课题组近年来在植物叶片单细胞转录组测序领域取得了一系列重要的研究进展,解析了拟南芥气孔系细胞早期发育的单细胞转录组图谱(Liu et al, 2020, Mol Plant)和干旱与盐胁迫条件下幼苗表皮细胞发育的动态模式(Liu et al, 2022, Int J Mol Sci)。
1.Furuta, K. M.; Hellmann, E.; Helariutta, Y., Molecular control of cell specification and cell differentiation during procambial development. Annu Rev Plant Biol 2014, 65, 607-38.
2.Lucas, W. J.; Groover, A.; Lichtenberger, R.; Furuta, K.; Yadav, S. R.; Helariutta, Y.; He, X. Q.; Fukuda, H.; Kang, J.; Brady, S. M.; Patrick, J. W.; Sperry, J.; Yoshida, A.; Lopez-Millan, A. F.; Grusak, M. A.; Kachroo, P., The plant vascular system: evolution, development and functions. J Integr Plant Biol 2013, 55, (4), 294-388.
3.Ito, Y.; Nakanomyo, I.; Motose, H.; Iwamoto, K.; Sawa, S.; Dohmae, N.; Fukuda, H., Dodeca-CLE peptides as suppressors of plant stem cell differentiation. Science 2006, 313, (5788), 842-845.
4.Hirakawa, Y.; Kondo, Y.; Fukuda, H., TDIF Peptide Signaling Regulates Vascular Stem Cell Proliferation via the WOX4 Homeobox Gene in Arabidopsis. The Plant cell 2010, 22, (8), 2618-2629.
5.Hirakawa, Y.; Shinohara, H.; Kondo, Y.; Inoue, A.; Nakanomyo, I.; Ogawa, M.; Sawa, S.; Ohashi-Ito, K.; Matsubayashi, Y.; Fukuda, H., Non-cell-autonomous control of vascular stem cell fate by a CLE peptide/receptor system. Proceedings of the National Academy of Sciences of the United States of America 2008, 105, (39), 15208-15213.
6.Carland, F. M.; Nelson, T., Cotyledon vascular pattern2-mediated inositol (1,4,5) triphosphate signal transduction is essential for closed venation patterns of Arabidopsis foliar organs. The Plant cell 2004, 16, (5), 1263-75.
7.Liu, Z. X.; Zhou, Y. P.; Guo, J. G.; Li, J. A.; Tian, Z. X.; Zhu, Z. N.; Wang, J. J.; Wu, R.; Zhang, B.; Hu, Y. J.; Sun, Y. J.; Yan, S. G.; Li, W. Q.; Li, T.; Hu, Y. H.; Guo, C. X.; Rochaix, J. D.; Miao, Y. C.; Sun, X. W., Global Dynamic Molecular Profiling of Stomatal Lineage Cell Development by Single-Cell RNA Sequencing. Molecular plant 2020, 13, (8), 1178-1193.
8.Kim, J. Y.; Symeonidi, E.; Pang, T. Y.; Denyer, T.; Weidauer, D.; Bezrutczyk, M.; Miras, M.; Zollner, N.; Hartwig, T.; Wudick, M. M.; Lercher, M.; Chen, L. Q.; Timmermans, M. C. P.; Frommer, W. B., Distinct identities of leaf phloem cells revealed by single cell transcriptomics. The Plant cell 2021, 33, (3), 511-530.
9.Maruyama-Nakashita, A.; Watanabe-Takahashi, A.; Inoue, E.; Yamaya, T.; Saito, K.; Takahashi, H., Sulfur-Responsive Elements in the 3 '-Nontranscribed Intergenic Region Are Essential for the Induction of SULFATE TRANSPORTER 2;1 Gene Expression in Arabidopsis Roots under Sulfur Deficiency. The Plant cell 2015, 27, (4), 1279-1296.
10.Walerowski, P.; Gundel, A.; Yahaya, N.; Truman, W.; Sobczak, M.; Olszak, M.; Rolfe, S.; Borisjuk, L.; Malinowski, R., Clubroot Disease Stimulates Early Steps of Phloem Differentiation and Recruits SWEET Sucrose Transporters within Developing Galls. The Plant cell 2018, 30, (12), 3058-3073.

长按扫码咨询
欧易生物技术工程师
猜你想看
1、exo+snRNA-seq(外泌体+单细胞核测序)助力更系统、更深入、更精准的生物学研究
2、项目文章 | 欧易生物单细胞转录组测序教你如何挖掘lncRNA数据!
3、项目文章 | 欧易生物单细胞转录组助力揭示心肌梗死后心脏免疫的动态变化
4、欧易生物署名文章│水稻转录因子文库——中科院遗传所陈凡课题组钜献
End 本文系欧易生物原创






