
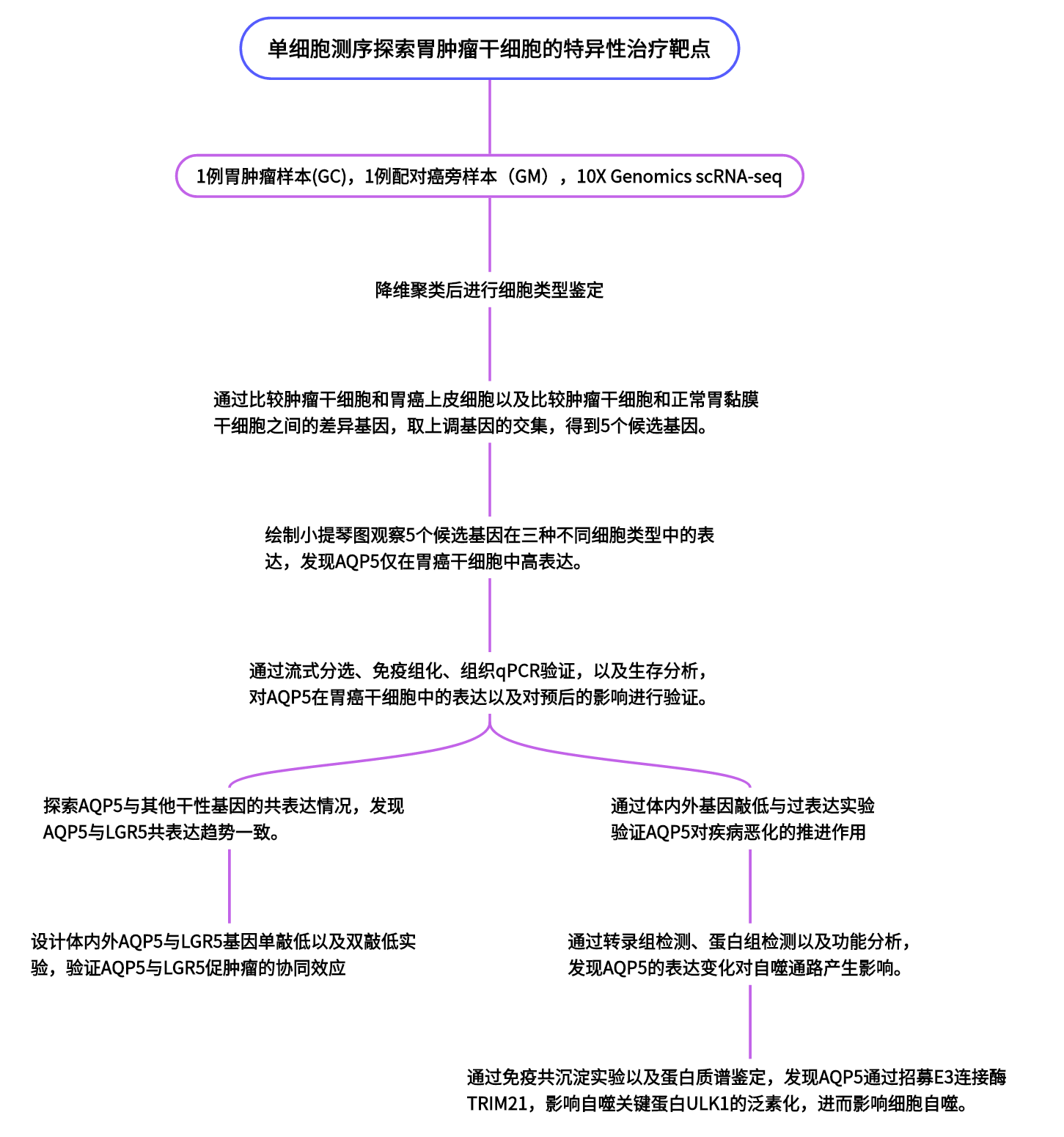
单细胞测序、肿瘤干细胞等都是国自然中的热点,那么他们怎么才可以联系在一起的呢?2022年11月14日,济宁医科大学附属医院张斌教授团队在Journal of Experimental & Clinical Cancer Research(IF:12.658)发表了题为“AQP5 complements LGR5 to determine the fates of gastric cancer stem cells through regulating ULK1 ubiquitination”的研究论文。该研究对比了胃粘膜组织和胃癌组织的单细胞数据,鉴定了一种新型胃癌上皮细胞表面标志物AQP5,并确定了AQP5通过与E3连接酶TRIM21相互作用并促进关键自噬蛋白ULK1的泛素化来增强胃癌干细胞自噬,为胃癌的连床治疗提供新的靶向治疗方案。我们一起来学习一下这篇文章吧。

期刊:Journal of Experimental & Clinical Cancer Research
影响因子:12.658
发表年月:2022.11.14
材料:1例胃癌样本,1例配对癌旁样本
方法:10xGenomics scRNA-seq、普通转录组、蛋白质组、基因敲低与过表达

肿瘤干细胞被认为是肿瘤发生、转移、复发和耐药的“种子细胞”。然而,不同来源的肿瘤干细胞的特异性表面标记还未得到深入研究。胃癌作为全球第三大恶性肿瘤,患者预后往往较差。因此,针对胃癌肿瘤干细胞特异性表面标记物的研究对于肿瘤治疗具有深远意义。

作者通过单细胞测序分析,绘制了胃肿瘤单细胞图谱,并分析得到了肿瘤样本中胃癌干细胞的特征基因AQP5。进而通过基因过表达与敲低的体内外模型构建,一步步确证了AQP5与LGR5的共表达情况、两者对肿瘤的协调促进作用以及AQP5对自噬通路影响的分子机制。这些发现对胃肿瘤的分子诊断以及靶向治疗提供了新的思路。


Result1 胃肿瘤组织与配对癌旁组织的单细胞图谱
为了挖掘胃癌肿瘤干细胞的特异性表面标记,作者首先收集了一对临床胃癌肿瘤样本以及配对的癌旁组织,分别进行了单细胞转录组测序。经过降维聚类以及细胞类型鉴定后,共鉴定到7个主要的细胞类型(图1a),作者利用CD44、CD24、ALDH1A1等marker基因对干细胞进行进一步细分。为了进一步探究胃癌肿瘤干细胞(GC-CSCs)与正常胃粘膜干细胞(GM-SCs)以及肿瘤上皮细胞之间的差异,挖掘其特异性表面标记,作者分别比较了GC-CSCs与肿瘤上皮细胞,以及GC-CSCs与GM-SCs之间的差异基因(图1 b、c),并通过venn取上调差异基因交集(图1 d),最终获得了5个候选基因(图1 e)。
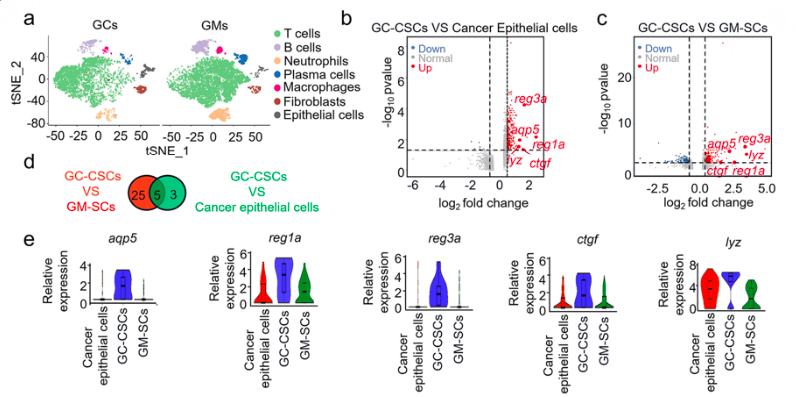
图1 胃癌与对照样本的单细胞转录组分析结果
Result2 AQP5为胃癌干细胞的特异性表面标记物且与预后不良高度相关
为了从五个候选基因中挑选最为显著的标志基因,作者进一步对候选基因进行实验验证。
首先,作者设置了流式分选实验,分别分选了GC-CSCs、GC上皮细胞与GM-SCs,并分别检测了5个候选基因的表达情况,结果显示AQP5在GC-CSCs中特异性表达且具有统计学意义(图2 f),并且在后续的体外验证实验中,AQP5同样表现出胃癌干细胞的标志特异性。
为进一步探究AQP5对胃肿瘤疾病进程的影响,作者通过mRNA定量、组织芯片以及生存分析,发现AQP5在胃肿瘤样本中高表达,并且与不良预后高度相关(图2 j-l)。
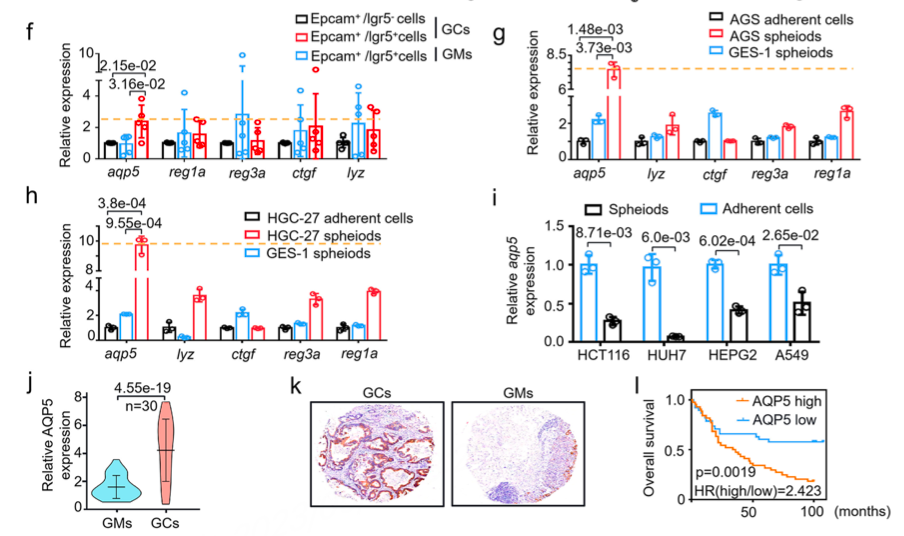
图2. CDs可减弱辐射诱导的BMSCs损伤和衰老
Result3 过表达/敲低实验与异种移植共同验证AQP5的促肿瘤作用
为验证AQP5对胃肿瘤的影响,作者进一步设计AQP5过表达与敲低实验,并且构建了异种移植模型,结果显示AQP5的过表达对胃肿瘤有显著的促生长作用(图3)。
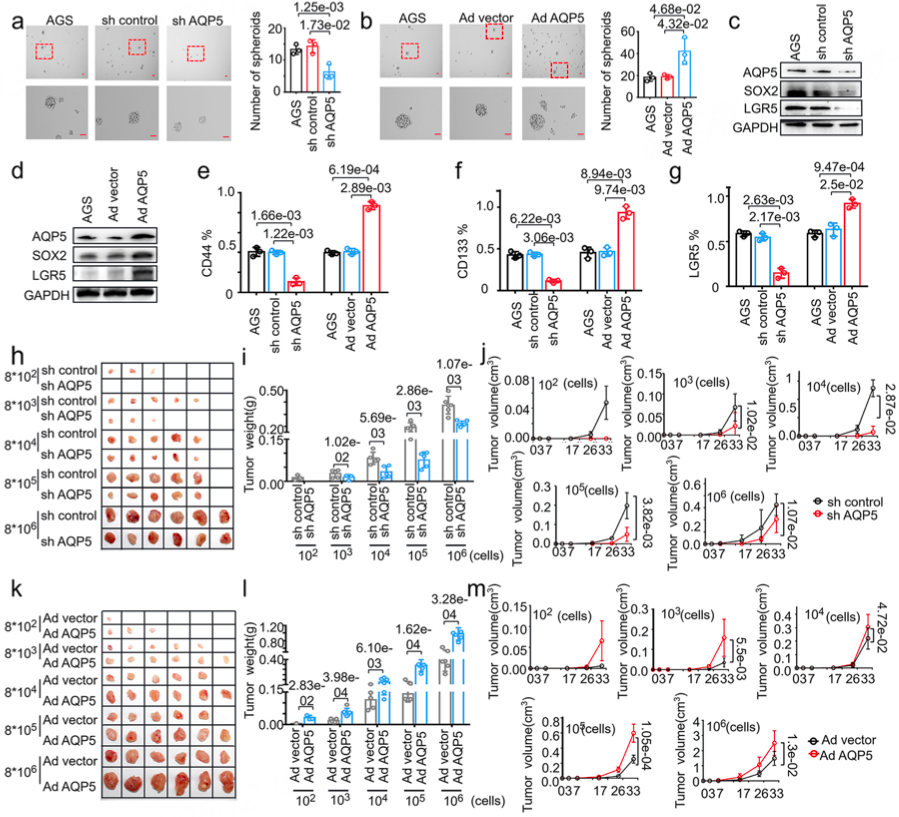
图3 AQP5对胃肿瘤促进作用的模型验证结果
Result4 AQP5与LGR5在胃癌干细胞中存在共表达趋势且具有协同促肿瘤作用
进一步探究AQP5与其他经典肿瘤干细胞marker之间的相关性,作者通过TCGA数据分析,以及体外实验验证的方式,发现AQP5与LGR5存在共表达趋势(图4),进一步证明AQP5作为胃癌干细胞特异性标志物的可靠性。
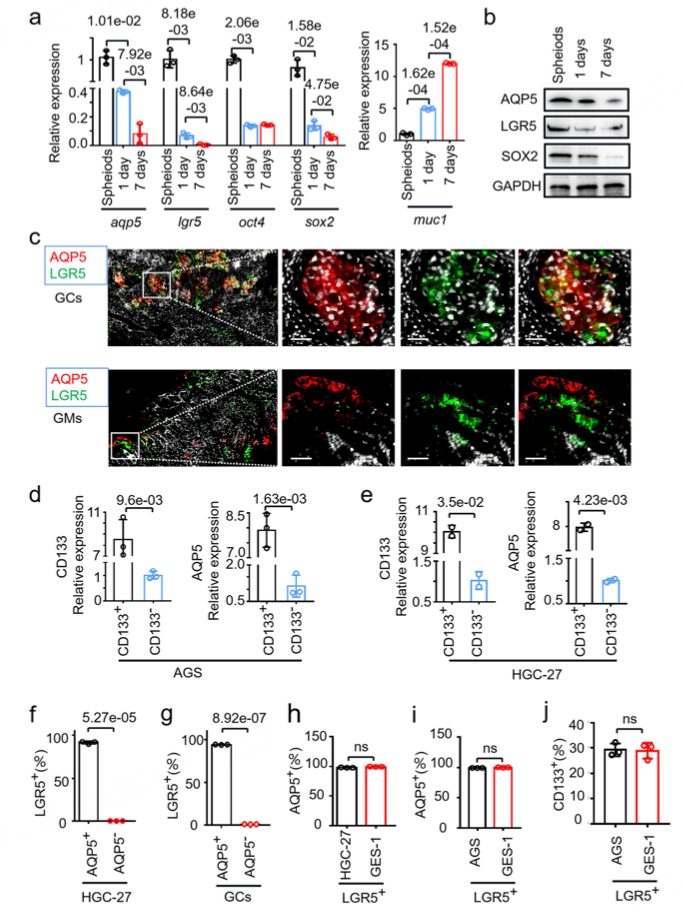
图4 AQP5与LGR5共表达趋势的验证结果
随后作者分别设计了AQP5与LGR5分别单独敲低以及共同敲低体内外实验,发现双敲低组相比于单敲低组对肿瘤生长的抑制作用更加明显(图5),说明了AQP5与LGR5具有协同促肿瘤作用。
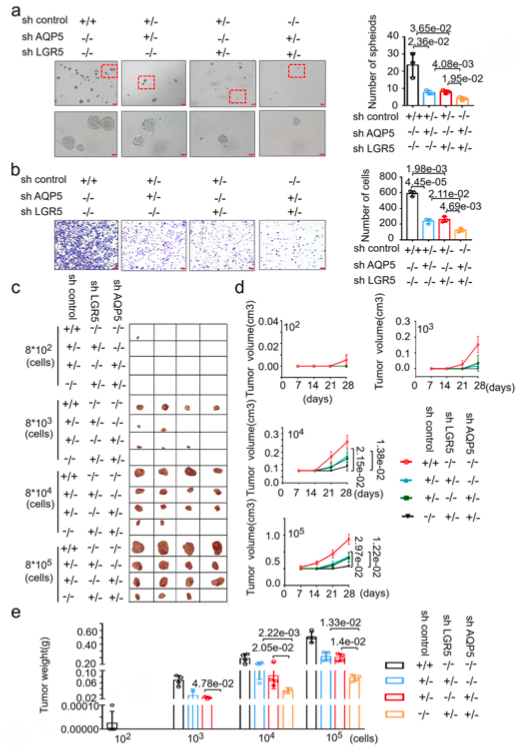
图5 AQP5与LGR5单敲低与双敲低的体内外实验结果
Result5 AQP5通过介导自噬通路中ULK1的泛素化,进而影响肿瘤生成
通过对AQP5过表达样本进行转录组与蛋白组检测,功能富集分析结果显示干性相关通路并未发生显著变化,因此作者参考AQP5同家族中AQP3对自噬通路的影响以及对肿瘤发展的促进作用,对建立起AQP5通过影响自噬作用促进肿瘤发生的假说。
随后,作者通过一系列验证实验,发现AQP5的过表达与敲低对自噬通路确有影响(图6)。进一步的机制研究表明,AQP5通过介导自噬相关蛋白ULK1的泛素化,进而影响了肿瘤的生成(图7)。
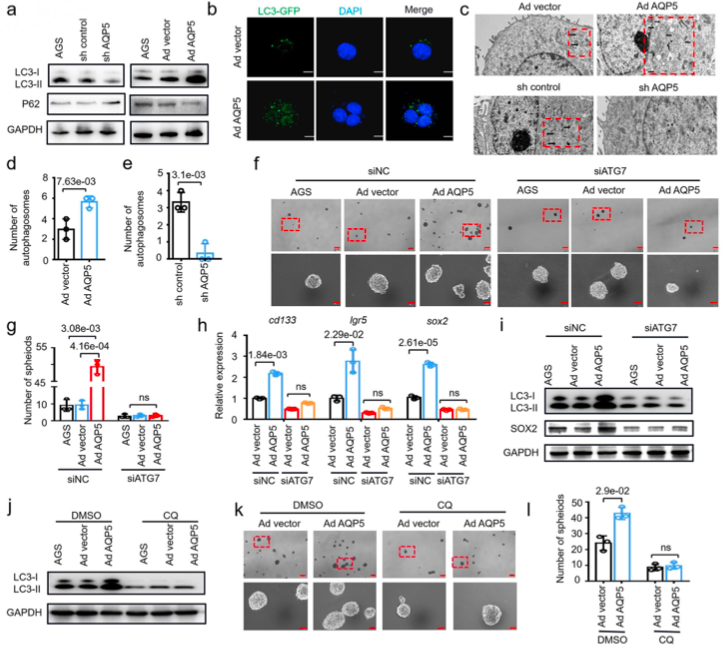
图6 AQP5对自噬小体以及自噬相关蛋白的影响
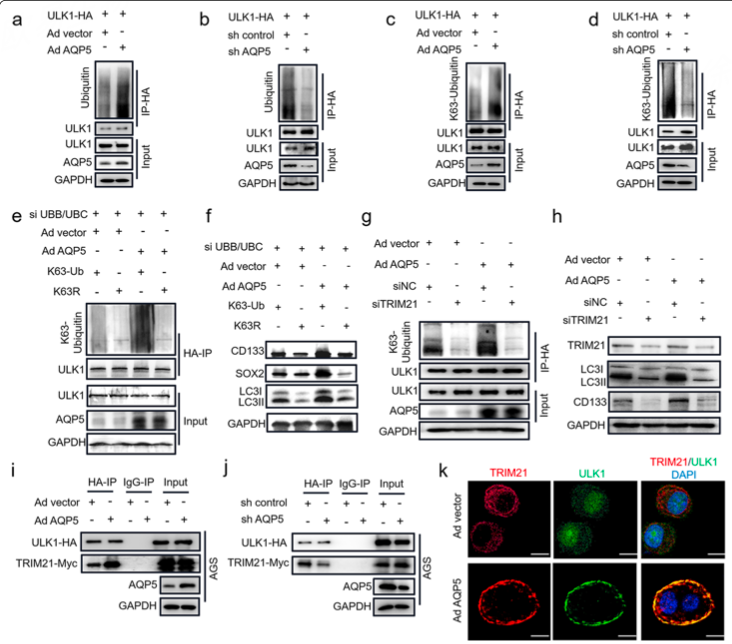
图7 AQP5对ULK1泛素化的影响

1.单细胞测序及分析绘制胃癌单细胞图谱并挖掘胃肿瘤干细胞标记物分子AQP5
2.流式分选、定量PCR以及生存分析联合说明AQP5作为分子标志物的潜力。
3.体内外基因敲低与过表达实验验证AQP5与LGR5的协同促肿瘤作用。
4.AQP5通过介导自噬通路相关蛋白泛素化,影响肿瘤发展。
5.本文有利于更好的理解肿瘤干细胞的分子机制,并为胃癌治疗提供了新靶点。
【参考文献】
Zhao, Rou, et al. "AQP5 complements LGR5 to determine the fates of gastric cancer stem cells through regulating ULK1 ubiquitination." Journal of Experimental & Clinical Cancer Research 41.1 (2022): 322.
DOI:https://doi.org/10.1186/s13046-022-02532-w






