近期,华中科技大学附属同济医院神经内科王伟教授团队在国际著名期刊《美国国家科学院院刊》(PNAS杂志 IF:11.1)在线发表了题为“Single-cell analysis of refractory anti-SRP necrotizing myopathy treated with anti-BCMA CAR-T cell therapy”的研究论文,该研究首次应用靶向成熟B细胞抗原(BCMA)的CAR-T细胞对坏死性肌病进行治疗并取得显著疗效。同时结合单细胞测序、免疫组库等技术对CAR-T细胞治疗自身免疫性疾病的潜在分子机制和治疗后的免疫微环境重塑等进行了深入的描绘。

发表期刊:PNAS
影响因子:11.1
研究材料:IMNM患者血液PBMC(N=8)、IP(infusion product)
研究方法:10x Genomics :5端转录组+ 免疫组库V(D)J
研究背景
免疫介导的坏死性肌病(IMNM)是一种与自身抗体相关的自身免疫性疾病,其临床表现为快速进行性肌肉无力和肌酸激酶水平升高,但通过传统的药理学方法进行治疗的效果通常非常有限。靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR-T)细胞已成为一种有前景的治疗策略,但需要确定CAR-T细胞在自身免疫中的分子特征,进一步了解CAR-T治疗后的免疫微环境变化和IMNM患者CAR-T细胞的特点,从而寻求CAR-T细胞在治疗自身免疫性疾病的治疗中发挥更高效率和更持久的时间。
技术路线
1. 患者的特点和临床评价
本研究患者为25岁男性,有7年抗SRP抗体血清阳性IMNM病史。在发病时,他表现为近端肢体无力,血清肌酸激酶水平显著升高,超过16000U/L(图1A)。给予患者6.534*107个抗BCMA CAR-T细胞作为治疗方案(图1B),CAR-T细胞迅速扩张扩增,在10天达到峰值,然后在2个月内逐渐下降(图1c和d)。到第三个月时,他的上肢力量有所改善(抬臂没有限制),下肢力量也有所改善,并恢复了行走能力。CD3-CD19+B细胞在前2个月内检测不到,而CD4+T细胞、CD8+T细胞和NK细胞出现波动(图1I-K)。在CAR-T细胞输注后,在没有定期静脉注射免疫球蛋白的情况下,总IgG显著下降(图1L),血清中抗SRP和抗Ro52自身抗体水平均下降,超过18个月后仍为阴性(图1M)。
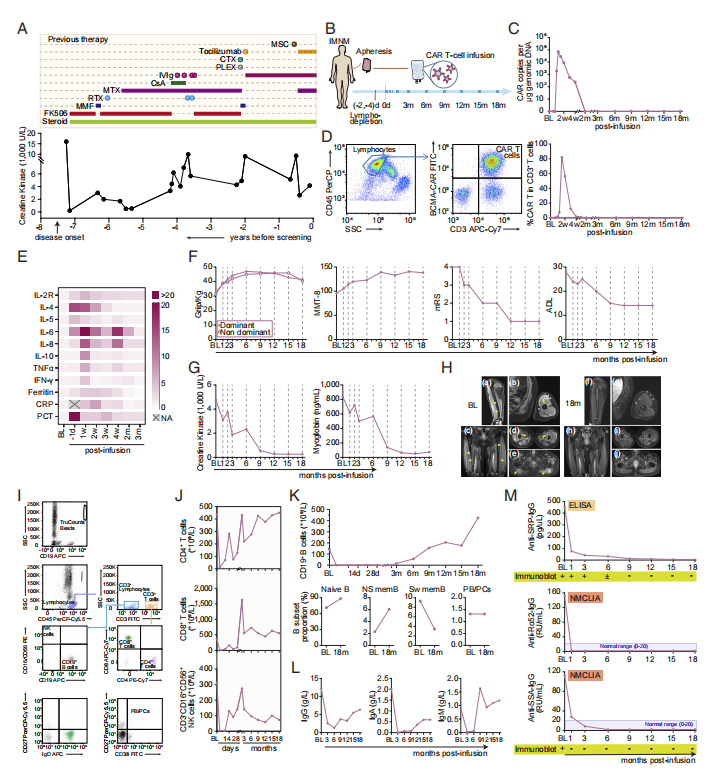
图1 CAR-T细胞输注后的临床评价
2. CAR-T细胞治疗后的免疫环境改变
为了说明CAR-T治疗期间细胞谱的变化,研究团队对IMNM患者的PBMC进行了5 '单细胞测序(scRNA-seq)、T细胞受体测序(TCR-seq)和B细胞受体测序(BCR-seq),样本分别为基线、CAR-T治疗后1个月、3个月、6个月、9个月、12个月、15个月和18个月。共解析出68350个高质量细胞(图2A);15种不同的免疫细胞类型(图2B)。结果显示,B细胞数量在1个月时明显下降,随后在输注后逐步恢复,主要由CD19+CD27−IgD+B幼稚细胞组成。此外,治疗后CD8+T细胞显著扩增和CD4+Te细胞的显著减少,髓系细胞的比例在1个月时上升,并在输注后下降到基线水平(图2 C和D)。尽管细胞组成发生了变化,但ssGSEA分析表明,CAR-T治疗导致抑制免疫反应和内源性T细胞、NK细胞和髓系细胞的炎症相关特征(图2E)。这表明CAR-T疗法除了重建B细胞系外,还可能有助于免疫微环境的改善。
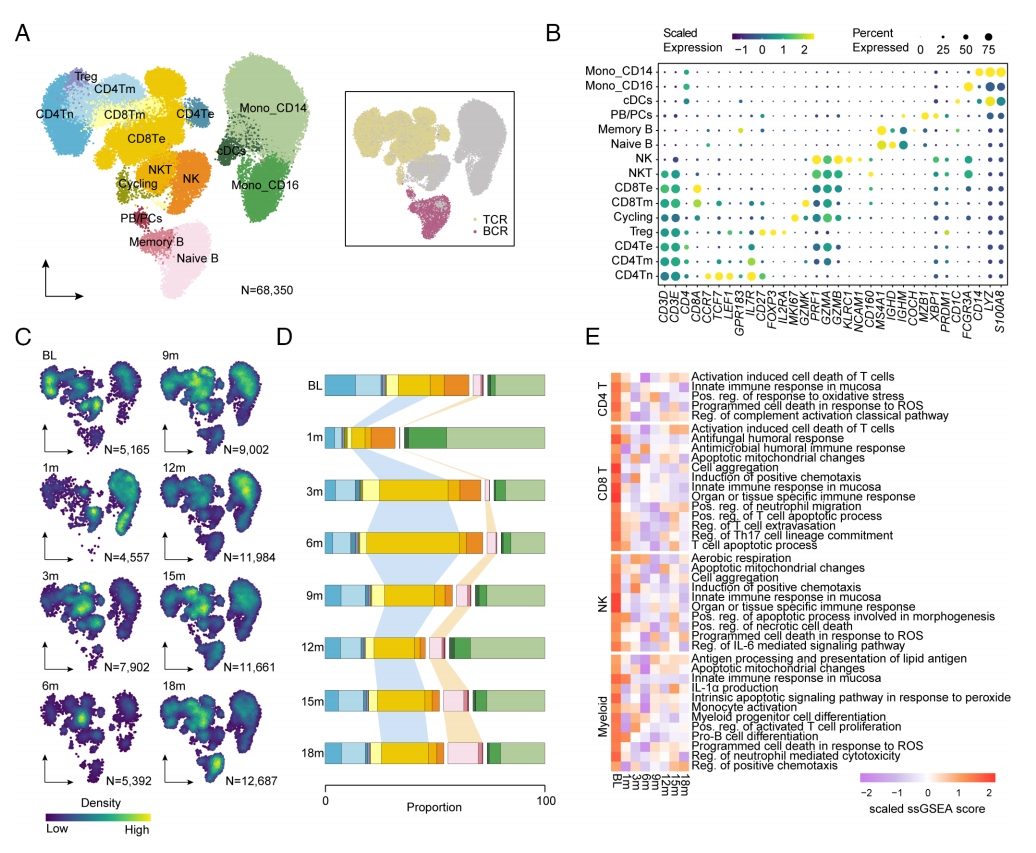
图2 CAR-T细胞治疗后的免疫变化
B Cell谱系进行细致分析
研究团队通过对B细胞和浆细胞进行重新聚类,得到6种细胞亚型(图3 A)。PB/PCs被认为是主要的BCMA表达细胞,负责产生致病抗体,在CAR-T治疗1个月后被成功消除;治疗3个月后逐渐恢复,异常致病B细胞数量降低(图3C和D)。比较不同时间点B细胞的CDRH3序列发现,CAR-T治疗可以有效去除异常致病B细胞谱系并成功产生具有不同克隆类型的全新B细胞(图3 E)。此外,当比较基线时的B细胞与输注后18个月恢复的B细胞时,鉴定出1366个差异表达基因(图3F)。功能富集分析显示,在恢复的B细胞中,与B细胞功能和能量代谢相关的通路明显下调,基因表达也较低(图3G和H),这表明CAR-T治疗后,B细胞从过度激活状态正常化到接近自然状态,可以产生一定水平的防御抗体,而非致病抗体(图1L和M)。
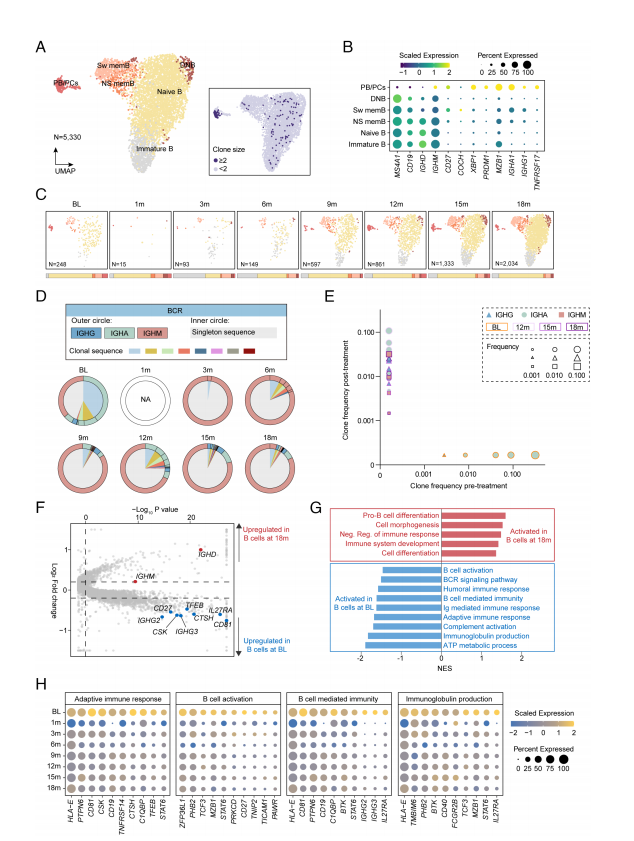
图3 CAR-T细胞治疗后B淋巴细胞的组成和克隆分析
T cell谱系进行细致分析
研究团队对内源性T细胞进行重新降维聚类,最终鉴定出11个细胞亚型(图4 A和B)。CD8+Te细胞进一步细分为三个更精细的簇(CD8+Te-1/2/3),在CAR-T治疗后3个月,这三个簇的比例都显著增加,并在随后的随访中保持相对稳定(图4C)。TCR分析显示CD8+Te-3细胞中高频克隆型显著扩增,而高度扩增的CD8+Te-1细胞在输注后3个月和6个月出现一定程度的减少,随后逐渐恢复(图4D)。进一步的差异基因鉴定及富集分析,CD8+Te-3细胞具有相对较低表达GZMB(颗粒酶B)和较高表达CCL5 (C-C基序趋化因子配体5)和KLRG1(杀伤细胞凝集素样受体G1)的特征,呈现出细胞趋化性和NK受体增强的特征(图4E),这可能有助于消除致病细胞并促进细胞存活。相比之下,GZMB表达较高的CD8+ Te-1细胞表现出更多的细胞毒性和神经炎症特征,并倾向于促进体液免疫反应(图4E)。在输注后18个月,恢复的CD8+Te-1细胞表现出免疫反应和炎症反应减弱,与其他细胞类型的细胞因子相互作用明显减少的特征(图4F、G)。表明CD8+Te-1细胞过度的免疫和炎症作用也可以在CAR-T治疗后得到改善。
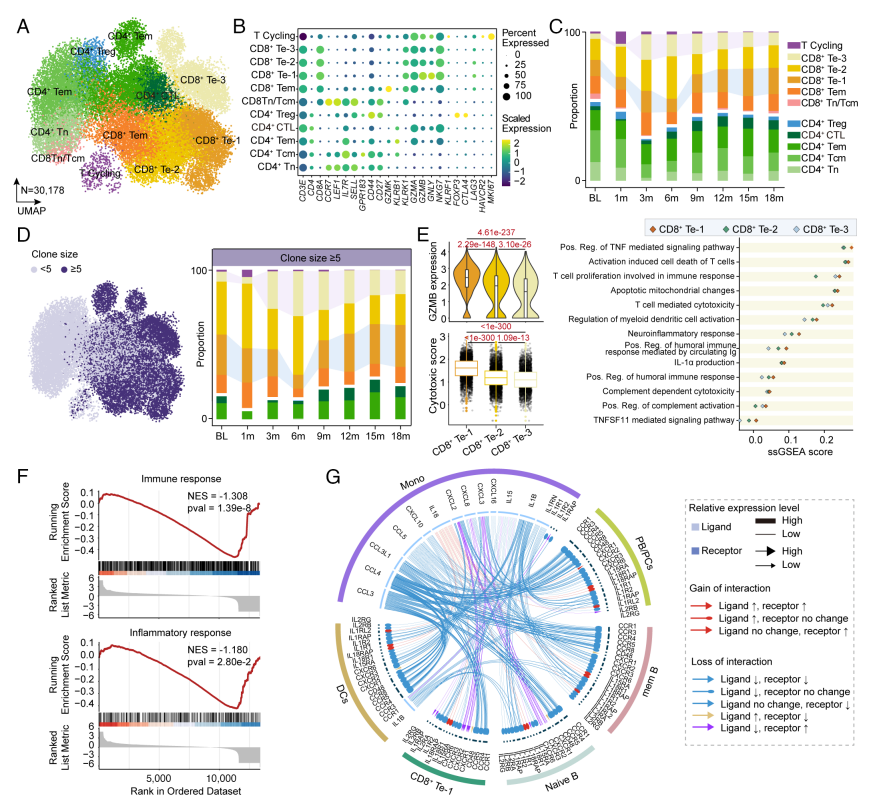
图4 CAR-T细胞治疗后内源性T淋巴细胞的组成和克隆分析
3. IMNM患者输注后CAR-T细胞的特性
为了研究转移的CAR-T细胞如何在宿主体内发挥作用,以及如何被并被宿主免疫环境塑造,研究团队对该IMNM患者的输注产物(IP)以及输注后1个月用流式细胞术分选的体内CAR-T细胞进行了scRNA-seq和配对TCR-seq。通过重新聚类分析基线时收集的T细胞,输注后1个月时的输注产物,CAR-T细胞和内源性T细胞,鉴定出不同的T细胞簇。在IP中,CD4+CAR-T细胞拥有更高的比例,但在输注后1个月,这种优势在CAR-T细胞中减弱(图5C)。CD8+CAR-T细胞可能有更关键的作用。随后的克隆跟踪分析表明,体内1个月的CD8+ TCR克隆在基线时主要来源于内源性Te和Tem细胞,并在输注后分化为Te细胞(图5D)。CD4+CAR-T细胞呈现类似的动态模式(图5D),但在1个月时倾向于Tem形式(图5C)。与CAR-T细胞的表型变化一致,基因模块评分显示CD4+和CD8+CAR-T细胞在体内1个月时具有明显的效应特征和增殖和能量代谢功能受损(图5E)。
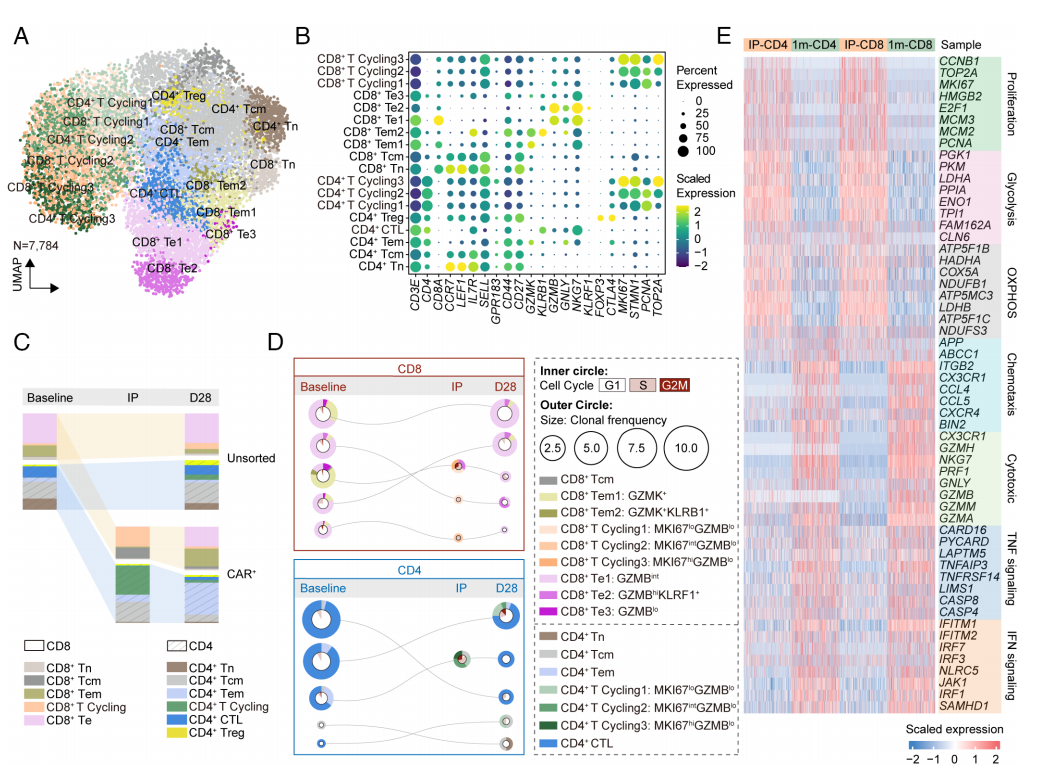
图5 CAR-T细胞在IMNM中的转录特征和克隆跟踪
接下来,研究团队鉴定了来自IMNM患者体内的CD8+CAR-T细胞的独特特征。用体内1个月收集的CAR-T细胞的转录组谱与4个外部公布的数据集进行了整合。来自不同数据集的细胞被重新降维聚类,分为四个clusters(图6A)
其中,CD8+CAR-T细胞的增加更为活跃,其动态表型模式与CD4+细胞相似。比较不同时间点收集的IMNM患者和恶性肿瘤患者的CD8+CAR-T细胞,发现其表型更像nk:细胞死亡和神经炎症倾向增强,CD8+CAR-T细胞的增殖能力受到抑制,而神经炎症可能是其明显的特征。需要进一步的研究来确定CAR-T细胞在自身免疫中的分子特征,并寻求CAR-T细胞在治疗自身免疫性疾病中的更高效率和更长的持久性。
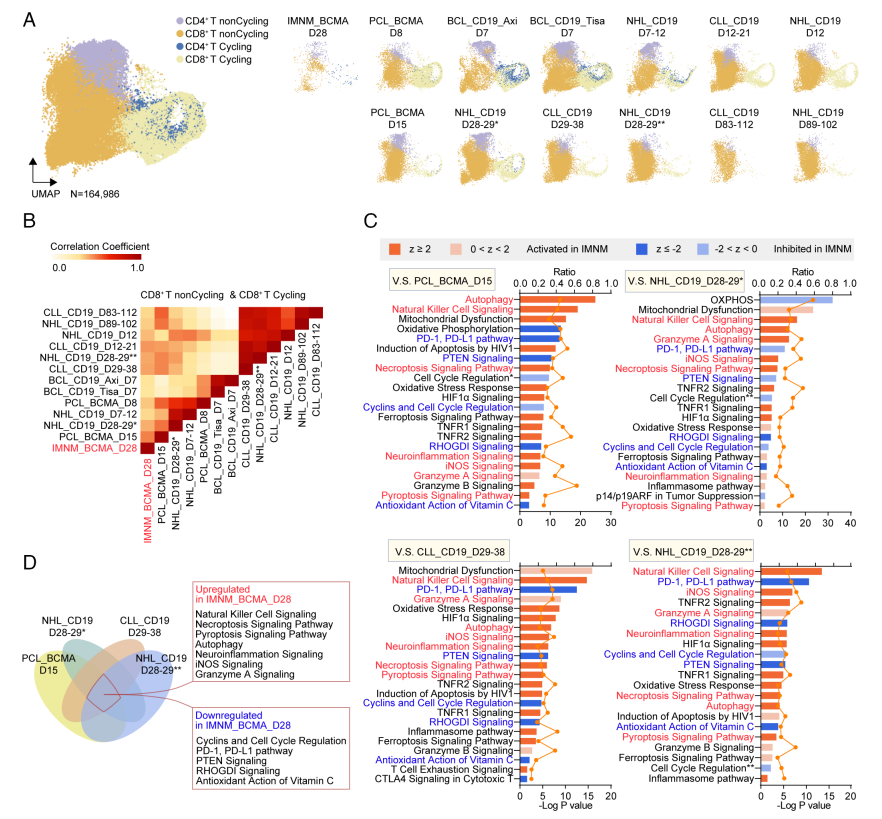
图6 来自IMNM患者的CAR-T细胞的不同特征
小欧推荐
本研究采用10x 5‘端转录组测序结合免疫组库TCR-seq、BCR-seq,首次揭示靶向B细胞成熟抗原的嵌合抗原受体(CAR-T)细胞在治疗抗信号识别颗粒肌病方面具有巨大的潜力,其具有持续的自身抗体消耗和超过18个月的治疗效果。此外,通过比较IMNM患者和恶性肿瘤患者的CAR-T细胞单细胞谱,显示了CAR-T细胞在人类自身免疫中的独特特征,这可能指导未来CAR-T治疗自身免疫性疾病的改进。






