2024年7月2日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所/深港脑科学创新研究院朱英杰团队在Neuron期刊上发表了题为“Cellular and circuit architecture of the lateral septum for reward processing”的研究论文,深圳先进院朱英杰课题组的博士后陈高伟、云南大学博士生赖诗诗为论文的共同第一作者。
本文详细描述了外侧隔核脑区(LS)的单细胞转录图谱及其主要神经元类型的空间分布,并发现集中在腹侧亚区的雌激素1型受体阳性神经元(LSEsr1)通过激活腹侧被盖区(VTA)多巴胺神经元促进奖赏效应且在甲基苯丙胺(METH)成瘾中发挥重要作用。
欧易生物助力本研究单细胞核转录组测序服务。

发表期刊:Neuron
影响因子:14.7
涉及的欧易生物服务产品:单细胞核转录组测序
外侧隔核脑区(LS)是边缘大脑的一个区域,先前的研究表明它在动机和情感中扮演关键角色,尤其是在奖赏系统中发挥重要功能。然而,对于LS区域中不同类型的神经元、它们的转录特征、空间分布以及它们如何连接和相互作用,从而影响奖赏和成瘾行为的具体机制,科学界了解甚少。
随着单细胞核RNA测序(snRNA-seq)和光遗传学等先进技术的发展,研究者现在能够更精确地识别和操纵特定的神经元群体。这项研究强调了对LS区域细胞异质性的深入了解,以及这些细胞类型如何参与调节奖赏和成瘾行为的重要性。通过识别和操纵特定的神经元群体,研究旨在揭示大脑如何加工奖赏信息,并为开发治疗成瘾的新策略提供潜在的靶点。
LS由多种异质性细胞类型组成,对各种动机行为至关重要。然而,这些细胞类型的转录谱、空间排列、功能和连接性尚未得到系统研究。利用单细胞核RNA测序技术,作者描绘了LS中多种遗传定义的细胞类型,它们在奖赏处理中扮演不同的角色。作者发现表达雌激素受体1(Esr1)的腹侧LS(LSEsr1)神经元是奖赏寻求的关键驱动因素,通过向腹侧被盖区(VTA)的投射,这些神经元在甲基苯丙胺(METH)奖赏和METH寻求行为中发挥了重要作用。长期暴露于METH通过上调超极化激活的环核苷酸门控(HCN)通道,增加了LSEsr1神经元的兴奋性,从而促进了METH诱导的运动敏化。
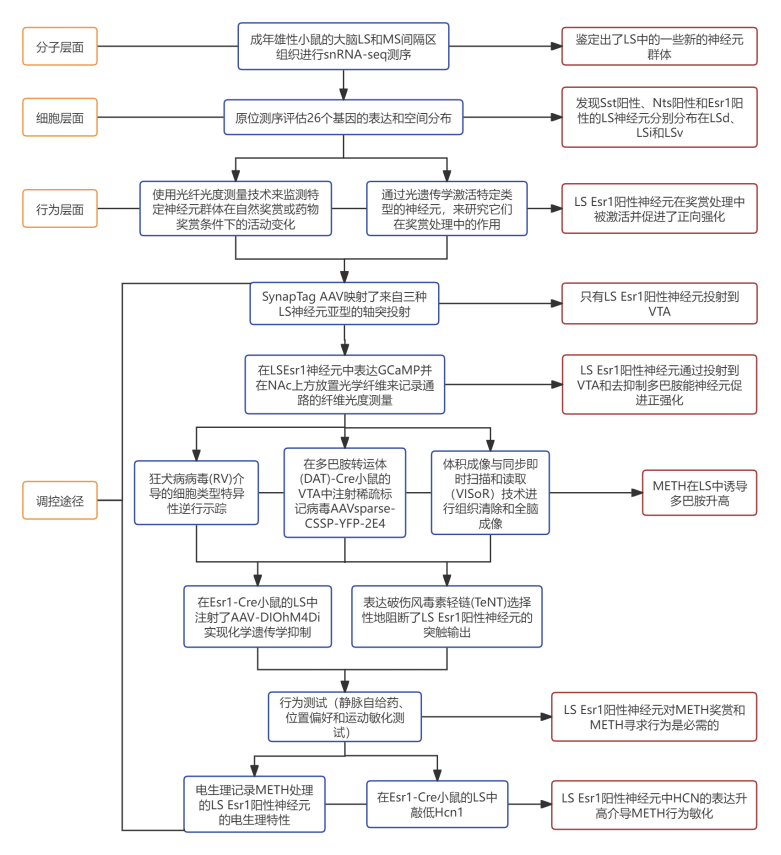
1. snRNA-seq揭示间隔区的主要细胞类型
作者在成年雄性小鼠的活体大脑切片中微解剖了包括LS和内侧隔核(MS)的间隔区,将组织进行snRNA-seq(图1A),聚类分析得到15个不同的神经元簇(图1B和1C),并鉴定出了每个簇的标记基因(图1D)。在大多数神经元簇中表达GABA合成基因谷氨酸脱羧酶1(Gad1),囊泡谷氨酸转运体2(Vglut2)阳性的谷氨酸能神经元主要在14和15簇中发现,胆碱乙酰转移酶(Chat)和促肾上腺皮质激素释放激素受体 2(CRHR2)在8簇中富集(图1E和1F)。作者还鉴定出了LS中的一些新的神经元群体(见图1G)。
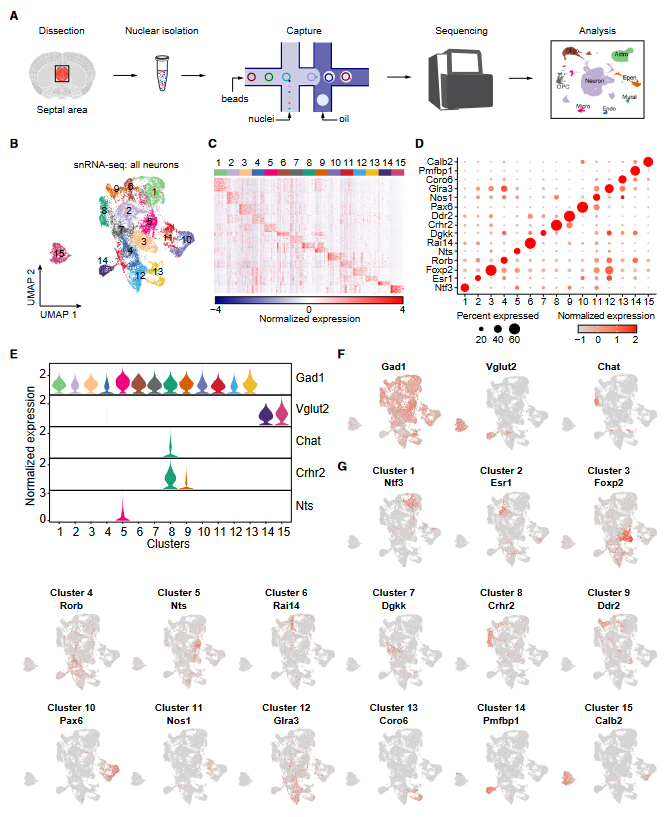
图1 snRNA-seq揭示间隔区的主要神经元类型
2. 在间隔区中主要神经元类型的空间组织
作者使用了原位测序(ISS)方法发现囊泡GABA转运体(Vgat)阳性的GABA能神经元遍布间隔区,而Vglut2阳性的谷氨酸能神经元主要分布在腹内侧LS和MS区域(图2B)。接下来,作者使用ClusterMap分析生成了7个在转录和空间上定义的细胞簇(图2C-2E)。作者选择了以Sst、Nts或Esr1为标记三个簇(图2F和2G),通过RNAscope原位杂交确认了表达这些标记基因的神经元的空间模式(图2H)。Sst阳性、Nts阳性和Esr1阳性的LS神经元(LSSst、LSNts和LSEsr1)分别分布在LSd、LSi和LSv(图2H和2I)。
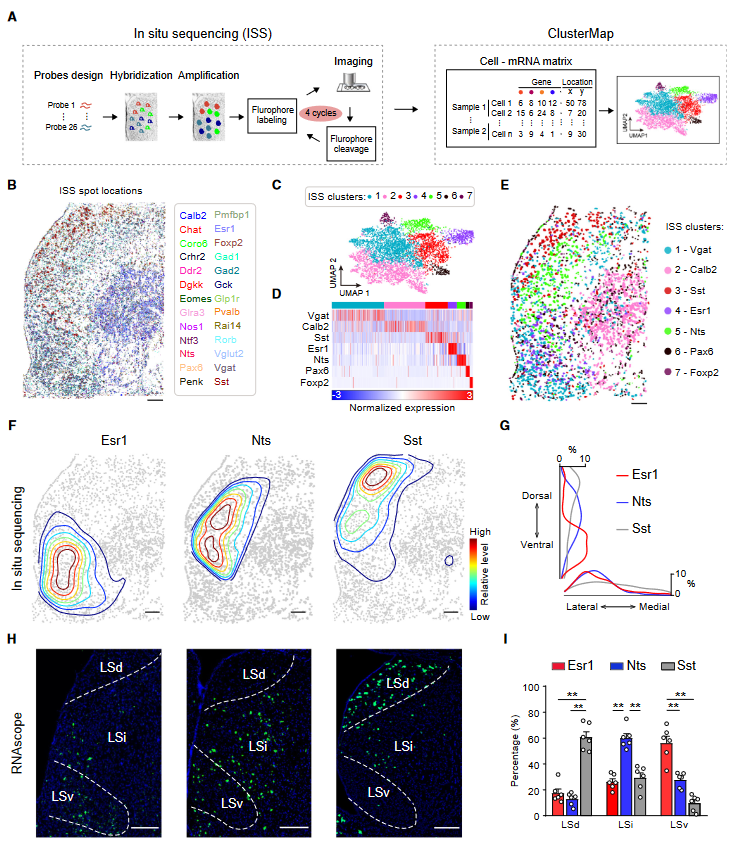
图2 间隔区主要神经元类型的空间组织
3. LSEsr1神经元在奖赏处理中被激活并促进了正向强化
作者在小鼠中注射了Cre依赖的基因编码的Ca2+指示剂(GCaMP6s)的腺相关病毒(AAV),并植入了光学纤维到LS以记录LSEsr1、LSNts和LSSst神经元的活动(图3A-3C),以此来检查每种LS神经元亚型在寻求奖励(巧克力奖励,社交互动和静脉注射METH)中的活动。结果表明只有LSEsr1神经元被各种奖赏类型一致性地激活。作者在小鼠中注射了携带光敏蛋白ChR2的AAV,它可以选择性地在LSSst、LSNts和LSEsr1神经元中表达ChR2(图3P和3Q)。通过自我刺激测试(图3R-3T),和实时位置偏好(RTPP)测试(图3R和3U-3V),作者判定是光遗传激活LSEsr1神经元促进了正向强化。
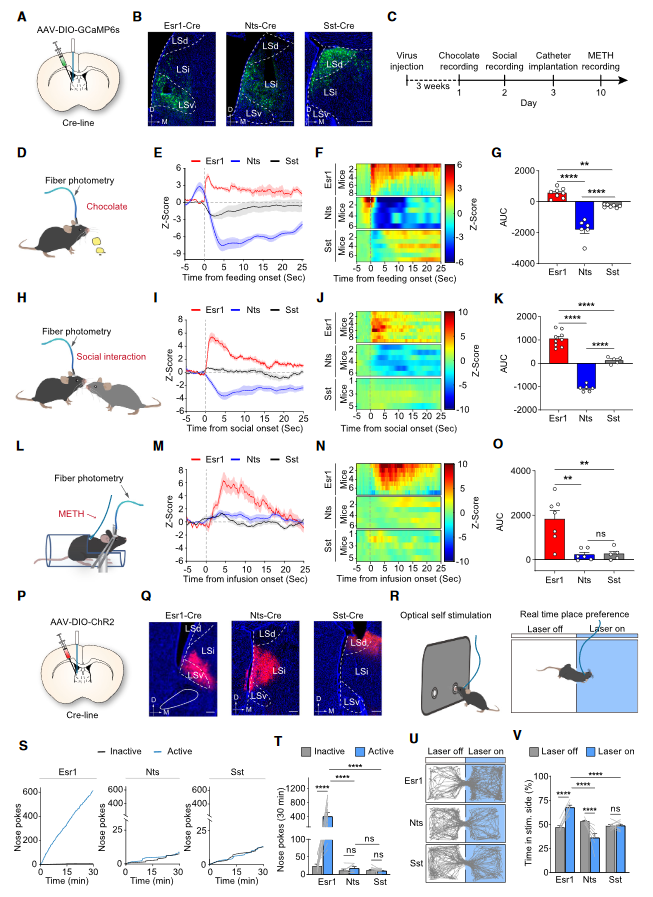
图3 LS神经元亚型的不同奖赏处理
4. LSEsr1神经元通过VTA中多巴胺能神经元的去抑制促进正向强化
顺行示踪实验发现,LSEsr1神经元投射到VTA脑区,而LSSst或LSNts神经元不投射到VTA(图4A和4B)。接着,作者用光遗传学测试了从LSEsr1神经元到VTA的投射的激活具有正强化效应(图4C和4D),发现LSEsr1→VTA通路的光激活支持自我刺激并诱导位置偏好(图4E和4F)。随后,发现LSEsr1轴突末梢的光刺激在VTA的GABA能神经元中诱发了强烈的抑制性突触后电流(IPSC)(7/8)(图4H和4I)。基于此,作者假设LSEsr1神经元的激活将抑制VTA GABA能神经元,然后通过去抑制机制激活多巴胺能神经元。随后作者通过光遗传学激活(图4J-4L)和荧光多巴胺探针(图4M-4P)验证了这一猜想。
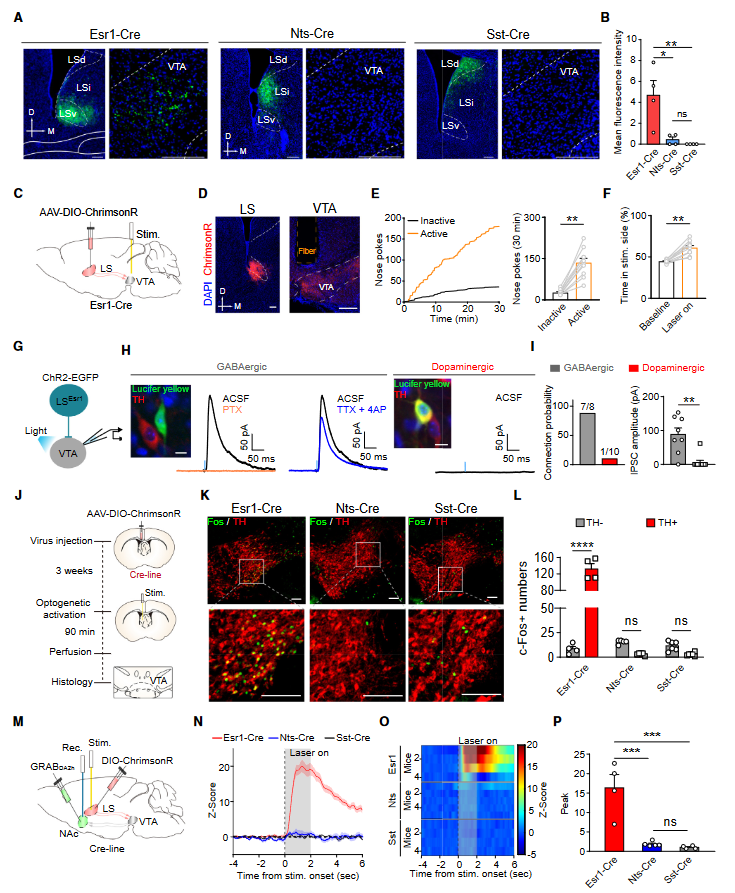
图4 LSESR1神经元通过投射到VTA和去抑制多巴胺能神经元促进正强化
5. METH而非可口食物或社交互动在LS中诱导多巴胺升高
通过逆行示踪实验,作者在LS中检测到许多起始细胞(图5A),发现LSEsr1神经元从VTA多巴胺能神经元接收直接突触输入(图5B-5D)。通过VISOR 3D重构单细胞水平神经投射,清楚地看到一些VTA多巴胺能神经元将长距离轴突发送到间隔区,导致密集的神经支配(图5E和5F)。随后,作者在LSEsr1神经元中表达了多巴胺探针GRABDA2h(图5G),发现只有腹腔注射METH会诱导立即和持久的多巴胺升高(图5H-5J)。
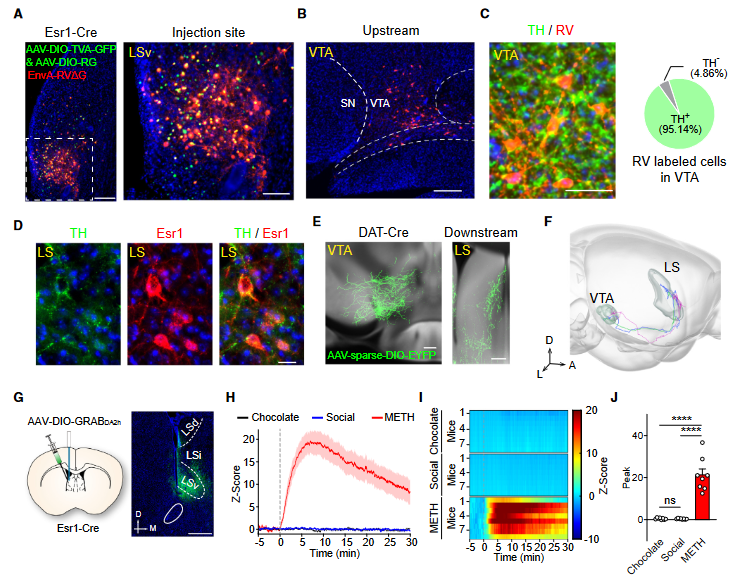
图5 METH诱导LS多巴胺释放
6. LSEsr1神经元对METH奖赏和METH寻求行为是必需的
为了研究LSEsr1神经元对奖赏寻求行为的贡献,作者通过表达破伤风毒素轻链(TeNT)选择性地阻断了LSEsr1的突触输出(图6A和6B)。结果表明LSEsr1神经元对食物和社会奖赏都不是必需的(图6C-6I)。然而,在静脉METH自我给药实验中,用TeNT沉默LSEsr1神经元显著抑制了METH寻求行为(图6C和6J-6I)。此外,TeNT表达几乎完全消除了METH诱导的条件性位置偏好(CPP)(图6M)以及METH诱导的过度运动(图6N)。为了检验LSEsr1神经元是否在线索诱导的METH复吸行为中发挥作用,作者向Esr1-Cre小鼠的LS中注射了AAV-DIO-hM4Di,以实现化学遗传抑制,这允许作者在线索呈现之前特异性抑制LSEsr1神经元(图6O和6P)。结果表明LSEsr1神经元也是线索诱导的METH复吸行为所必需的(图6Q)。
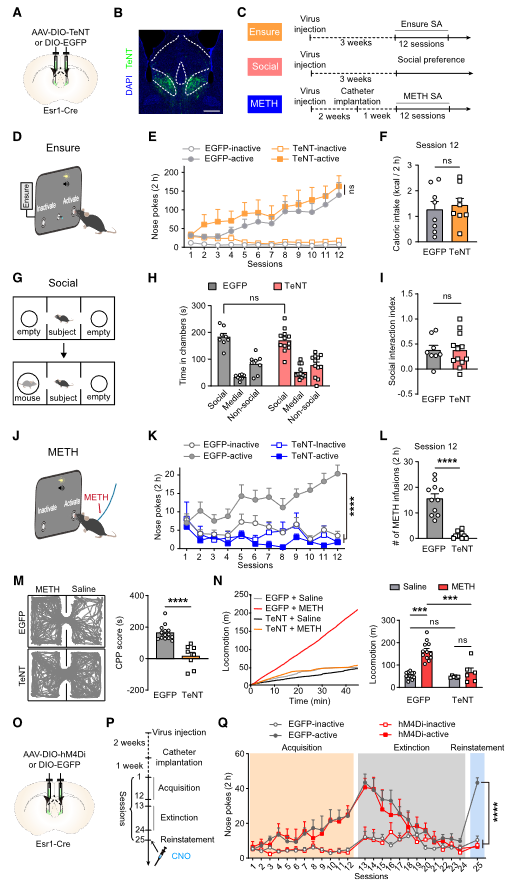
图6 LSEsr1神经元是METH奖励和METH寻求行为所必需的
7. LSEsr1神经元中HCN的表达升高介导METH导致的行为敏化
作者使用膜片钳电生理技术发现METH处理显著增加了LSEsr1神经元的自发动作电位发放频率(图7A)并且兴奋性显著增强(图7B),HCN电流增加(图7C和7D)。snRNA-seq数据分析显示,在LSEsr1神经元群体中Hcn1特异性显著富集(图7E)。通过使用选择性HCN阻断剂(图7E)和小鼠实验(图7G),表明METH处理后LSEsr1神经元中Hcn1上调。作者发现shRNA介导的Hcn1敲除实验进行了进一步的验证(图7J-7L)。总的来说,这些结果表明METH诱导的LSEsr1神经元中的可塑性变化可能是METH成瘾的重要驱动因素。
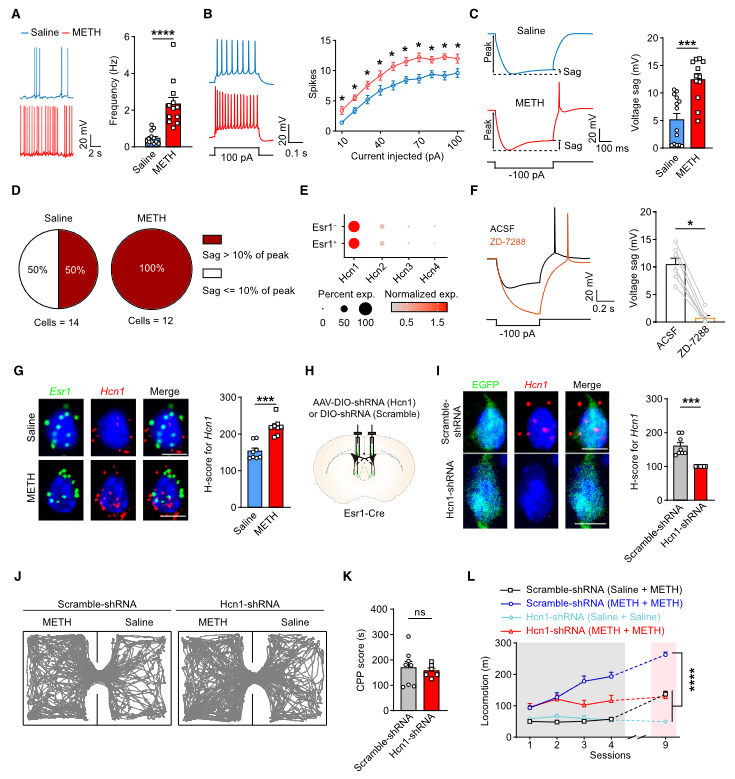
图7 HCN电流(Ih)介导的LSEsr1过度兴奋性有助于METH诱导的运动敏化
研究结论
本文的研究结论强调了LS中特定神经元群体在奖赏处理和METH成瘾中的核心作用。通过单细胞核RNA测序技术,研究揭示了LSEsr1在奖赏寻求行为中的关键性。研究进一步发现,METH的长期暴露能够通过上调HCN1通道增强LSEsr1神经元的兴奋性,导致运动敏化现象。
此外,LSEsr1神经元的激活与METH诱导的过度运动、条件性位置偏好、自我给药和线索诱导的复吸行为紧密相关。重要的是,HCN1通道的敲除能够阻止METH诱导的运动敏化,表明这一通道在成瘾行为中扮演了关键角色。这些发现不仅为理解奖赏和成瘾的神经机制提供了新的视角,而且为开发针对METH成瘾的潜在治疗策略提供了新的靶点。






