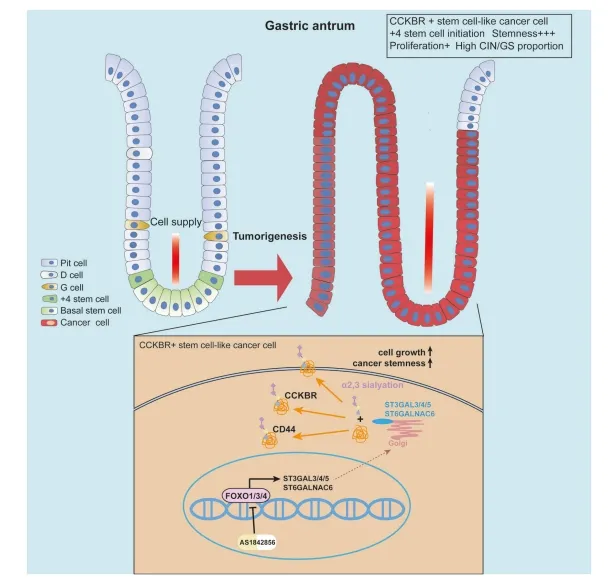
胃腺癌(GA)是最常见的恶性肿瘤之一,也是癌症相关死亡的常见原因。目前对于胃腺癌的发病机制仍知之甚少,主要原因是因为胃腺癌的细胞来源不清楚,肿瘤的主要细胞成分存在很大的异质性。干细胞由于具有长期存活能力更容易积累更多的致癌突变,特定基因突变会诱导干细胞发生恶性转化,从而导致胃腺癌的发生。
LGR5+基底干细胞是胃窦干细胞,胃窦+4干细胞标记物CCKBR(胆囊收缩素B受体)位于胃窦+4细胞中,与LGR5不同,被认为对胃泌素敏感以维持干细胞稳态。临床患者中CCKBR+癌细胞的异质性及其对GA治疗和生存的影响尚未见报道。因此,值得进一步探索源自该细胞群的恶性转化肿瘤特征。
欧易生物助力本研究单细胞转录组测序服务。

发表期刊:Cell Death Differ.
影响因子:13.7
发表年月:2024年8月
研究材料:5例胃腺癌(GA)和4例胃窦和1例胃体腺癌患者的样本
研究方法:单细胞转录组测序、转录组测序、RTqPCR、小鼠模型实验、类器官
研究内容
在这里,作者使用单细胞RNA测序(scRNA-seq)技术,鉴定了与分化差和预后差相关的CCKBR+干细胞样癌细胞,并说明了GA的异质性。作者对scRNA-seq文库(GSE183904)和TCGA进行了靶向分析,以验证结果。
表1临床统计来自scRNA-seq的样本
研究结果
1.CCKBR+癌细胞表现出类似干细胞的特性
作者对5例胃腺癌(GA)和4例胃窦和1例胃体腺癌患者的样本进行了单细胞转录组测序。术后验证并记录了这些受试者的临床特征(表1)。经过质量控制和去除离群细胞后,共获得24,931个细胞和8种细胞类型。然后,作者对上皮细胞簇进行了重新分类,以研究肿瘤细胞的异质性。t-SNE降维方法将5个样本中的6568个肿瘤上皮细胞聚集为9个簇。所有上皮细胞簇均表现出较高的恶性评分。值得注意的是,上皮细胞亚组5(Epi5)表现出高表达的CCKBR(图1C)。这是一种胃窦+4干细胞。作者进一步鉴定了Epi5特异性表达的胃窦粘液腺相关标记物(图1D),以及胃窦基底干细胞的标记物。Epi5没有表现出主要的分化成熟细胞特征,符合其干细胞状态。CCKBR+细胞的恶性转化使其失去了其原来的生理功能(图1H)。然而,Epi5保留了较高的肿瘤干细胞特性,并伴随着较高的肿瘤干细胞(CSC)标志物CD44、PROM1和ALCAM的表达(图1I,J)。
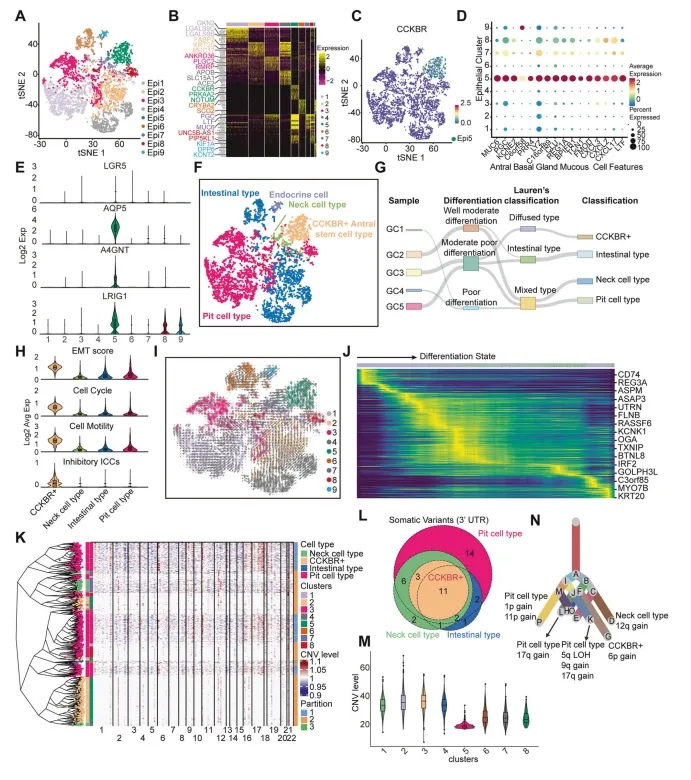
图1 单细胞RNA测序(scRNA-seq)揭示了CCKBR+干细胞样肿瘤细胞在胃腺癌(GA)中的鉴定
为了进一步区分肿瘤的异质性,作者根据胃腺细胞类型对上皮细胞进行了分类。将肿瘤细胞分为肠型、小凹细胞型、颈细胞型。CCKBR+干细胞型,和肿瘤内少量混合内分泌细胞(包括GAST+G和SST+D细胞)。CCKBR+肿瘤细胞也表现出更高的恶性生物学特性的激活(图1H和图1M)。此外,分析确定Epi5是最原始和分化最差的肿瘤细胞类型(图1I).作者还鉴定了与低分化癌细胞相关的标记物,如CD74、REG3A和ASPM(图1J)。
为了确定CCKBR+肿瘤细胞是来源于+4干细胞还是其他肿瘤细胞的去分化,作者选择了样本GC5(包含小凹细胞型、颈细胞类型和CCKBR+肿瘤细胞)来推断大规模拷贝数变异(CNVs)随后进行系统发育重建分析。CCKBR+细胞显示出一个独特的CNV亚克隆结构,与窝细胞和混合细胞相比,具有不同的模式(图1K)。体细胞变异分析和小提琴图的突变重叠显示,CCKBR+细胞CNV水平最低,而小凹细胞CNV水平最高,与CCKBR+细胞重叠。1L,M)。这表明CNV从CCKBR+细胞到窝细胞型肿瘤细胞的进化关系,而不是去分化。进一步的进化系统树分析也表明,CCKBR+肿瘤细胞具有独立的进化关系,不来自于于小凹细胞型的转化。
2. CCKBR高表达与预后不良相关
作者通过对154个来自胃体和胃窦的样本进行免疫染色,调查了人GA中CCKBR的表达,包括不同程度的分化。CCKBR在窦腺基底层表达,并随着细胞分化的增加而表达逐渐减少。相反,早期CCKBR+肿瘤细胞在腺体下部区域明显增加,并随着肿瘤的推进而扩张和扩散。作者还观察到了淋巴转移瘤中CCKBR+肿瘤细胞的存在(图2A),表明CCKBR+肿瘤细胞的转移潜能。CCKBR在CCKBR+肿瘤中的表达也显著高于癌旁肿瘤组织(图2B)。作者发现,与GA中Top5上调基因相比,CCKBR在预测GA方面具有更高的敏感性。因此,CCKBR是GA的一个潜在的预测因子。CCKBR+肿瘤主要为胃窦性肿瘤,与低分化呈正相关(图2C),生存率较低,治疗后生存结果较差。这个可能归因于CCKBR+肿瘤中残留微小肿瘤的可能性较高(补充图2C)。
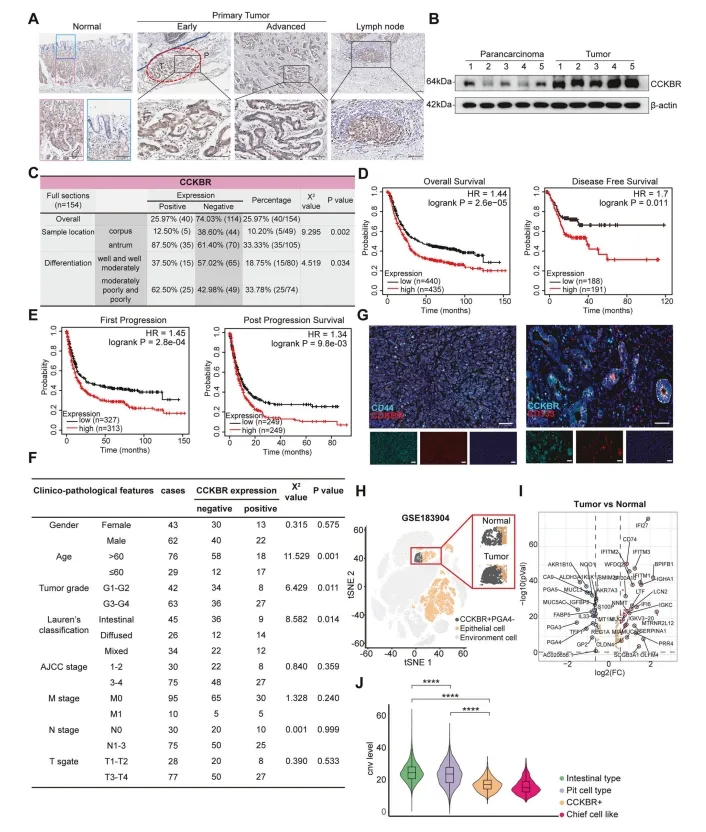
图2 CCKBR的表达与胃腺癌的低分化和预后不良相关
此外,作者还进行了CCKBR阳性和阴性胃窦癌相关的临床病理分析。CCKBR+肿瘤与较低的发病年龄(χ²=11.529,p=0.001)、较高的肿瘤分级(χ²=6.429,p=0.011)和Lauren分型(χ=8.582,p=0.014)相关,但与肿瘤TMN分级不相关(图2F).作者还检测到了CCKBR与CD44和CD133高共表达 (图2G),这与作者的scRNA-seq结果一致。为了避免样本量造成的偏差,作者使用另一个单细胞RNA-seq库(GSE183904)验证了作者的结果,该库包含40个来自GA和正常组织的样本。CCKBR+型胃窦肿瘤分化程度较低,恶性程度较高,导致患者生存率较差。
3.CCKBR+肿瘤倾向于形成染色体不稳定
为了识别CCKBR肿瘤中的基因组畸变,作者首先将来自TCGA的CCKBR+干细胞样癌细胞进行了分组,并检测了Epi5标记物水平的升高。CCKBR+肿瘤细胞具有独特的转录组特征,与单细胞的结果一致。
有趣的是,作者发现CCKBR+肿瘤具有较低的肿瘤突变负担(TMB)评分和微卫星不稳定性(MSI)评分,在单个肿瘤中肿瘤突变频率非常低(平均变异:193vs602)根据TCGA分类,CCKBR+肿瘤的微卫星不稳定型(MSI)(10.47%vs30.94%)和eb病毒(EBV)(0%vs10.07%)型肿瘤发生率显著降低,但基因组稳定(GS)(16.28%vs8.63%)和染色体不稳定型(CIN)(72.09%vs48.92%)的发生率明显增加(图3C)。使用基础干细胞标记物(LGR5、AQP5、A4GNT、LRIG1)进行分类也得到了类似的结果,如图3D所示。这表明干细胞样肿瘤更容易产生GS和CIN型肿瘤,而不是MSI或EBV型肿瘤。此外,CCKBR肿瘤表现出更高的突变频率CCKBR+肿瘤主要由TP53、GLI3、APC和SMAD4的突变驱动,导致GS和CIN肿瘤的形成(图3H,J)。
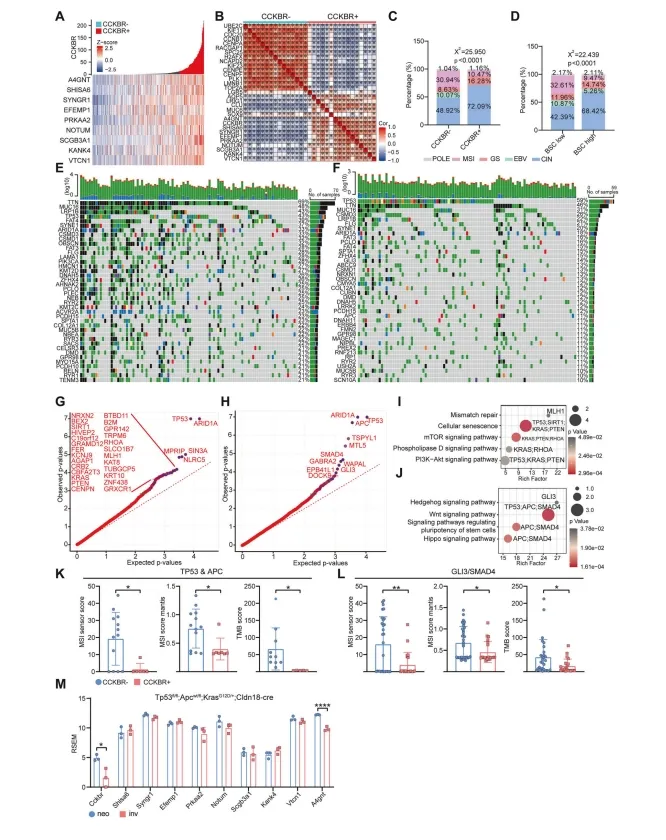
图3 CCKBR+肿瘤倾向于形成染色体不稳定(CIN)和基因组稳定(GS)亚型
为了确定TP53、APC、GLI3和SMAD4突变是否驱动CCKBR+肿瘤发生,作者筛选了TP53和APC突变的CCKBR阳性和阴性患者,以及GLI3或SMAD4突变的患者,并比较了它们的CNV变异。虽然发生了相同的情况在肿瘤驱动基因中,CCKBR+肿瘤的TMB和MSI评分仍然较低(图3K,L),这表明这些突变并不是产生CCKBR+肿瘤的唯一因素。同样,在胃腺细胞中由TP53、APC和KRAS突变联合引起的小鼠GA模型中,也未检测到CCKBR或Epi5相关标志物的表达升高(图3M)。总之,这些突变和胃干细胞的恶性转化都是产生CCKBR+肿瘤所必需的。相反,非干细胞中的这些肿瘤突变并不表现出CCKBR+肿瘤的特征,也不能形成去分化的CCKBR+肿瘤。
4.CCKBR+干细胞样癌细胞激活FOXO
为了研究CCKBR+肿瘤细胞的生物学特性,作者对Epi5进行了功能富集分析。Epi5主要与转录起始、自噬、粘附、缺氧和免疫反应相关(图4A和补充图4A,B),表明它们存在于缺氧的微环境中,并依赖于自噬和粘附来生存和增殖。此外,Epi5没有表现出过度的增殖相关信号,主要受NFKB1、RELA、STAT3、ZFP36(炎症相关)和JUN、FOXO3、FOXO4、CTNNB1(干性相关)的调控(图 4B)。值得注意的是,这些细胞激活了信息相关通路,如NF-kB、TNF、IL-17信号通路,以及干细胞相关通路,包括FOXO、Hippo、HIF1、TGF-b信号通路(图4C)。作者观察到Epi5观察到FOXO信号通路明显富集。
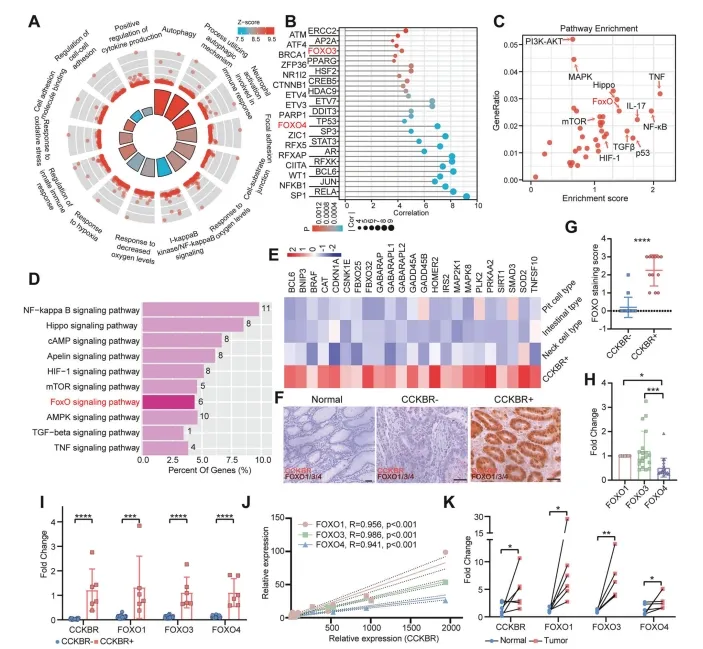
图4 CCKBR+肿瘤显示FOXO活化增强
作者还利用GSE183094的数据,特别地确定了CCKBR+PGA4-肿瘤细胞的富集水平升高(图4D)。在来自Epi5和GSE183094的CCKBR+肿瘤细胞中,参与FOXO信号通路的基因均表达上调(图4E)。
5.FOXO维持癌症干细胞的稳态
此外,对CCKBR阳性和阴性细胞进行分类,并进行肿瘤球形成实验,结果显示CCKBR+细胞具有更大的肿瘤球形成能力(图5B,C)。为了评估CCKBR+细胞是否比CCKBR细胞具有更高比例的CSCs含量,作者在小鼠体内进行了稀释实验,将分类为CCKBR表达的HGC27细胞注入免疫缺陷小鼠体内。与CCKBR细胞相比,CCKBR+细胞形成了更大的肿瘤(图5D-G和补充图5B)。与常规细胞培养相比,肿瘤球形成显著提高了6种细胞系中CCKBR和FOXO1/3/4的蛋白表达水平(图5H,I)。此外,FOXO1、FOXO3和FOXO4在肿瘤球中均升高(图5J,K)。
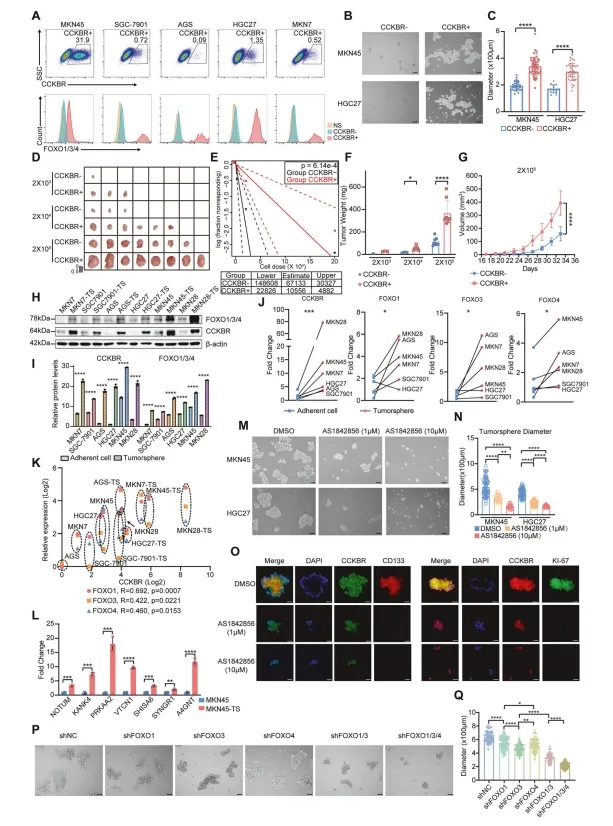
图5 FOXOs维持CCKBR阳性的癌症干细胞内稳态
作者还发现,与epi5相关的标记物在肿瘤球中也表现出表达升高(图5L)。作者用不同浓度的AS1842856(FOXO抑制剂)治疗肿瘤干细胞,值得注意的是,1μM的AS1842856的显著抑制了肿瘤球的形成。此外,RTqPCR还证实了Wnt相关基因、胃干细胞标记物和CSC标志物表达下调(补充图。5E)。为了确定哪个FOXO基因参与了肿瘤干细胞的形成,作者分别敲除了MKN45中的FOXO1、FOXO3和FOXO4。单独抑制单个基因的表达对肿瘤球的形成有轻微的抑制作用,而同时敲除FOXO1/3可有效抑制肿瘤球的生成。同时敲除FOXO1、FOXO3和FOXO4具有更大的抑制作用(图5P,Q)。因此,抑制单一的FOXO同工酶可能导致家族其他成员的补偿,而协同抑制FOXO家族成员可能是抑制CSC更有效的方法。
6.靶向富集FOXOs抑制CCKBR+肿瘤生长
为了确定CCKBR+和CCKBR肿瘤细胞之间的差异,作者建立了CCKBR阳性和阴性表型的胃腺癌类器官(图6A)。与上述结果一致,CCKBR+类器官显示了CCKBR和干细胞标记物的高表达。已经证明肿瘤类器官表现出药物敏感性与原发性肿瘤相一致。接下来,为了证实FOXO抑制CCKBR+肿瘤的生长,作者用AS1842856处理类器官,观察到明显抑制CCKBR+肿瘤类器官的生长。具体来说,1μM的AS1842856降低了细胞活力,而较高浓度的AS1842856对CCKBR+GA类器官表现出肿瘤杀伤作用。而AS1842856对CCKBR器官类化合物没有影响(图6B,C)。另一种新型FOXOs抑制剂卡苯诺酮也显著抑制了CCKBR+GA类器官的生长(图6D)。
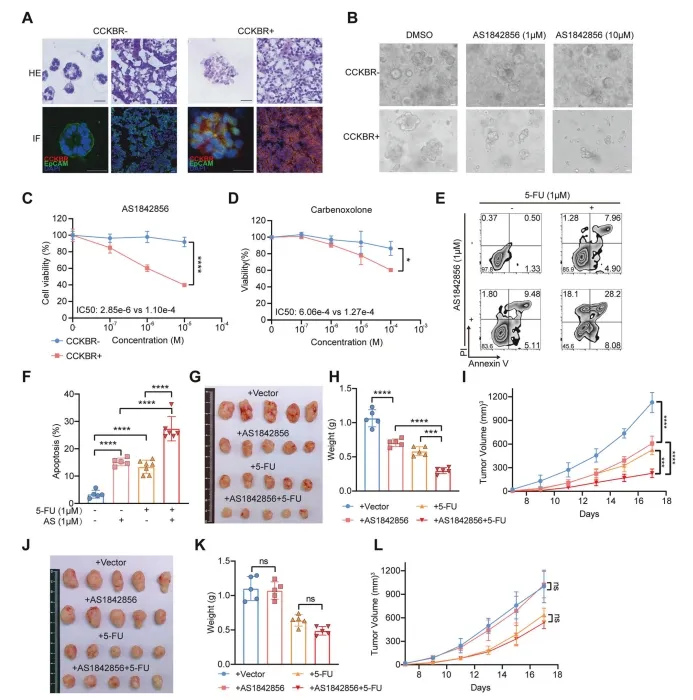
图6 靶向FOXO可抑制CCKBR+肿瘤细胞的生长
此外,同时传递5-FU和AS1842856可使CCKBR+肿瘤细胞凋亡更明显(图6E,F)。然后,作者评估了AS1842856和5-FU在体内的协同效应,因为之前已经有研究表明,FOXO与化疗敏感性相关。裸鼠皮下移植分选的CCKBR+的MKN45细胞,然后用AS1842856和5-FU处理AS1842856治疗减少了肿瘤的生长,而AS1842856和5-FU联合治疗显著降低了CCKBR+肿瘤的生长(图6G–I)。而对CCKBR阴性的AGS肿瘤移植小鼠没有明显的效果(图6J-L)。结合体外实验,作者认为FOXO抑制剂AS1842856特异抑制CCKBR+干细胞样肿瘤细胞生长。
7.FOXOs介导的唾液酰化作用来维持CCKBR+干细胞
为了研究FOXOs调控的维持CCKBR+肿瘤细胞的下游基因,作者在CCKBR阳性和阴性肿瘤中进行了高通量CUT&Tag测序。与预期的一样,作者发现FOXOs相关基序,FOXO1、FOXO3和FOXO4的富集可以利用相同的基序进行转录调控(图7A)。通过对启动子区域差异峰的分析,作者观察到FOXOs促进CCKBR+肿瘤细胞存活,增强缺氧反应(图7B)。ST3GAL家族主要介导α2,3唾液化,而ST6GALNAC家族主要介导α2,6唾液化过程。肿瘤细胞的唾液酰化已被证明是恶性肿瘤进展、转移和免疫逃逸的关键。RT-qPCR也证实了CCKBR+GA类器官中ST3GAL家族表达的显著增加,而不是ST6GALNAC家族的表达,而AS1842856有效抑制了它们的表达(图7I)。MALI凝集素染色结果也得到相似的结果(图7J)。最后,P3FAX-Neu5Ac,一种α2,3唾液酸转移酶抑制剂,显著抑制CCKBR+肿瘤的生长,而对CCKBR肿瘤的影响较小(图7K)。
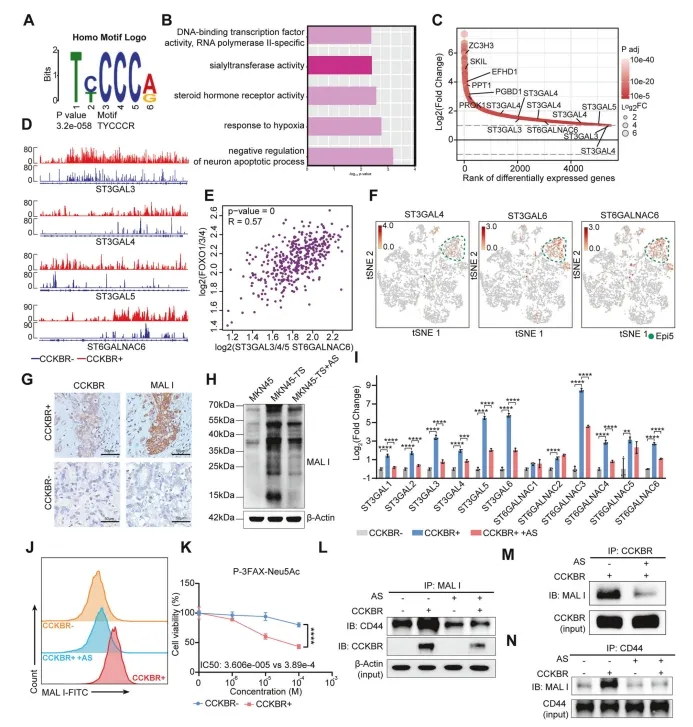
图7 FOXOs转录调控α2,3唾液酰化,促进CCKBR阳性肿瘤的生长
综上所述,FOXOs可促进了CCKBR+肿瘤细胞中ST3GAL3、ST3GAL4、ST3GAL5、ST6GALNAC6的表达,导致CD44和CCKBR上的α2、3个唾液聚糖水平升高。
研究结论
肿瘤的异质表型导致对特殊药物治疗不同水平的耐药性,最终限制治疗的有效性。正常的胃腺是由长寿的干细胞来维持的。基底干细胞和+4干细胞都已被证明通过细胞特异性致癌突变作为胃窦癌的来源。
在这里,作者通过单细胞测序技术鉴定了一个表达CCKBR的远端胃+4干细胞型肿瘤细胞亚群。这些肿瘤细胞分化程度较低,恶性程度较高,导致生存率较差。与小凹细胞型或肠型肿瘤细胞相比,CCKBR+肿瘤细胞表现出炎症、自噬和各种干细胞相关信号通路的激活。作者还研究了与CCKBR+肿瘤相关的基因畸变模式,发现CCKBR+的肿瘤依赖于FOXO的活化维持肿瘤生长。细胞系统中FOXO-唾液酸转移酶轴的相互作用,促进了CCKBR起始的癌症干细胞的生长和存活(图8)。这一见解提供了开发针对CCKBR相关癌症治疗的靶向治疗策略的新前景。