研究背景
聚乳酸(Polylactic acid,PLA)是一种新型的生物降解材料,利用可再生的植物资源(如玉米)所提出的淀粉原料制成,可用于加工各种塑料制品、包装食品、快餐饭盒、无纺布、工业及民用布等。微/纳米塑料(Micro/nanoplastics,MNPs)在人类肝脏中被检测到,并对人类健康构成重大威胁。
研究发现PLA口罩可释放MNPs,这些纳米颗粒和微塑料可能通过呼吸道或者口腔进入人体,影响呼吸系统,消化系统的健康。已有研究证实聚乙烯、聚苯乙烯释放的MNPs可引起肝脏毒性和肺部的组织病变,但是空气和食物中可生物降解的PLA-MNPs对人体影响的机制研究还不够全面。
2024年4月,浙江大学李兰娟教授(中国工程院院士)团队在Environmental Science and Ecotechnology期刊(IF:14.0)发表的题为“Polylactic acid micro/nanoplastic-induced hepatotoxicity: Investigating food and air sources via multi-omics”的文章,通过代谢组学、转录组学、微生物组学技术,深入分析了空气和食源性纳米塑料对人体健康的影响。研究结果表明,食源性和空气传播的 PLA-MNP都会损害肝功能,破坏血清抗氧化活性,并引起肝脏和肺组织病变。欧易生物提供代谢组学、转录组学以及微生物组检测及技术支持。

发表期刊:Environmental Science and Ecotechnology
影响因子:14 .0
研究材料:
60只4周龄无病原体的ICR小鼠,分为6组,每组10只:
1、食物纳米塑料组(FQ)每天灌胃100毫升无菌水,含有0.2毫克NPs;
2、食物微塑料组(FR)每天灌胃100毫升无菌水,含有0.2毫克MPs;
3、食物对照组(FNC)每天灌胃100毫升无菌水,含有0毫克MNPs;
4、空气纳米塑料组(AQ)每3天经鼻给予10毫升无菌生理盐水,含有0.03毫克NPs;
5、空气微塑料组(AR)每3天经鼻给予10毫升无菌生理盐水,含有0.03毫克MPs;
空气对照组(ANC)每3天经鼻给予10毫升无菌生理盐水,含有0.03毫克0毫克MNPs;
运用的技术方法:
代谢组学、转录组学、微生物组学
技术路线

研究结果
1、MNPs影响肝功能和血液抗氧化活性
AST(天冬氨酸转氨酶)和ALT(丙氨酸转氨酶)是两种在医学上常用的肝功能检测指标。它们主要存在于肝脏细胞中,当肝脏细胞受损或坏死时,这些酶就会释放到血液中,导致血液中的AST和ALT水平升高。实验结果显示,暴露于食源性和空气中的的聚乳酸MNPs后,小鼠血清中的AST和ALT水平均显著上升(图1a,1b,1e,1f)。与此同时,聚乳酸MNPs暴露后,小鼠血清T-AOC和SOD水平的明显下降(图1c,1d),其中食源性小鼠抗氧化活性指标降低程度明显高于空气中MNPs。
2、MNPs引起肝脏和肺部病变
从肝脏和肺组织的组织切片结果中可以看出,聚乳酸MNPs食源性和空气暴露都会导致肝组织和肺组织发生病变(图1i-k)。与对照组相比,暴露后的组织切片中可以明显看出肝细胞肿胀、点状坏死、细胞空泡化和核脓性硬化。

图1 PLA NP和MP暴露组的血清生化参数和组织学变化
3、食源性MNPs改变了肠道微生物群
肠道微生物组学结果显示,食源性聚乳酸MNPs能够显著改变肠道微生物群的组成和功能。厚壁菌门是各组中最丰富的细菌门(图2a),但在FNC组中,Lachnospiraceae科是丰度最高的细菌科(图2b)。根据PERMANOVA结果(图2f,2g)可以看出FQ、FR和FNC组的肠道菌群组成之间存在显著差异(R2= 0.18,P< 0.001)。此外,食源性MNPs还改变了肠道微生物群网络(图2k),FQ和FR组中多种功能通路出现上调,如ABC转运蛋白、鞭毛组装和细菌趋化性。

图2 PLA NP和MP食源性暴露组和对照组肠道菌群的主要成分和α多样性指数
4、空气传播的MNPs改变了鼻腔微生物群
聚乳酸MNPs的空气暴露改变了鼻腔微生物的组成、网络结构以及功能通路。三组中鼻腔菌群的50%以上是厚壁菌门,葡萄球菌科是三组中最丰富的菌科(图3a,3b)。AQ组和AR组的鼻腔α多样性指数均高于ANC组(图3c,3e)。三组间的鼻腔微生物群也有明显差异(图3f,3g)。Prevotella和Pelomonas菌群在AQ和AR组的微生物群落分布的相关性最强,空气暴露也上调了鞭毛组装和细菌趋化性功能通路,同时细胞周期-caulobacter功能通路也出现明显上调。

图3 PLA NP和MP空气暴露组和对照组鼻腔微生物群的主要成分和α多样性指数
5、空气传播的MNPs改变了肺微生物群
聚乳酸MNPs的空气暴露改变了肺微生物群的组成在门水平上,厚壁菌门和假单胞菌门在AQ和AR组的肺菌群中含量最高,而厚壁菌门和拟杆菌门在ANC组的肺菌群中丰度最高(图4a)。Muribaculaceae,Lachnospiraceae和Staphylococcaceae是ANC组中数量最多的三个肺部细菌科(图 4b)。肺部的微生物网络分析结果显示Klebsiella和Muribaculaceae两个菌群在AQ和AR组的微生物群落分布的相关性最强。肺组织的微生物功能通路的改变与鼻腔微生物不一样,主要体现在AQ组的鞭毛组装、卟啉和叶绿素代谢和苯丙氨酸代谢的上调最显著,而AR组的鞭毛组装、细菌趋化性和苯丙氨酸代谢的上调最显著。
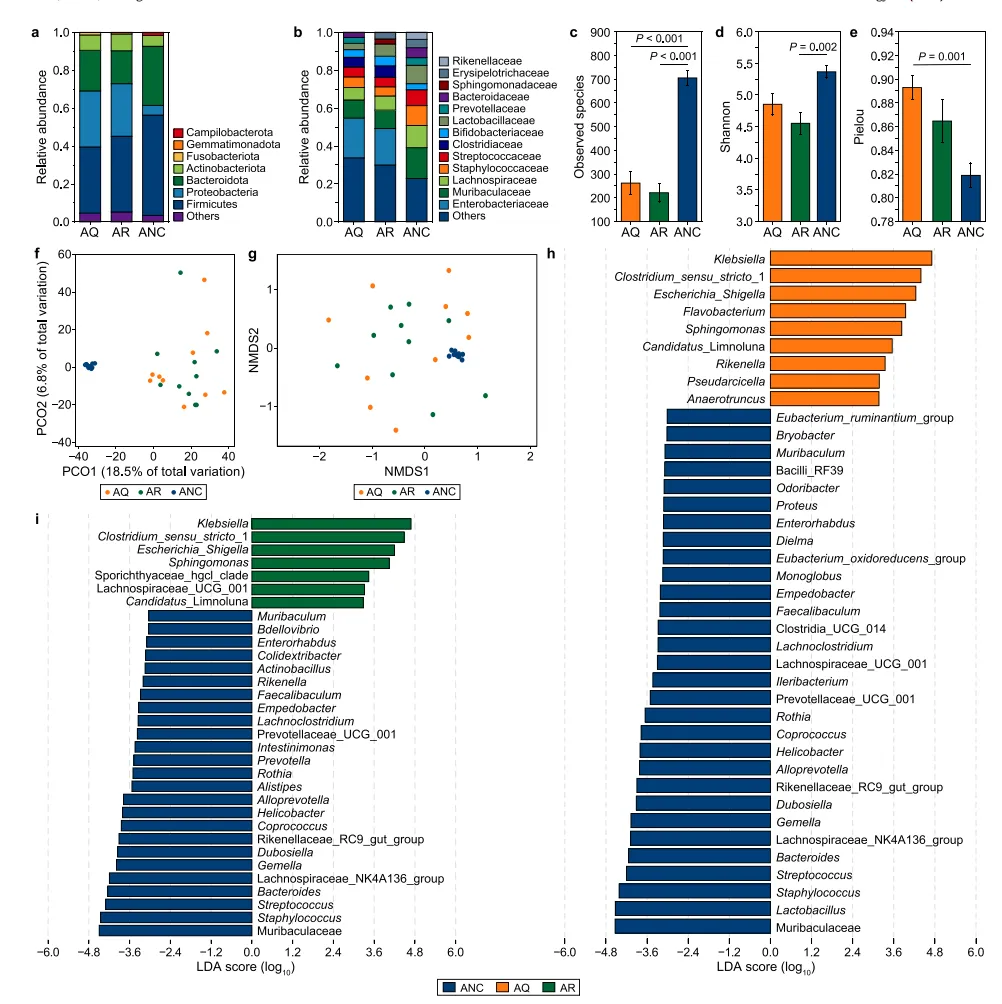
图4 PLA NP和MP空气暴露组和对照组肺微生物群的主要成分和α多样性指数
6、食源性MNPs诱导的肠道和血清代谢改变
食源性MNPs导致FQ组和FR组分别有752和637种肠道代谢物发生改变(图5a,5b),以及832和753种血清代谢物发生改变(图5c,5d)。食源性暴露改变的肠道代谢物主要富集在类固醇激素生物合成、癌症中枢碳代谢、ABC 转运蛋白、蛋白质消化和吸收等通路,其中癌症中枢碳代谢上调最显著。血清的差异代谢物主要富集在亚油酸代谢、色氨酸代谢等通路(图5f)。
7、食源性MNPs诱导的肝脏转录组改变
转录组结果显示,食源性MNP暴露能够改变肝脏的转录谱。FQ组和FR组分别有307和262个肝脏基因发生改变(图 5g,5h)。GO富集分析发现,FQ组大量富集了染色质沉默、细胞外区域和核小体DNA结合的负调控(图5i),而核小体组装富集程度最高(图5j)。两组不同的9条肝脏通路在FQ和FR组中富集,其中昼夜节律在FQ和FR组中上调最多(图5k)。

图5食源性-PLA NP和MP诱导的代谢和转录组改变
8、空气传播的MNPs诱导的肺和血清代谢的改变
肺组织和血清的非靶向代谢组学结果显示,空气MNPs暴露同样能够改变肺组织和血清的代谢谱。AQ组和AR组分别有864和596种肺代谢物升高(图6a,6b),血清代谢分别有503和664种血清代谢物发生改变(图6c,6d)。空气暴露后改变的肺组织代谢物与食源性暴露的肠道代谢富集的代谢物通路类似,都包含癌症中枢碳代谢以及蛋白的消化吸收。
9、空气传播MNPs诱导的肝脏转录组改变
AQ、AR和ANC组之间的肝脏转录组谱存在很大差异。AQ和AR组分别改变了两组303和289个肝脏DEG(图6g,6h)。在AQ和AR组中,核小体组装是肝脏GO中上调最多的项(图6i,6j)。AQ和AR组中有多种肝脏通路上调,其中酒精中毒、系统性红斑狼疮和中性粒细胞胞外陷阱形成在两组中都大幅上调(图6k)。研究结果显示,在食源性和空气暴露的肝脏组织的转录组结果中,昼夜节律通路均普遍上调。
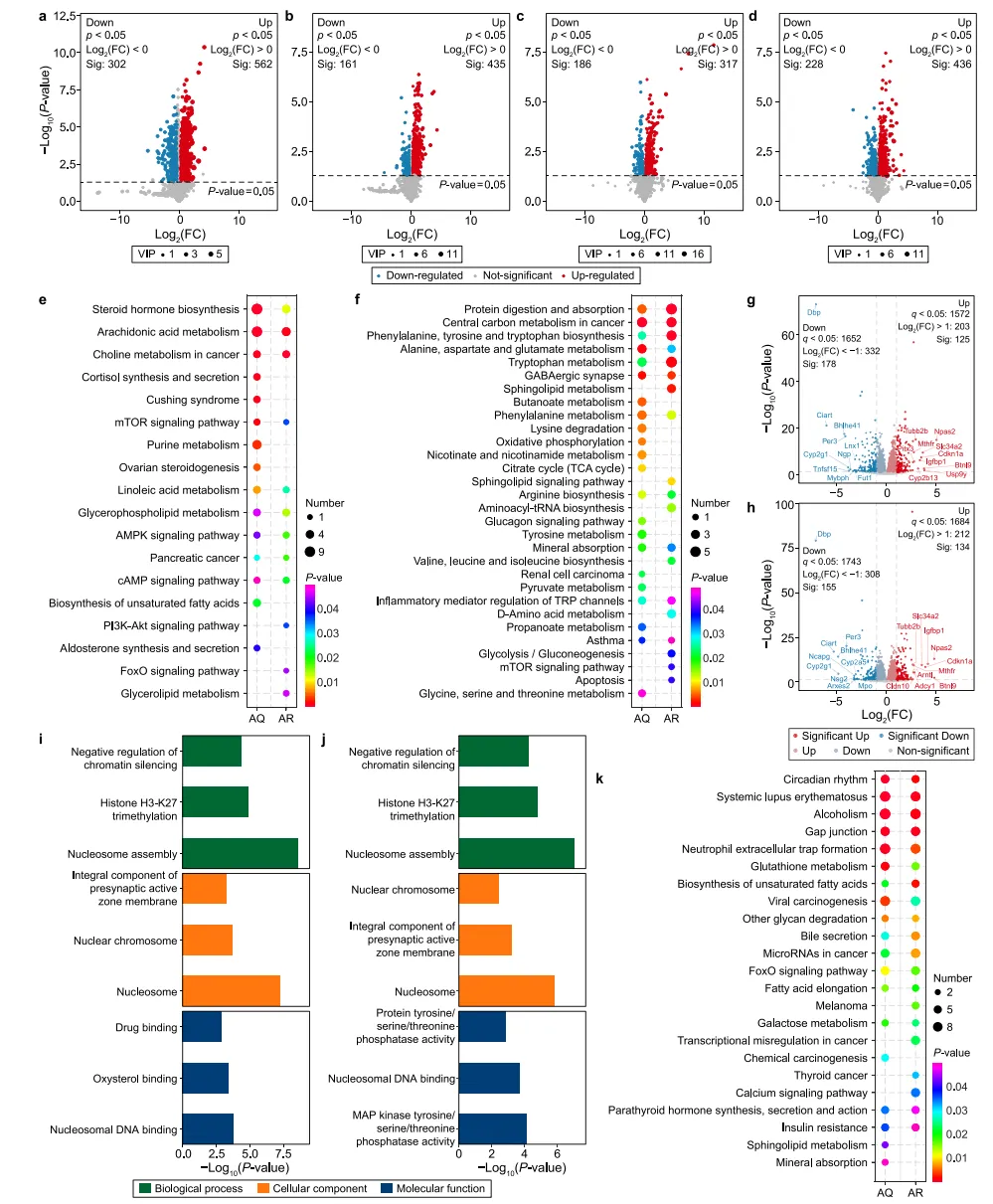
图6 PLA NP和MP空气暴露诱导的代谢和转录组改变
10、多组学联合分析确定了NP和MP暴露之间的差异
暴组中由改变的微生物、代谢物和转录本组成的四个相关网络分析结果显示(图 7a,7d),食源性暴露FQ组的基因Gm1673和FR组的基因cyp2b9、klhdc7b及代谢物bacterioruberin diglucoside都是关键的相关核心因子。在空气暴露的NP(AQ)和MP(AR)组中,关键的相关核心因子是AQ组的zfp804b和AR组的代谢物11-cis-3,4-didehydroretinol。
食源性的NP和MP暴露组之间,肠道微生物组、代谢组学和富集通路上表现出显著差异,例如FR组在Roseburia和氧化磷酸化通路差异较大,而FQ组在Lachnospiraceae_A2和ABC转运蛋白通路改变较为显著。
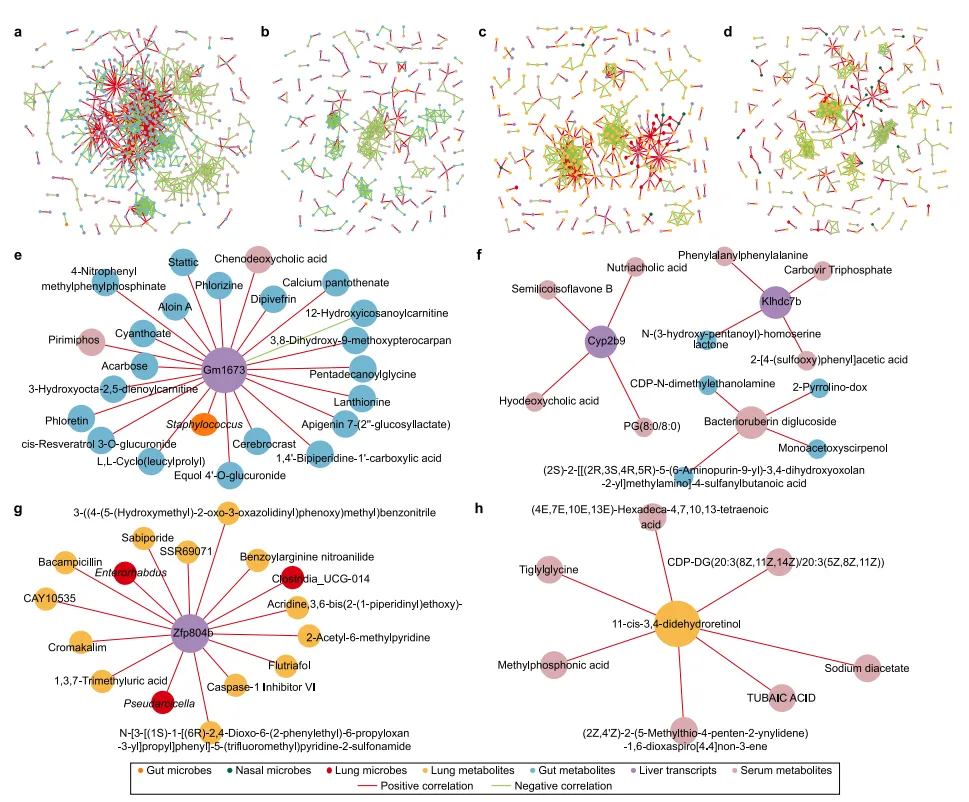
图7 PLA NP和MP暴露的相关性网络分析和组学差异
空气暴露的NP(AQ)和MP(AR)组在肺组织代谢组学以及富集通路上也有很大差异,AR组在嘌呤代谢和D-氨基酸代谢通路上显著富集,AQ组的花生四烯酸代谢和类固醇激素合成通路较为显著。不同MNPs暴露对血清代谢、肺组织微生物群以及肝脏的转录组学结果的影响也有存在差异,比如,Hungatella在AQ中更富集,Lachnospiraceae_A2在AR组中更富集。
研究结论
食源性和空气传播的PLA NPs和MP可导致小鼠的微生物群改变、代谢破坏和转录组失调。口服PLA MNP可破坏“肠道菌群-肠-肝”轴并诱发肝毒性,而PLA MNP鼻腔暴露可影响“气道微生物群-肺-肝”轴并引起肝毒性。
小欧推荐
本文章利用代谢组学、转录组学、微生物组学技术多角度多层级地检测了MNPs暴露对于小鼠肝脏组织、肺组织、血清的转录谱,代谢谱、肠道微生物、鼻腔微生物以及肺组织微生物群落组成的影响,揭示了MNPs通过不同途径引起肝毒性的机制,将可能有助于食源性和空气传播PLA MNP诱导的肝毒性的临床诊断。
原文链接
DOI:10.1016/j.ese.2024.100428






