研究背景
糖尿病血管病变的主要表现为动脉粥样硬化,晚期可出现斑块内钙化甚至血管闭塞,进而导致中风、心肌梗死、心力衰竭,是糖尿病患者致死致残的主要原因。随着空间组学技术和单细胞测序技术的不断发展,能够基于组织切片进行微米级精度的基因表达检测和代谢特征研究。平滑肌细胞表型的转化是糖尿病大血管病变的重要机制。作者对糖尿病患者的下肢血管进行了空间转录组、空间代谢组和单细胞测序的多组学联合研究,构建了一个糖尿病血管的多组学图谱。作者确定了平滑肌细胞的三个表型转化趋势,作者还确定了与不同表型转化相对应的转录驱动因子。作者的研究可以为血管平滑肌谱系追踪和血管代谢重编程的进一步研究提供依据。糖尿病大血管病变的多组学图谱也为临床治疗和检测提供了新的方向。
2024年10月12日,江苏大学附属医院王中群教授团队在《Cardiovascular Diabetology》(IF 8.5)发表题为“Spatial multiomics atlas reveals smooth muscle phenotypic transformation and metabolic reprogramming in diabetic macroangiopathy”的研究论文。作者基于多组学整合技术,首次构建了糖尿病完整动脉的空间多组学图谱,研究了钙化区域的细胞组成和生物学功能特征。进一步地,构建了糖尿病血管激活代谢网络,并结合公开数据发现HNMT和CYP27A1参与了糖尿病血管病变的代谢重编程。欧易生物提供空间代谢组检测及技术服务。

发表期刊:Cardiovascular Diabetology
影响因子:8.5
研究材料:
组织样本:11例糖尿病截肢患者的胫前动脉
运用的技术方法:单细胞测序、空气动力辅助解吸电喷雾质谱成像(AFADESI-MSI)、空间转录组测序、基因组关联研究(GWAS)、蛋白质组学检测
文章亮点:作者创新性的使用时空多组学技术(单细胞测序、空间转录组、空间代谢组)结合公共数据库,构建了糖尿病大血管病变的空间多组学图谱,确定了平滑肌细胞不同表型转化的转录驱动因子,为临床治疗和检测提供了新的方向。
技术路线
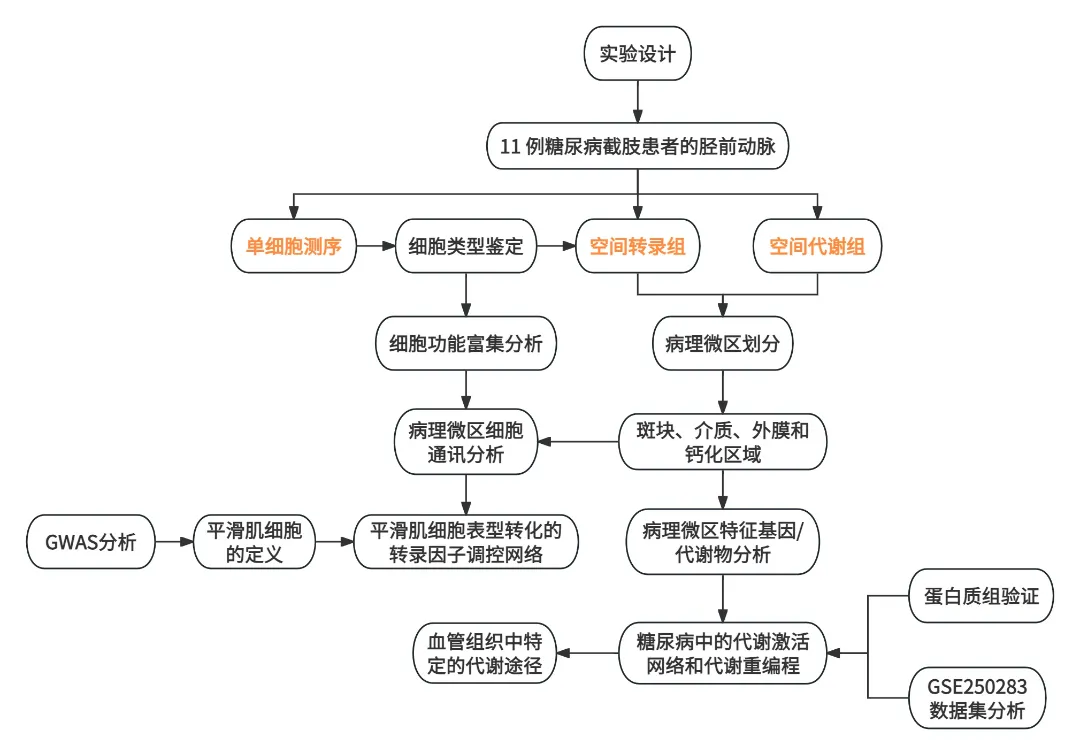
研究结果
1.糖尿病大血管病变的单细胞转录图谱
根据单细胞测序和经典细胞标志物对所有细胞簇进行注释(图 1)。图1C展示细胞注释的经典标志物。每种细胞类型中基因表达也符合预期(图 1D)。图1E展示各细胞群富集到的信号通路。

图1:糖尿病患者胫前动脉分离的单细胞转录组图谱
2. 糖尿病大血管病变的空间转录图谱
作者通过对空间转录组所有spot位点进行聚类,得到14个簇(图 2A、B和C)。基于空间热图,可以看出存在血管结构的空间特征。作者根据苏木精-伊红(HE)染色切片对病理进行注释,分为斑块、中膜、外膜和钙化(图2D和E)。为鉴定与斑块和钙化相关的关键基因,作者对斑块和钙化的标志基因进行了筛选,获得了50个病变特征性表达的基因。
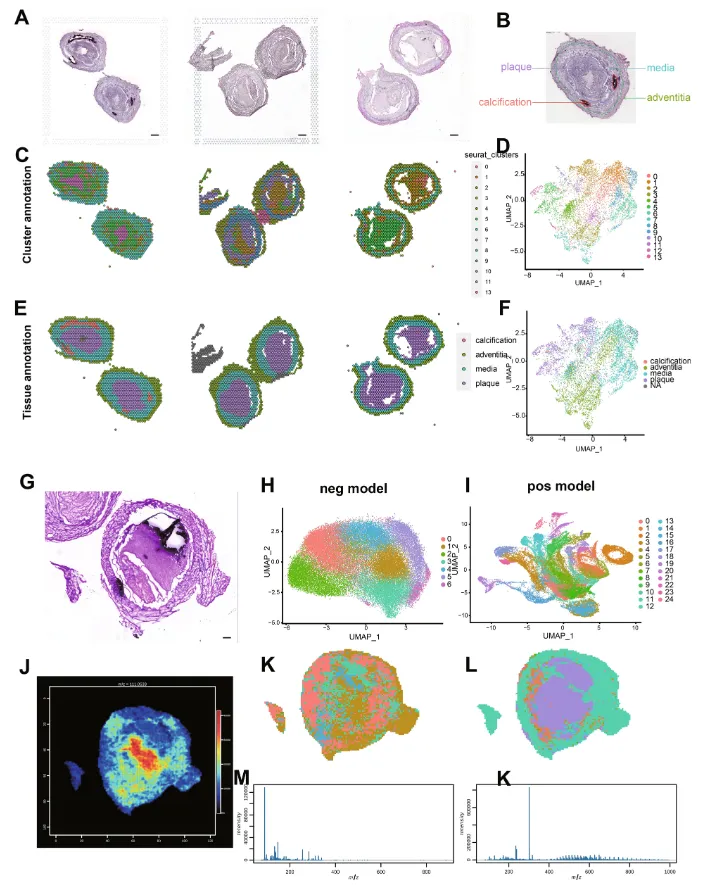
图2:糖尿病患者胫前动脉的空间代谢组和空间转录组图谱
3.空间转录组单细胞转录组的联合分析
作者使用单细胞转录组数据为空间转录组spot位点进行细胞注释。T细胞主要集中在血管外膜和斑块与中膜交界处;平滑肌细胞仅位于中膜,并位于斑块和中膜中;B细胞分布在部分血管中;内皮细胞少量分散在血管中。作者推测巨噬细胞和单核细胞在某些血管的斑块中浸润。成纤维细胞大多富集在血管外膜,肥大细胞分散在血管中。在糖尿病血管中,内皮细胞不连续,平滑肌细胞侵入斑块,免疫细胞在斑块和血管外膜区域富集。
4.糖尿病大血管病变的空间代谢图谱
空间代谢组分别对空转上机切片的相邻切片进行正负双离子模式检测,分别对正负模式数据进行聚类。负离子模式有7个簇,正离子模式有25个簇(图 2G和H)。基于HE染色结果,将空间代谢组分为钙化区域、斑块、中膜和外膜。在负离子模式中鉴定出的大多数杂环化合物主要富集在钙化区域,在外膜和中膜中并未显著富集。一些有机酸和脂质主要集中在中膜,而脂质主要集中在斑块中,这与先前的研究结果一致。
5. 糖尿病大血管病变中细胞通讯的特点
作者将血管组织分为斑块、中膜、钙化和外膜,对各区域之间进行细胞通讯分析。作者发现钙化周围区域存在与核富集相关的病变,这与正常介质不同(图 3A)。作者将钙化周围的核富集区域以及远离钙化的正常核形态区域定义为钙化相邻区域和非钙化相邻区域,并将其映射到空间降维图上(图 3B和C)。在相邻区域和非相邻区域中鉴定标志物,对标志物基因进行富集分析。钙化相邻区域中,趋化因子、erk1/2功能功能激活。同时,还富集到了苯丙氨酸通路(图 3D和E),可能导致苯丙氨酸的产生。钙化区域中平滑肌细胞减少,T细胞增加,相邻区域中巨噬细胞增加。
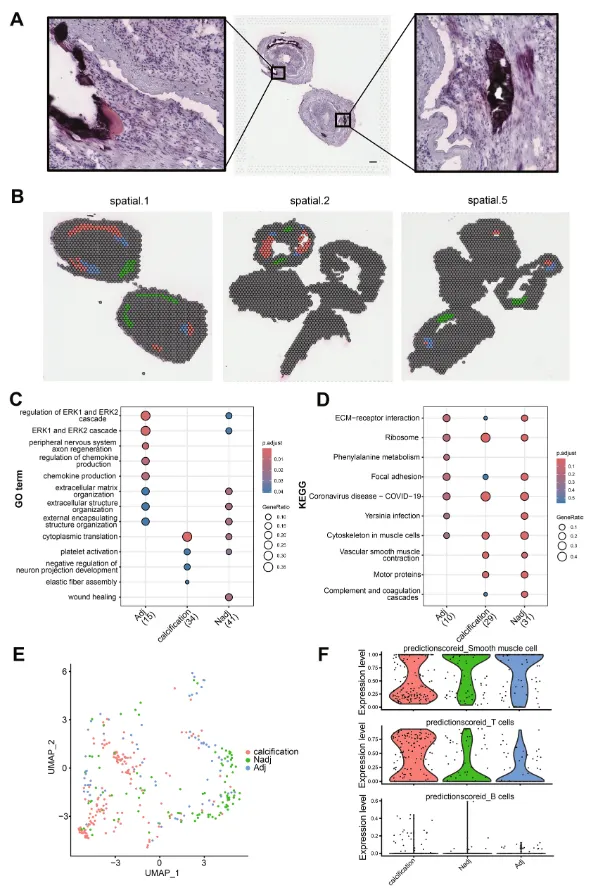
图3:钙化及钙化邻近区域特征
6. 钙化平滑肌细胞的定义以及驱动平滑肌细胞表型转化的转录因子调节网络的构建
血管钙化是糖尿病血管疾病的重要病理特征,为评估各种细胞类型在血管钙化进展中的作用,作者基于GWAS分析获得了与钙化相关基因(图4A和B)。结果表明,平滑肌细胞和成纤维细胞的基因评分较高(图4D),由此得出结论,平滑肌细胞和成纤维细胞是参与血管钙化的主要细胞。血管钙化的核心过程主要是由平滑肌细胞向成骨性平滑肌细胞转化。
7. 平滑肌细胞亚群的定义
4号、6号和8号簇为收缩性平滑肌细胞,这些簇中MYH11高表达。6号簇为CXCL3+平滑肌细胞,介导趋化作用,9号簇为APOE +平滑肌细胞,为泡沫状平滑肌细胞。3号簇为IGFBP2+平滑肌细胞,为合成性平滑肌细胞,是平滑肌细胞表型转化的中间形式(图 4)。基于经典钙化基因的鉴定以及经典成骨细胞相关基因(RUNX2、SPP1、SP7、IBSP和BGLAP)的多基因评分,将成骨细胞样平滑肌细胞鉴定为IGFBP2+平滑肌细胞的一部分(图 4J)。作者在空间转录组上验证了经典钙化基因的表达(图 4E-I),发现RUNX2、SP7、IBSP和BGLAP在一些血管钙化区域的边缘也高表达(图 4K-P)。
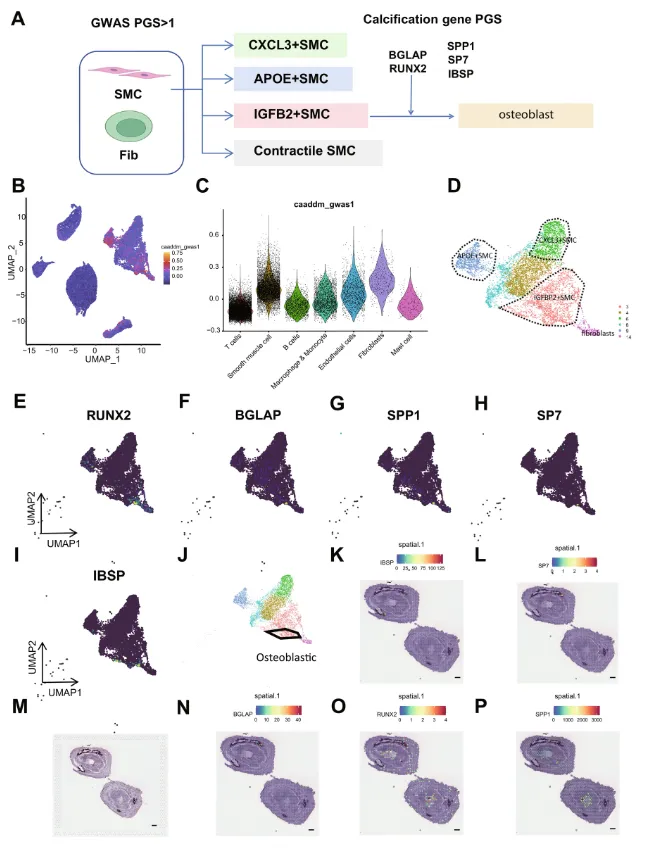
图4:钙化细胞的定义和数据验证
8. 平滑肌细胞表型转化趋势及根源的定义
利用TFvelo(基于转录调控的RNA速度推理方法)和Monocle3(拟时序分析)等工具分析了平滑肌细胞的表型转化趋势,并定义了平滑肌细胞的根细胞。研究发现,平滑肌细胞在糖尿病血管病变中可以转化为多种不同表型的细胞,包括促炎症趋化平滑肌细胞、类巨噬细胞平滑肌细胞、泡沫样平滑肌细胞以及成纤维细胞/软骨细胞样平滑肌细胞。此外,研究还通过TRRUST数据库和DoRothEA(转录因子活性预测工具)方法,识别了可能驱动这些表型变化的转录因子,为理解平滑肌细胞在糖尿病血管钙化中的作用提供了新的见解。
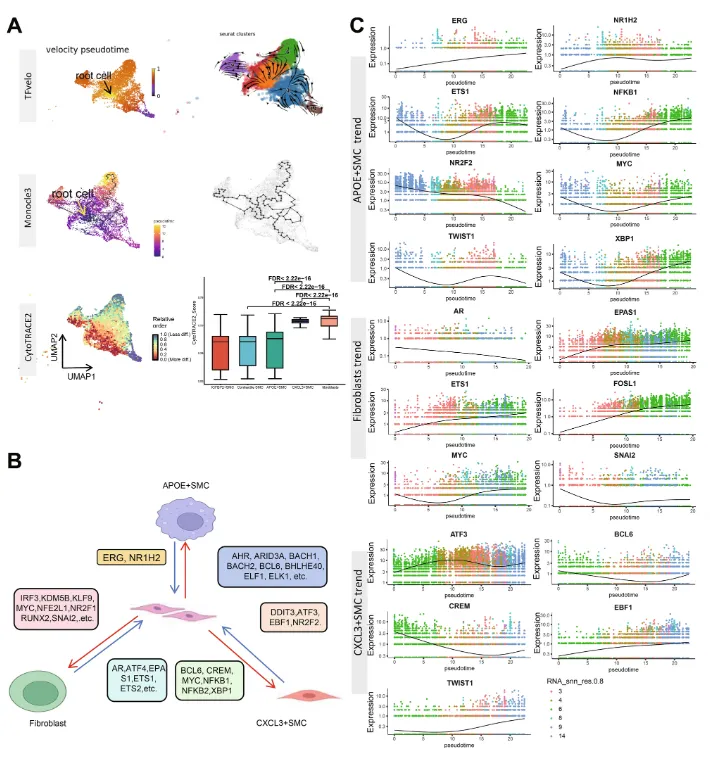
图5:平滑肌细胞的表型转化和驱动基因
9. 糖尿病中的代谢激活网络和代谢重编程
作者通过比较不同血管的代谢途径,发现了血管组织特异性的代谢途径。α-亚麻酸和亚油酸代谢在外膜中富集,叶酸生物合成在钙化区域中特异性表达,O-糖链生物合成在斑块中特异性表达,初级胆汁酸生物合成在斑块中特异性表达。某些途径,例如花生四烯酸代谢在斑块和外膜中共表达(图 6A)。作者通过整合基因表达和富集的代谢途径(跨组织结构) 以及通过空间代谢组学鉴定出的代谢物,绘制了糖尿病血管代谢激活网络(图 6B)。为验证这些代谢途径的激活情况,作者对已知基因的表达和代谢水平进行了蛋白质水平验证(图 6C)。我们选择了具有空间分布特征和细胞特征的基因进行验证,确认了ALDH1B1、NDUFA4L2、SDS、SCD、FBP1和PLA2G2A等基因在特定细胞类型中的表达与糖尿病血管病变的代谢途径激活相一致。
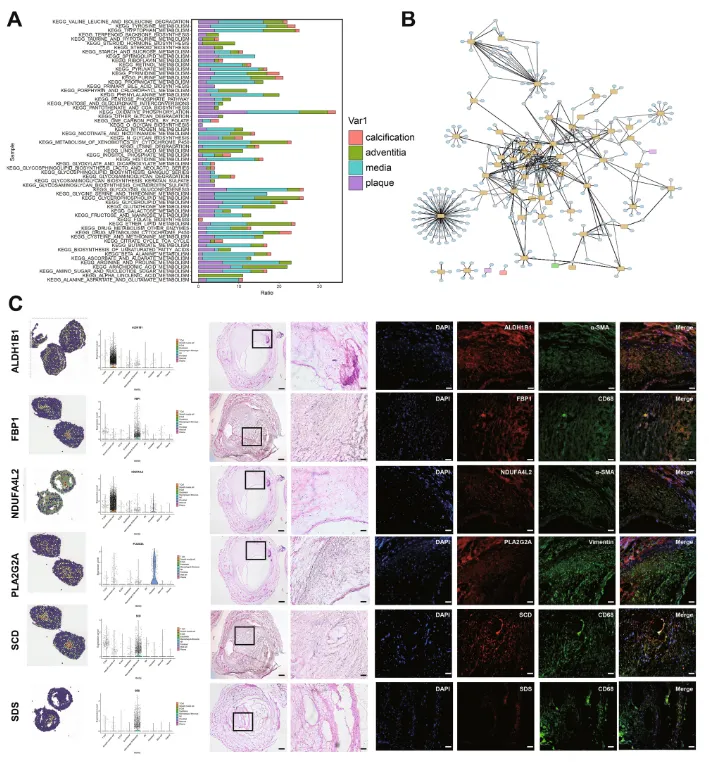
图6:代谢途径的激活和验证
作者为进一步探究糖尿病血管中的代谢重编程,引入了GSE250283数据集的差异表达分析,发现糖尿病患者血管中CYP27A1和HNMT的表达高于健康人(图 7A)。通过比较糖尿病截肢者和非糖尿病(车祸)截肢者的组织切片,发现尽管羟甲基转移酶(HNMT)和细胞色素P450 27A1(CYP27A1)的平均光密度(AOD)在两组间无显著差异,但阳性区域面积有显著区别,表明这两种蛋白在糖尿病血管中的表达更广泛。
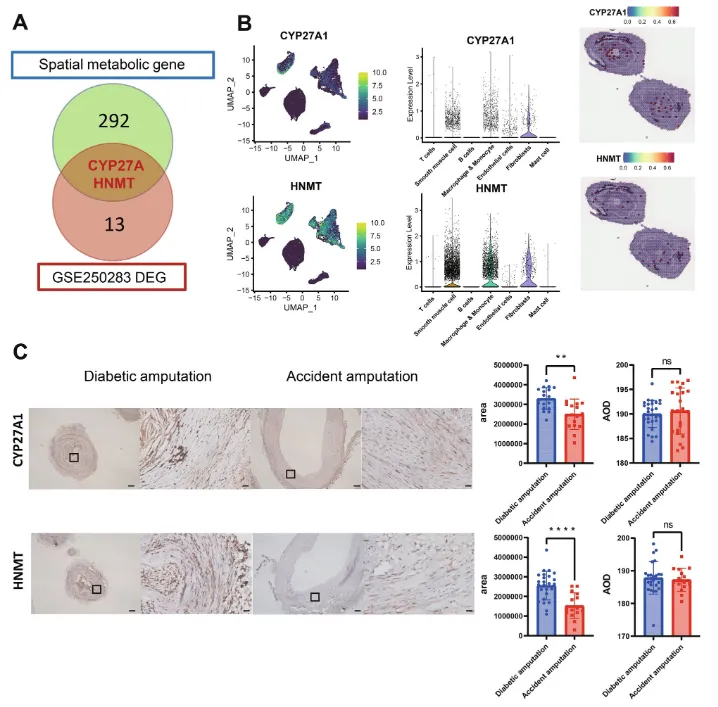
图7:基因的代谢重编程和验证
研究结论
作者通过构建糖尿病大血管病变的多组学图谱,揭示了血管钙化的特征、平滑肌细胞的表型转化趋势以及平滑肌细胞表型转化的转录驱动网络。作者从整合转录组和代谢组的角度,展示了糖尿病血管中激活的代谢通路以及参与糖尿病代谢重编程的关键基因。作者的研究为代谢相关药物的应用提供更精确的指导,并为平滑肌细胞表型转化和代谢重编程的进一步研究提供基础。
小欧推荐
作者创新性的对糖尿病患者胫前动脉组织样本进行单细胞转录组测序、空间转录组测序和空间代谢组检测,首次构建了整个胫前动脉的空间多组学图谱,揭示了糖尿病大血管病变血管钙化特征、平滑肌细胞表型转化网络,结合转录组和代谢组证明了糖尿病血管中激活的代谢途径以及参与糖尿病代谢重编程的关键基因,并采用了公共数据集和蛋白质组学技术对研究结果进行了验证。空间多组学检测创新性高,能够更加全面快速对研究的关键机制进行分析,结合简单的验证手段就能发表高质量论文~是科研工作者的好帮手~
原文链接:
PMID: 39395983 DOI: 10.1186/s12933-024-02458-x






