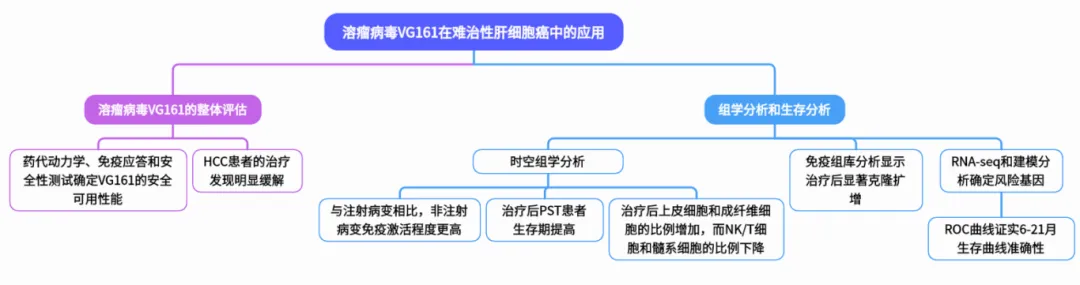
2025年3月19日,浙江大学梁廷波团队在Nature(IF=50.5)上发表题为“Oncolytic virus VG161 in refractory hepatocellular carcinoma”的研究论文。作者发现,溶瘤病毒VG161在难治性肝细胞癌患者中表现出良好的安全性和显著的抗肿瘤活性,有望成为三线治疗难治性肝细胞癌的有效选择,并为溶瘤病毒免疫疗法的发展提供了新的方向。本项目由欧易生物提供常规转录组测序、单细胞转录组测序、单细胞免疫组库测序及空间转录组测序等服务内容。
发表期刊:Nature
影响因子:50.5
样本情况:
多中心I期临床试验:44名患者,剂量递增阶段(11名患者)和剂量扩展阶段(33名患者);
单细胞测序:1例HCC患者的手术标本,4例HCC患者的活检样本(给药前n=4,给药后n=4);
空间转录组测序:1例HCC患者的手术标本。
技术路线:
肝细胞癌是一种危及生命的恶性肿瘤,在二线治疗失败后,治疗选择有限。溶瘤病毒选择性地在癌细胞中复制和溶解,释放新抗原,刺激全身抗肿瘤免疫,提供了一种潜在的治疗选择。
作者展示了一项多中心I期临床试验的结果评估VG161在晚期肝癌患者中的安全性和有效性,发现VG161耐受性良好,没有观察到剂量限制毒性,此外,以前对检查点抑制剂治疗敏感的患者,VG161治疗的疗效增强。本研究中作者开发了一个基于差异表达基因的疗效预测模型,该模型成功识别了可能受益于VG161的患者,并预测了总生存期的延长。
患者登记情况
从2021年4月8日至2023年11月21日,作者在3个参与中心招募了44名患者,该队列被分为剂量递增阶段(11名患者)和剂量扩展阶段(33名患者)。所有参与者均被纳入安全性分析,只有完成了至少一项肿瘤评估的患者才被纳入疗效分析。截至2024年1月12日的数据截止日期,中位随访期为7.0个月。
药代动力学和药效学数据
对处于剂量增加阶段的患者肿瘤内注射VG161,VG161在给药后24小时的不同时间点在血液中可检测到,但之后下降到无法检测到的水平。在尿液样本、粪便或唾液样本中未检测到病毒脱落。
作者检测了口服抗乙肝药物是否影响VG161的疗效。患者分为服用抗病毒药物(n=6)和未服用(n=5),包括8例肝细胞癌(HCC)患者和3例肝内胆管癌(ICC)患者。两组间血液中VG161病毒DNA浓度无显著性差异。
接着,作者检测了恩替卡韦是否对溶瘤病毒的复制产生影响。构建了一个异种移植小鼠模型,这些药物并没有明显影响VG161杀死Hep3B细胞的能力或其在这些细胞中的复制能力。
免疫应答
剂量增加患者的血液中淋巴细胞亚群、血浆细胞因子和T细胞免疫标志物均有显著改变。CD3+,CD4+,CD8+等细胞浓度在每次给药24小时后最初下降,在第15天和第28天恢复到或超过基线水平。TNF和IFNγ水平在给药24小时后升高,之后恢复到基线水平。免疫相关标志物(PD-L1、PD-1等)的比例在给药后最初增加,并在第15天和第28天恢复正常。
安全性特征
VG161在整个研究过程中显示出了良好的安全性,且没有剂量限制毒性(DLTs),在剂量递增阶段未达到最大耐受剂量。最常见的与治疗相关的不良事件(TRAEs)包括发热(86.4%的患者)、低白蛋白血症和贫血(每65.9%)、淋巴细胞计数下降(84.1%)、血小板计数(52.3%)、中性粒细胞计数(52.3%)和白细胞计数(70.5%)。淋巴细胞计数减少是最常见的3级TRAE。值得注意的是,一名患者经历了严重的TRAE(面瘫),在适当的医疗干预后解决。没有4级TRAE或治疗相关的死亡报告。
对HCC患者的疗效观察
由于ICC患者数量较少(n = 4),作者重点对37例患者进行评估。根据改良的实体肿瘤缓解评价标准(mRECIST),7例患者获得部分缓解,17例患者病情保持稳定。客观有效率(ORR)为18.92%,疾病控制率(DCR)为64.86%。图1描述了目标病变大小与基线的变化和治疗持续时间。为了客观评价VG161的疗效,作者排除了2例仅一线治疗失败的患者和1例死于COVID-19的患者。在其余34例患者中,6例获得部分缓解,16例病情保持稳定,ORR为17.65%,DCR为64.71%。
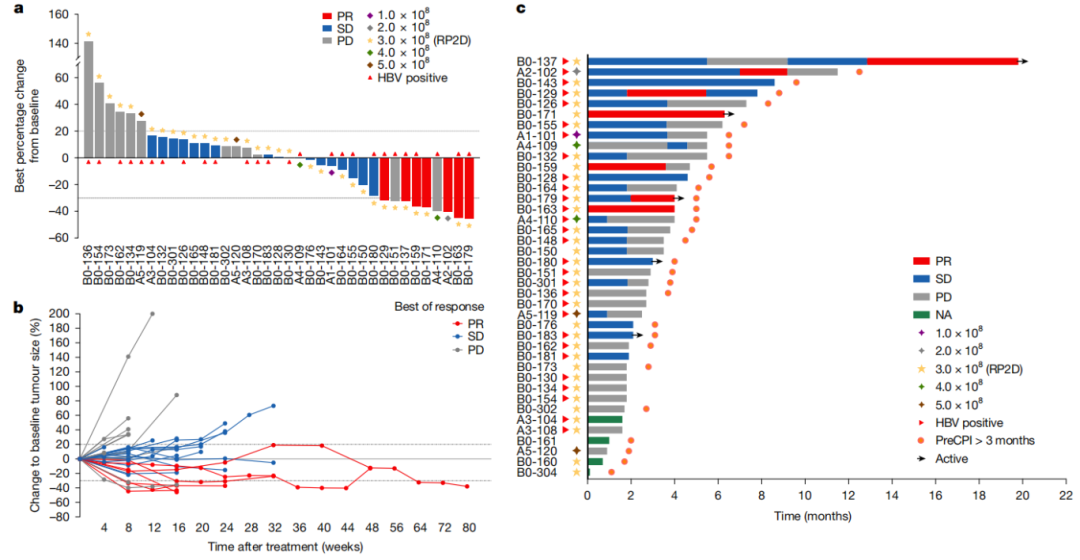
图1 基于mRECIST的治疗反应
HCC对VG161的治疗反应
经VG161治疗的HCC患者表现出显著的治疗反应,主要以治疗病变的坏死为特征。例如,1例患者在一个治疗周期后的计算机断层扫描(CT)上显示出目标病灶没有明显的增强(图2a)。活检后的病理评估证实病变内有大量坏死,病变最初扩大,随后是大量坏死。CT扫描显示,注射和非注射病灶的大小最初增加,但随着治疗的继续,核心明显坏死,最终接近几乎完全坏死(图2b)。
作者对1例HCC患者的手术标本进行了单细胞RNA测序(scRNA-seq)和空间转录组分析,研究了非注射病变对VG161的反应优于注射病变的原因(图2e)。将空间转录组数据与scRNA-seq结果相结合,发现注射病变富含上皮细胞,而未注射病变有更高的NK/T细胞和成纤维细胞浸润(图2g,h)。stLearn空间配体-受体分析显示非注射病变中细胞相互作用的增强,特别是在NK/T细胞之间,表明与注射病变相比免疫激活更高(图2i,j)。
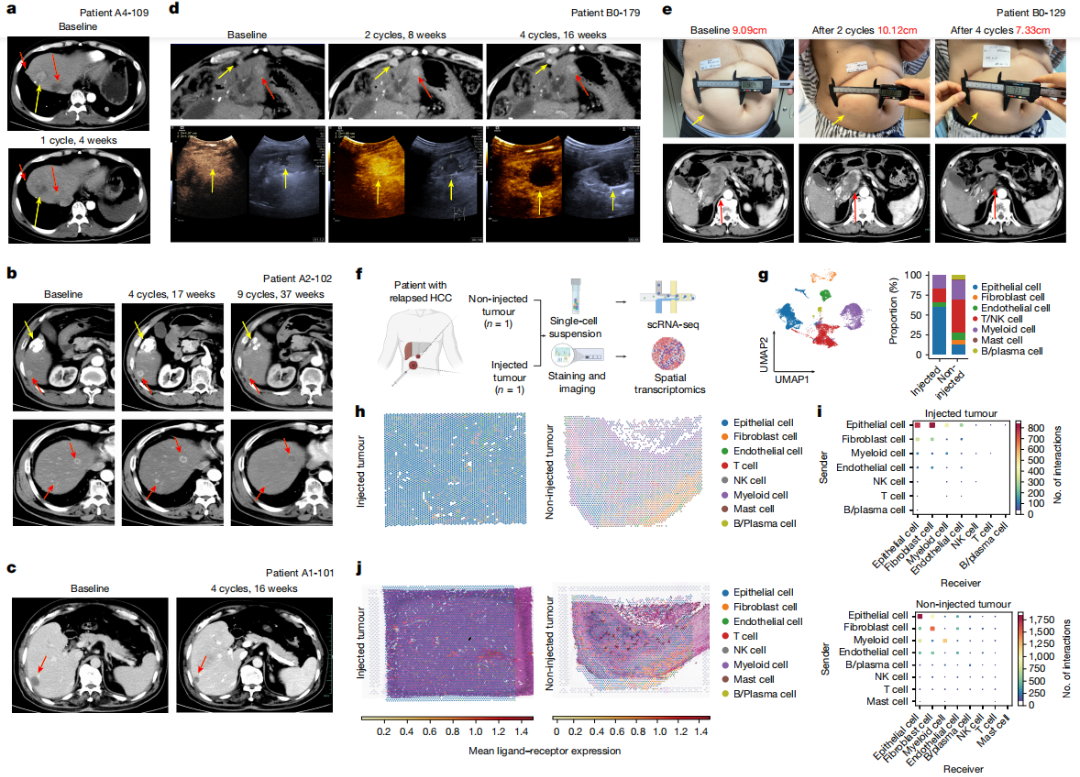
图2 应答患者的代表性肿瘤反应数据
生存分析
对37例患有可评估肿瘤的HCC患者进行了生存分析。中位无进展生存期(PFS)为2.9个月,总生存期(OS)为12.4个月(图3a,b)。排除2例仅一线治疗失败的患者和1例死于COVID-19的患者后,中位PFS和OS分别为2.8个月和9.40个月(图3c,d)。6个月和12个月的生存率分别为80.2%和47.8%。与入组前接受CPI治疗3个月或更少的患者(PreCPI>3m)相比,22例患者的PFS和OS显著延长(PreCPI≤3m)。该亚组的中位PFS为3.6个月对1.8个月(图3e),中位OS显著延长(17.30个月对7.40个月;图3f)。VG161治疗后接受全身治疗(PST)的患者生存期也有所提高(图3h)。口服抗乙型肝炎病毒(HBV)对生存结果的影响评估显示,使用这些药物和未使用这些药物的患者之间的中位PFS或OS没有显著差异(图3i,j)。VG161治疗后的PreCPI >3 m和PST是影响OS的显著自变量(P = 0.02)。
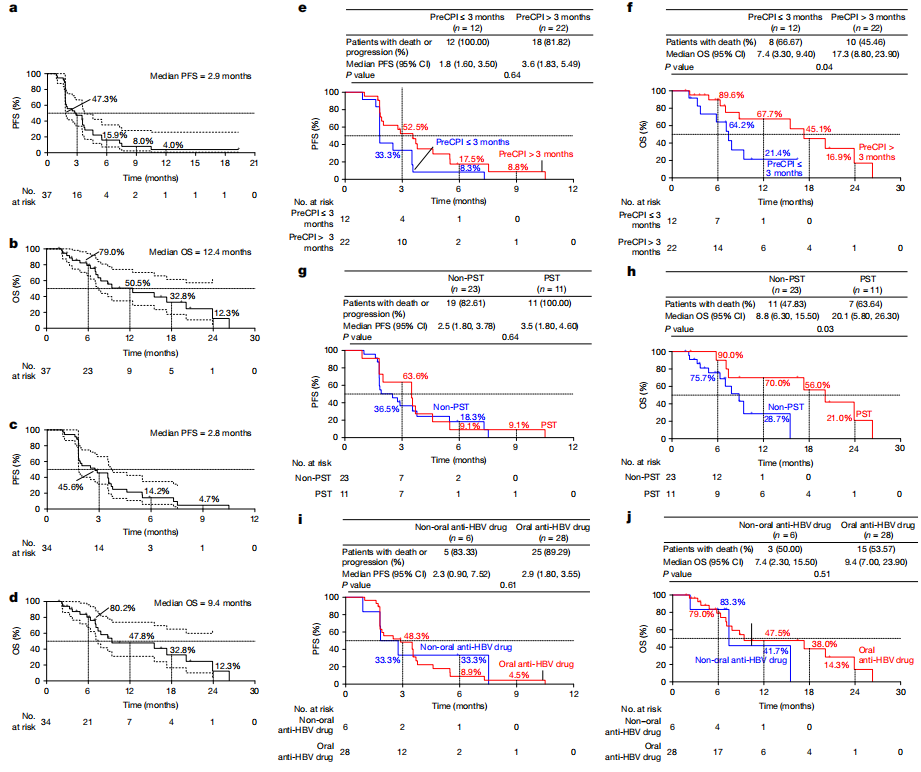
图3 基线开始的Kaplan-Meier曲线
VG161处理下的TME动态研究
对4例患者的活检样本使用单细胞免疫组库测序,分析VG161对HCC肿瘤微环境(TME)的影响(图4a)。鉴定出4个上皮细胞和成纤维细胞簇,1个内皮细胞簇,9个NK/T细胞簇,12个髓系簇,1个肥大细胞簇和2个B/浆细胞簇(图4b,c)。治疗后,上皮细胞和成纤维细胞的比例增加,而NK/T细胞和髓系细胞的比例下降(图4d-f)。
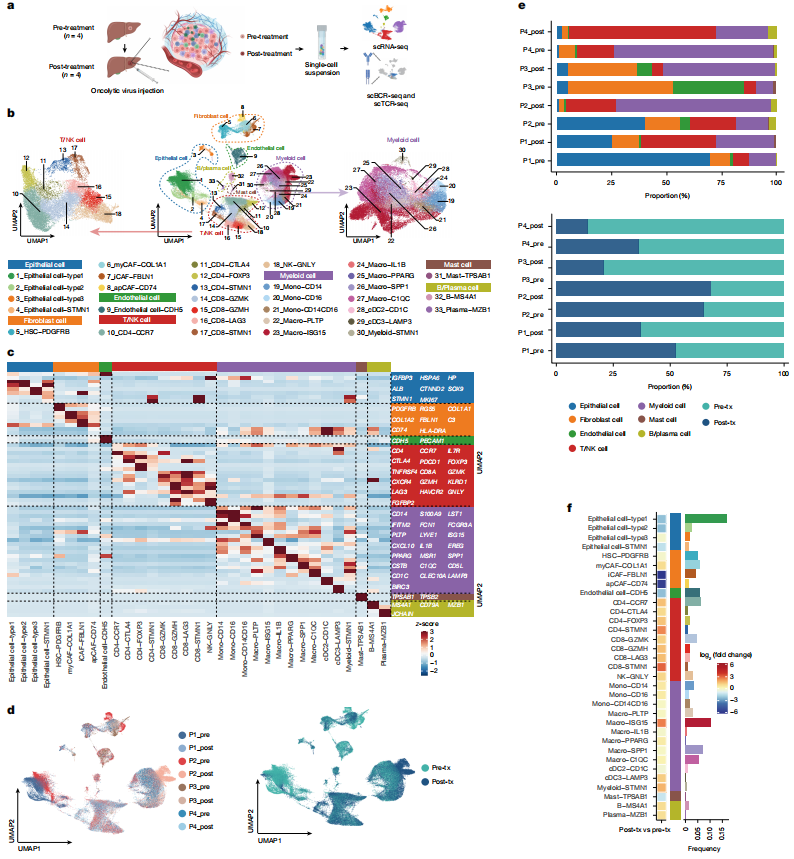
图4 VG161治疗后TME免疫景观的变化
T细胞受体分析显示,治疗后有显著的克隆扩增,特别是在CD4-CCR7和CD8-GZMH亚群中,表明有强大的T细胞反应(图5a,b)。相比之下,scBCR-seq在处理前和处理后组之间表现出克隆扩增的微小差异(图5a,b)。治疗后免疫检查点基因表达的增加(图5c),表明肿瘤对CPI的敏感性增强。同样,多重免疫荧光证实了VG161给药后CD3和CD8 T细胞的浸润增加,突出了TME中VG161驱动的免疫原性转移(图5e)。
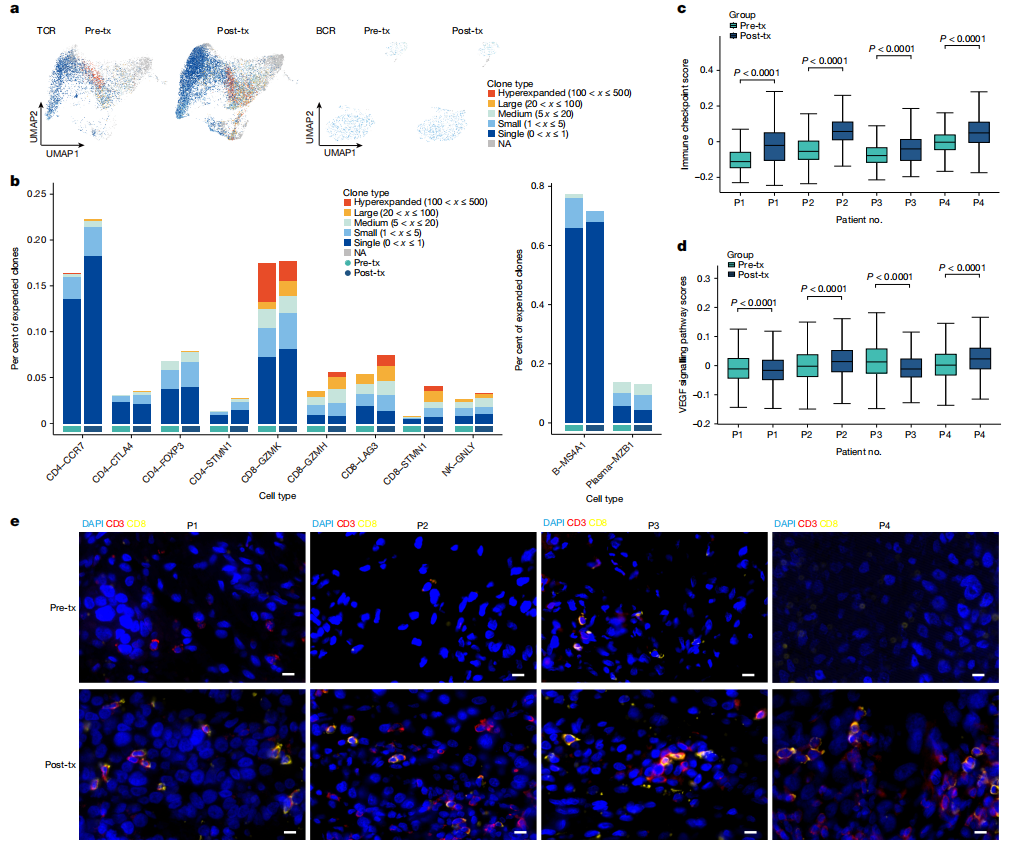
图5 VG161治疗可调节TME,并增强肿瘤中的T细胞浸润
基因组学洞察和预测建模
对27例患者的基线肿瘤样本进行了分析,不包括4例ICC患者、1例一线治疗失败的患者和1例死于COVID-19的患者,剩下21份HCC样本用于RNA-seq分析(图6a)。鉴定出49个上调基因和745个下调基因,并根据中位OS根据生存结果进行分类(图6b)。KEGG和GO分析显示,它们在几个功能基因类别中富集(图6d)。单因素Cox回归分析进一步确定了差异基因中的299个潜在的预后基因(图6e)。
采用LASSO Cox回归分析建立疗效预测模型,纳入5个风险基因:SEZ6、AKR1C1、LILRA5、NCKAP5和SETD9(图6f,g)。通过多变量Cox回归分析计算风险评分,验证该模型,确定NCKAP5和SETD9为显著的独立预测因子(图6h)。采用Kaplan-Meier曲线和时间依赖性受试者工作特征(ROC)曲线评估预测准确性。根据中位风险评分将患者分为高获益组和低获益组,Kaplan-Meier曲线显示高获益组的生存率显著更高(图6i)。时间依赖的ROC曲线证实了该模型在6—21个月范围内多个时间点生存率的准确性(图6j)。
对癌症基因组图谱肝癌(TCGA-LIHC)中418例晚期HCC患者的生存数据进行了进一步测试。该分析显示,由该模型定义的高受益组和低受益组之间的生存结果没有显著差异(图6k)。为了促进临床整合,作者开发了一个病毒预测1.0模型的初始版本,并将其在线提供(https://viropredict.github.io/)。
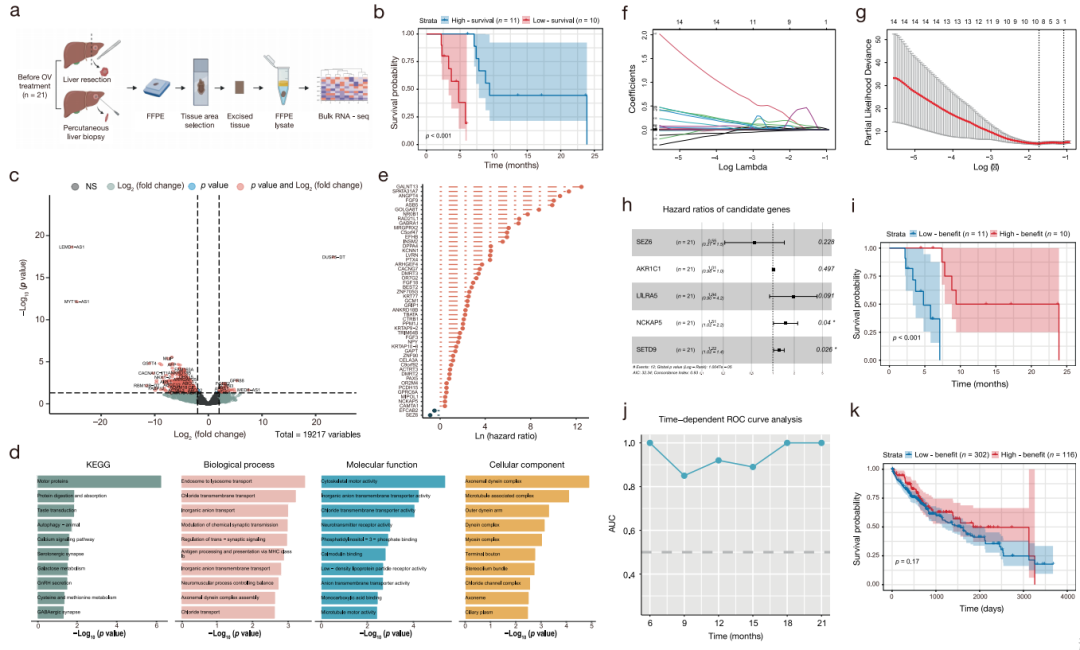
图6 晚期HCC中VG161的疗效预测模型
VG161在治疗肝癌方面具有良好的安全性,显示出显著的治疗潜力。本研究关注的是接受至少两种治疗后难治的HCC患者(三线患者)。VG161重塑了肿瘤免疫微环境,并显示出了与二线治疗相当的疗效。此外,VG161显著延长了一组亚组患者的生存期,这与作者先前的治疗反应或作者的新的疗效预测模型的预测一致,这一结果强调了迫切需要进一步的研究来扩大可能从这种治疗中受益的患者队列,在VG161给药前后整合全身治疗也突出了联合策略提高临床结果的潜力。作者的研究表明,抗乙型肝炎药物不会影响溶瘤病毒的复制和疗效。这一发现为VG161在并发乙型肝炎患者中的安全应用开辟了新的途径,提高了其临床实用性和相关性。
[1]Shen, Y., Bai, X., Zhang, Q. et al. Oncolytic virus VG161 in refractory hepatocellular carcinoma. Nature (2025). https://doi.org/10.1038/s41586-025-08717-5






