2025年2月18日,复旦大学附属肿瘤医院大肠外科蔡国响教授课题组联合北京大学生物医学前沿创新中心白凡教授课题组、美国希望之城贝克曼研究所Ajay Goel教授,在Nature Cancer 在线发表了题为“Microbiome dysbiosis, neutrophil recruitment and mesenchymal transition of mesothelial cells promotes peritoneal metastasis of colorectal cancer”的论文。该论文的第一作者为复旦大学附属肿瘤医院大肠外科李清国老师。本研究通过单细胞测序技术构建了结直肠癌腹膜转移(CRC-PM)的单细胞图谱,揭示了微生物组失调、中性粒细胞(Neu)募集和间皮细胞间质转化(MMT)在CRC-PM中的作用,为CRC-PM的治疗提供了新的治疗策略。欧易生物提供了单细胞转录组的测序工作。

发表期刊:Nature Cancer
影响因子:23.5
涉及的欧易生物服务产品:单细胞转录组测序
结直肠癌(CRC)是全球公共卫生的重大挑战,死亡率居高不下。腹膜转移(PM)是CRC最常见的转移方式之一,且CRC-PM的预后较差。目前,CRC-PM的治疗手段有限,5年存活率低,复发率高。深入研究CRC-PM的转录组变化和肿瘤微环境(TME)的重塑机制,有助于揭示其病理机制,并为开发更有效的治疗策略提供理论依据。
本研究采用单细胞转录组测序(scRNA-seq)技术,对12位患者的48例样本进行分析,构建了CRC-PM的单细胞图谱,揭示了CRC-PM进展中的细胞异质性和TME变化,并发现Neu
募集和MMT在CRC-PM中的关键作用。研究还结合了外来单细胞数据、体内外实验、微生物组学和代谢组学等多种验证手段,对scRNA-seq结果进行了全面验证。
1. ScRNA-seq图谱揭示CRC和PM的细胞异质性
作者收集了12为患者的48例样本,包括原发结直肠肿瘤(n=12)、邻近健康结肠组织(n=12)、腹膜转移组织(n=12)、邻近健康腹膜组织(n=9)、肝转移组织(n=2)和邻近健康肝组织(n=1),并通过ScRNA-seq技术构建了CRC的单细胞图谱(图1A)。通过比较各组细胞比例的变化,作者全面描述了CRC-PM中TME的重塑。研究发现,PM组中基质细胞富集,而肥大细胞和Neu减少;与健康结肠相比,CRC的TME中Neu显著增加,而与黏膜免疫相关的B细胞和浆细胞显著减少;与健康腹膜组织相比,PM的TME中成纤维细胞大量增加,而Neu和间充质干细胞缺失。这些结果表明,CRC和PM均发生了TME重塑,且肿瘤细胞从肠道转移至腹膜微环境的过程中,逐渐从“肠上皮细胞特征+炎症表型”转变为“间充质表型”。
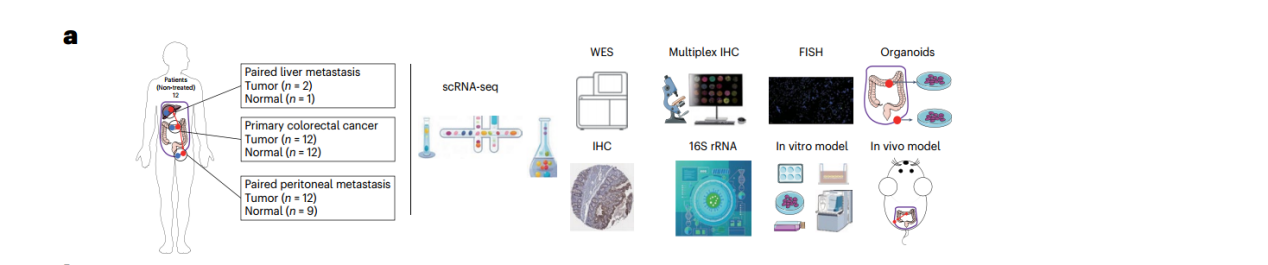
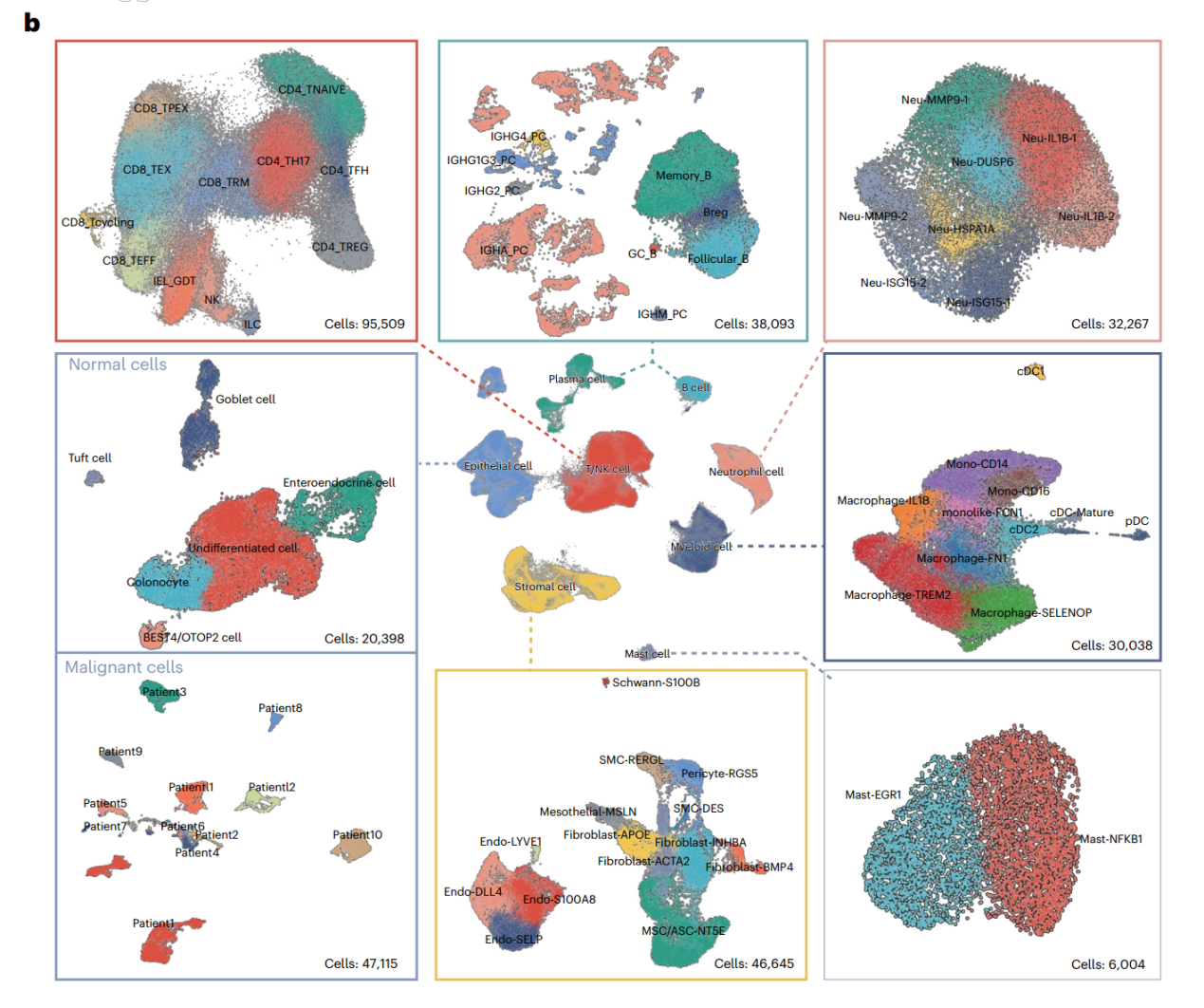
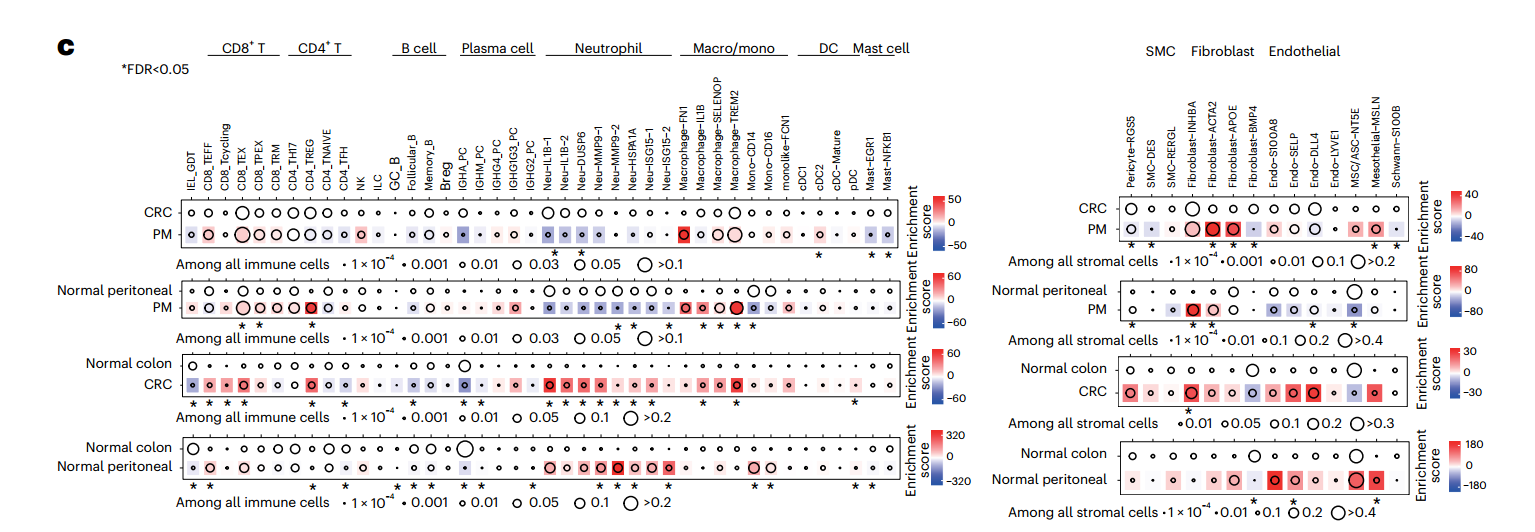
图1. CRC-PM单细胞图谱以及各组间免疫细胞和基质细胞亚群的成分变化
2. 三种恶性程序在不同患者中共享
接下来,作者重点关注了肿瘤转移的罪魁祸首—上皮细胞。作者基于12位患者24个肿瘤组织的全外显子测序数据,结合单细胞测序结果对上皮细胞进行CNV分析,构建发育树,结果显示,高比例的共享突变提示CRC的腹膜和肝转移播散相对较晚(附图2)。通过对不同上皮细胞的差异分析,发现CRC炎症特征显著升高,而PM表现出间质细胞特征。进一步通过cNMF分析,作者发现了42个恶性细胞程序,其中程序11和程序13在CRC中表达显著高于PM,而程序22则在PM中表达更高(图2)。
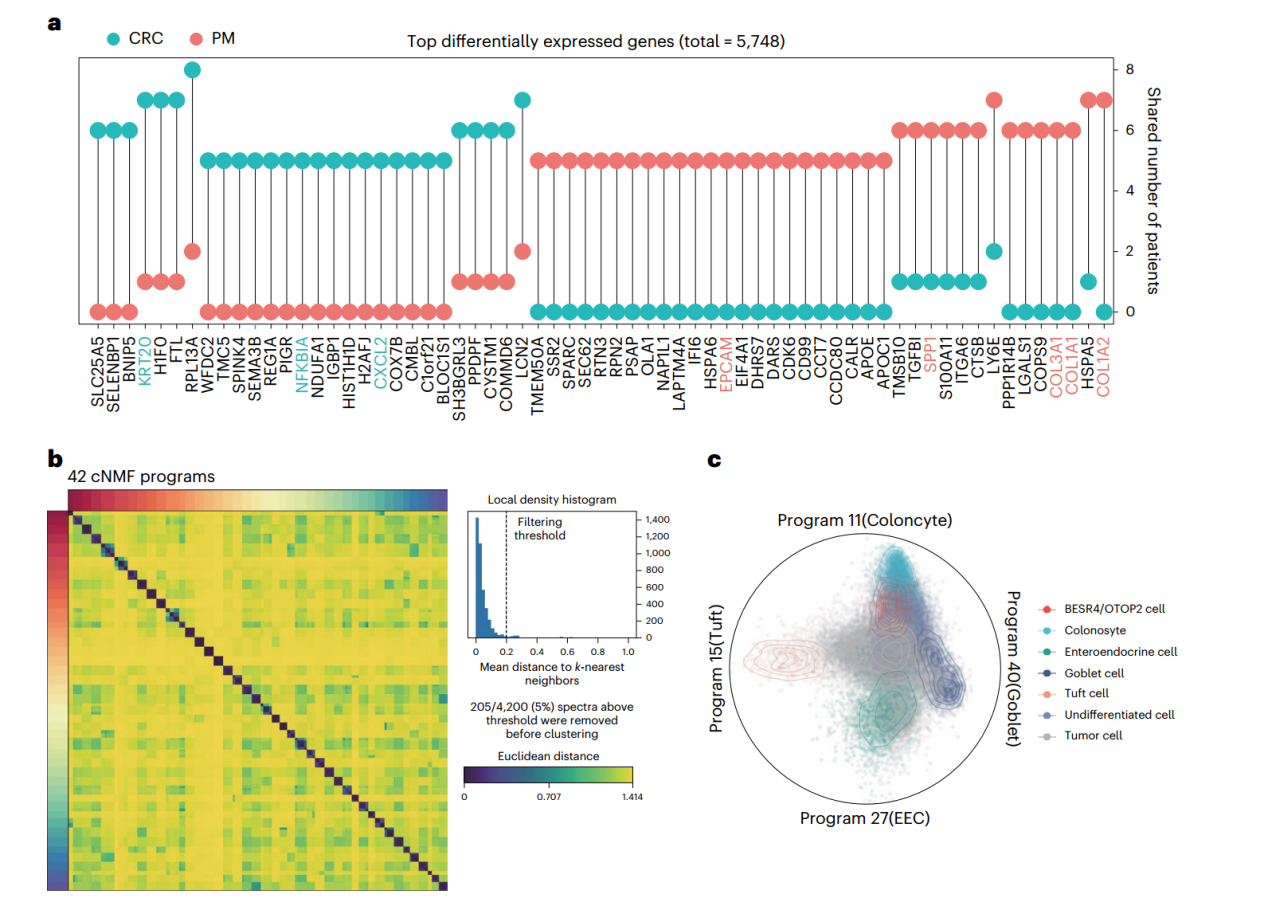
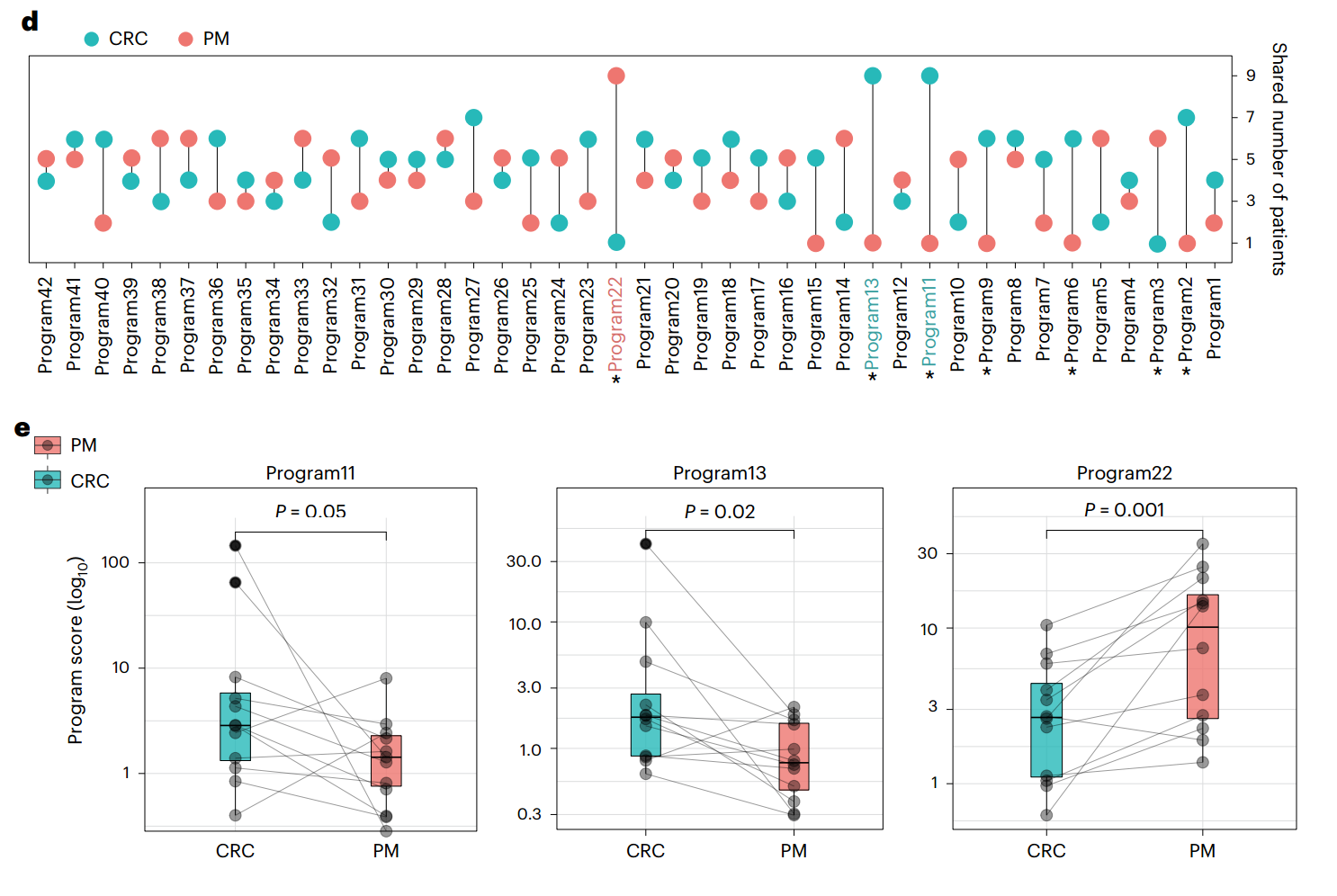
图2. 腹膜转移和结直肠癌中癌细胞的转录组差异
3. Neu在CRC中的富集与生态失调相关
作者对三个共享的恶性程序进行了深入研究。首先,在CRC中高表达的程序13中,作者发现该程序的基因集与Neu募集因子CXCL2相关,并在炎症反应相关的功能中富集。进一步分析发现,CRC微环境中Neu显著富集,而PM微环境中Neu显著减少(图3a,b)。细胞间通讯分析显示,CRC中的各细胞类型均高表达趋化因子,募集CXCR2/4⁺Neu,且CRC中Neu的富集可能与对细菌感染的自然免疫反应有关。通过FISH成像和16S rRNA基因测序验证了这一发现(图3c,e)。此外,scRNA-seq显示CRC黏膜免疫成分显著减少,并通过IF染色进行了验证(图3d)。这些结果表明,CRC肿瘤发生过程中,黏膜免疫的重塑和肠道细菌的生态失调相互作用,导致了抗菌Neu的募集。
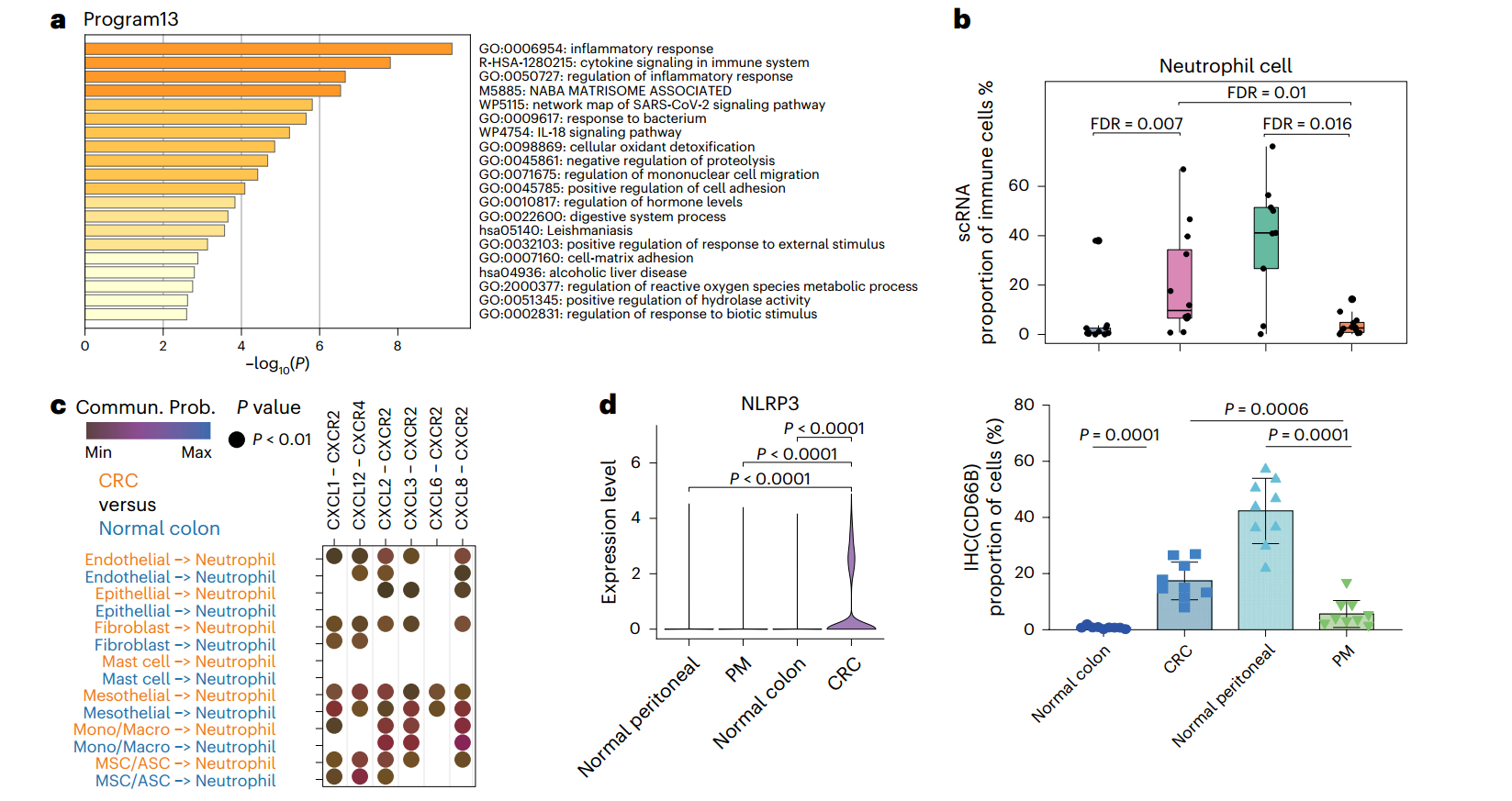
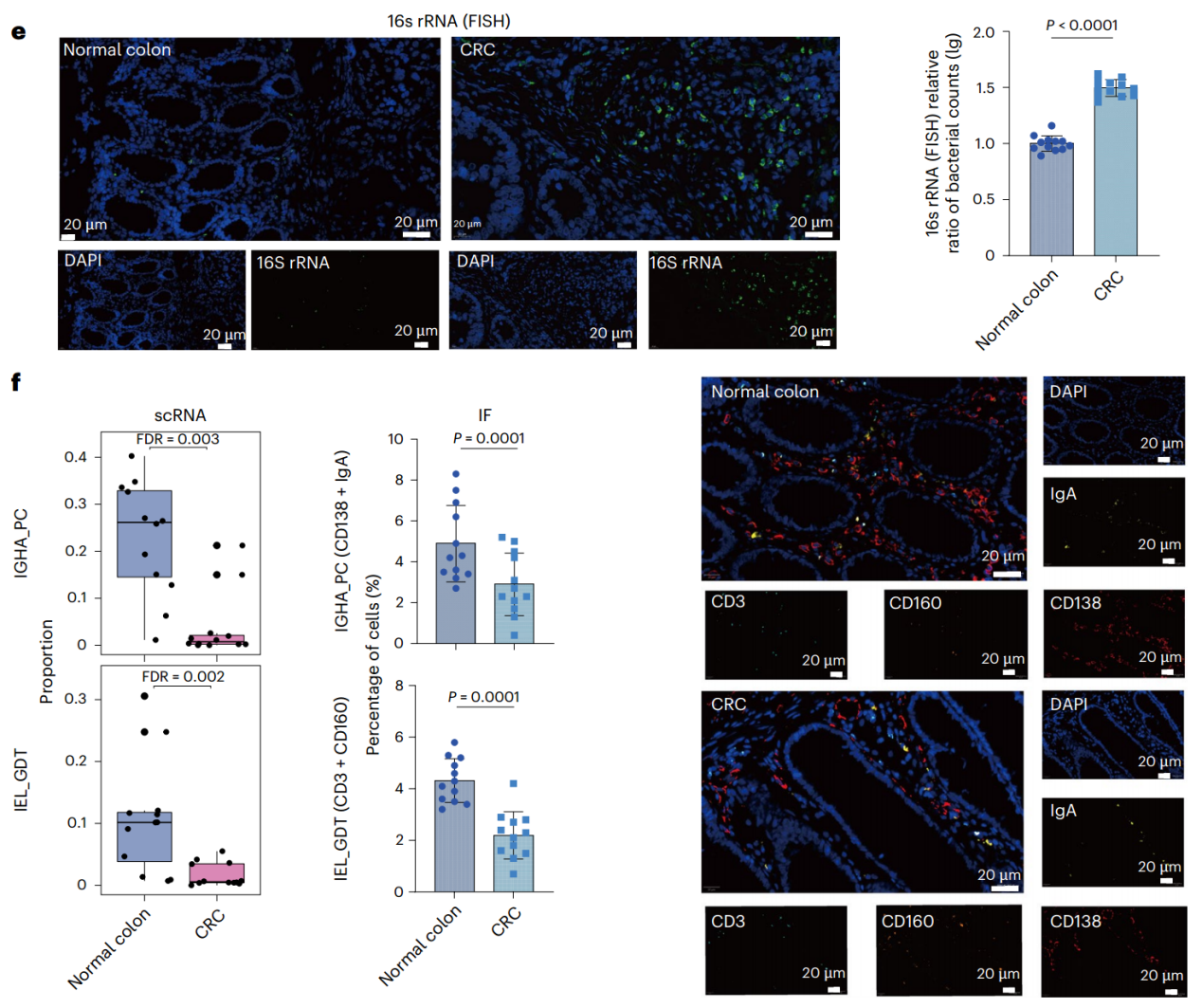
图3. Neu在CRC中的富集与生态失调相关
4. PM中的Neu耗竭是由于CXCL14的丢失
与健康腹膜组织相比,PM中Neu显著减少。CXCL14在健康腹膜组织中优先表达,主要富集于MSC/ASC簇。转移癌细胞定植后,微环境发生重塑,实验验证显示,表达CXCL14的MSCs/ASCs在健康腹膜组织中显著累积,且Neu与这些细胞非常接近(图4a-c)。综上所述,程序13在CRC和PM恶性细胞中的差异表达与Neu分布相关。Neu在CRC中的富集可归因于益生菌浸润触发的炎症反应,而在缺乏MSCs/ASCs的PM中,这些募集的Neu缺失。
5. CRC中的肿瘤Neu和PM中的抗肿瘤Neu
作者进一步研究了Neu分布的重塑对肿瘤发展的影响。scRNA-seq数据集中,作者发现了8个具有明显组织特异性偏好的Neu亚群。CRC中的Neu特异性富集于与细菌感染和经典炎症性IL4和IL13信号通路相关的通路,而健康腹膜组织中的Neu则富集于与IFN信号传导和免疫系统相关的通路(图4d,e)。体外实验发现,NFKB1过表达显著增强肿瘤细胞的增殖和迁移能力,而STAT4过表达则显著抑制这些能力。体内实验显示,注射NLRP3⁺TNFSF10⁻Neu的小鼠肿瘤显著增大,而注射TNFSF10⁺NLRP3⁻Neu的小鼠肿瘤显著减小(图4f-i)。这些结果表明,CRC中募集的Neu具有促肿瘤功能,而PM中缺失的Neu具有抗肿瘤功能,Neu的这种动态变化促进了CRC和PM的进展。
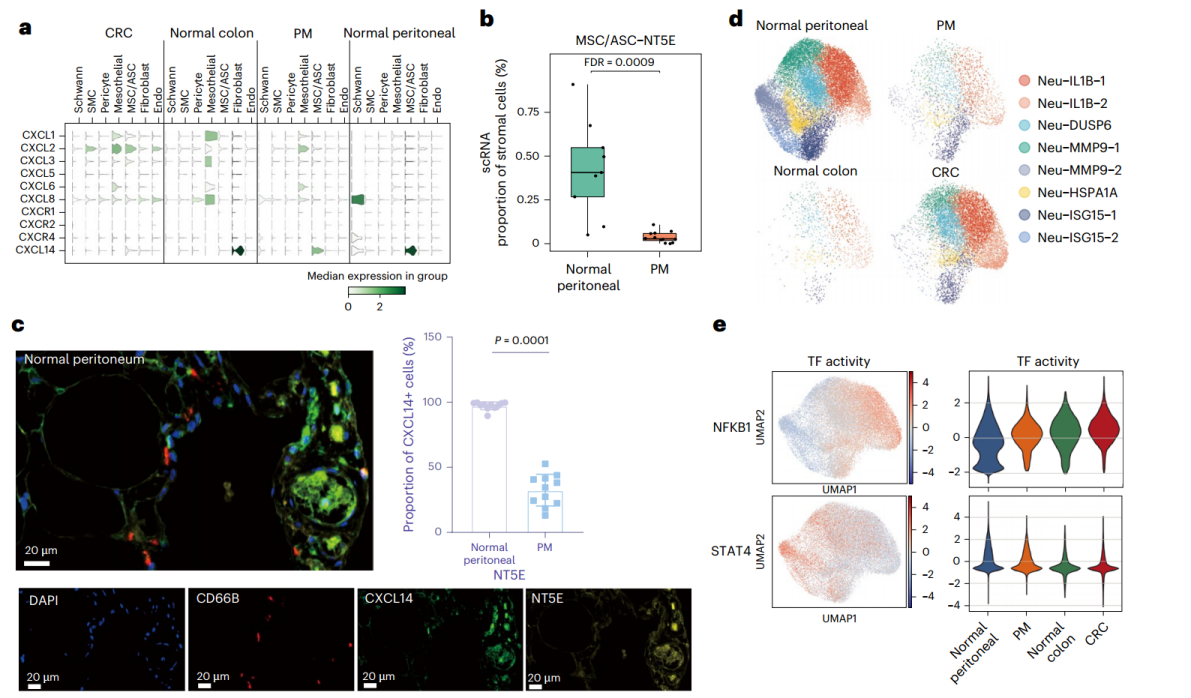
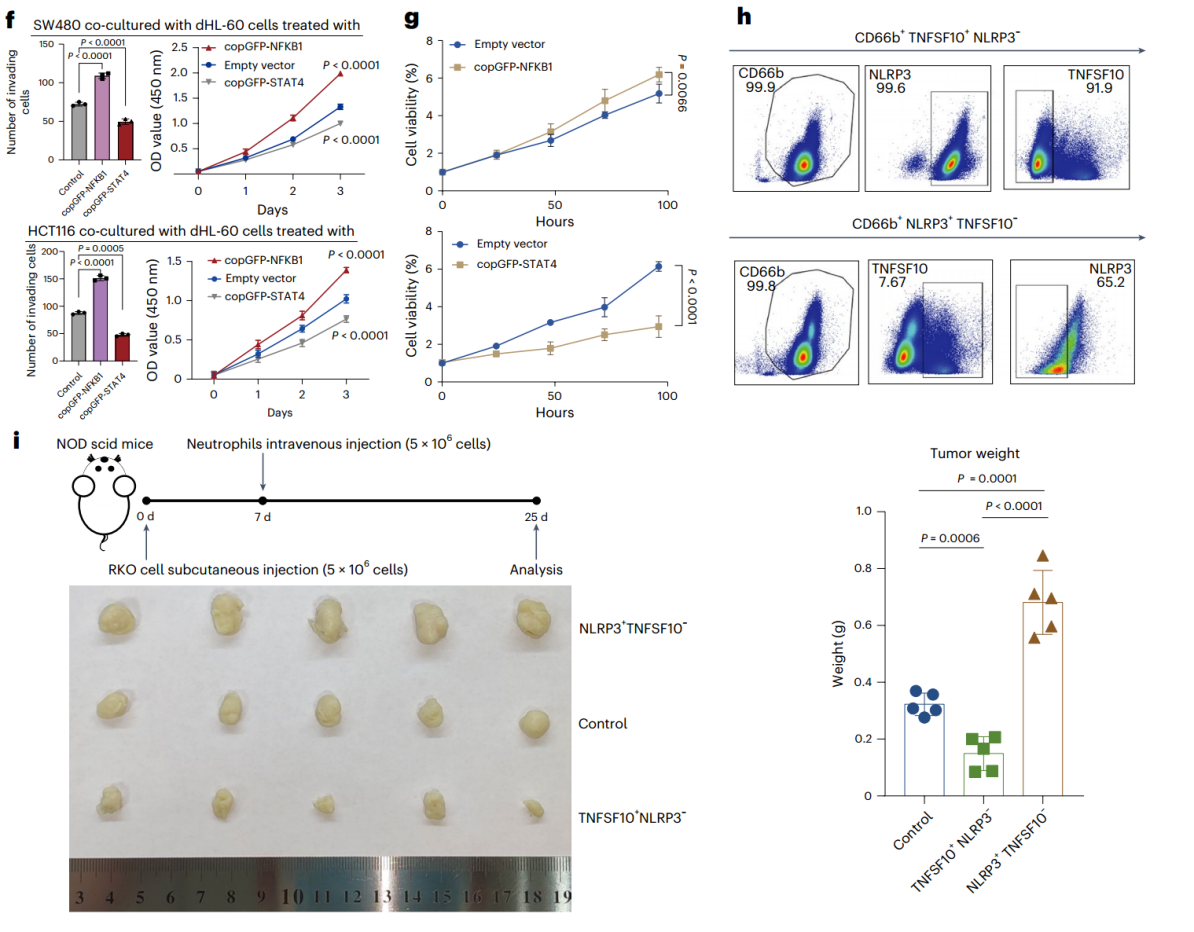
图4. PM中Neu的减少归因于CXCL14表达和Neu的多样性的丧失
6. PM中的间皮-间充质转化
在PM的恶性细胞中高表达的程序22被确定为间充质程序,富集于参与基质体和细胞外基质组织的通路和基因。与PM下调的程序11(结肠细胞程序特征)相结合,发现PM中的恶性细胞缺乏结肠细胞特征并经历上皮-间充质转化(图5a)。多个结果显示,PM恶性细胞的改变与基质细胞的重塑有关(图5b-e)。间皮细胞标志物MSLN在PM的成纤维细胞中广泛表达,而在健康腹膜组织的间皮细胞中严格表达。拟时序分析(Markov chain)显示,PM中的大部分成纤维细胞来源于间皮细胞,而健康腹膜组织中的成纤维细胞来源于MSCs/ASCs(图5f)。
进一步分析间皮细胞中的差异表达基因(DEG)、转录因子(TF)活化和通路富集,作者确定了PM中的间皮-间充质转化。具体而言,间质相关基因在PM的间皮细胞中优先表达,PM中高表达基因参与调节细胞扩张和细胞拉伸。GSVA分析表明,与健康腹膜组织相比,PM中胶原蛋白和ECM相关通路优先富集(图6a-c)。体外实验显示,CRC-PDO和PM-PDO组的MET-5A细胞形态向更间质化转变,且PM-PDO组的人结直肠癌细胞系(RKO)和永生化的人间皮细胞系(MET-5A)直接相互作用后黏附更紧密(附图6b)。这些结果表明,间皮细胞经历了MMT,且上皮细胞和间皮细胞之间的直接相互作用促进了肿瘤进展。
综上所述,程序22在恶性细胞中的差异表达与成纤维细胞的重塑有关。PMs中大量的成纤维细胞来自接受MMT的间皮细胞,取代了在健康腹膜组织中典型募集Neu的MSC/ASCs。
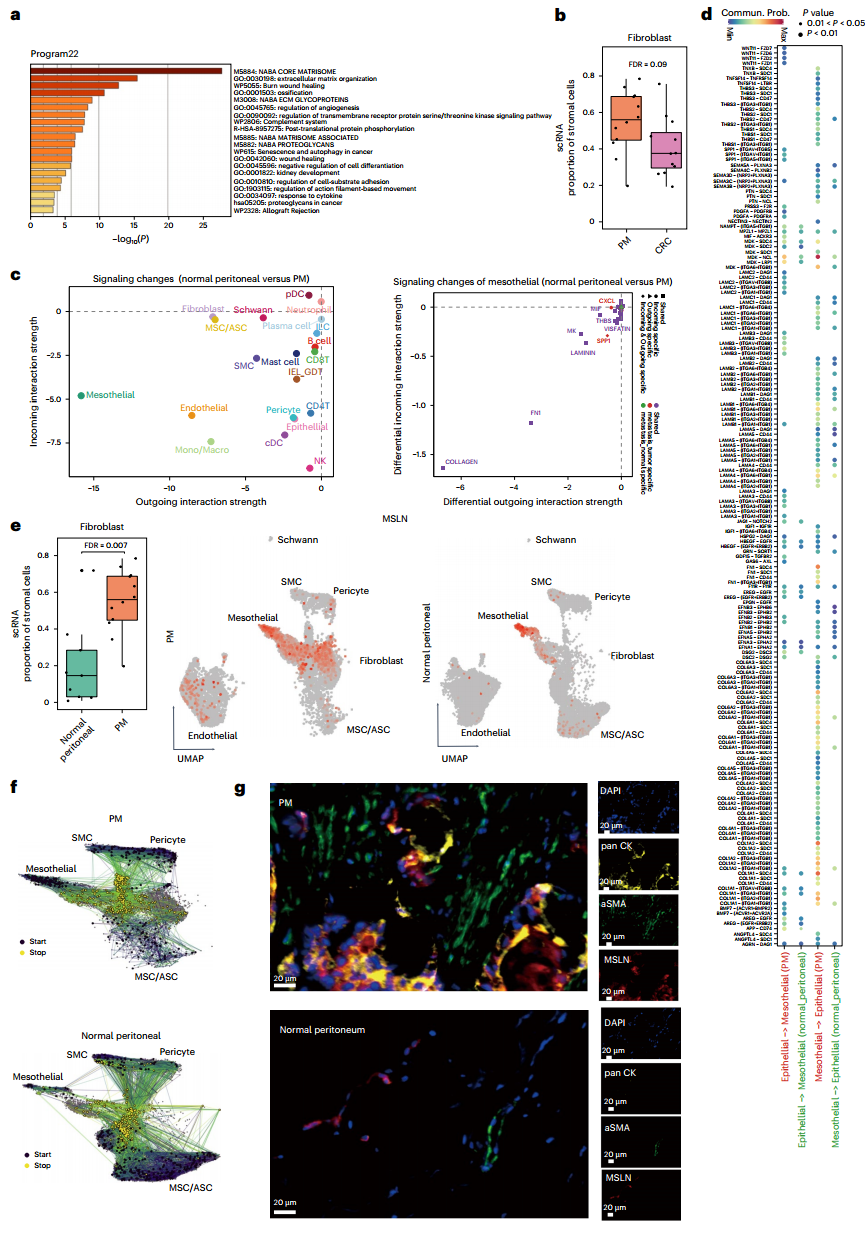
图5. 间皮-间充质转化
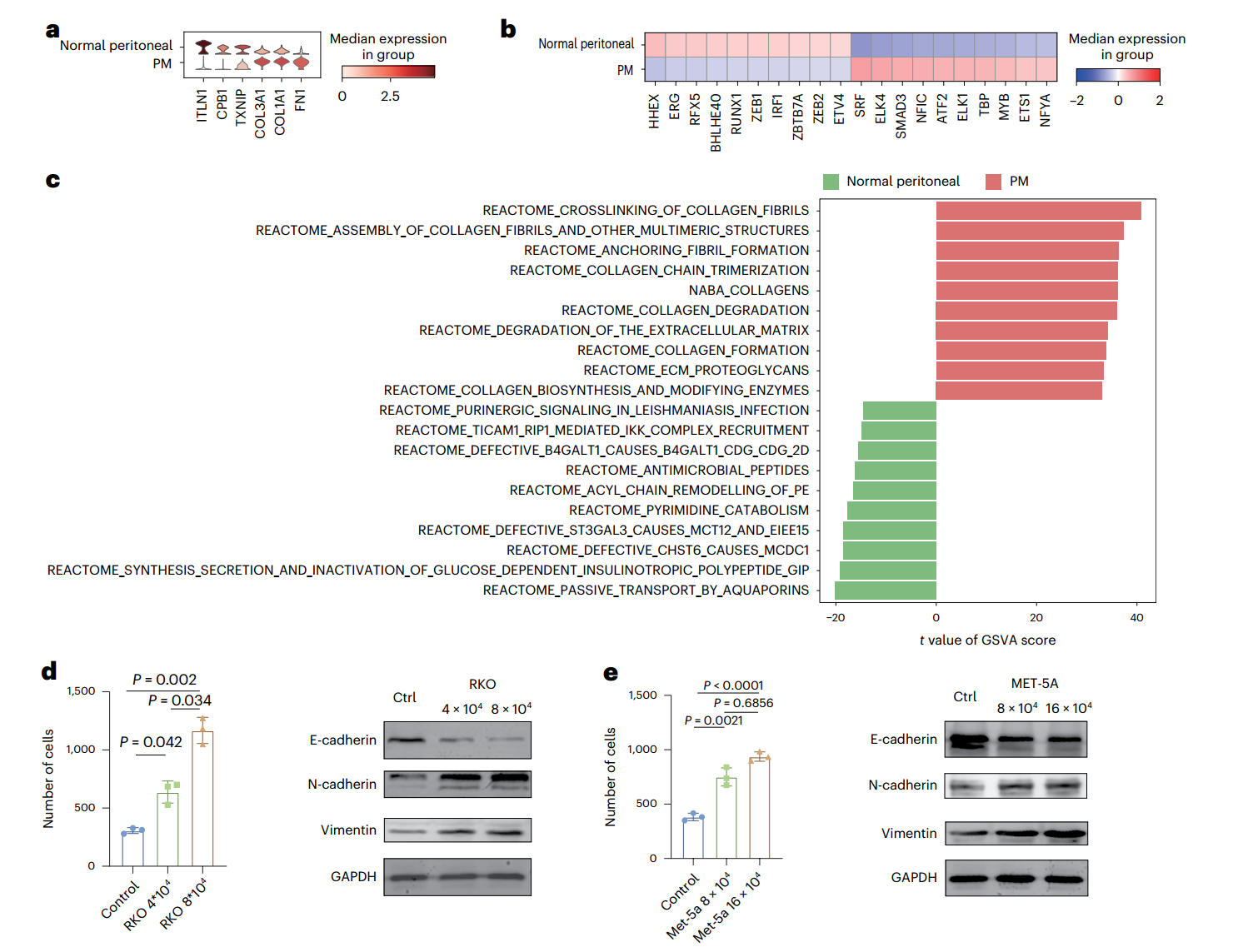

图6. 抗MSLN治疗策略抑制结直肠癌腹膜转移
7. CRC-PM可被抗间皮素抗体抑制
为了研究癌症和间皮细胞之间的相互诱导间质转化,作者使用RKO和MET-5A进行了共培养实验。研究发现RKO和MET-5A细胞中上皮标志物E-cadherin的蛋白水平降低,间质相关蛋白的蛋白水平升高,且共培养的细胞表现出更强的侵袭能力(图6d,e)。体外实验,MET-5A与两种类器官培养基Transwell共培养后发现,表现出显著的迁移能力,且PM-PDO组的迁移能力较CRC-PDO组更强。通过scRNA-seq数据集的代谢反应通路分析,结合癌细胞共培养前后的间皮细胞代谢组学,发现恶性肿瘤细胞与间皮细胞直接相互作用,共同转化为间充质状态并改变微环境,最终促进细胞增殖、侵袭和转移(图6g)。已有研究表明,使用间皮素抗体(抗MSLN)可成功抑制间皮向成纤维细胞转化。通过一系列体内外实验,作者证实靶向MSLN可能是一种有前景的抑制结直肠癌PM的治疗策略(图6h-j)。
本研究发现,微生物组失调、Neu募集和MMT在CRC-PM中发挥重要作用。CRC-PM恶性细胞的三个转录组程序发生变化,加上肿瘤微环境的重塑,创造了有利于肿瘤生长和转移的条件。通过揭示这些变化的分子机制及其调控,研究提出了抗间皮素(MSLN)的靶向治疗策略,为CRC-PM的治疗提供新的干预方法。
Li Q, Xiao Y, Han L, et al. Microbiome dysbiosis, neutrophil recruitment and mesenchymal transition of mesothelial cells promotes peritoneal metastasis of colorectal cancer. Nat Cancer. Published online February 18, 2025. doi:10.1038/s43018-025-00910-9IF: 23.5 Q1






