神经母细胞瘤是儿童最常见的致命实体瘤之一,尽管低危患者生存率较高(>95%),但高危患者五年生存率不足50%。传统放化疗及免疫治疗(如抗GD2抗体和CAR-T细胞疗法)疗效有限,主要归因于肿瘤微环境(TME)的强免疫抑制特性及肿瘤细胞的固有耐药性。TME中复杂的细胞间相互作用,包括肿瘤细胞与免疫细胞的动态对话,显著影响免疫治疗效果。γδT细胞因其MHC非依赖性、高肿瘤浸润性和强杀伤活性,成为癌症免疫治疗的潜在靶点。研究提示肿瘤细胞表面配体(如CD112和CD155)可通过与γδT细胞上的激活受体DNAM-1结合,介导免疫激活或抑制。然而,肿瘤细胞中CD112和CD155表达的异质性及其对γδT细胞的具体调控机制尚未完全阐明。本研究旨在通过单细胞与空间分析技术,揭示神经母细胞瘤中CD112和CD155表达的异质性及其与γδT细胞功能状态的关联。
2025年1月,国家儿童医学中心/首都医科大学附属北京儿童医院/北京市儿科研究所倪鑫/桂晋刚教授团队在Cancer Research上在线发表题为“Spatial and Single Cell Analyses Reveal Heterogeneity of DNAM-1 Receptor-Ligand Interactions that Instructs Intratumoral γδT-Cell Activity”的研究论文。该研究通过空间转录组学与单细胞转录组测序(scRNA-seq)联合应用,绘制神经母细胞瘤中CD112和CD155的全局表达图谱,发现二者在肿瘤内部的区域异质性与肿瘤细胞分化状态(神经元样/增殖型)及代谢特征显著相关。空间代谢组学进一步揭示CD112/CD155比值与神经元代谢通路活性的空间分布存在正相关性。通过体外共培养、蛋白质互作及动物模型验证CD155通过TRIM21介导DNAM-1泛素化降解的分子机制。这项研究强调了肿瘤-免疫交叉对话的复杂性,为肿瘤的异质性如何塑造免疫景观提供了见解。本项目中空间代谢组学研究由欧易生物提供技术支持。

 研究材料
研究材料
患者样本:91例神经母细胞瘤患者(45男/46女,年龄47.1±4.7个月)及53例健康儿童。
细胞系:SH-SY5Y、SK-N-BE2、IMR-32、CHLA-255等神经母细胞瘤细胞系。
动物模型:裸鼠皮下移植模型(SK-N-BE2-KoCD155 vs. SK-N-BE2-NC)及NOD/SCID γ小鼠原位肿瘤模型。
主要技术
空间转录组学,单细胞转录组测序(scRNA-seq),空间代谢组学
基因敲除,siRNA敲低/Crispr-Cas9敲除
流式细胞术
Co-IP
1. γδT细胞功能缺陷引发的DNAM-1下调与神经母细胞瘤肿瘤细胞的直接接触密切相关
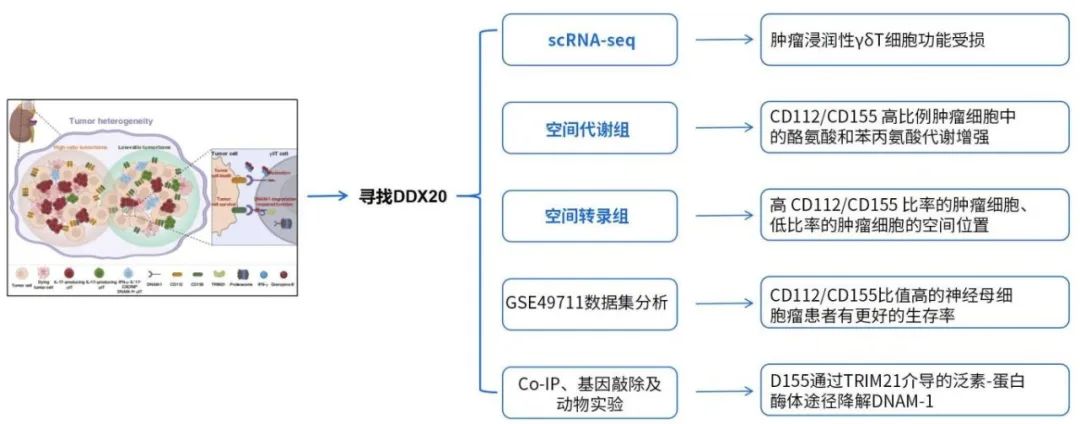
对21个原发肿瘤样本,以及来自HC的PB(n¼3)和神经母细胞瘤患者的循环T细胞进行单细胞转录组测序(scRNA-seq),共注释出11种主要细胞类型,包括肿瘤细胞、内皮细胞、成纤维细胞、雪旺细胞、肌细胞、CD4 T细胞、CD8 T细胞、γδT细胞、NK细胞、B细胞和髓系细胞。通过差异表达分析发现与循环中的γδT细胞相比,肿瘤浸润的γδT细胞的比例明显增加。肿瘤浸润性γδT细胞功能受损,免疫抑制分子,包括PD-1、TIM3和TIGIT的表达升高。与循环γδT细胞相比,肿瘤浸润性γδT细胞中DNAM-1、IFN-γ、穿孔素(Perforin)和颗粒酶B(GZMB)的表达进一步降低。
通过功能富集分析发现γδT细胞在循环与肿瘤浸润状态下的功能差异(如激活、耗竭、代谢特征)。为了进一步阐明细胞直接接触对DNAM-1调控的必要性,将体外扩增的γδT细胞与SH-SY5Y细胞共培养。直接共培养诱导了γδT细胞中DNAM-1的显著减少,而阻止直接接触的Transwell系统则没有。此外,随着SH-SY5Y细胞数量的增加,DNAM-1的减少幅度更大,这表明DNAM-1的减少与肿瘤细胞数量相关。
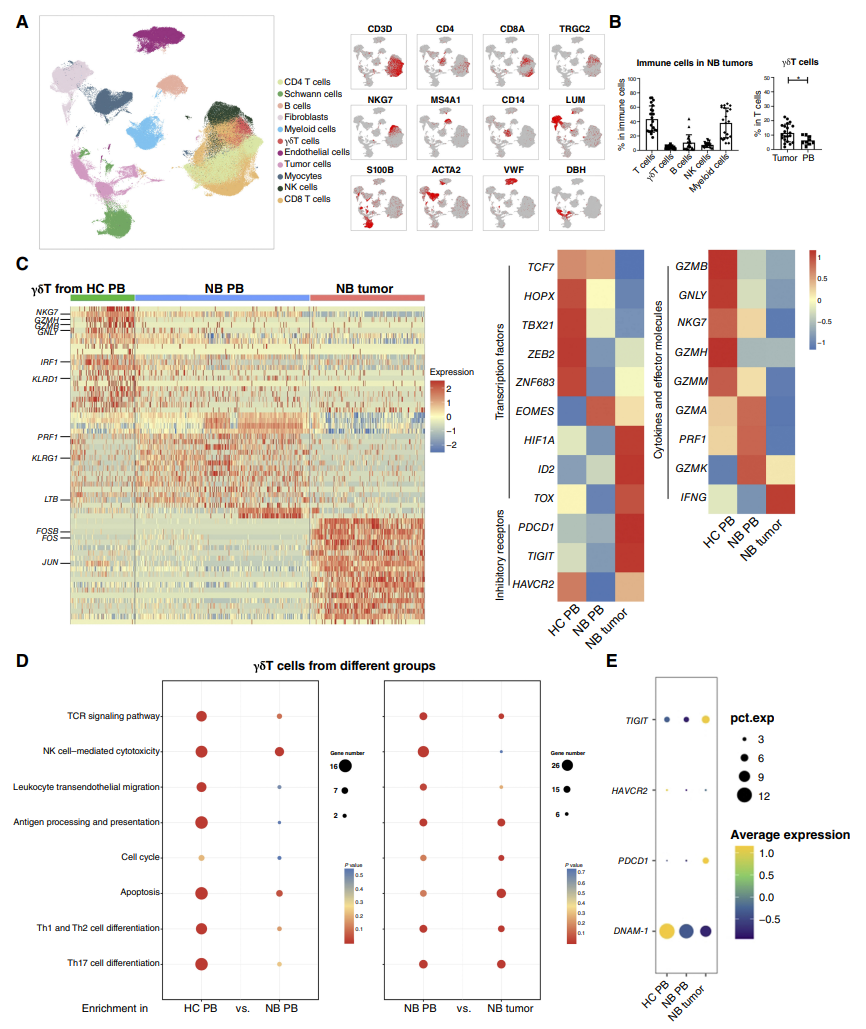
图1. 神经母细胞瘤肿瘤中积累的 γδT 细胞具有 DNAM-1 降低和 scRNA-seq 显示功能受损的特点
使用GSE49711数据集进行的生物信息学分析显示,DNAM-1表达与神经母细胞瘤预后之间有很强的相关性:IV期肿瘤、高危病例、MYCN扩增和患者死亡均与DNAM-1表达降低相关,而低DNAM-1表达与较低的生存概率相关。这些数据共同表明,神经母细胞瘤肿瘤细胞通过细胞间直接接触下调DNAM-1表达,损害γδT细胞功能。


图2. 神经母细胞瘤患者的循环和瘤内γδT细胞在与神经母细胞瘤细胞直接接触后表现出DNAM-1减少和功能衰竭
2. 差异表达DNAM-1配体CD112和CD155的肿瘤细胞属于不同的功能亚群,并显示出区域特异性的模式
对高危神经母细胞瘤肿瘤的组织切片进行空间转录组分析,通过空间聚类发现细胞被分为八种主要细胞类型:表达高 CD112/CD155 比率的肿瘤细胞、低比率的肿瘤细胞、淋巴细胞、髓样细胞、基质细胞、肌细胞、红细胞和肥大细胞,CD155在特定的亚区域富集,而CD112转录均匀分布在整个肿瘤块中。
通过KEGG通路分析显示,CD112/CD155高比例的肿瘤细胞富含神经元功能。相比之下,低比例的肿瘤细胞在与自我更新和代谢相关的途径中富集,这意味着增殖和代谢变化增加。通过空间代谢组学的空间聚类发现与低比例肿瘤细胞中的强劲脂质代谢增强相比,高比例肿瘤细胞中的酪氨酸和苯丙氨酸代谢增强。揭示了代谢异质性与肿瘤细胞功能亚群的关系。

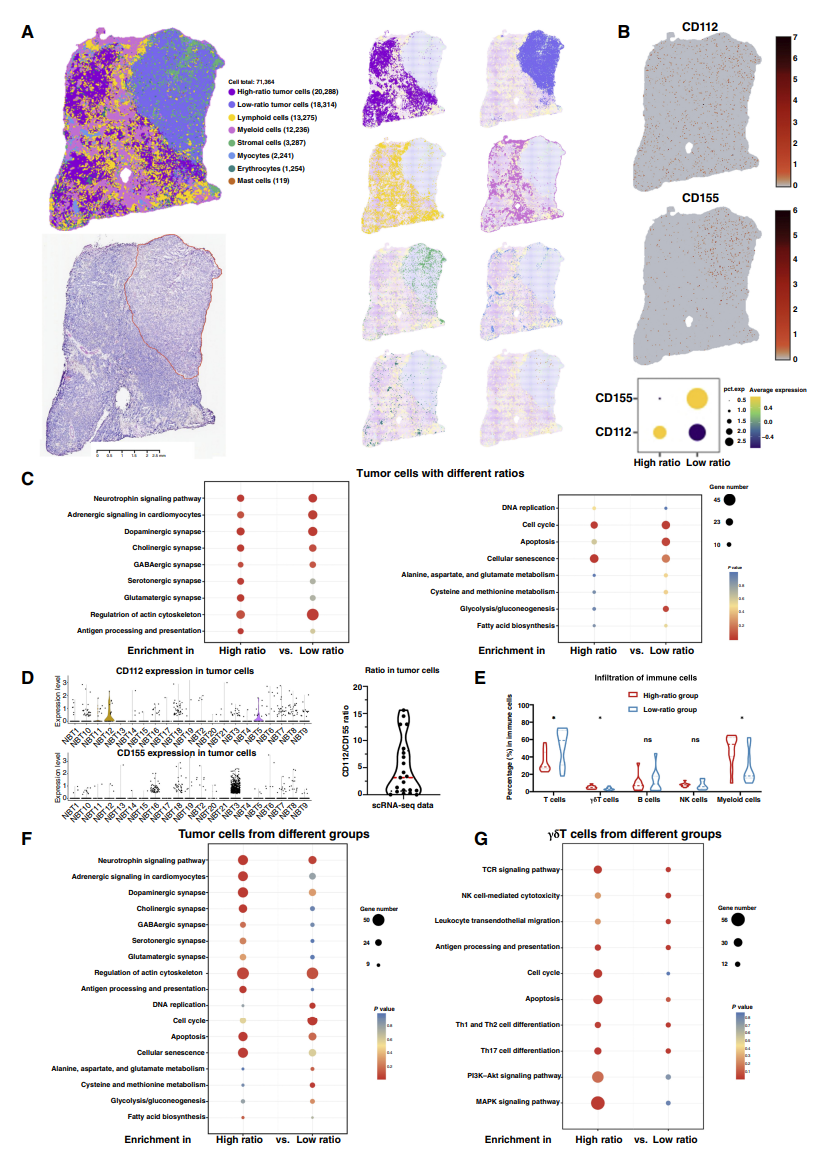

图3. 不同CD112/CD155表达比例的肿瘤属于不同的功能亚群,具有特征的基因表达谱和不同的功能γδT细胞浸润
由于CD112和CD155在神经母细胞瘤肿瘤中的表达水平和空间分布的异质性,说明这两种分子的不同比例可能代表肿瘤细胞的风险,并调节γδT细胞反应。因此对神经母细胞瘤GSE49711数据集的分析显示,具有高风险、MYCN扩增和死亡结果的神经母细胞瘤肿瘤的CD112/CD155表达率较低。
然后,研究者将神经母细胞瘤样本分为CD112/CD155比值高和低的两个亚组,发现CD112/CD155比值高的神经母细胞瘤患者有更好的生存率。根据两组间的基因表达模式,高比率组中IFN-γ、穿孔素、GZMB等溶细胞因子的表达增强,与DNAM-1相似。研究者进一步收集了38个神经母细胞瘤组织样本用于批量转录组测序。结果表明免疫激活信号被发现与高比例肿瘤相关,而低比例肿瘤与神经母细胞瘤肿瘤生长和不同代谢活动相关的基因相关。
为了进一步在细胞水平上验证这一结果,将γδT细胞与SK-N-BE2细胞进行共培养,并在SK-N-BE2细胞中构建Tet-on可控表达系统,模拟不同CD112/CD155表达比例的肿瘤细胞,结果表明CD112/CD155比值较低的肿瘤细胞诱导γδT细胞中DNAM-1表达的更大降低,并增加PD-1和TIM3的表达。

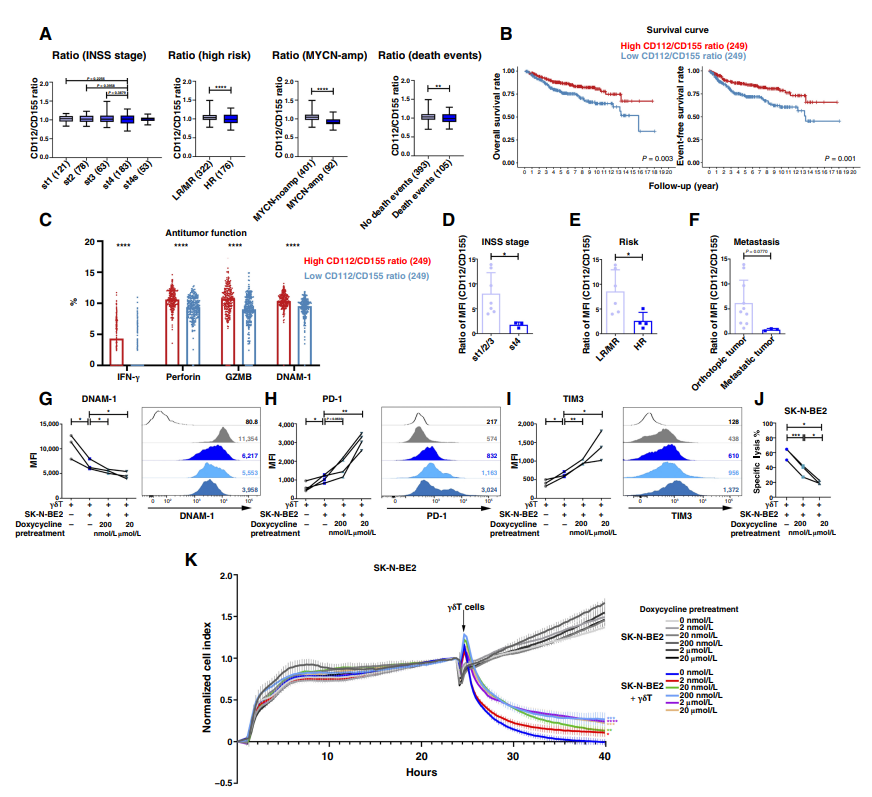

图4. NB中CD112/CD155的表达率与神经母细胞瘤(NB)患者的预后和直接的γδT细胞功能命运相关
为了研究CD112和CD155与DNAM-1表达和γδT细胞激活的相关性,分析了CD112是否表现出与肿瘤风险变化相对应的表达模式。在GSE49711数据集中,与低或中风险患者相比,高危神经母细胞瘤肿瘤的CD112水平明显较低。然而,CD112的表达在不同的INSS分期、MYCN扩增状态或患者死亡率中没有显著差异。此外,生存分析显示,神经母细胞瘤的预后与患者CD112水平的相关性较差。通过构建CD112稳定敲低的CHLA-255细胞(CHLA-255-shCD112)和CD112过表达的IMR-32细胞(IMR-32-CD112)并与γδT细胞进行共培养,实验结果显示,CD112并不直接调控DNAM-1的表达。
另外,使用CD112中和抗体(α-CD112)和重组CD112蛋白(rhCD112)处理γδT细胞,评估其对DNAM-1表达和细胞毒性的影响,结果直接添加的rhCD112可以促进γδT细胞介导的肿瘤杀伤,而α-CD112则抑制这种杀伤作用。这些结果表明,尽管肿瘤细胞上的CD112并不调节DNAM-1的表达,但它对γδT细胞的激活至关重要。


图 5. CD155 而不是 CD112 减少 γδT 细胞中的 DNAM-1 并抑制 γδT 细胞对神经母细胞瘤的细胞毒性
为了验证肿瘤细胞上的CD155是否通过与γδT细胞的接触诱导DNAM-1表达的减少,并抑制γδT细胞的细胞毒性活性,从而影响神经母细胞瘤的疾病进展。通过以往数据库分析,体外实验,细胞模型构建与基因敲除,体内实验等结果表明CD155表达与高危肿瘤、MYCN扩增和死亡结果呈正相关,CD155高表达患者的生存率显著较低。rhCD155降低了DNAM-1的表达,显著抑制了γδT细胞的细胞毒性。SH-SY5Y细胞与γδT细胞共培养导致DNAM-1减少和杀瘤活性降低,这种效应可被CD155中和抗体(α-CD155)逆转。CD155敲除的SK-N-BE2细胞(SK-N-BE2-KoCD155)表现出迁移能力降低,并且未能诱导DNAM-1的减少,促进了共培养中更强的γδT细胞活化。这些结果表明,与肿瘤细胞上CD155表达的相互作用可诱导DNAM-1的减少,并抑制γδT细胞的细胞毒性。
为了研究CD155如何通过与γδT细胞的相互作用导致DNAM-1表达的减少,特别是其分子机制,包括降解途径和相关蛋白的参与。通过用重组CD155蛋白(rhCD155)处理后的γδT细胞中DNAM-1 mRNA和蛋白水平的变化,结果表明hCD155处理或与SK-N-BE2肿瘤细胞共培养后,γδT细胞中DNAM-1的膜表达和总蛋白水平显著下降,但mRNA水平未发生变化,表明DNAM-1的减少发生在翻译后水平。
通过在γδT细胞与SK-N-BE2肿瘤细胞共培养过程中,添加蛋白酶体抑制剂MG132或溶酶体抑制剂氯化铵,评估DNAM-1降解的变化,发现蛋白酶体抑制剂MG132可以部分抑制DNAM-1的降解,而溶酶体抑制剂氯化铵无效,表明泛素-蛋白酶体途径参与了CD155诱导的DNAM-1降解。另外,使用特异性Src激酶抑制剂PP2处理γδT细胞,结果表明,Src激酶抑制剂PP2可以阻止γδT细胞共培养或rhCD155处理后DNAM-1的降解,表明Src激酶介导的泛素化参与了DNAM-1降解。
后续通过免疫沉淀-质谱鉴定(IP-MS)技术筛选并验证了DNAM-1互作蛋白E3泛素连接酶TRIM21,并验证其介导了DNAM-1的降解。综上所述,本研究揭示了CD155通过Src激酶和TRIM21介导的泛素化途径降解DNAM-1的分子机制,为理解神经母细胞瘤免疫逃逸机制提供了新的视角。

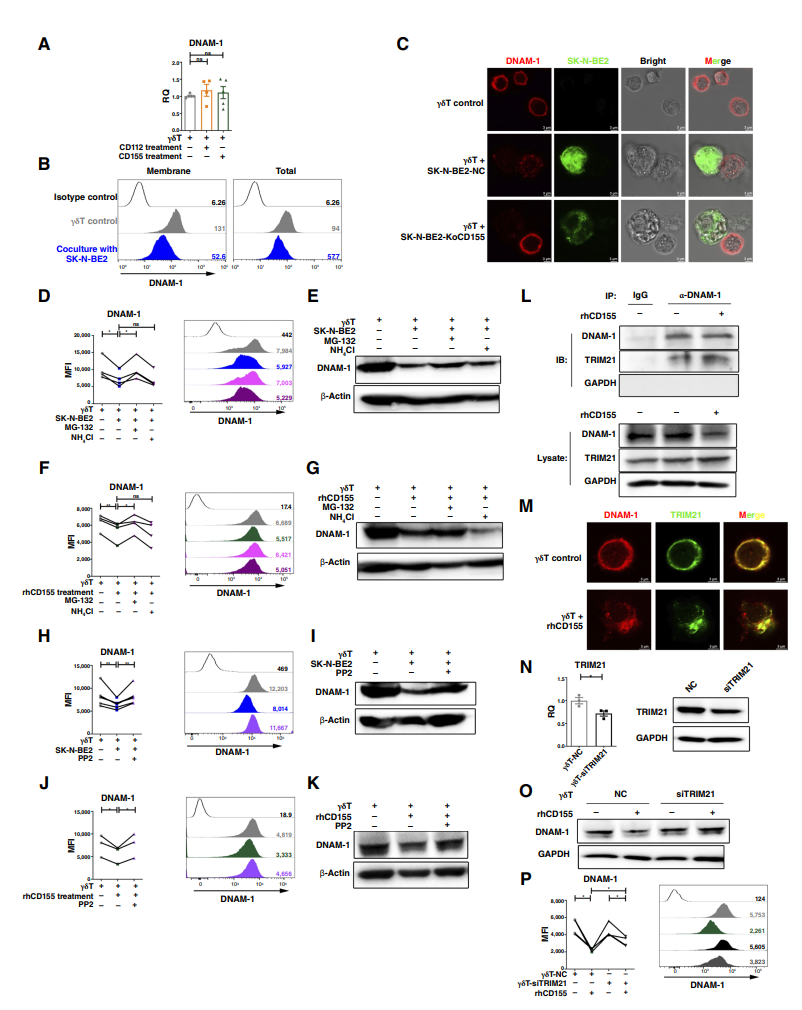

图6.在与神经母细胞瘤细胞相互作用过程中,CD155通过trim21介导的泛素化诱导DNAM-1降解
本研究通过空间转录组学、单细胞RNA测序、空间代谢组学技术,来系统分析神经母细胞瘤中CD112和CD155的表达模式及其在肿瘤内外的分布特征,阐明其异质性的来源(如肿瘤细胞分化状态、代谢途径等);通过结合患者队列分析、体外细胞模型及体内肿瘤实验,揭示高/低CD112/CD155比值肿瘤的免疫微环境特征(如yδT细胞亚群分布、功能状态)及其与患者生存率、治疗敏感性的相关性;通过体外细胞实验验证CD112和CD155对yδT细胞表面DNAM-1受体的动态调控作用,特别是CD155通过TRIM21介导的泛素-蛋白酶体途径导致DNAM-1降解的分子机制,以及CD112对yδT细胞激活的支持作用;通过综合多组学数据(转录组、代谢组、蛋白质组),解析CD112/CD155异质性如何通过重塑肿瘤微环境(如代谢重编程、免疫抑制网络)促进肿瘤免疫逃逸,为开发新型联合疗法奠定基础。
参考文献:DOI:10.1158/0008-5472.CAN-24-1509






