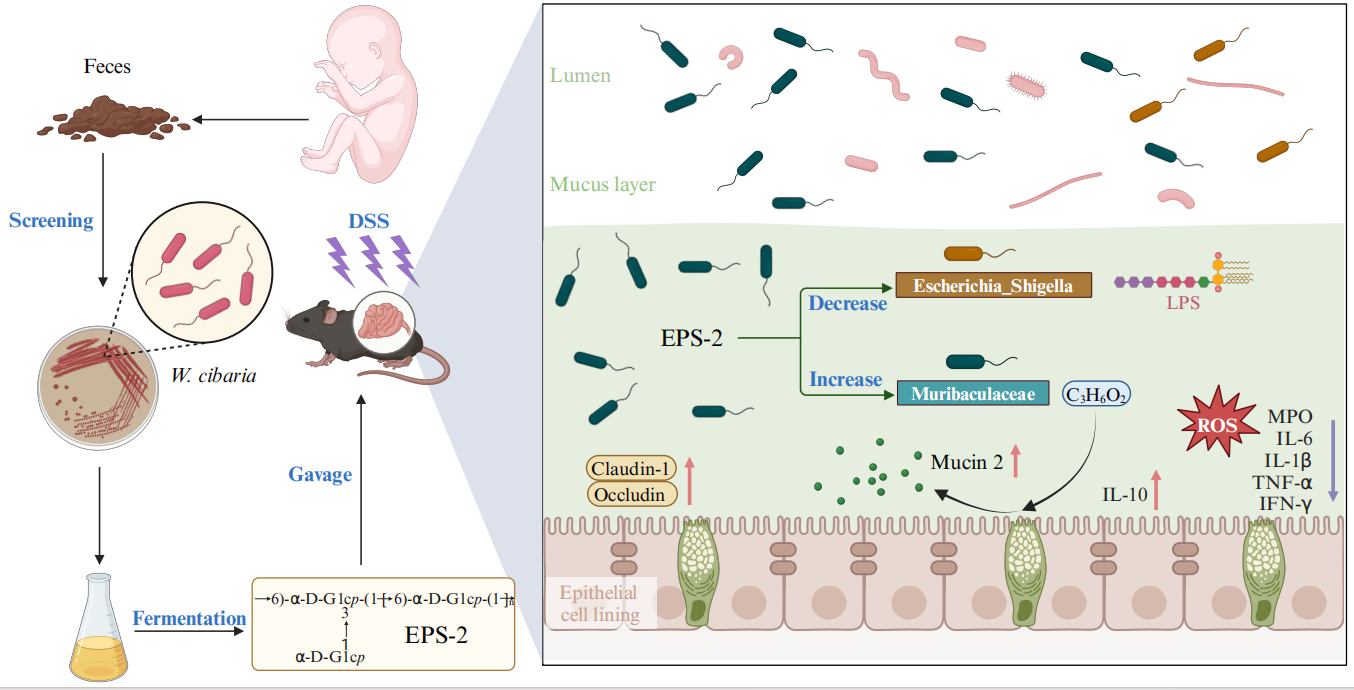
肠黏膜屏障对维持人体健康至关重要。受损的肠黏膜屏障可能导致多种疾病的发生与发展,包括炎症性肠病、心血管疾病、代谢综合征以及精神疾病。黏液层直接与肠道细菌和肠上皮细胞相互作用,一旦黏液层被破坏,肠道屏障的通透性增加,细菌和有毒物质就会从肠腔转移到体循环,并引发异常的免疫系统激活,导致慢性炎症反应,损害肠道和远处的器官。
肠道菌群在维持肠黏膜层的功能方面起着至关重要的作用。某些肠道源性细菌,如 Akkermansia muciniphila和Bacteroides thetaiotaomicron,已被证明可调节肠道黏膜屏障。胞外多糖(Exopolysaccharides,EPS)是微生物的次生代谢物,具有多种生物功能。
本研究对从健康婴儿粪便中分离到的ZMC030菌株产生的EPS-2的结构进行了表征。这种新型葡聚糖(右旋糖酐)可以通过调节肠道微生物群和提高丙酸水平来保护肠道黏膜屏障,说明了微生物衍生的右旋糖酐在健康和疾病中的潜在应用。
2025年1月,郑州大学第一附属医院肿瘤科马望教授(通讯作者)和赵环副研究员(一作)在Carbohydrate Polymers期刊(IF:10.7)发表题为“Dextran from human feces-derived Weissella cibaria facilitates intestinal mucosal barrier function by modulating gut bacteria and propionate levels”的文章,通过16S rDNA测序、LC-MS短链脂肪酸靶向检测技术,探究了EPS-2在维护肠道菌群平衡与保护肠道黏膜屏障中的作用机制,为肠道屏障功能障碍类疾病的治疗提供了参考。
欧易生物提供16S rDNA测序、LC-MS短链脂肪酸靶向检测技术。

1、EPS的发酵、纯化以及结构表征
研究人员从一名健康婴儿的粪便中分离出一株高产EPS的W.cibaria菌株,并对其分泌的多糖进行纯化得到EPS-2。首先,作者利用高效液相色谱技术对提纯的EPS-2其进行洗脱,得到单一、对称的窄峰,证实了EPS-2是均匀的。然后,作者通过单糖组成分析确定葡萄糖是唯一的成分,并将EPS-2归类为葡聚糖。最后利用GC-MS质谱和NMR技术,进一步阐明了EPS-2的结构。
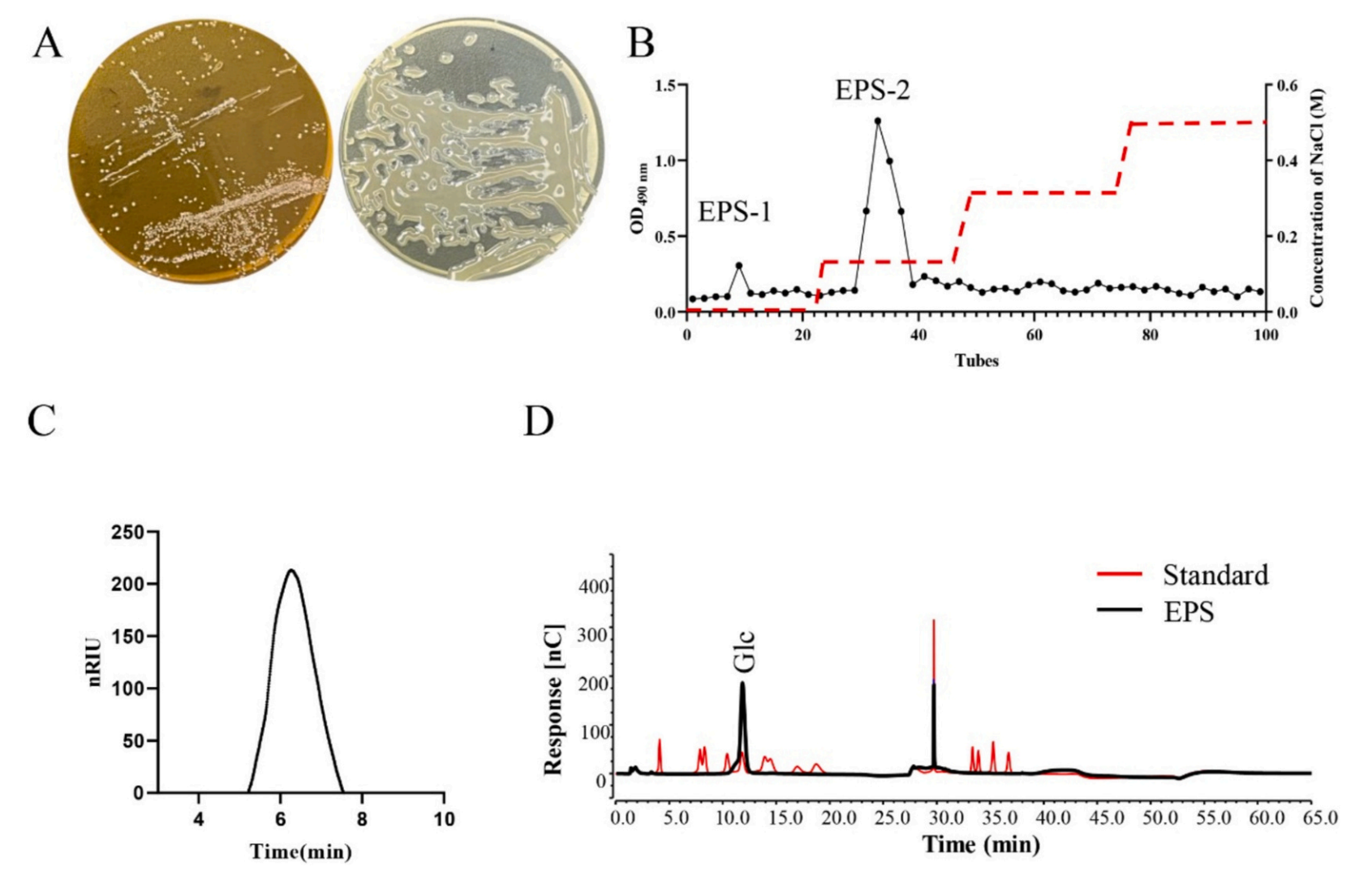
图1 EPS-2的纯化和鉴定
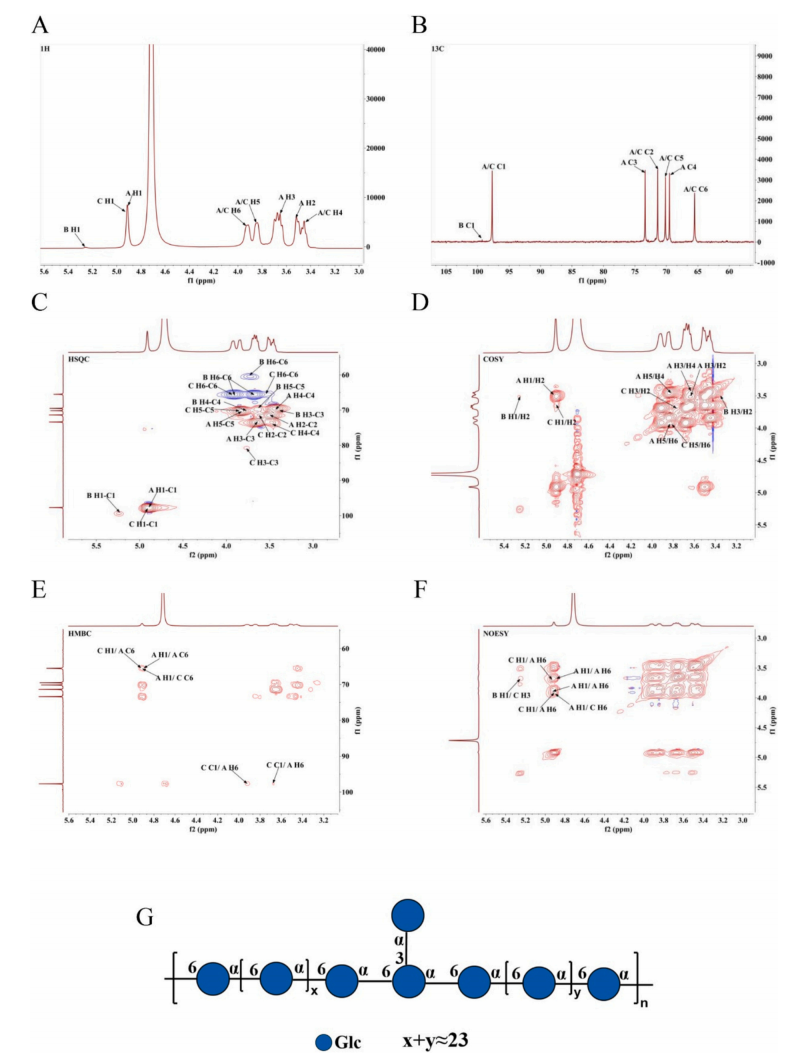
图2 EPS-2的核磁共振谱及结构式
2、EPS-2改善DSS诱导的结肠炎小鼠肠黏膜屏障稳态
为了评估EPS-2对肠黏膜屏障的影响,作者建立了DSS诱导的结肠炎模型。与健康对照组的小鼠相比,给予DSS的小鼠结肠长度变短,体重显著下降,疾病活动度评分(DAI)显著增加。然而,EPS-2治疗可以恢复小鼠的结肠长度、改善体重减轻以及DAI评分。组织病理学染色结果显示EPS-2治疗可显著降低肠道损伤。
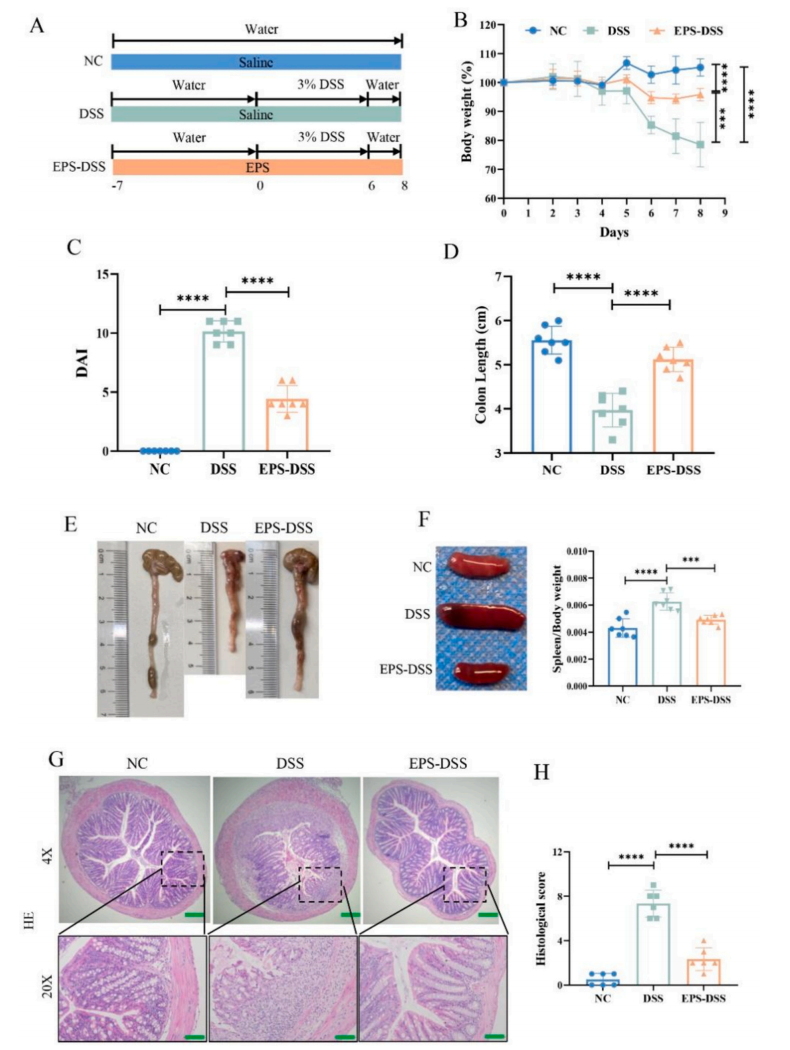
图3 EPS-2减轻了DSS诱导的结肠炎小鼠的肠道损伤症状
分泌粘蛋白-2(MUC-2)的杯状细胞的稳态对于维持肠道屏障稳态至关重要。AB/PAS染色显示,EPS-2处理显著提高了MUC-2的含量和MUC-2+和AGR2+细胞的数量,通过qRT-PCR技术,发现muccll-2、Klf4、Tiff3、Spdef、Clca1、C1galt1、St3gαl3和B3gnt6等与杯状细胞分化和功能相关的基因在EPS-2处理后显著上调。这些结果说明,EPS-2改善了杯状细胞的功能,增强了DSS诱导的结肠炎小鼠的黏液屏障功能。
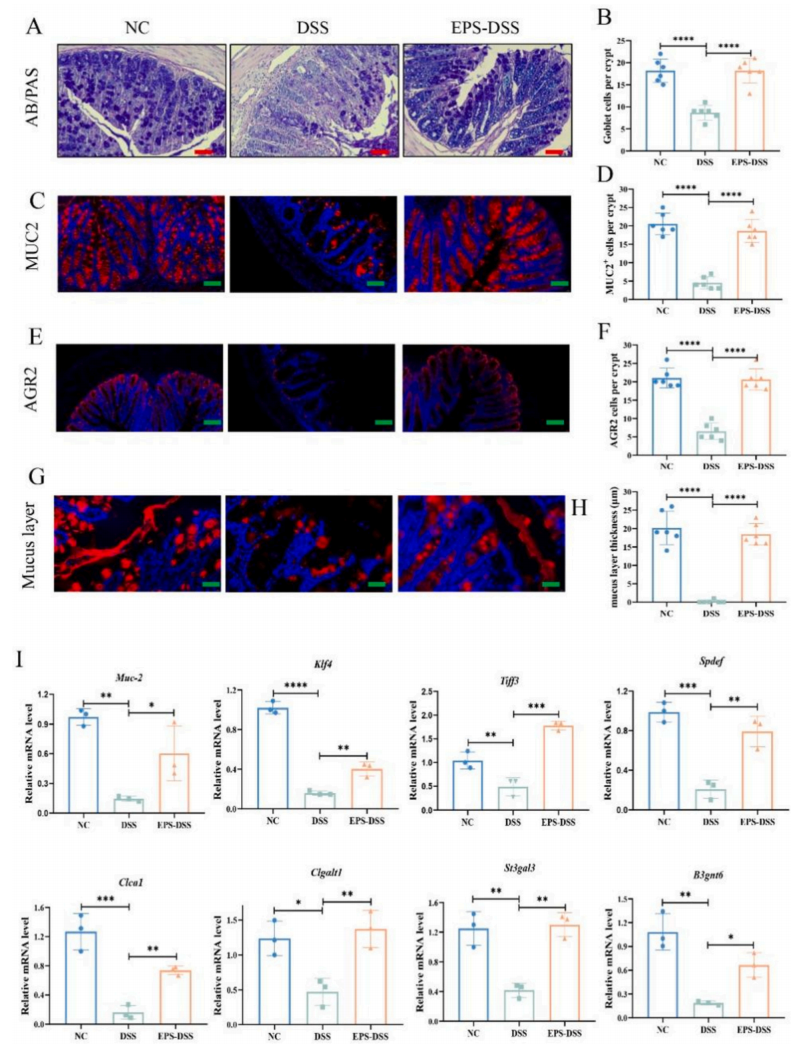
图4 EPS-2可改善结肠炎小鼠肠道黏液屏障稳态
3、EPS-2可调节结肠炎小鼠的肠道微生物群和丙酸含量
由于肠道菌群丰度与肠黏膜稳态间有很大的相互影响。作者推测EPS-2可能会改善肠道菌群,进一步治疗肠道黏膜的损伤。通过对16S rDNA测序数据的分析发现,DSS组的alpha多样性指数、Shannon指数和Simpson指数均低于健康对照组。这些指标在EPS-2治疗后都得到了改善。
通过对门水平上微生物丰度的分析,发现EPS-2治疗可以显著提高Bacteroidota的相对丰度,同时降低Proteobacteria的相对丰度。在属水平上,EPS-2处理提高了Muribaculaceae水平,降低了Escherichia-Shigella水平。
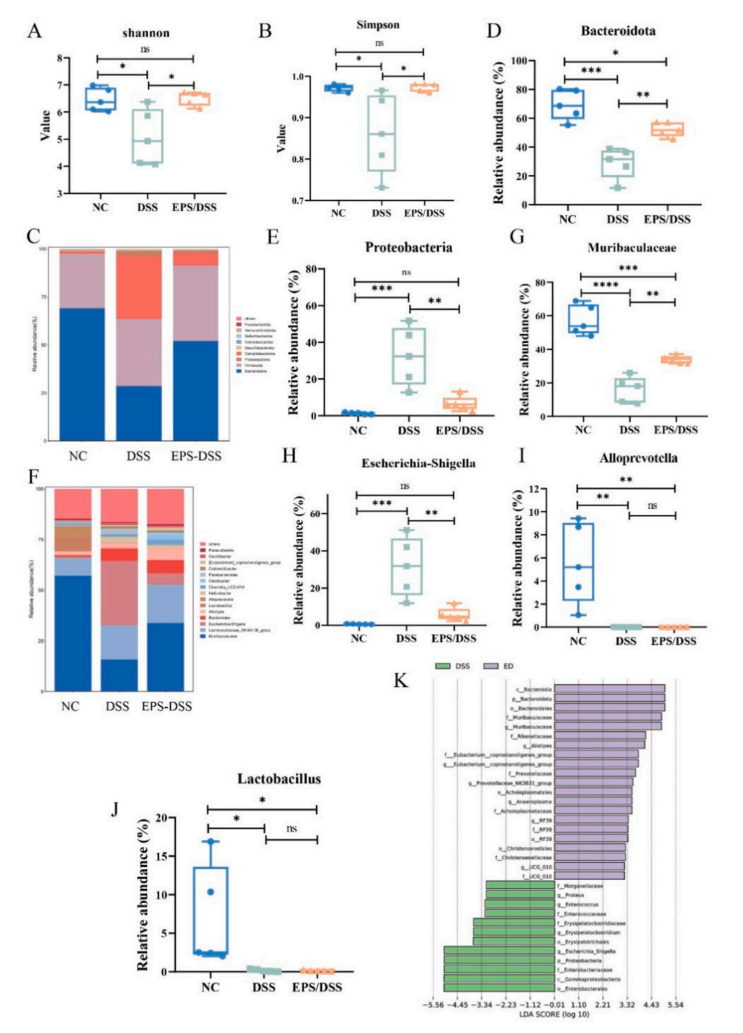
图5 EPS-2调节肠道微生物群
Muribaculaceae可以将多糖发酵成短链脂肪酸(SCFAs),在减少促炎介质、增强黏膜屏障完整性和维持肠道稳态方面发挥关键作用。为了探索EPS-2对菌群代谢的影响,作者对小鼠粪便样本进行了LC-MS靶向短链脂肪酸检测。结果显示,EPS-2处理改善了DSS处理小鼠粪便中的丙酸水平,使其恢复到基线值。肠道微生物群与短链脂肪酸的相关性分析显示,Muribaculaceae的丰度与丙酸水平呈正相关,Escherichia-Shigella和Helicobacter均与丙酸浓度呈负相关。此外,结肠炎小鼠粪便中升高的Erysipelatoclostridium与丙酸水平呈负相关。这些结果表明,EPS-2 通过促进Muribaculaceae等产丙酸菌的增殖、恢复丙酸水平,并抑制Escherichia-Shigella等促炎菌的丰度,有效重建结肠炎小鼠的肠道菌群稳态。
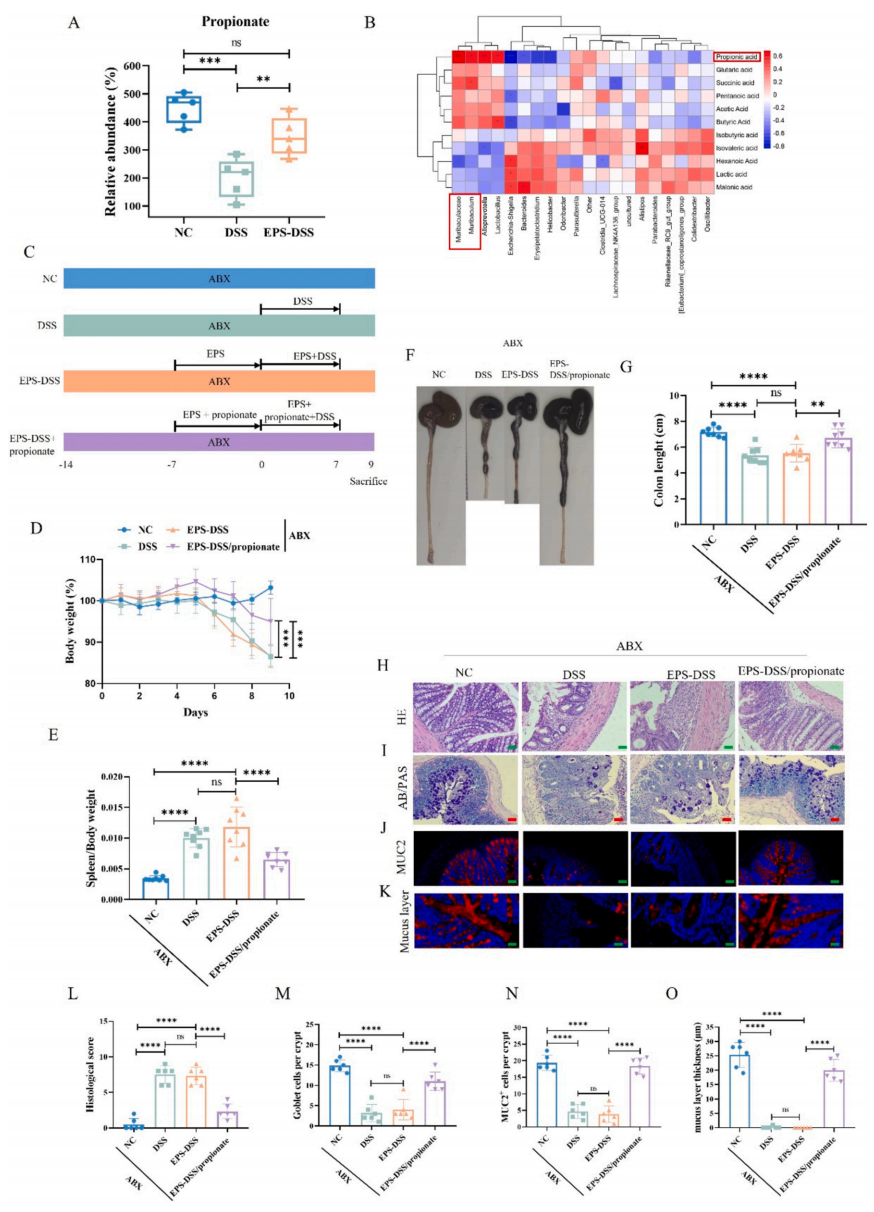
图6 EPS-2调节丙酸含量(A、B);EPS-2对肠道黏液屏障的影响依赖于肠道细菌和丙酸盐(C~O)
4、EPS-2对肠黏膜屏障的影响依赖于肠道细菌和丙酸盐
为了确定EPS-2对肠黏膜的保护作用是否依赖于肠道微生物群和丙酸,作者进行了抗生素验证实验。结果表明,ABX处理下,EPS-2对结肠炎小鼠肠黏膜屏障的保护作用减弱。DSS组和EPS/DSS组之间的体重、脾脏重量比和结肠长度均无显著差异。HE染色的组织学检查显示,EPS-2并没有减少ABX处理的结肠炎小鼠的肠道损伤。此外,AB-PAS和muc2染色显示,EPS-2并没有增加ABX处理的结肠炎小鼠黏膜屏障中杯状细胞的数量。
EPS/DSS/丙酸组的丙酸干预与EPS/DSS组相比,在体重、脾脏重量比、结肠长度和肠结构完整性方面改善了小鼠的黏液屏障功能。此外,丙酸干预增加了杯状细胞数量和muc2蛋白水平,并使粘液层增厚。这些结果表明,EPS-2并没有直接增强结肠炎小鼠模型中肠黏膜屏障的完整性,它是通过调节分泌丙酸的肠道细菌丰度来发挥作用的。
5、EPS-2增强了肠上皮屏障的内稳态
为了进一步评估EPS-2处理对肠道黏膜炎症水平的改善情况,作者分析了结肠中抗炎细胞因子的水平。DSS处理的小鼠显示抗炎细胞因子IL-10水平降低,而促炎细胞因子如MPO、IL-6、IL-1β、TNF-α和IFN-γ水平升高。EPS-2的干预显著降低了这些促炎细胞因子的水平,并增加了IL-10的水平。此外,EPS-2降低了小鼠的活性氧(ROS)水平。
脂多糖(LPS)作为一种促炎物质,会加剧全身炎症。血中脂多糖水平升高是肠道屏障功能受损的标志。如图7n所示,DSS处理导致小鼠血清LPS水平升高,而EPS-2处理显著降低了LPS水平。
综上所述,本研究结果表明,EPS-2降低氧化应激,调节炎症细胞因子的产生,减少上皮细胞死亡,以缓解DSS引起的肠屏障损伤。
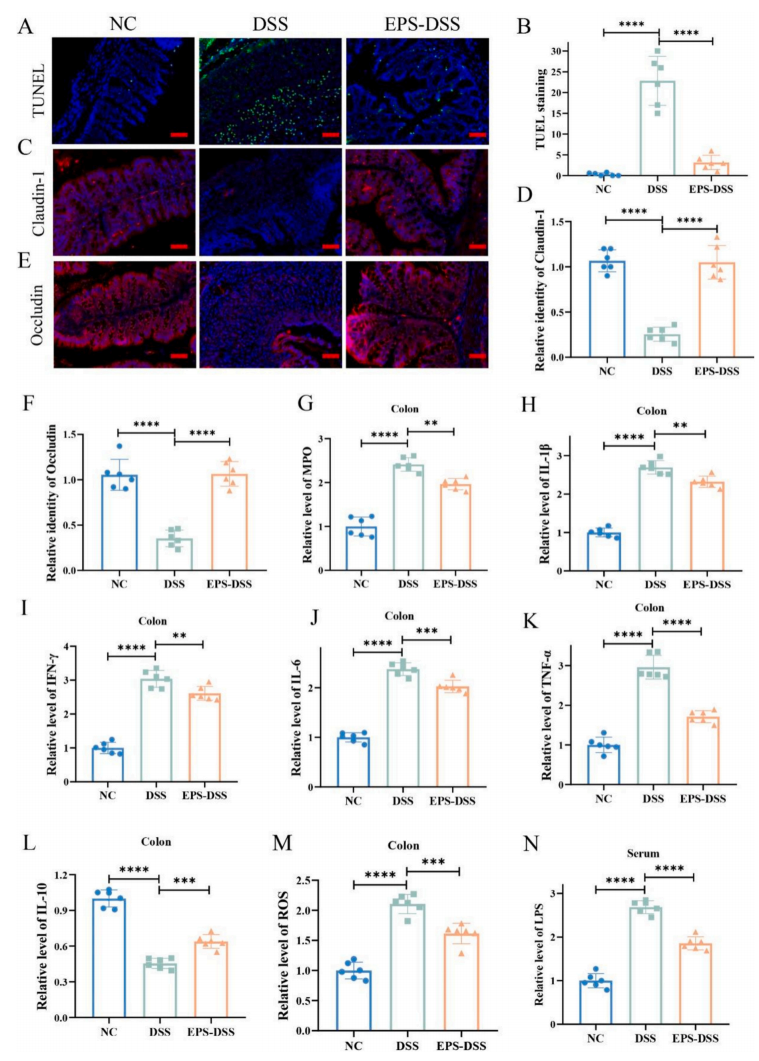
图7 EPS-2增强了肠上皮屏障的稳态
6、EPS-2对宿主来说是安全的
最后,作者对EPS-2的生物安全特性进行了全面的评价。检测EPS-2对正常上皮细胞系NCM460的细胞毒性。结果显示,EPS-2对NCM460细胞无明显的毒性。此外,在持续灌胃一个月后,接受EPS处理的小鼠与对照组之间的体重没有明显的变化。此外,生化分析显示,EPS-2处理动物的肝肾功能没有发生改变。苏木精和伊红染色结果显示对照组和EPS-2处理组没有明显的病理学差异。总之,这些发现表明,口服EPS-2不会引起体内毒性。
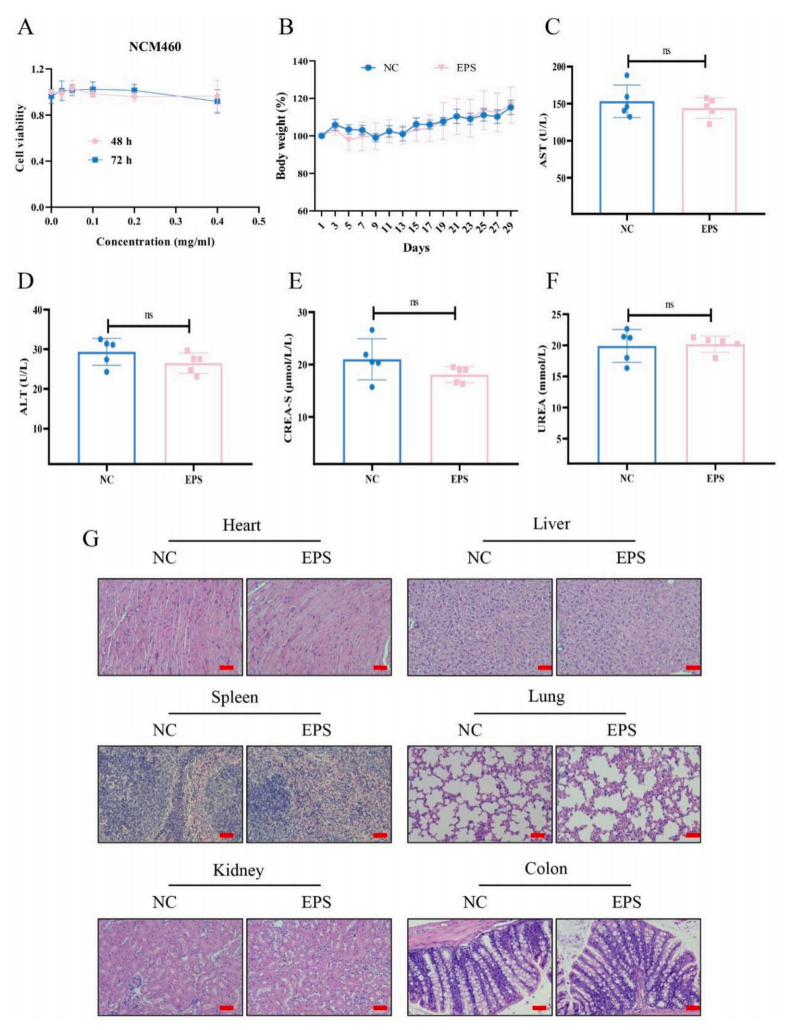
图8 EPS-2对人体无毒
本研究阐明了EPS-2帮助维持肠道黏膜屏障稳态的机制。具体来说,EPS-2以一种完全依赖于肠道微生物群产生的丙酸的方式调节杯状细胞的功能和粘液的产生,从而减轻DSS诱导的结肠炎。这些发现说明EPS-2可以作为一种有前途的营养补充或药物,用于预防和治疗肠道黏膜损伤和其他与肠道屏障功能障碍相关的疾病。
本文综合利用16S rDNA测序、LC-MS短链脂肪酸靶向检测技术以及qRT-PCR等多种技术手段,评估了一个新型葡聚糖药物在肠道黏膜修复上的作用。研究发现EPS-2药物主要通过调控肠道微生物稳态,提高肠道中丙酸含量发挥修复肠道黏膜和肠上皮杯状细胞功能的作用,为肠粘膜屏障功能障碍导致的肠炎及相关疾病治疗提供了新的方向。
原文链接:https://doi.org/10.1016/j.carbpol.2025.123300






