国际权威学术期刊《Science》于2025年3月28日发表了一项由全球多国科学家合作完成的重要研究成果。来自沙特阿卜杜拉国王科技大学(KAUST)、澳大利亚联邦科学与工业研究院(CSIRO)等科研团队,首次揭示了小麦通过串联激酶与NLR蛋白协同作用抵抗秆锈病的分子机制。该发现为开发广谱抗病小麦品种提供了新的理论框架,对应对全球粮食安全挑战具有重要意义。
秆锈病是由真菌病原体(Puccinia graminis f. sp. tritici)引起的毁灭性病害。2022年,KAUST团队从野生沙融山羊草(Aegilops sharonensis)中克隆出抗病基因Sr62TK,该基因编码的串联激酶可使感病小麦获得广谱抗性。然而,Sr62TK单独转化小麦后虽能触发免疫反应,但其作用机制尚未明确。研究人员在对突变体材料的深入分析中发现,位于Sr62TK基因20.4kbp外的NLR类基因(后命名为Sr62NLR)可能参与调控抗病过程。

双基因协同的防御体系
通过遗传学实验验证,Sr62NLR被证实是Sr62TK发挥功能的关键辅助因子。在感病突变体中,Sr62TK编码区未发生变异,但Sr62NLR基因出现突变且与抗病表型完全共分离。进一步的基因功能互补试验表明,只有当Sr62TK与Sr62NLR共同表达时,才能激活针对秆锈菌效应蛋白AvrSr62的特异性免疫反应。

研究团队通过多学科交叉手段揭示了这一复合体的作用机理:
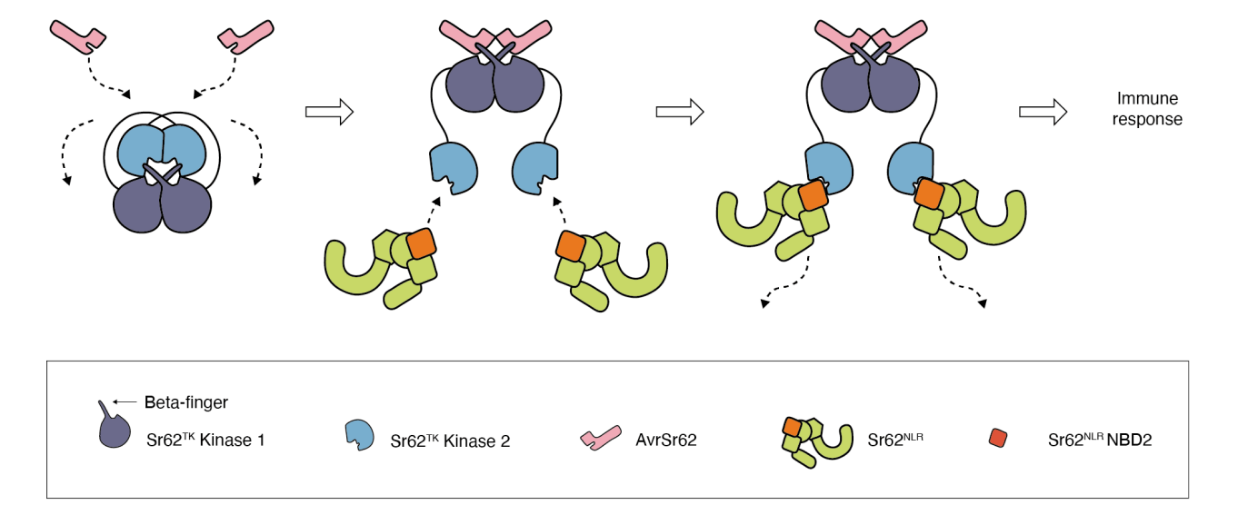
1.病原识别:Sr62TK的Kinase1结构域直接结合AvrSr62效应蛋白,该互作通过酵母双杂交、植物体双杂交及免疫共沉淀实验得到验证。
2.信号传导:当AvrSr62与Kinase1结合后,原本通过"β-链指状结构"形成的激酶二聚体构象发生改变,导致Kinase2结构域暴露,进而与Sr62NLR蛋白结合。
3.免疫激活:结构生物学分析显示,Kinase2与Sr62NLR的互作界面具有高度保守性。通过设计Kinase2结构域截短体实验,研究人员成功在烟草中重建了独立于病原识别的免疫激活通路。
值得注意的是,该复合体在进化过程中展现出独特的适应性:Kinase1的病原识别界面呈现显著多态性,反映其应对病原体变异的选择压力;而负责信号传递的Kinase2和Sr62NLR则保持高度保守,确保免疫信号通路的稳定性。
研究团队利用AlphaFold2对Sr62蛋白复合体进行三维结构建模,成功预测了关键功能模块:
- Kinase1通过β-链指状结构形成同源二聚体
- Kinase2通过同一界面交替连接Kinase1和Sr62NLR,实现构象转换

这些预测结果通过21个位点的定点突变实验得到验证。例如,对Kinase1二聚体界面的丙氨酸突变导致蛋白互作消失,而改造AvrSr62-5的受体结合基序则使其成功逃逸免疫识别。这些精细的分子设计为后续抗病育种提供了可操作的靶点。
这项研究不仅深化了植物与病原体协同进化的理论认知,更展现了跨机构、跨领域合作在解决全球性农业问题中的核心价值。随着气候变暖导致病害分布范围扩大,此类基础研究的现实意义将愈加凸显。
本研究中部分酵母双杂交实验由欧易生物完成。
沙特阿卜杜拉国王科技大学(KAUST)博士后陈壬杰和生物信息学专家Oliver Powell,澳大利亚联邦科学与工业研究院(CSIRO)博士后陈健,博士后Megan Outram为共同第一作者。KAUST的Brande Wulff教授与CSIRO的Peter Dodds院士为共同通讯作者。英国国家农业植物学研究所(NIAB)Kostya Kanyuka教授课题组,福建农林大学唐定中教授课题组,美国明尼苏达大学Brian Steffenson教授课题组,南非自由州大学Willem Boshoff教授课题组,KAUST的Stefan Arold教授课题组与Łukasz Jaremko教授课题组参与了该研究。






