2025年6月17日,复旦大学附属肿瘤医院周世崇/常才/郑东东、芬兰埃博学术大学张宏博团队在Advanced Materials(IF=27.4)上发表了题为“Artesunate Nanoplatform Targets the Serine-MAPK Axis in Cancer-Associated Fibroblasts to Reverse Photothermal Resistance in Triple-Negative Breast Cancer”的研究论文,深入探究了肿瘤相关成纤维亚群ECM CAFs通过丝氨酸代谢-MAPK轴介导光热疗法耐药的作用机制,为突破吲哚菁绿(ICG)介导PTT耐药,促进三阴性乳腺癌的临床治疗提供了新的策略。

发表期刊:Advanced Materials
影响因子:27.4
测序技术:单细胞转录组测序、空间转录组、空间代谢组、转录组、蛋白组、代谢组
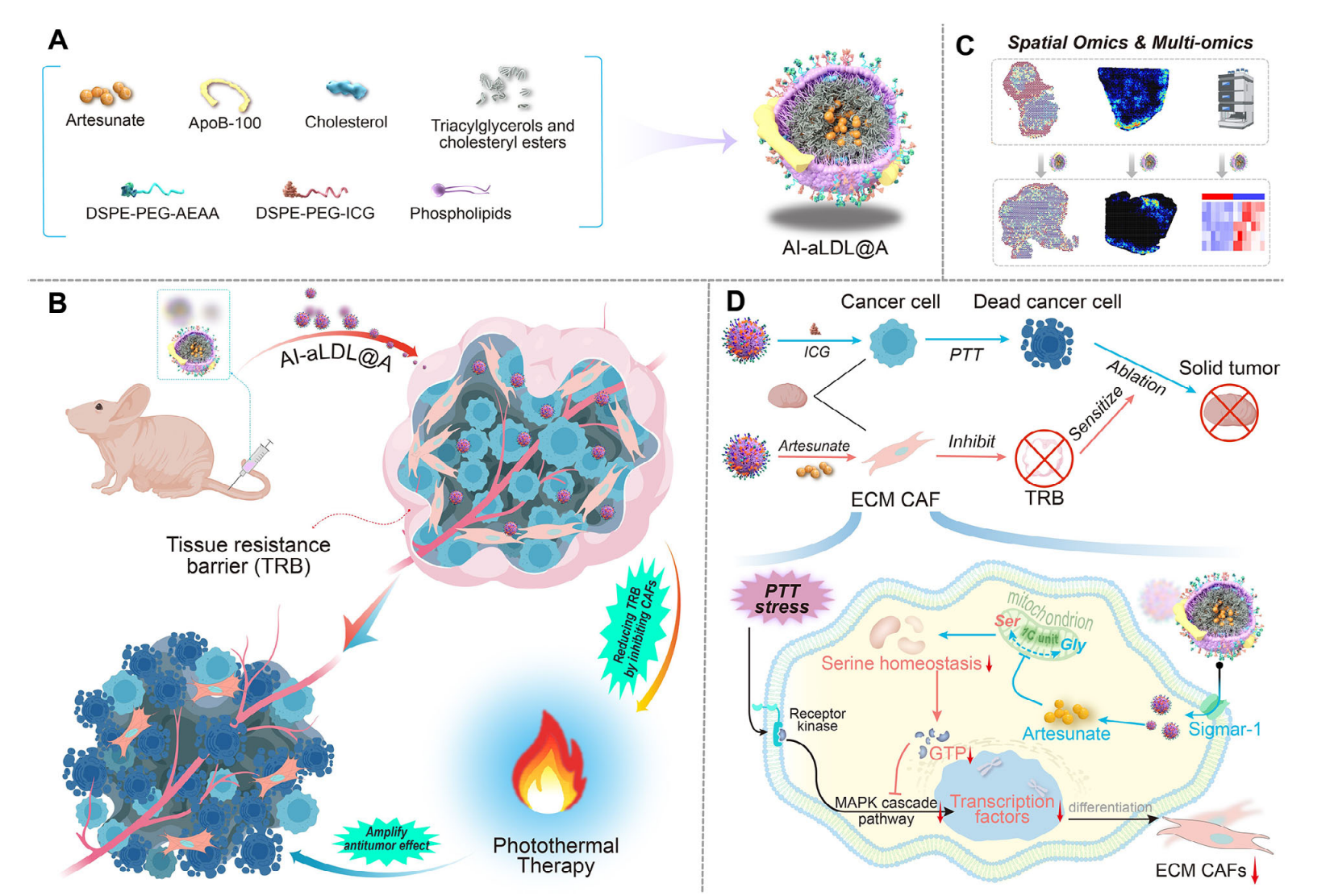
光热疗法(PTT)是一种有前景的肿瘤热治疗方式,特别是与肿瘤靶向纳米材料结合使用时,可以实现精确和远程的肿瘤治疗,尤其适用于三阴性乳腺癌(TNBC)。吲哚菁绿(ICG)介导的PTT已被用于临床试验中治疗转移性乳腺癌,但肿瘤对PTT的耐受机制仍不清楚。前期研究表明,在对疗法的响应中,癌相关成纤维细胞(CAFs)可以产生各种细胞因子和激活途径,促进肿瘤纤维化和对治疗的耐药性,但由于CAFs的异质性,明确调控耐热的CAFs亚群及其引发耐热机制对于促进PTT的临床转化尤为重要。作者在先前的研究中发现,在PD-1单克隆抗体治疗后,肿瘤中细胞外基质CAFs(ECM CAFs)参与免疫抵抗,此外,STAT3抑制剂青蒿琥酯(ARS)已被证明能够有效且特异性地抑制ECM CAFs。因此,ARS是一种有潜力的药物,可以调节ECM CAFs以克服三阴性乳腺癌(TNBC)的耐热性,实现ARS的特异性递送促进对CAF在PTT抵抗中的作用机制的理解。
本研究设计了载有ARS和ICG的仿生低密度脂蛋白(LDL)载体,通过氨乙基茴香酰胺(AEAA)实现对ECM CAFs和癌细胞的靶向抑制。通过时空组学和传统组学评估ECM CAFs在TNBC PTT耐药中的作用,并进一步揭示ARS调控CAFs中丝氨酸稳态和MAPK通路GTP酶活性的机制,指出了限制ICG介导的PTT耐药在临床试验中疗效的显著原因,为促进PTT的临床转化,有效治疗TNBC铺平了道路。
Result1 CAFs参与肿瘤对PTT的耐药性
先前有研究表明热休克蛋白(HSP)抑制剂能够提高PTT的疗效和敏感性,因此,热休克蛋白已成为评估肿瘤PTT疗效的前瞻性标志物。为评估CAFs在TNBC中PTT耐药性中的作用,作者通过重新分析之前发表的scRNA-seq 数据,以评估不同细胞亚群中的热休克蛋白表达,发现CAFs表现出更高的热休克蛋白mRNA 水平(图1A),表明CAFs具有更高的耐热性。此外,通过在Balb/c裸鼠模型中移植肿瘤细胞评估ICG介导的PTT耐药机制,发现人类永生化CAFs细胞和MDA-MB-231细胞共移植组相较于肿瘤细胞单独植入组会呈现出更弱的治疗效果(图1B),表明CAFs与PTT耐药有关。基于每个CAFs亚型的基因表达水平,作者将高表达Tnc的CAFs亚型定义为ECM CAFs,随后用WB检测游离ICG介导的PTT治疗的Eo771肿瘤组织中ECM CAFs的标志物,发现其表达相较于对照组显著增加(图1C),这些结果表明,CAFs尤其是ECM CAFs在TNBC对PTT的耐药中起关键作用。
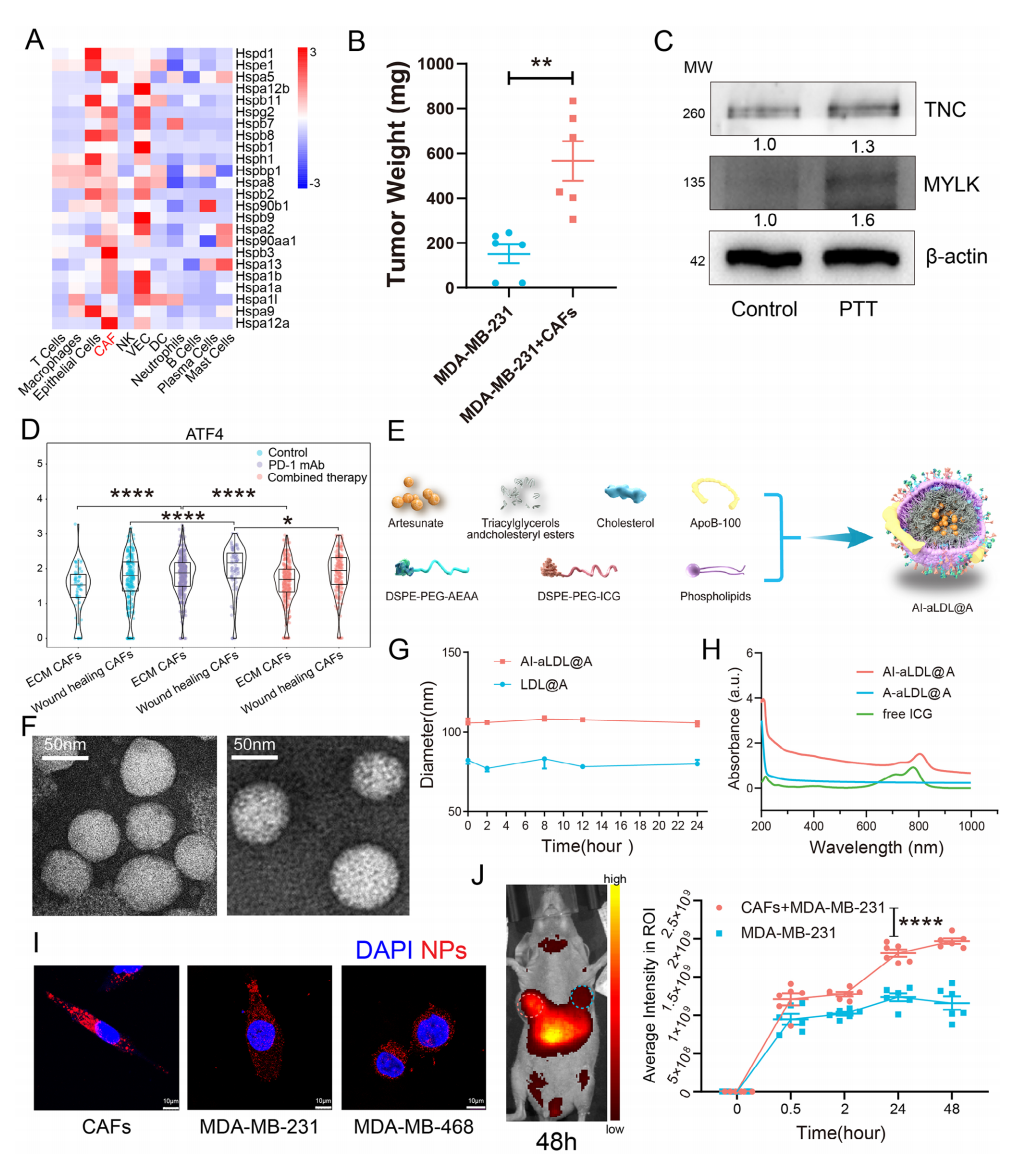
图1 ECM CAFs参与PTT耐药及青蒿琥酯纳米平台表征
Result 2 制备双靶向ARS纳米平台以特异性抑制CAFs
ATF4是CAFs应激的重要标志物,拟时序分析显示ECM CAFs和伤口愈合CAFs增加了Atf4表达水平。ARS也被报道可抑制CAFs并使肿瘤对治疗敏感,因此,作者前期研究测试了PLGA负载的ARS,发现其可降低两种CAFs亚型中的Atf4表达水平(图1D)。为了进一步实现对PTT的致敏,作者开发了一种以LDL为载体的纳米平台来负载ARS(aLDL@A),并进一步通过结合茴香酰胺(A-aLDL@A)和ICG(AI-aLDL@A)对表面进行修饰(图1E),通过扫描电镜、粒径检测等方法评估该纳米平台的稳定性及细胞毒性以证明其具有良好的生物安全性(图E~H);评估纳米平台的抑制效率和体外靶向效果时也发现其可以同时靶向并特异性抑制 TNBC 细胞和 CAFs(图1I),同时该纳米平台在共移植肿瘤中也显示出更高的积累(图 1J)。
Result 3 ARS纳米平台可以增强TNBC细胞对ICG介导的PTT的敏感性
另外,作者在各种TNBC小鼠模型中验证了该纳米平台的有效性(图2A),结果显示ARS纳米平台在人TNBC异种移植瘤模型中表现出优异的治疗效果(图2B)。在联合治疗组的肿瘤组织中,应激相关的蛋白表达水平低于I-LDL+L组(图2D),免疫组化结果显示I-LDL+L组中肿瘤组织和PTT消融区域界面的JNK表达水平高于I-LDL@A+L组(图2E),这些结果表明ARS在PTT后可抑制肿瘤中的创伤后应激并有效降低了肿瘤压力。在 Eo771小鼠TNBC肿瘤模型中,ARS纳米平台同样展示了出色的治疗效果并显著抑制了JNK蛋白的表达(图2F、G)。免疫荧光实验结果表明PTT后肿瘤组织中的ECM CAFs增加,I-LDL+L组的ATF4表达高于对照组,表明PTT诱导了肿瘤压力和纤维化(图2H、I)。检测小鼠血液中的炎症因子则表明ARS纳米平台可以减轻PTT后炎症风暴引起的肿瘤纤维化程度(图2J),不同组小鼠肿瘤组织的免疫荧光和WB结果显示联合组的TNC表达水平显著低于仅PTT治疗组,这些结果表明开发的AI-aLDL@A纳米平台在抑制ECM CAFs后能产生更好的PTT效果,表明ARS纳米平台的设计策略是成功的并且具有良好的生物安全性。
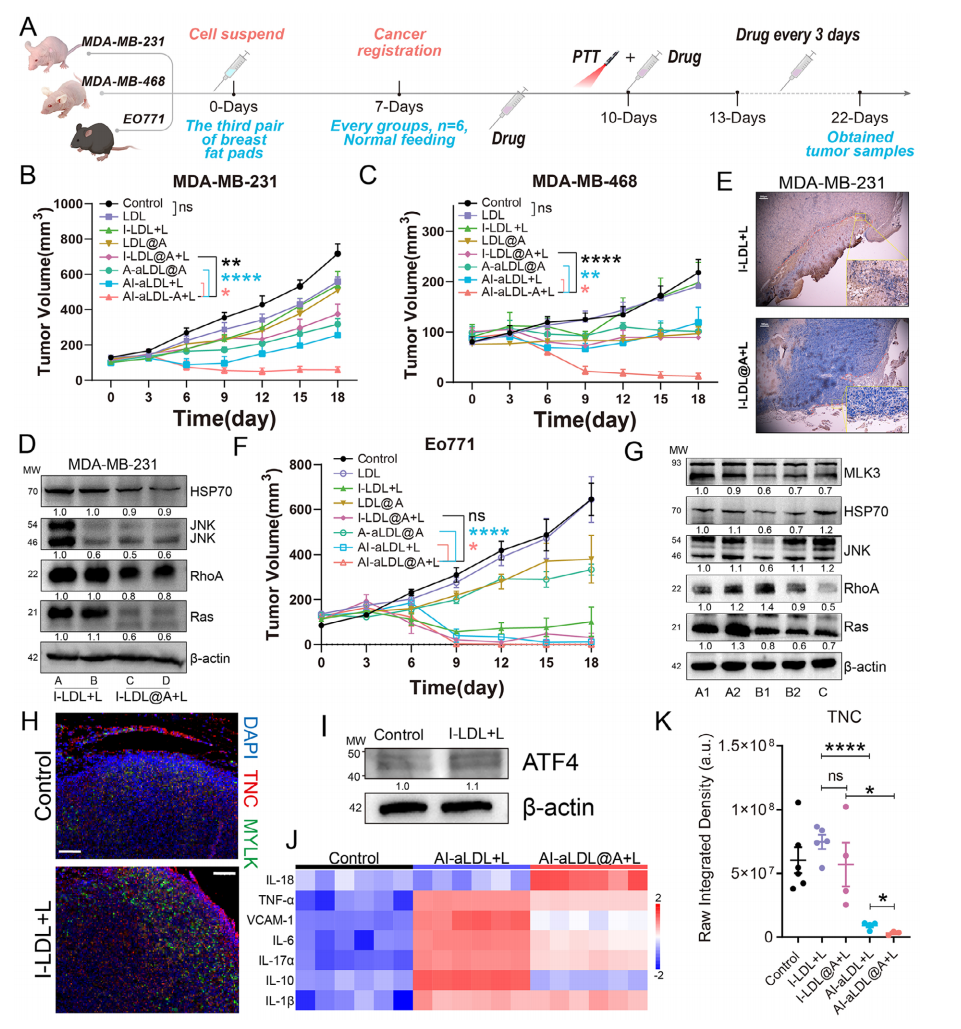
图2 青蒿琥酯纳米平台缓解多种TNBC模型PTT后应激
Result 4 空间转录组学证实ECM CAFs形成的组织抗性屏障与PTT抗性有关
进一步评估肿瘤组织内ECM CAFs的空间分布对PTT疗效的影响,作者从非靶向组(I-LDL+Laser和I-LDL@A+Laser)中选择肿瘤,以及从对照组和A-aLDL@A组中选择肿瘤进行空间转录组测序分析,结果显示,在I-LDL+L组中,肿瘤边缘呈现CAFs和巨噬细胞相关标志物的高表达,表明它们的共定位形成免疫屏障,而联合治疗组(I-LDL@A+L)形成的组织阻力屏障显著降低(图3A)。此外,通过细胞通讯分析继续探究哪些CAFs和TAMs亚群形成这种组织屏障结构,发现M2巨噬细胞通过SPP1通路与ECM CAFs和伤口愈合CAFs发生强烈相互作用(图3B),同时通过scRNA-seq数据的细胞通讯分析揭示ECM CAFs、伤口愈合CAFs和血浆样巨噬细胞之间强烈的相互作用(图3C),而不同组肿瘤组织H&E染色、多重免疫荧光及ECM CAFs与浆细胞样巨噬细胞空间分布结果显示浆细胞样巨噬细胞和ECM CAFs共定位(图3D~F)。分析ATF4基因表达与肿瘤血管区域距离关系则反映了青蒿琥酯可以抑制肿瘤应激以避免纤维化(图3G)。细胞通讯分析结果中IL-6 信号通路里ECM CAFs和浆细胞样巨噬细胞亚群之间强烈的相互作用表明ARS纳米平台可特异性抑制ECM CAFs浆细胞样巨噬细胞之间的相互作用,从而减少组织抵抗屏障的形成(图3H),并通过评估MDA-MB-231肿瘤组织中TNC和MYLK的表达水平同样证实了联合组TNC和MYLK的表达强度显著低于单纯 PTT 组(图3I)。综上所述,ARS纳米平台可以特异性削弱由 ECM CAFs 和浆细胞样巨噬细胞组成的组织屏障。
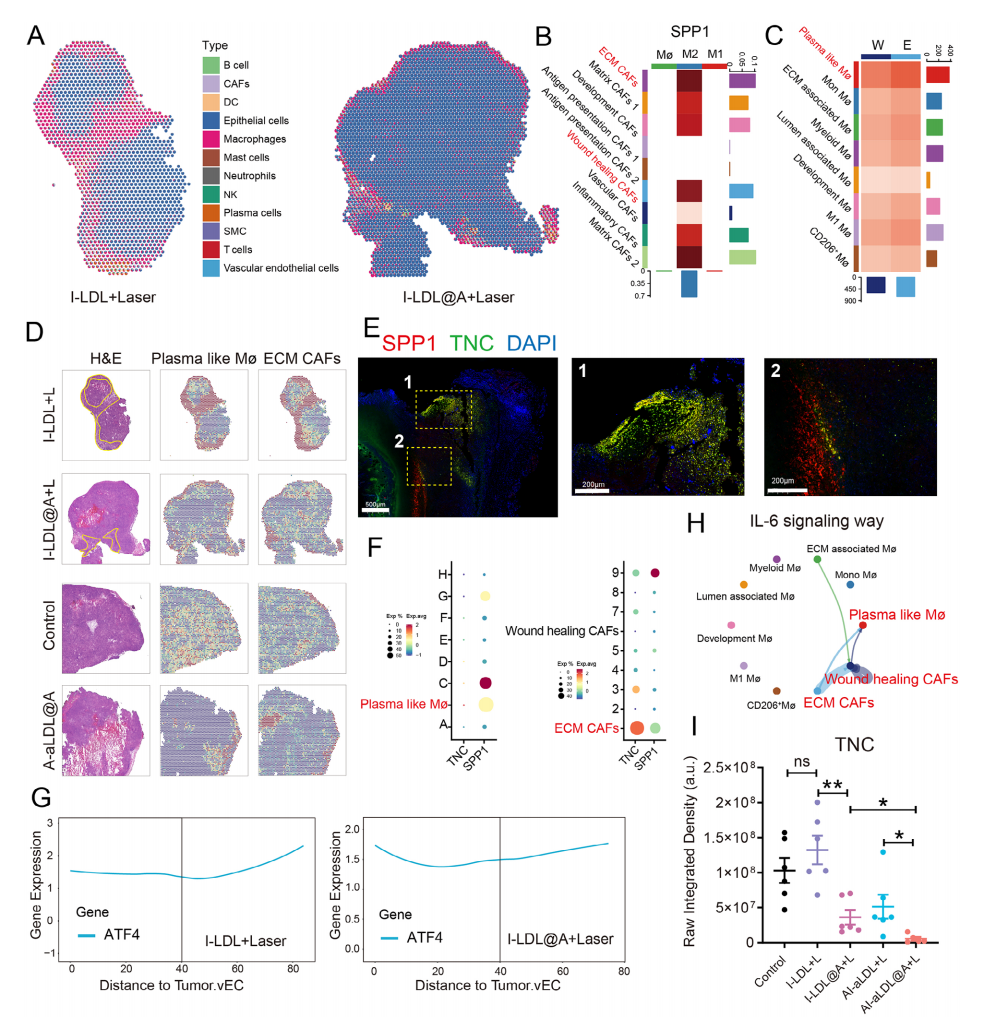
图3 空间转录证实认ECM CAFs组成的组织抗性屏障参与PTT耐药
Result 5 丝氨酸代谢在ECM CAFs中更活跃
由于ATF4是CAFs应激的重要标志物,也调节参与细胞内丝氨酸合成的关键酶的表达,因此,作者进一步探讨丝氨酸代谢是否可能是ECM CAFs抑制的潜在靶点。根据每种CAFs亚群中表达的基因进行富集分析,发现ECM CAFs在氨基糖和核苷酸糖代谢、TCA 循环和磷酸戊糖途径中高度富集(图4A),与对照组相比,A-aLDL@A组尿苷5’-单磷酸盐等肿瘤中核苷酸相关代谢物的丰度较低(图4B),乙酰甲胆碱和柠檬酸在ECM CAFs中的表达比其他肿瘤区域更丰富(图4C),ECM CAFs亚群的代谢富集分析显示该亚群在甘氨酸、丝氨酸和苏氨酸代谢途径中高度富集(图4D),表明丝氨酸代谢途径是ECM CAFs的潜在代谢靶标。鉴于鉴于 ECM CAFs 和浆细胞样巨噬细胞共定位,进一步比较两者在伪时间轴上的代谢物强度以确认 ECM CAFs 中丝氨酸代谢的特异性,发现它们呈现相似的代谢分布(图4E),而胆碱、胸腺嘧啶、苯乙酰甘氨酸和肌酸在ECM CAFs 中的含量明显高于浆细胞样巨噬细胞(图4F),这些发现同样支持丝氨酸代谢途径在 ECM CAFs 中高度活跃的结论,同样,基于对照组和 A-aLDL@A 组肿瘤组织代谢功能的通路富集揭示了 A-aLDL@A 组丝氨酸代谢通路和胆碱通路的显著调节,因此,ARS 纳米平台可以抑制ECM CAFs中的甘氨酸/丝氨酸/苏氨酸代谢途径,并可以通过减少与丝氨酸途径相关的代谢物的丰度,从而特异性抑制ECM CAFs。
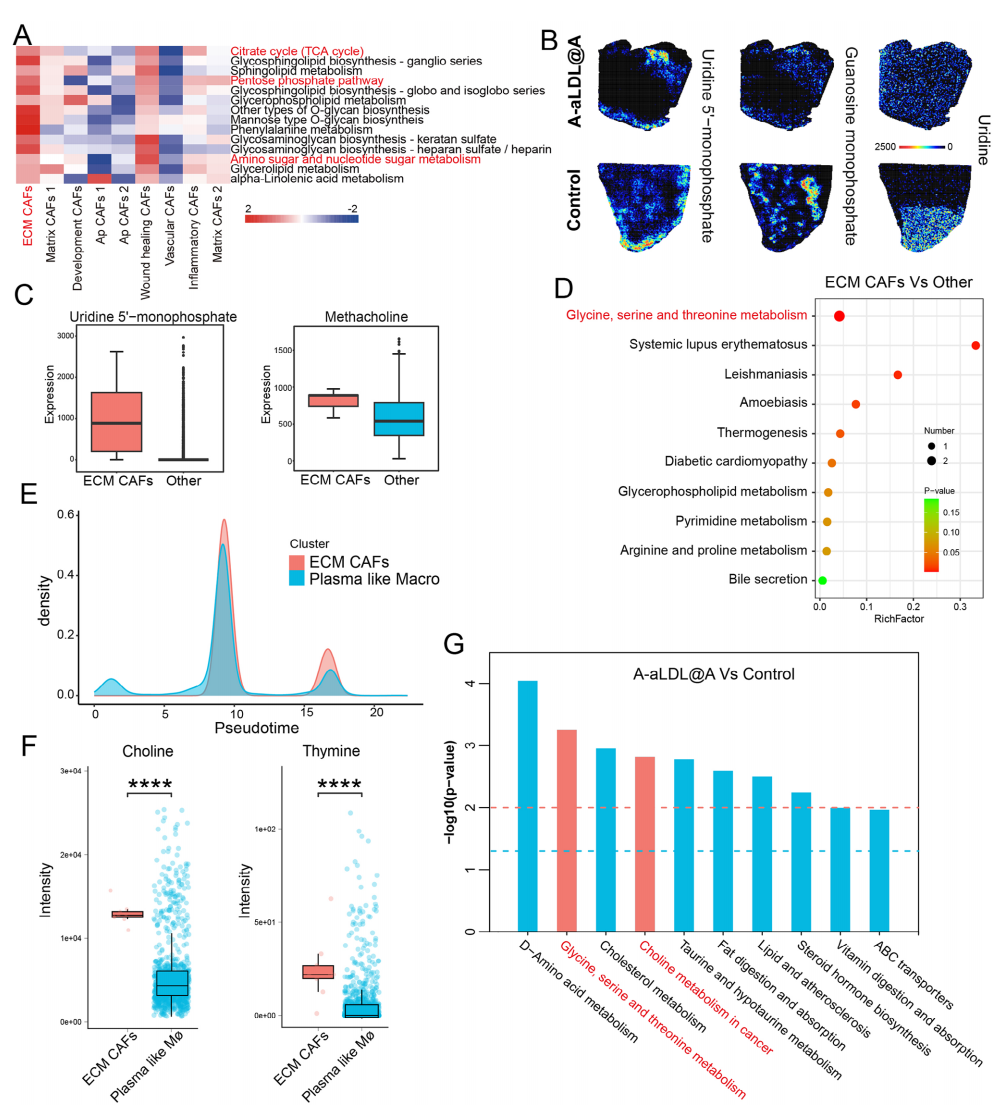
图4 ECM CAFs与丝氨酸代谢高度相关
Result 6 ARS纳米平台抑制CAFs中的MAPK级联反应和丝氨酸稳态
为了阐明ARS纳米平台抑制CAFs逆转PTT耐药能力的机制,对对照组和ARS靶向递送组 (A-aLDL@A)的肿瘤组织进行了转录组、蛋白质组学和代谢组学测序分析(图5A),考虑到PTT治疗期间的温度变化可以诱导MAPK通路激活。作者首先评估了MAPK通路中不同CAFs 亚型的表达,结果显示ECM CAFs中的MAPK级联反应水平显著高于其他亚型(图5B)。RNA-seq和蛋白质组学则显示,用ARS纳米平台处理后,MAPK通路相关基因受到抑制。蛋白组富集分析结果表明ARS纳米平台显著抑制肿瘤MAPK级联反应(图5C),代谢组学显示对一碳单元的显著抑制,因此,ARS纳米平台可以特异性抑制ECM CAFs中的MAPK级联反应和丝氨酸代谢。为了进一步探讨丝氨酸代谢与CAFs中MAPK通路级联之间的调控关系,作者研究了丝氨酸耗竭如何在蛋白质和转录水平影响MAPK通路相关基因,发现这些基因在转录和蛋白水平呈现相反的趋势(图5D),总体而言,丝氨酸耗竭影响CAF细胞中的 MAPK 通路级联反应,但它们的具体调控关系仍不清楚。
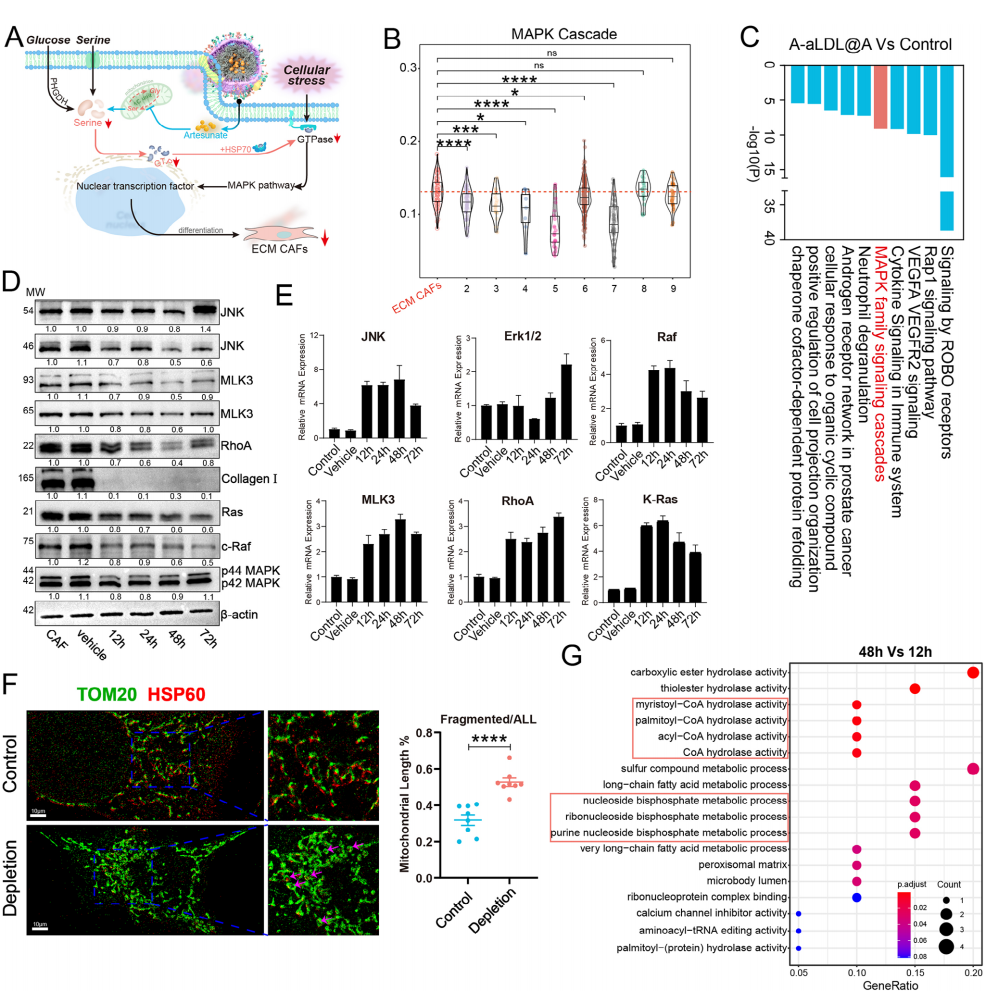
图5 丝氨酸调控ECM CAFs中MAPK通路机制
Result 7 丝氨酸耗竭影响CAFs中的GTP酶活性
鉴于丝氨酸稳态与CAFs中MAPK级联反应之间的调节关系尚不清楚,作者进一步探索其中所涉及的调节机制,以确定PTT致敏的新靶点。结果显示丝氨酸耗竭显著影响线粒体功能(图5F),丝氨酸对核苷酸代谢、CoA活性途径和GTP酶活性关闭(图5G),表明丝氨酸耗竭会干扰能量代谢并进一步抑制CAFs中MAPK通路的GTP酶活性。接着,作者证实了丝氨酸耗竭对体外和体内PTT的致敏作用, 总体而言,ARS纳米平台可以特异性抑制CAFs中的一碳单元并破坏丝氨酸稳态,从而抑制细胞内能量合成和HSP70合成。缺乏对细胞膜受体相关GTP酶的GTP供应会降低细胞对外界刺激的响应能力。ECM CAFs在MAPK级联反应中高度富集,且sigmar1的高表达使得它们特别容易受到ARS纳米平台的抑制(图6)。
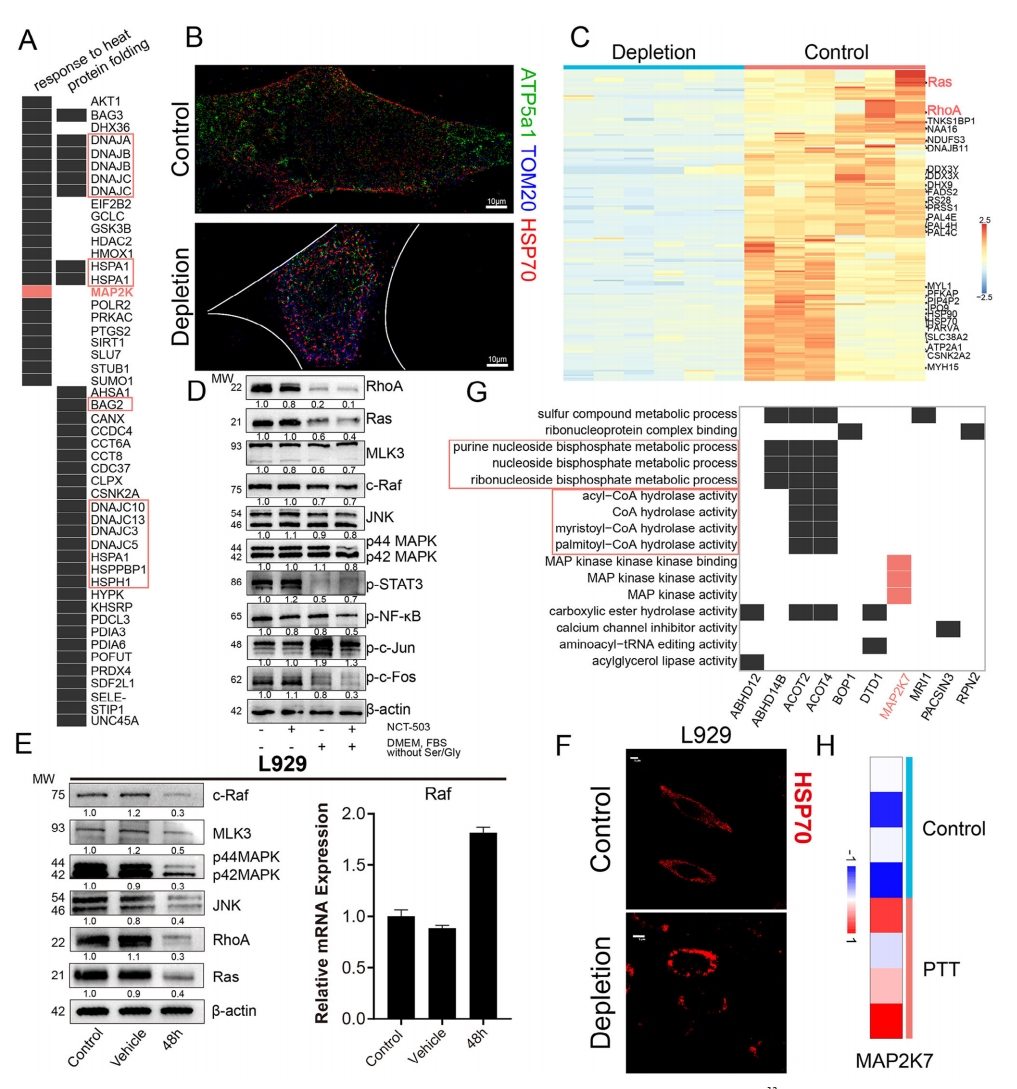
图6 HSP70在丝氨酸调控MAPK通路中的作用
Result 8 MAP2K7 可以作为 PTT 致敏的新靶点
作者发现,在所有丝氨酸位点都被同位素标记的蛋白质中,MAP2K7在丝裂原活化蛋白激酶活性中发挥作用,并在对热的应答中具有相应的功能(图6A、G),且用游离ICG进行PTT处理后,小鼠Eo771肿瘤组织中MAP2K7的表达增加(图 6H),因此,作者推测MAP2K7可以作为新的靶点来增强细胞对PTT的敏感性。使用MKK7抑制剂DTP3进一步验证MAP2K7在PTT中的作用,结果显示,PTT结合DTP3可以产生更好的治疗效果(图7A、B)。此外,作者在体外建立耐热CAFs (CAFsHR) 模型(图7C、D)进一步验证了MAP2K7在促进CAFs耐热性中的作用以及PTT对激活CAFs中MAPK通路和增加丝氨酸代谢的影响,CAFsHR 和 CAFs 的蛋白组学差异和富集分析结果也表明CAFsHR中MAP2K7的表达显著增加(图7I),GSEA分析结果表明CAFsHR的MAP激酶活性、ERK1和ERK2级联调节以及MAPK级联途径活性均是激活状态(图7J)。最后,基于FUSCC(复旦大学上海肿瘤中心)临床队列进一步评价了MAP2K7(MKK7)的临床转化价值,结果表明MKK7可能通过调节肿瘤细胞的应激反应通路来影响治疗效果,为探索其在PTT临床致敏治疗中的应用提供有价值的理论依据(图7)。
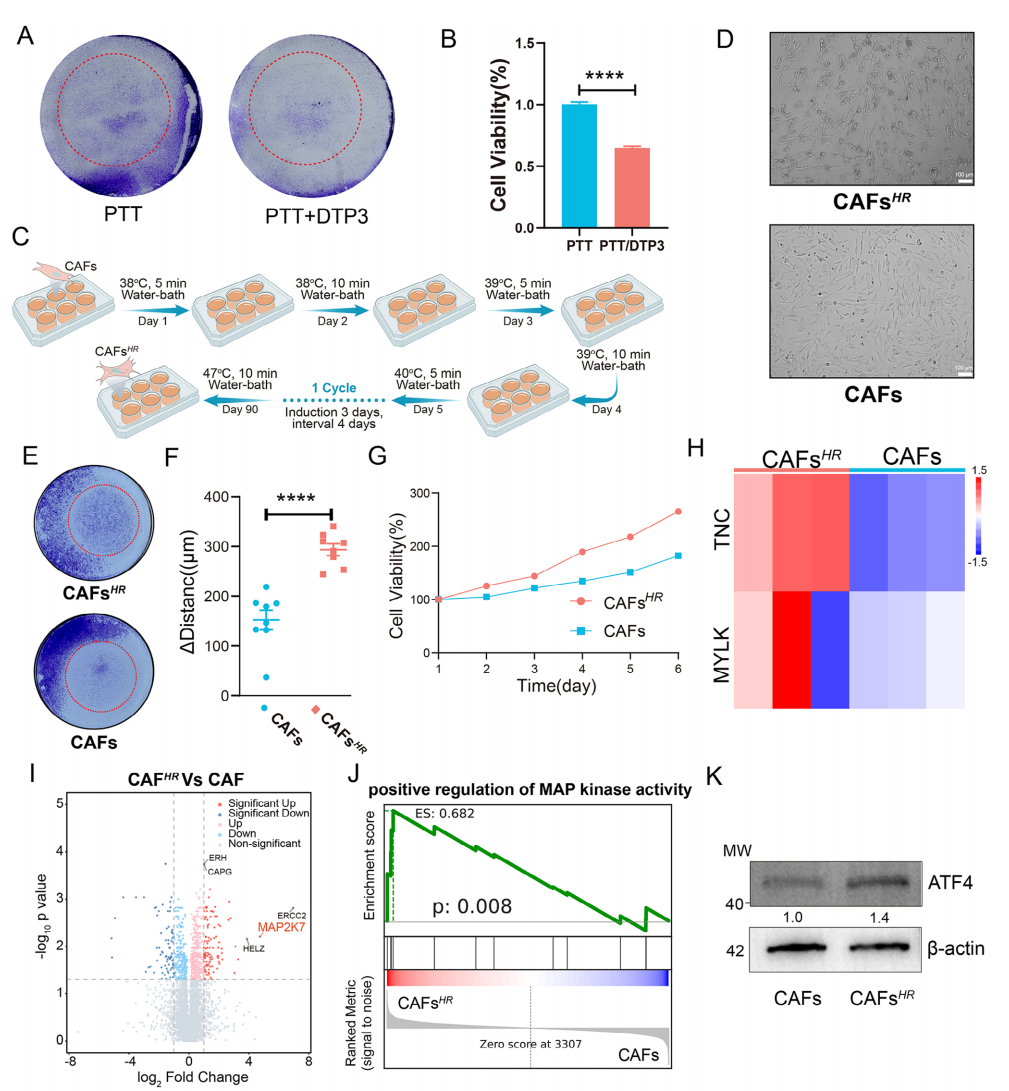
图7 耐热CAFs的验证
本研究确定了肿瘤相关成纤维细胞(CAFs)尤其是ECM CAFs在光热治疗(PTT)耐药中起关键作用。基于ECM CAFs中sigmar-1高表达,作者设计的ARS纳米平台可特异性抑制ECM CAFs,从而使细胞对PTT敏感,协同递送光热剂时,单次PTT的疗效显著提升。同时结合时空多组学及大量湿实验也探讨了ECM CAFs在PTT耐药性中的作用机制,创新性地提供了PTT敏化的新代谢和遗传治疗靶点——丝氨酸代谢和MAP2K7。未来,作者将使用MAP2K7特异性抑制剂或丝氨酸代谢抑制剂联合PTT进行系统研究,以验证其有效性并为临床试验铺平道路。
参考文献:https://doi.org/10.1002/adma.202502617






