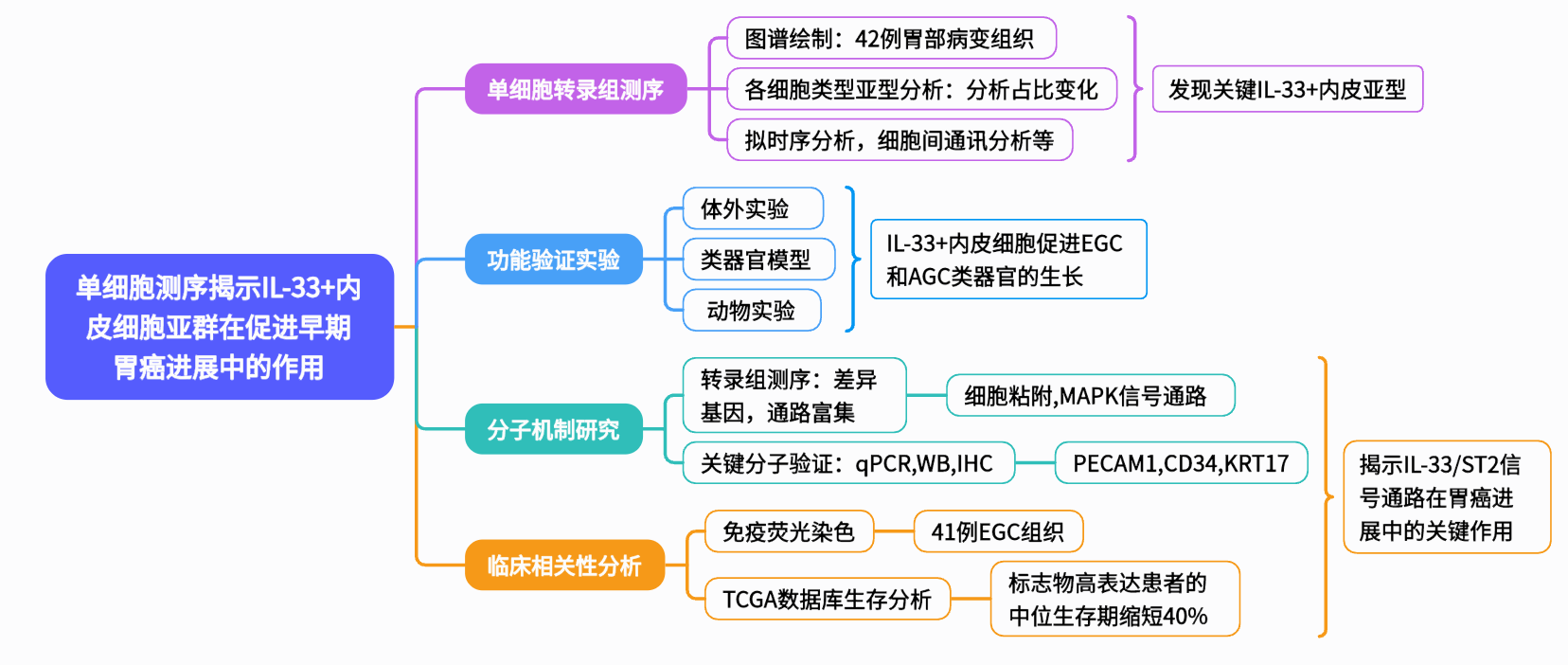
2025年6月5日,重庆医科大学附属第二医院的周智航团队在iMeta(IF=33.2)上发表题为“Single-cell sequencing reveals the role of IL-33+ endothelial subsets in promoting early gastric cancer progression”的研究论文。作者全面解析了早期胃癌的细胞组成和分子特征,揭示了IL-33+内皮细胞在促进肿瘤血管生成和进展中的关键作用。
本项目由欧易生物提供常规转录组测序和单细胞转录组测序等服务内容。
发表期刊:iMeta
影响因子:33.2
涉及的欧易生物服务产品:Bulk RNA测序,10×Genomics单细胞转录组测序
单细胞样本情况(结合内部和外部样本集):5例非萎缩性胃炎(NAG)活检、14例萎缩性胃炎伴肠化生(CAG-IM)活检、10例早期胃癌(EGC)样本、6例肿瘤淋巴结转移-II期(TNM-II)样本、5例肿瘤淋巴结转移-III期(TNM-III)样本和2例肿瘤淋巴结转移-IV期(TNM-IV)样本。

胃癌(GC)是全球第五大常见恶性肿瘤,EGC患者的5年生存率可达90%以上,而晚期胃癌(AGC)不足30%,凸显出早期诊断的重要性。肿瘤微环境(TME)在胃癌进展中发挥关键作用,其中血管内皮细胞的异质性和功能尚未完全阐明。IL-33作为IL-1家族细胞因子,在炎症和肿瘤中具有双重作用,但其在内皮细胞中的功能机制研究较少。本研究通过整合单细胞测序和类器官模型,系统探索EGC中IL-33+内皮细胞的特征和作用机制,为开发新的早期诊断标志物和治疗靶点提供理论依据。
本研究首先通过单细胞转录组测序,构建了EGC的单细胞图谱。在内皮细胞的分析中,发现IL-33+静脉-1亚群在EGC中特异性富集。体外实验证实IL-33通过上调PECAM1和CD34促进血管生成,并通过旁分泌作用增加肿瘤细胞KRT17表达。类器官和动物实验显示IL-33+内皮细胞显著促进肿瘤生长。临床样本分析表明IL-33表达与EGC恶性程度和不良预后显著相关。研究揭示了IL-33+内皮细胞通过“血管-肿瘤”双调控机制促进EGC进展,为早期诊断和治疗提供了新思路。
1.从胃炎进展为GC的单细胞图谱
本研究整合了42例胃部病变样本(5例NAG、14例CAG-IM、10例EGC和13例AGC),通过单细胞转录组测序,构建了完整的胃病变演进单细胞图谱,鉴定出8种主要细胞类型(上皮细胞、T/NK细胞、浆细胞、成纤维细胞、B细胞、肥大细胞、髓系细胞和内皮细胞)和22个亚群。作者发现,从胃炎到AGC,上皮细胞的比例逐渐下降。然而,随着GC的进展,T/NK细胞、B细胞、浆细胞、成纤维细胞、髓系细胞和内皮细胞的比例增加。这些发现与胃癌的临床发展一致。
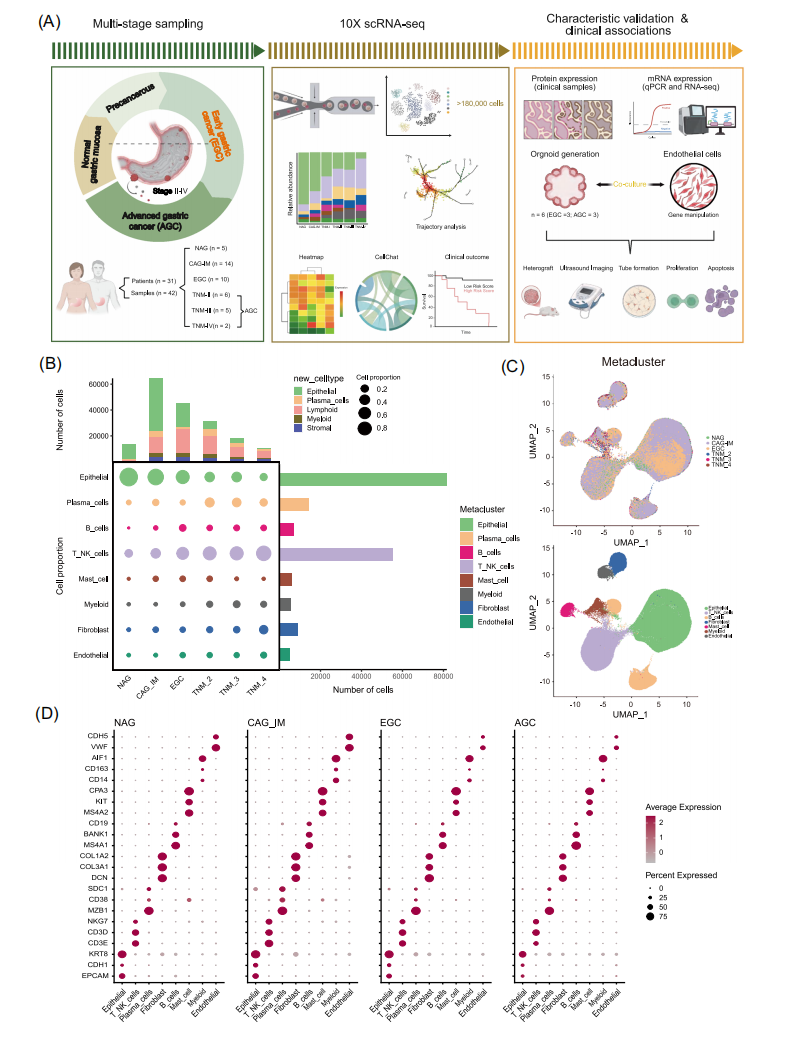
图1 从胃炎到GC进展的单细胞图谱
2.EGC中上皮细胞亚群的动态变化特征
通过对上皮细胞的深入分析,共鉴定出11个特征性上皮细胞亚群,包括基底腺黏液细胞(BMCs)、主细胞、肠上皮细胞等。其中,癌症前体细胞亚群在EGC中特异性富集,该亚群不仅高表达CEACAM5/CEACAM6等肿瘤标志物,还具有显著的拷贝数变异(CNVs)特征。通过TCGA数据验证发现,这些标志基因的表达水平与患者临床分期显著相关。
拟时序分析揭示了7条明确的分化轨迹,显示KRT18和DEFB1的表达水平随疾病进展呈现渐进性升高,而OLFM4的表达则在EGC阶段达到峰值后急剧下降。值得注意的是,TCGA数据分析证实,这些标志基因的高表达与患者不良预后显著相关,其中高表达组患者的5年生存率降低约30%。数据库验证还发现,在增殖细胞(PCs)亚群中异常高表达的癌基因(如CRABP2、LGR6等)与肿瘤转移风险显著相关。
研究进一步通过TCGA和GEO数据库联合分析发现,PMC-like亚群呈现明显的动态变化特征:MSLN+和XIST+亚群在EGC中显著增加,而LIPF+亚群则主要存在于正常组织中。通路富集分析显示,这些异常增殖的细胞亚群中核糖体通路被显著激活,这一发现在多个独立数据集中得到验证。
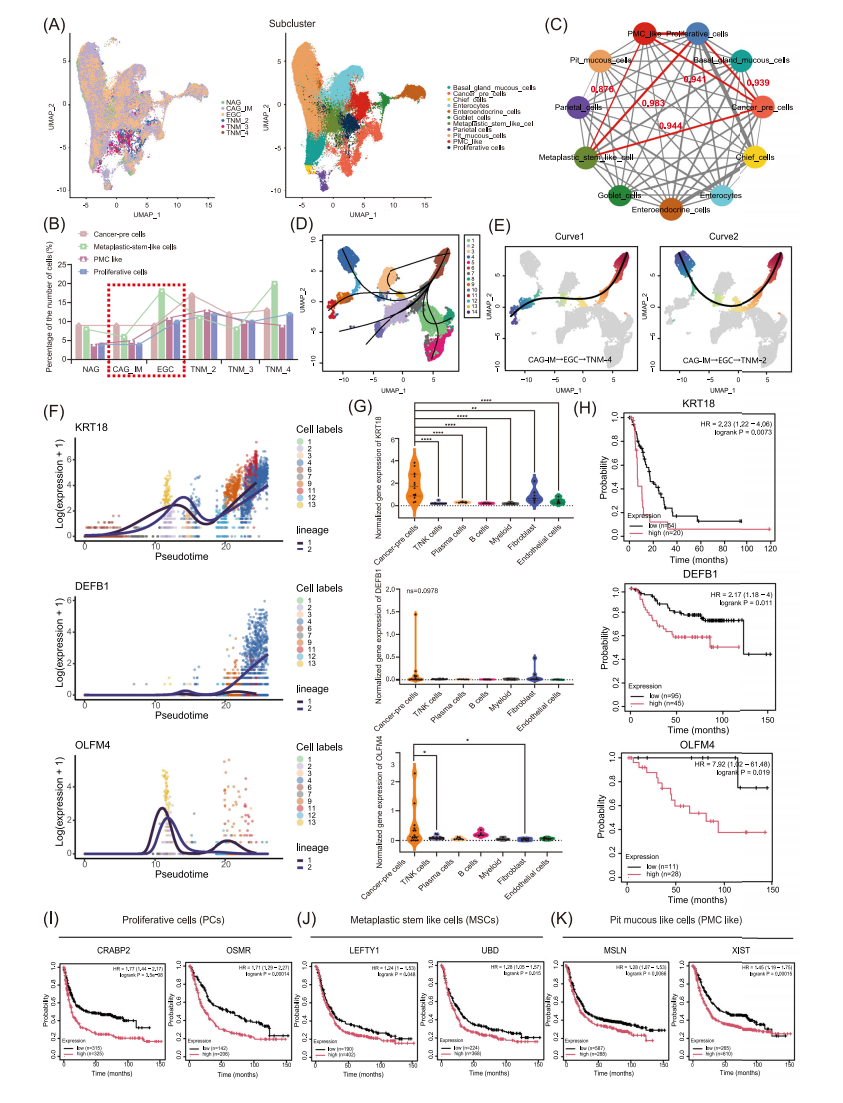
图2 胃癌上皮细胞的细胞谱系注释
3.EGC中T细胞亚群的组成特征及其临床意义
本研究进一步发现EGC微环境中存在显著的免疫细胞比例失衡,其中CD4+ T细胞亚群呈现Treg细胞(FOXP3+CTLA4+)和CCR7+ naive T细胞同时增加的特征。Spearman相关性分析显示,Treg细胞比例与肿瘤临床分期呈显著正相关。特别值得注意的是,研究首次鉴定出CH25H+CD4+这一独特的T细胞亚群在EGC中特异性富集,该亚群同时高表达耗竭标志物(PD-1、LAG-3等),提示其在肿瘤免疫逃逸中的潜在作用。TCGA生存分析证实其高表达与患者较差的5年生存率显著相关,提示其在肿瘤免疫逃逸中的潜在作用。
在CD8+ T细胞方面,研究观察到效应记忆T细胞(TEM)和GFPT2+亚群的显著增加,相关性分析显示TEM细胞比例与肿瘤突变负荷(TMB)呈正相关。具有黏膜免疫监视功能的MAIT细胞比例明显下降,TCGA数据验证其减少与患者不良预后显著相关,可能与其抗肿瘤免疫功能受损有关。
这些发现系统揭示了EGC特有的免疫抑制微环境特征:一方面,Treg和CH25H+亚群可能通过抑制抗肿瘤免疫应答促进疾病进展;另一方面,MAIT细胞的减少可能导致黏膜免疫防御功能下降。研究结果为理解EGC的免疫逃逸机制提供了新视角,并为开发针对这些特异性T细胞亚群的免疫治疗策略奠定了重要基础。特别是CH25H+CD4+亚群的发现,为EGC的免疫分型和精准治疗提供了潜在的生物标志物。
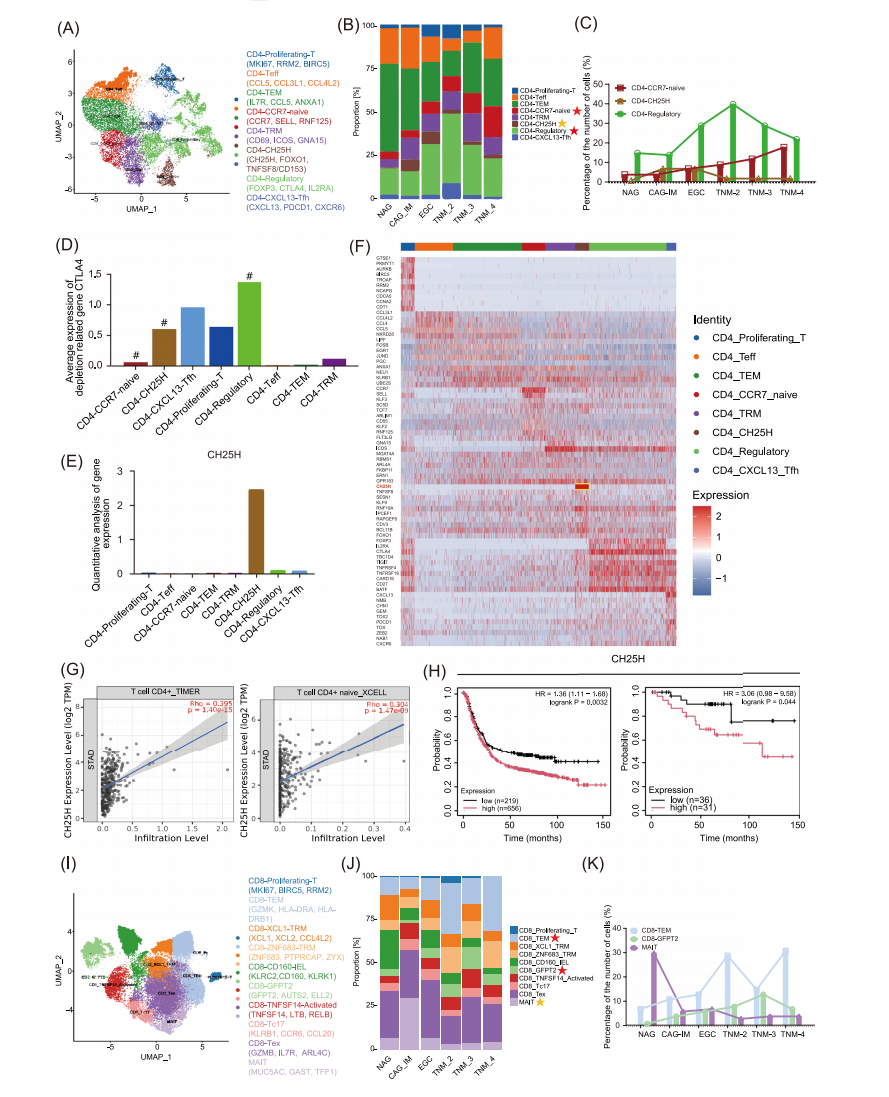
图3 T细胞状态的特征
4.EGC中B细胞和髓系细胞的动态变化特征
研究发现EGC组织中B细胞呈现显著扩增趋势,共鉴定出5个功能各异的B细胞亚群。其中,B-C5亚群特异性高表达TCLLA基因,且所有B细胞亚群均表现出MS4A1/CD20的显著上调,这一发现与TCGA数据库中胃癌患者的B细胞特征高度一致。
在髓系细胞方面,研究成功鉴定出7个特征性亚群,包括3个树突状细胞亚群和2个巨噬细胞亚群(M1/M2)。值得注意的是,M1型巨噬细胞在TNM II-III期显著增加,而在IV期却明显减少;单核细胞在EGC阶段呈现特异性扩增;中性粒细胞则表现出从正常黏膜缺失到随疾病进展逐渐出现的动态变化特征。通过CellChat通讯分析发现,这些髓系细胞亚群与癌前细胞之间存在复杂的配体-受体相互作用,特别是通过CCL3-CCR1等信号通路参与微环境调控。
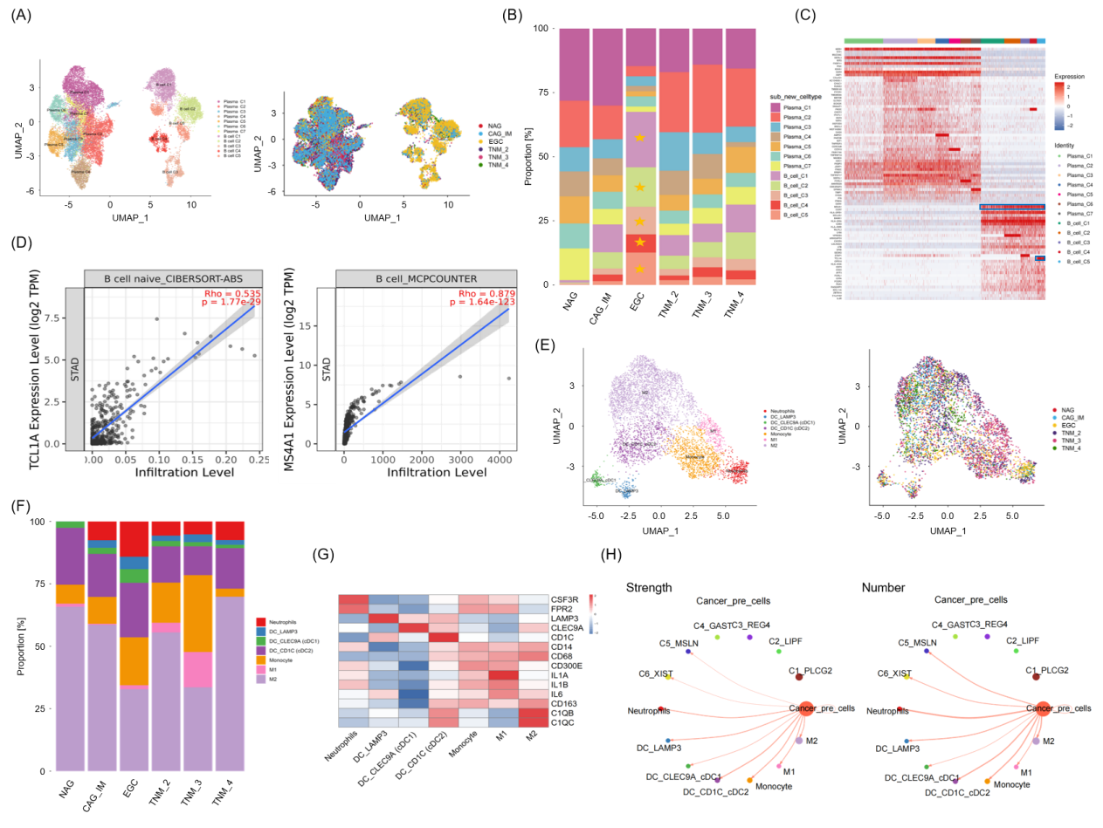
图4 B细胞和单核细胞在EGC中增加
5.EGC中癌症相关成纤维细胞(CAFs)的特征及动态变化
研究鉴定出5个主要CAFs亚群:基质型(CAFmat)、炎症型(CAFinfla)、脂肪细胞型(CAFadi)、肌成纤维细胞型(CAFmyo)和上皮-间质转化型(CAFEMT)。研究发现,在EGC阶段,成纤维细胞亚群保持相对稳定,但随着疾病进展至晚期胃癌(AGC),CAFinfla和CAFEMT亚群比例显著增加,而CAFmat亚群则明显减少。特别值得注意的是,CAFinfla-PRSS35、CAFinfla-MFAP5和CAFEMT-KRT19亚群在TNM-IV期肿瘤中特异性富集。生存分析显示,PRSS35和MFAP5的高表达与患者不良预后显著相关。CellChat分析揭示了这些CAFs亚群与癌前细胞之间存在复杂的细胞间通讯网络。这些发现表明,虽然EGC阶段成纤维细胞保持相对稳定,但在疾病进展过程中会发生明显的表型转变,提示CAFs亚群的重编程可能参与调控胃癌的恶性进展。
6.胃癌微环境中的内皮细胞异质性
作者鉴定出7种内皮细胞亚群,随着疾病进展,IL-33+静脉-1和ADAMTSL2+动脉-2亚群的比例显著增加,而CA4+毛细血管-2亚群则明显减少。其中,IL-33+静脉-1亚群表现出独特的分子特征,高表达IL-33和多种细胞黏附分子(MADCAM1、SELP和SELE),这些分子在免疫调节和血管生成中发挥关键作用。
生存分析显示,IL-33及其相关黏附分子的高表达与患者不良预后显著相关。进一步研究发现,IL-33+静脉-1亚群不仅与ENPEP+毛细血管-1亚群存在密切的细胞间相互作用,还与癌症前体细胞亚群建立了复杂的通讯网络。这些发现揭示了内皮细胞亚群在胃癌微环境中的动态变化规律,特别是IL-33+静脉-1亚群可能通过调控肿瘤血管生成和免疫微环境促进胃癌进展。
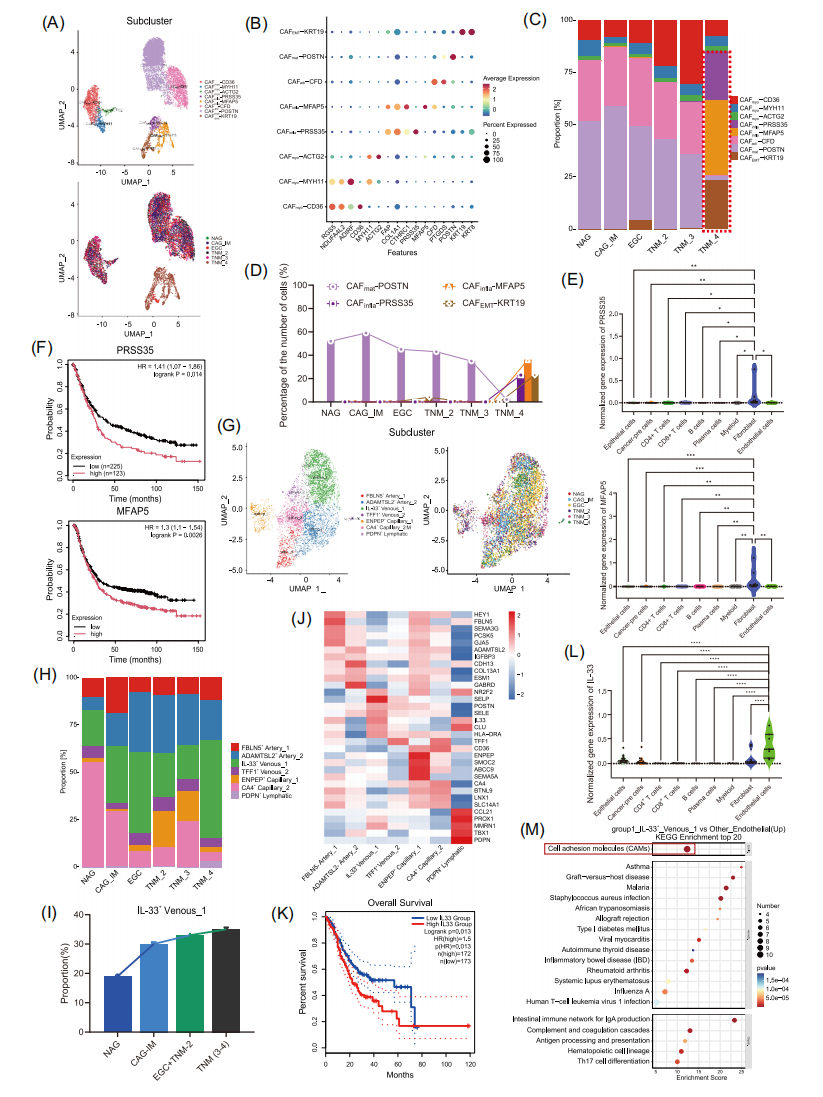
图5 基质细胞在GC进展中的重塑
7.体外和体内实验验证IL-33+内皮细胞促进EGC和AGC类器官的生长
研究发现,IL-33在EGC和AGC的内皮细胞中高表达,其受体ST2在肿瘤细胞和内皮细胞中的表达随疾病进展而增加。通过体外实验证实,IL-33过表达能显著促进人脐静脉内皮细胞(HUVECs)的血管形成能力和细胞增殖,同时抑制细胞凋亡。作者利用患者来源的EGC和AGC类器官模型进一步发现,IL-33敲低的内皮细胞条件培养基抑制类器官生长,而外源性重组IL-33蛋白则可促进其生长。
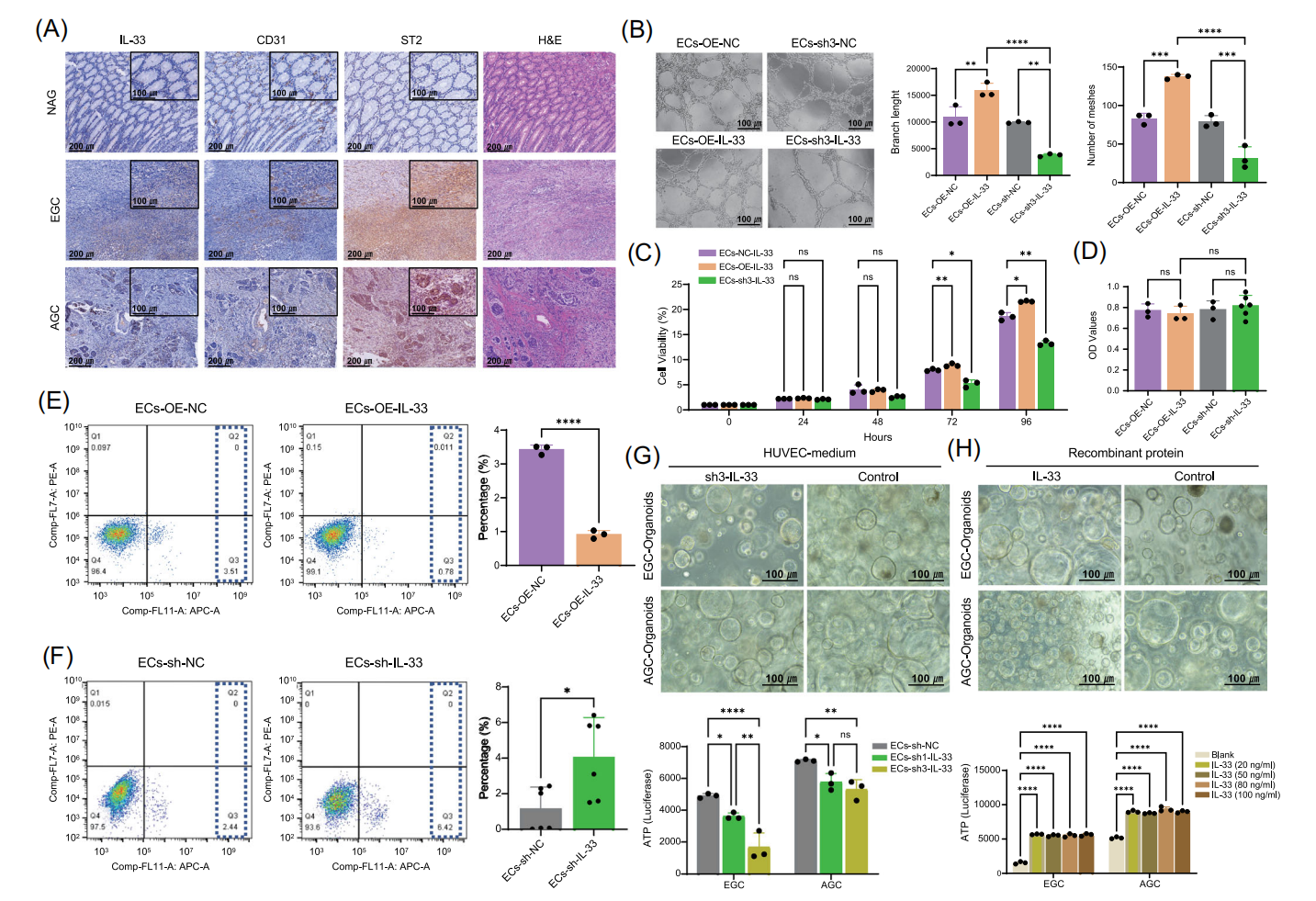
图6 IL-33驱动内皮血管生成,IL-33+EC促进体外EGC和AGC生长
在重度联合免疫缺陷(SCID)小鼠体内实验中,IL-33过表达的内皮细胞显著增强了EGC和AGC类器官的肿瘤形成能力,而IL-33敲低则产生相反效果。值得注意的是,超声检测显示IL-33敲低组的肿瘤血管生成减少、坏死区域增多,且血管主要分布在肿瘤周边而非核心区域。血流动力学参数分析表明,IL-33敲低组的峰值收缩速度和阻力指数较低,提示EGC的恶性程度较AGC为低。
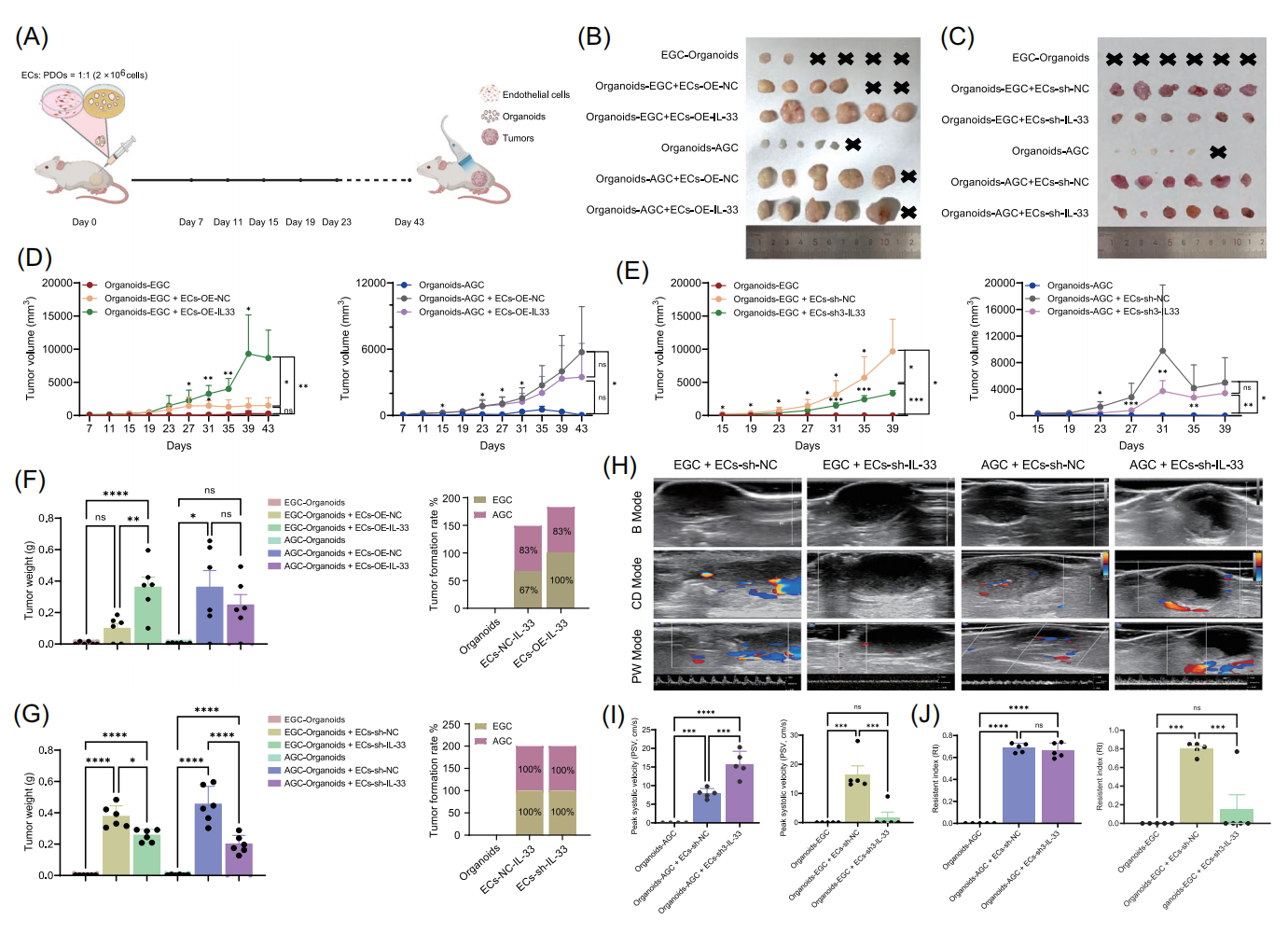
图7 IL-33+ECs促进EGC和AGC血管生成和体内生长
8.转录组测序和功能实验系统揭示IL-33/ST2信号通路在胃癌进展中的关键作用
在体外实验中,采用慢病毒转染技术构建IL-33敲低和过表达的HUVECs细胞模型,qPCR和Western blot结果显示IL-33显著上调内皮细胞黏附分子PECAM1和CD34的表达。临床样本免疫荧光分析(41例EGC组织)证实,IL-33和CD34的高表达与肿瘤浸润深度和病理分级显著相关。
在类器官实验中,通过建立患者来源的EGC类器官模型,发现重组IL-33处理可特异性上调KRT17基因表达,RNA-seq分析显示差异基因主要富集于细胞黏附和MAPK信号通路。动物实验进一步验证,IL-33过表达组的移植瘤体积较对照组增大,免疫组化显示肿瘤组织内微血管密度增加。
机制研究表明,IL-33通过双重作用促进胃癌进展:1)自分泌途径激活内皮细胞PECAM1/CD34促进血管生成;2)旁分泌途径通过ST2受体上调肿瘤细胞KRT17表达。生存分析显示,这4个标志物高表达患者的中位生存期缩短约40%。
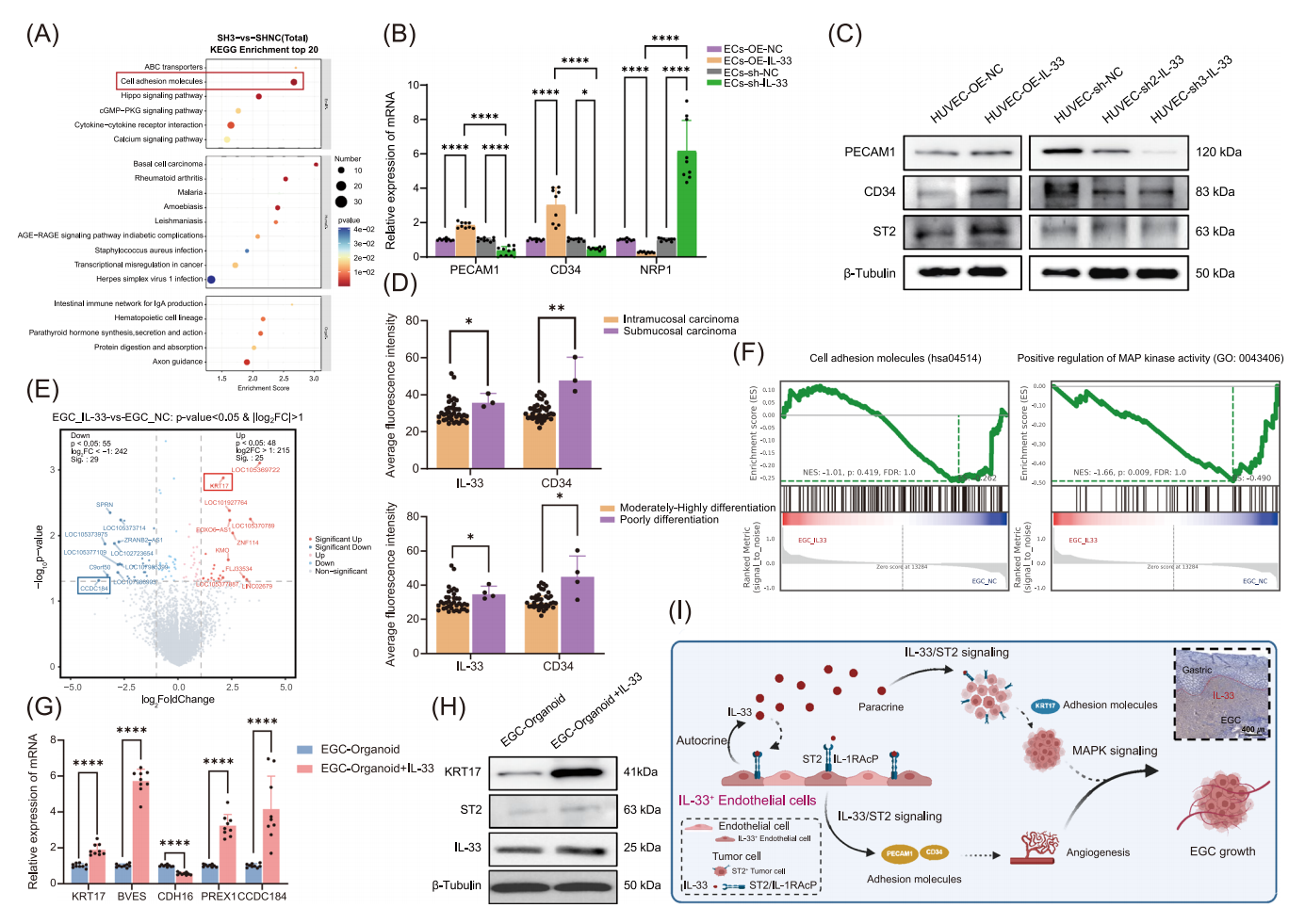
图8 IL-33上调EC和EGC相关黏附分子的表达
本研究构建了全面的EGC单细胞图谱,鉴定出IL-33+内皮细胞亚群在EGC进展中的关键作用。该亚群通过双重机制促进血管生成和肿瘤生长,其作为早期胃癌的分子标志物具有临床诊断价值。研究成果为EGC的早期干预提供了新思路,IL-33/ST2通路是值得深入研究的治疗靶点。
参考文献:https://doi.org/10.1002/imt2.70050






