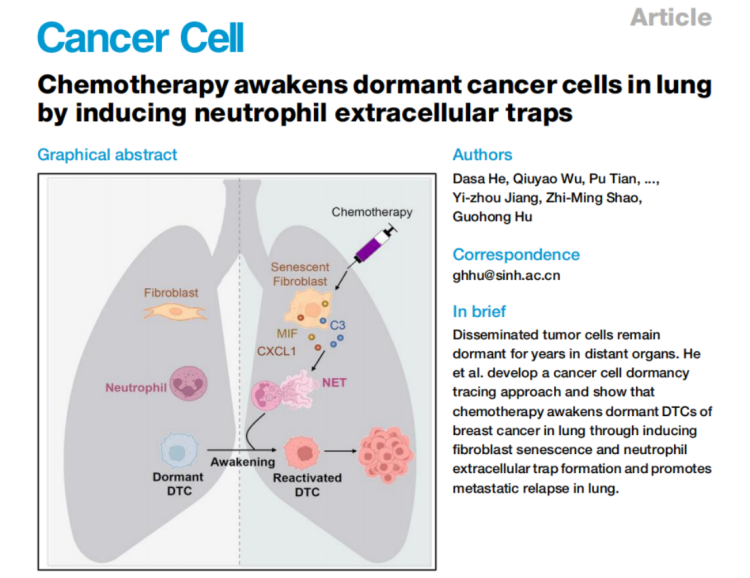
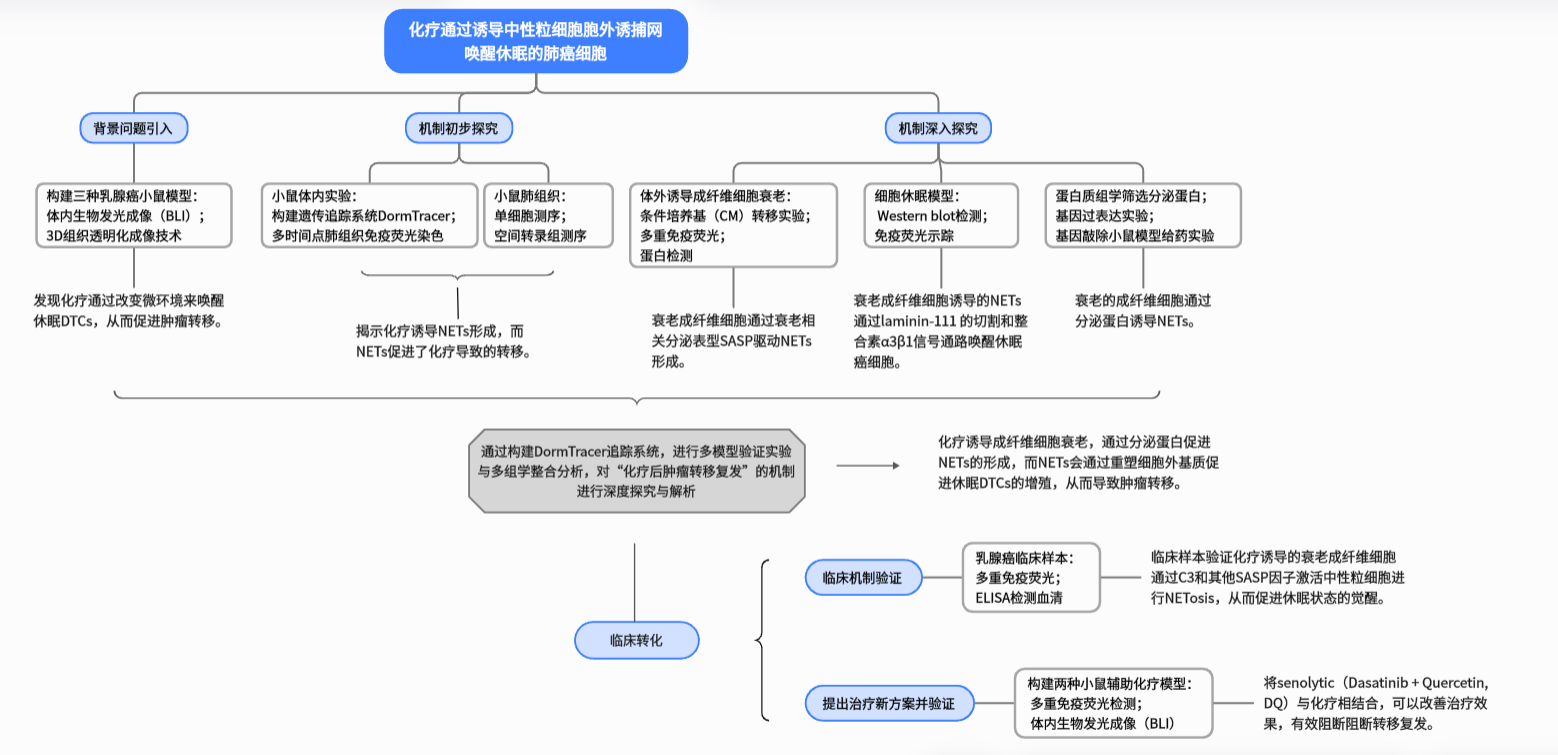
2025年7月3日,中国科学院上海营养与健康研究所胡国宏研究组在Cancer Cell杂志(IF=44.5)在线发表了题为Chemotherapy awakens dormant cancer cells in lung by inducing neutrophil extracellular traps的文章。该研究通过开发休眠肿瘤细胞谱系追踪系统DormTracer,首次证明化疗通过诱导成纤维细胞衰老和中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)形成,可以唤醒肺部休眠的播散性肿瘤细胞(Disseminated tumor cells,DTCs) ,促进肿瘤转移,这一机制解释了乳腺癌患者在临床上接受化疗获得初始疗效后仍会发生转移复发的现象。除此之外,该研究还提出了新型的Senolytic联合化疗的治疗策略,可以有效抑制DTCs在化疗后被唤醒,这为提高乳腺癌化疗疗效提供了防止复发的新方案,在临床应用上意义重大。
发表期刊:Cancer Cell
影响因子:44.5
涉及的欧易生物服务产品:10x单细胞测序、Visium空间转录组测序
在临床治疗中,即使在初次治疗后原发肿瘤完全消失,癌症仍可能复发。据推测,远处器官中休眠的DTCs的重新激活或苏醒,会导致无症状期后出现转移性复发。既往研究已在非转移性疾病动物中观察到休眠和持续存在的DTCs。多项研究还揭示了调节DTC休眠和转移性复发的分子机制。然而,既往对DTCs的分析无法区分是由休眠重新激活还是已存在的、罕见的增殖DTCs的扩张而导致的转移。而了解DTC复发的外部原因,将有助于癌症幸存者的疾病管理,为在初始治疗后预防和中断转移性复发提供机会。基于目前尚不清楚DTCs是否以及如何在长时间休眠后苏醒并导致转移的现状,该研究探讨了化疗促进休眠唤醒及肺部复发的影响和机制。
本研究通过构建多种乳腺癌小鼠模型,发现化疗会通过改变肺部微环境,而非直接作用于肿瘤细胞,来显著增加肺部休眠DTC的增殖。接下来构建了DormTracer系统,明确证实了DTCs在化疗后从休眠中苏醒并发生转移。随后通过单细胞RNA测序和空间转录组分析,在机制上挖掘发现化疗诱导成纤维细胞衰老,并且通过分泌蛋白促进NETs的形成,而NETs通过重塑细胞外基质促进休眠DTCs的增殖。最后,研究团队还提出,将衰老细胞清除药物 Senolytic(达沙替尼+槲皮素)与化疗药物阿霉素联合使用,不仅能抑制原发部位肿瘤生长,还能清除治疗诱导的衰老成纤维细胞,从而有效控制辅助治疗和新辅助治疗中的远处复发(目前该治疗方案已经启动NCT06355037 Ⅱ期临床试验)。
Result 1 化疗通过改变微环境来唤醒休眠DTCs,从而促进肿瘤转移
通过构建三种乳腺癌小鼠模型,对相关细胞进行体内标记后,利用体内生物发光成像bioluminescent imaging(BLI)和3D组织透明化成像技术,发现了化疗会显著增加肺内休眠DTCs的增殖比例(EdU+细胞↑),并加速转移灶形成(BLI信号↑);且该效应在化疗预处理模型中同样存在,证明化疗通过改变肺部的微环境,而不是直接作用于肿瘤细胞来唤醒休眠DTCs。
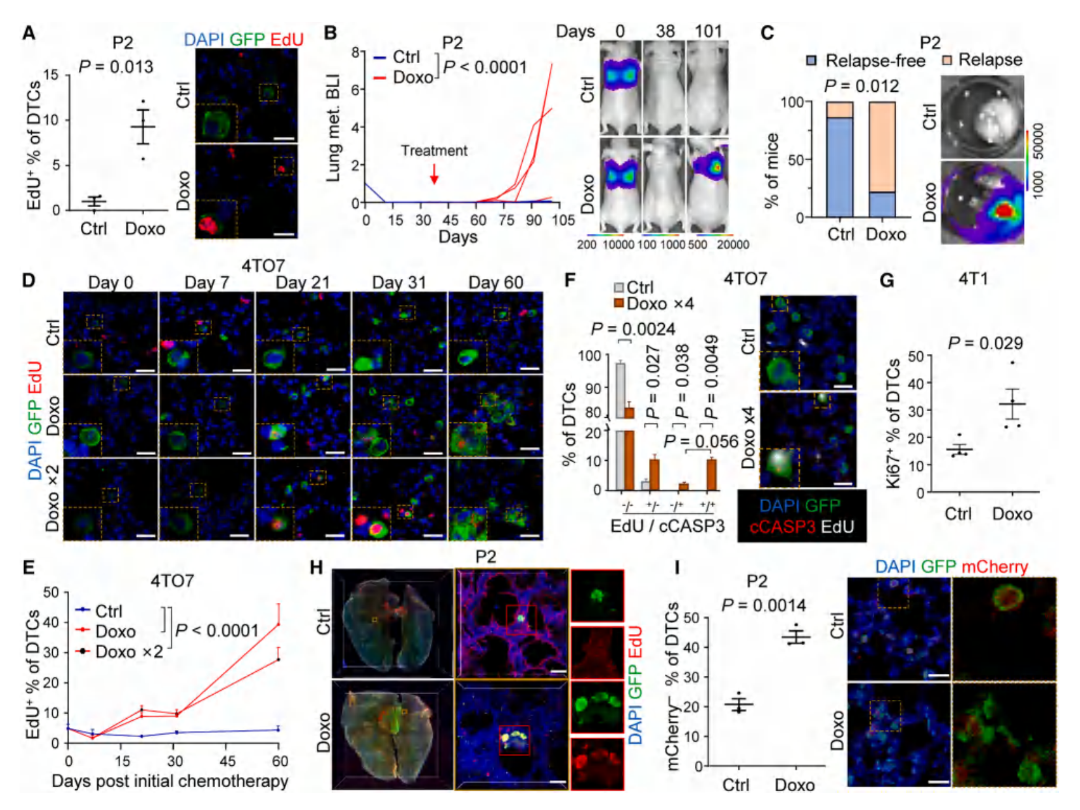
图1. 化疗促进肺部休眠DTC的转移性生长
Result 2 通过DormTracer系统直接证实休眠DTCs被化疗激活,导致肺部转移复发
开发了基于p27K⁻-Cre-LoxP的遗传追踪系统(DormTracer),将DormTracer-engineered P2细胞注入小鼠,化疗处理后对小鼠进行长期追踪,通过对多时间点肺组织mCherry/Ki67免疫荧光染色来区分持续增殖(mCherry⁻Ki67⁺)、休眠(mCherry⁺Ki67⁻)和再激活(mCherry⁺Ki67⁺)的三类DTCs。发现化疗组再激活DTCs的比例随时间持续增加,且转移灶几乎全部来源于再激活细胞,这提供了休眠细胞被化疗唤醒的直接证据。
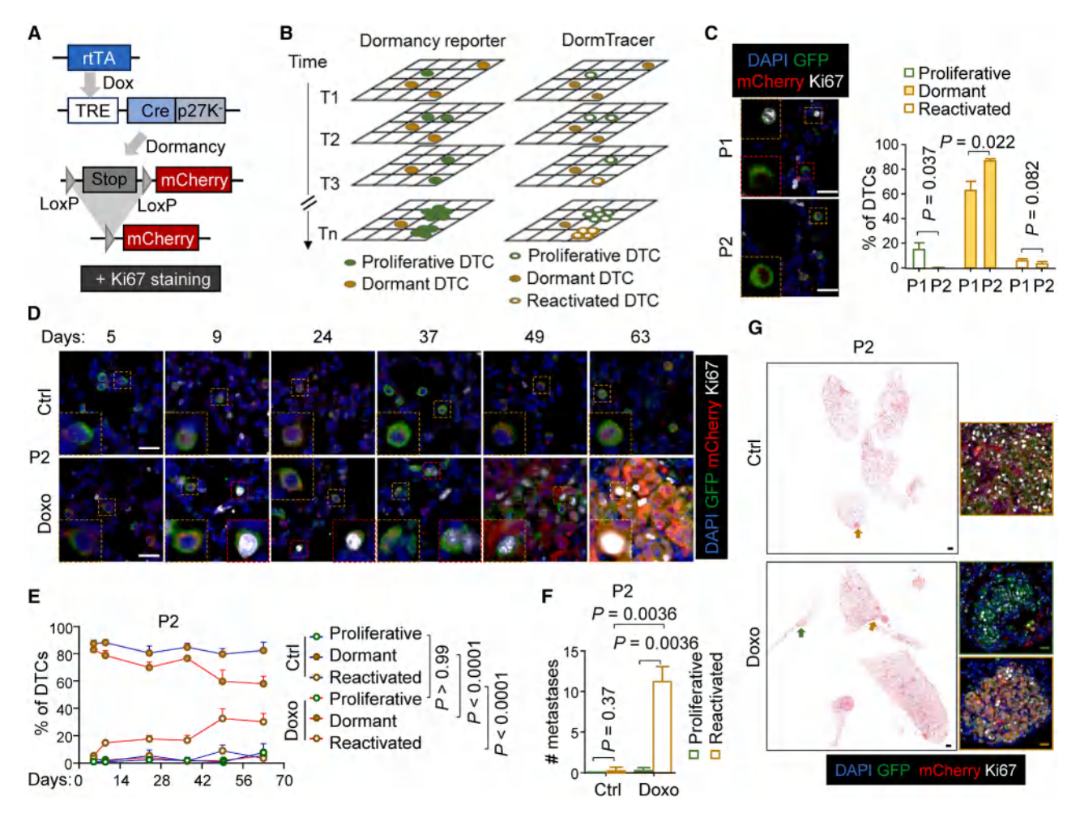
图2. 化疗唤醒肺部休眠的DTCs
Result 3 单细胞与空间组学揭示化疗诱导NETs形成,而NETs促进了化疗导致的转移
对4T1原位肿瘤切除后的小鼠肺组织进行了单细胞RNA测序(scRNA-seq),发现了化疗后肺内特异性中性粒细胞亚群(高表达NET标志物Padi4)大幅增多,证明了化疗诱导肺部中性粒细胞的NETs形成,即NETosis。随后进一步利用空间转录组测序(ST-seq)技术对携带4T1 DTCs的肺组织进行了分析,结果显示化疗后中性粒细胞仍呈现NETs形成特征。而免疫荧光结果显示,抑制NETs(GSK484/DNase I)可以完全阻断化疗药物对DTCs的再激活,并对NETosis的抑制也显示出类似的效果。
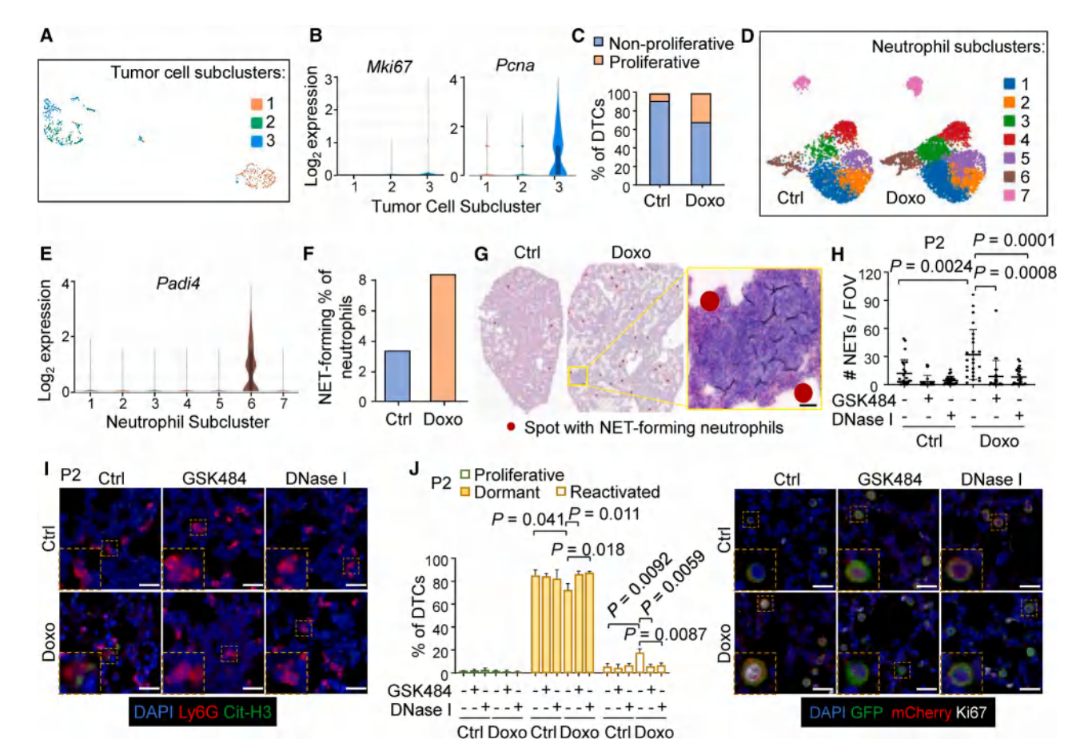
图3. 化疗诱导的NETosis对DTCs再活化至关重要
Result 4 衰老成纤维细胞通过衰老相关分泌表型(senescence-associated secretory phenotype,SASP)驱动NETs形成
ST-seq分析结果显示,化疗的小鼠肺中成纤维细胞衰老比例增加,且分泌C3/CXCL1/MIF等SASP因子。并通过体外诱导人/鼠成纤维细胞衰老(阿霉素/顺铂/紫杉醇处理)实验,p21蛋白表达、β-半乳糖苷酶(SA-β-gal)染色及肺组织免疫荧光(IF)染色技术,发现衰老条件培养基会直接诱导NETosis,而清除衰老细胞(ABT-263)可逆转该效应。
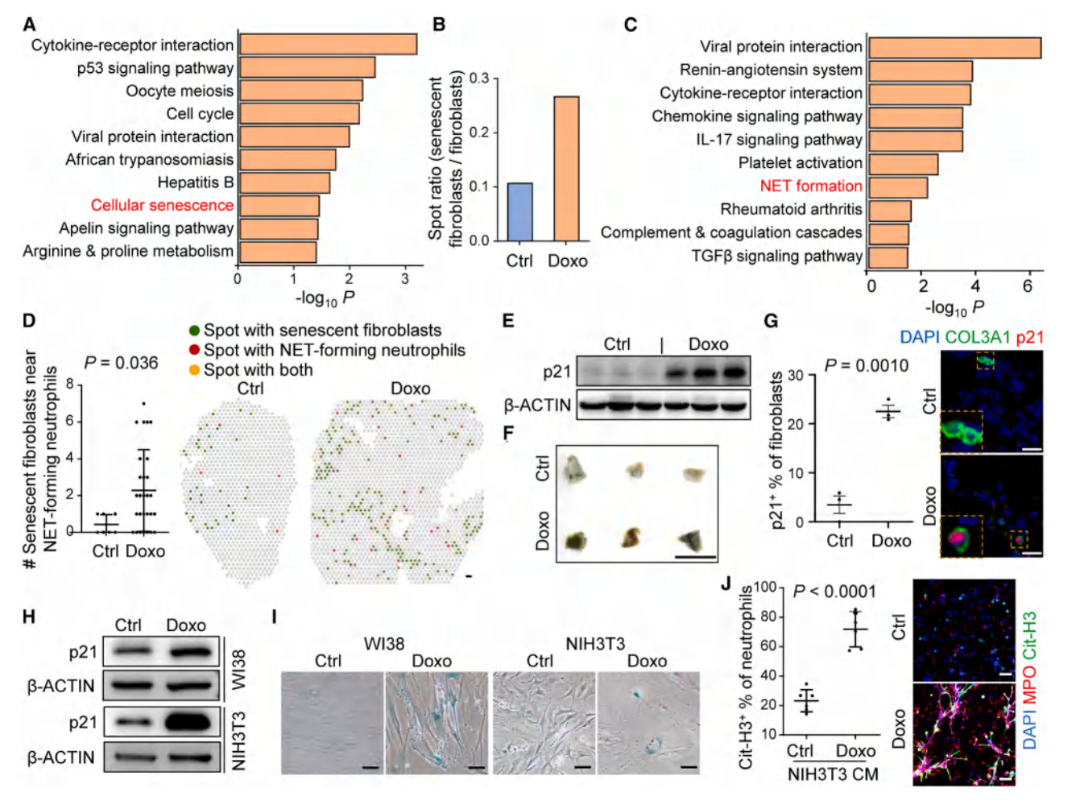
图4. 化疗诱导的衰老成纤维细胞激活NETosis
Result 5 衰老成纤维细胞诱导的NETs通过层粘连蛋白-111(laminin-111 )的切割和整合素α3β1信号通路(integrin α3β1 signaling)唤醒休眠的癌细胞
通过3D培养的细胞实验,结合DormTracer系统,由Western blot、免疫荧光示踪证实了NETs释放的蛋白酶(NE/MMP9)降解层粘连蛋白-111,激活整合素α3β1及其下游FAK-ERK信号通路,驱动休眠细胞再增殖。
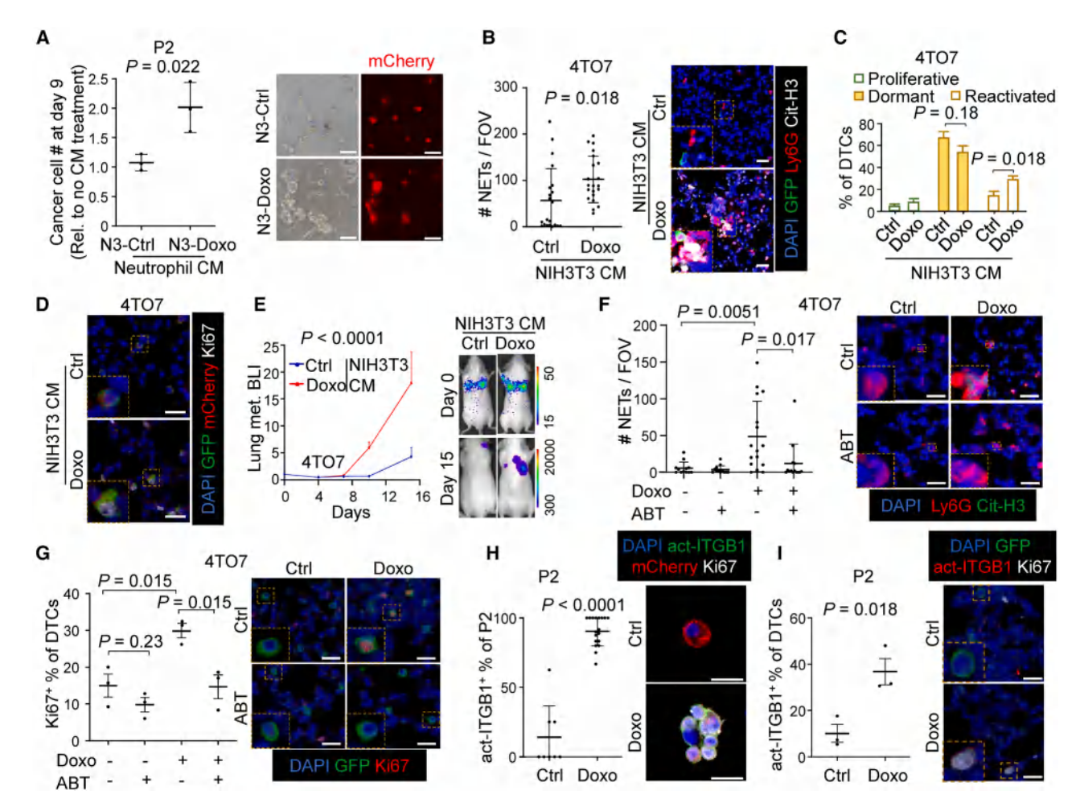
图5. 衰老成纤维细胞促进NETosis和休眠激活
Result 6 衰老的成纤维细胞通过分泌蛋白诱导NETs
通过蛋白质谱分析筛选了衰老成纤维细胞中上调的分泌蛋白,随后用重组蛋白(C3a/CXCL1/MIF)刺激中性粒细胞,另外还通过C3在成纤维细胞过表达和构建C3基因敲除小鼠模型等,证实了分泌蛋白C3是衰老成纤维细胞分泌的关键的NETosis诱导因子;小鼠宿主C3缺失使化疗诱导的NETs减少,且肺转移也得到了抑制。
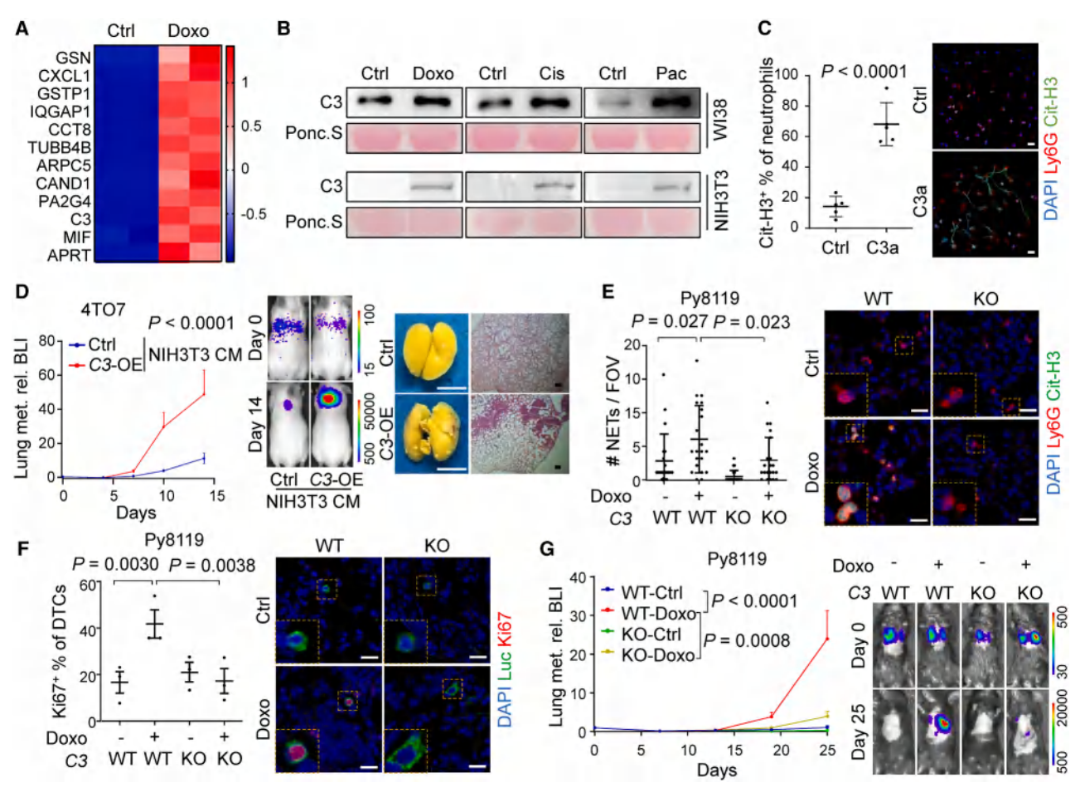
图6. 成纤维细胞分泌的C3会增强NETosis并促进肺部转移
Result 7 临床样本验证化疗诱导的衰老成纤维细胞通过C3和其他SASP因子激活中性粒细胞进行NETosis,从而促进休眠状态的觉醒
收集临床上的乳腺癌肺转移灶样本和患者化疗前后血清,通过多重免疫荧光和ELISA检测发现,在转移灶中,C3/CXCL1/MIF的表达与NETs密度正相关,患者化疗后血清C3/MIF水平显著升高,且肺转移水平高于未转移者。
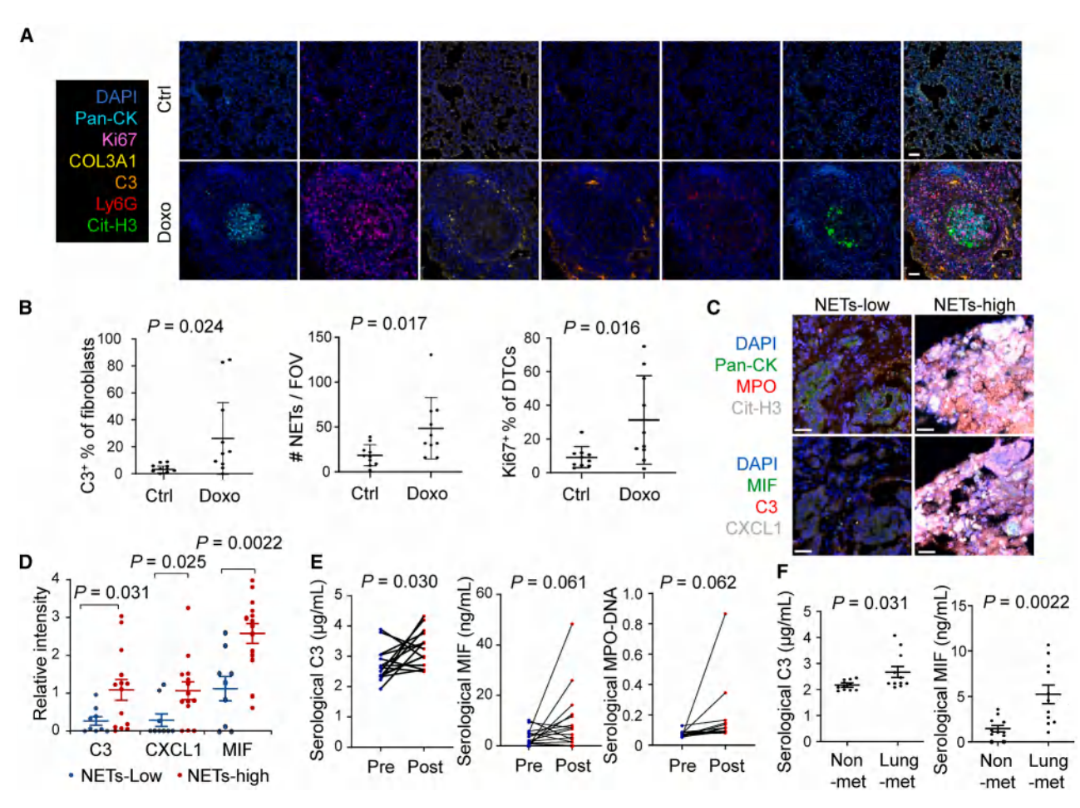
图7. C3、CXCL1和MIF与NETs形成和肺部复发相关
Result 8 将senolytic(Dasatinib + Quercetin, DQ)与化疗相结合,可以改善治疗效果,有效阻断转移复发
在小鼠辅助化疗模型中,DQ治疗可以有效清除化疗诱导的衰老成纤维细胞,抑制了肺部的NETosis和DTC增殖,消除了化疗引起的肺部复发。当DQ用于新辅助化疗时,虽然不能抑制已由新辅助化疗抑制的原发肿瘤生长或扩散,但也能有效抑制由化疗增强的肺部NETosis、DTCs增殖和转移性定殖。这些结果表明,将DQ与化疗相结合的乳腺癌治疗策略很有前景。
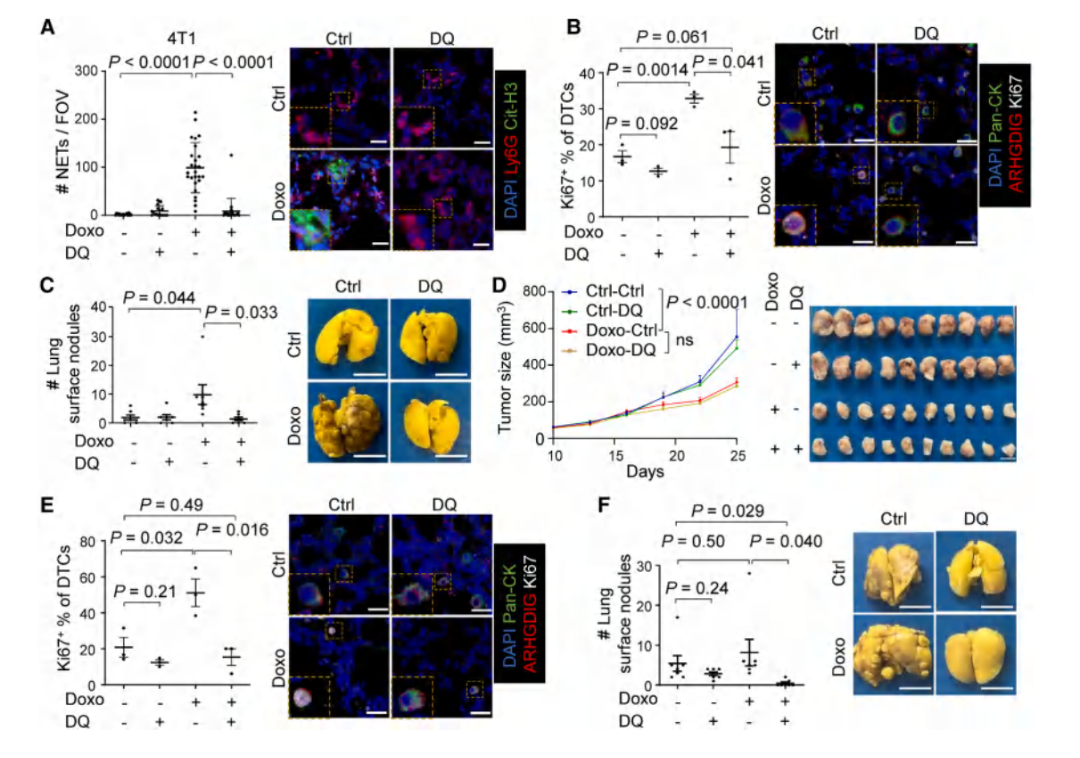
图8. DQ与化疗联合治疗可提高治疗效果
本研究发现,化疗会通过改变肺部微环境显著增加肺中休眠DTC的增殖。还通过DormTracer系统,明确证实DTCs在化疗后从休眠中苏醒并发生转移。随后在机制上发现化疗会诱导成纤维细胞衰老,并且通过分泌蛋白促进NETs的形成,而NETs通过重塑细胞外基质促进休眠DTCs的增殖。还提出,将衰老细胞清除药物 Senolytic(达沙替尼+槲皮素)与化疗药物阿霉素联用,可以通过选择性清除化疗诱导的衰老成纤维细胞,抑制NETs形成和DTCs唤醒来有效防止肿瘤转移。
总的来说,这项研究提供了休眠唤醒的直接证据,揭示了化疗对转移产生不利影响的机制,提出了在临床上改善癌症治疗的潜在策略。
原文链接:https://doi.org/10.1016/j.ccell.2025.06.007
He, Dasa et al. “Chemotherapy awakens dormant cancer cells in lung by inducing neutrophil extracellular traps.”Cancer cell, S1535-6108(25)00257-0. 24 Jun. 2025, doi:10.1016/j.ccell.2025.06.007






