2025年6月11日,暨南大学研究团队在期刊《Molecular Cancer》上发表了题为“Single-cell transcriptome reveals the reprogramming of immune microenvironment during the transition from MASH to HCC”的研究论文,通过构建 MASH 驱动的 HCC 小鼠模型,对不同阶段小鼠肝脏免疫细胞进行单细胞转录组测序,清晰地描绘出从 MASH 到 HCC 转变过程中肝脏免疫微环境的重编程过程,并揭示载脂蛋白 E(ApoE)在此过程中的关键促癌作用。欧易生物为单细胞转录组测序及分析提供了技术支持。

文章标题:Single-cell transcriptome reveals the reprogramming of immune microenvironment during the transition from MASH to HCC
发表期刊:Molecular Cancer
影响因子:27.7
涉及的欧易生物服务产品:单细胞转录组测序
肝细胞癌(HCC)是全球最常见的恶性肿瘤,90%的病例与肝硬化和慢性炎症密切相关。目前代谢功能障碍相关脂肪性肝炎(MASH)引起的HCC发病率显著上升,它以脂肪变性、纤维化和慢性炎症为特征,可进展为肝硬化乃至HCC。但是36.6%至50%的MASH患者HCC病例在无肝硬化的情况下发生,表明MASH相关HCC的发展可能涉及独特的病理生理机制。本研究旨在阐明MASH向HCC转变过程中的免疫学特征,并识别对MASH相关HCC发病机制有关键作用的基因。
首先构建了一个成熟的MASH驱动的HCC小鼠模型——STAM模型。取5例正常饮⻝、5例MASH饮⻝、5例HCC、5例癌旁肝脏组织,分选CD45+免疫细胞进⾏单细胞转录组测序。通过一系列生物信息学分析方法,全面解析免疫细胞在MASH向HCC转变过程中的动态变化。然后采用流式细胞术和多重免疫组化实验验证scRNA-seq的分析结果。最后,利用STAM模型比较ApoE缺陷小鼠和野生型对照小鼠的肿瘤发生情况。

一、MASH到HCC转变过程中肝脏免疫细胞图谱构建
对正常饮食、MASH饮食小鼠的肝脏组织,及HCC小鼠癌和癌旁组织的免疫细胞进行单细胞转录组测序,经质控分析获得31,882个细胞,分为23个簇,涵盖T细胞、B细胞、NK细胞及其他髓系细胞等9种细胞类型。对免疫细胞的占比进行分析,发现与正常饮食组相比,MASH组中性粒细胞、单核细胞、树突状细胞和嗜碱性粒细胞等显著增加,B细胞数量减少,表明MASH阶段肝脏微环境呈高度促炎症特征;HCC组中,肥大细胞、树突状细胞和肿瘤相关巨噬细胞增多,造血干细胞和嗜碱性粒细胞减少。图一呈现了肝脏免疫细胞图谱及各组细胞类型比例变化。
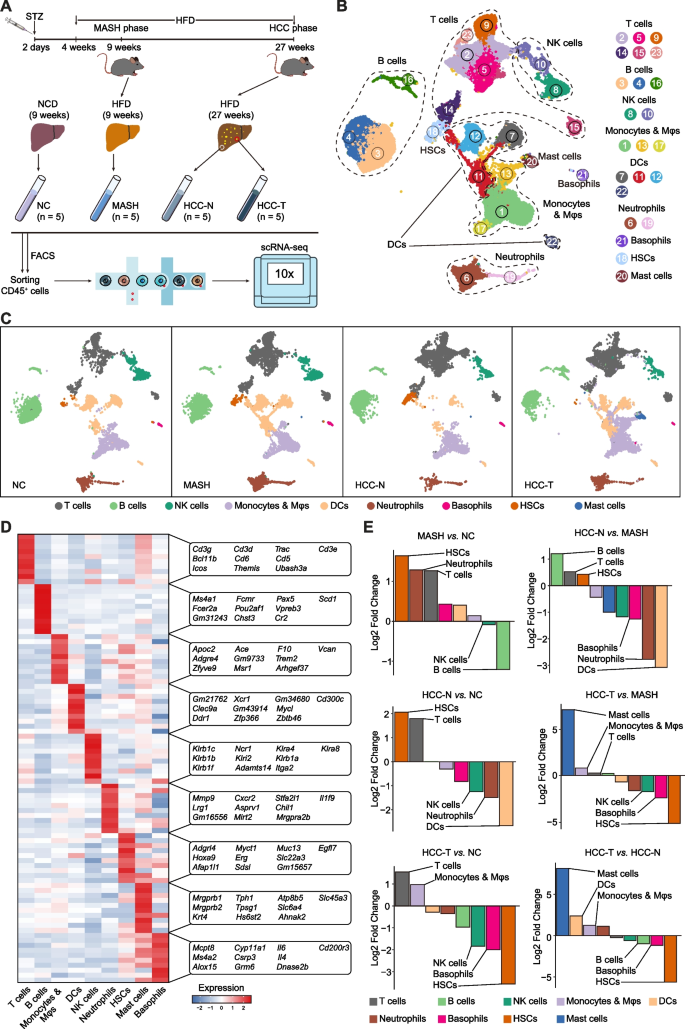
图1.MASH到HCC转变过程中肝脏免疫细胞的综合图谱
二、T细胞亚群动态变化
对T细胞进行亚群分析,共分为CD4 T、CD8 T、γδT和NKT4种亚型,并进一步对CD4T和CD8T细胞进行降维聚类。结合拟时序分析发现,从MASH到HCC转变过程中,免疫抑制性调节T细胞(IKZF2+OX40+FOXP3+CD4+)和耗竭表型CD4+ T细胞(GZMK+LAG-3+PD-1+CD4+)比例呈渐进性上升趋势;同时CD8+T细胞中LY49+免疫抑制亚群扩增并伴随细胞毒性功能下降,γδT细胞中IL-17A+促炎亚群显著增多。表明在MASH向HCC转变过程中,免疫抑制和耗竭的CD4、CD8和γδT细胞在肝脏中被触发。图二展示了T细胞亚群的分布特征以及动态变化趋势。
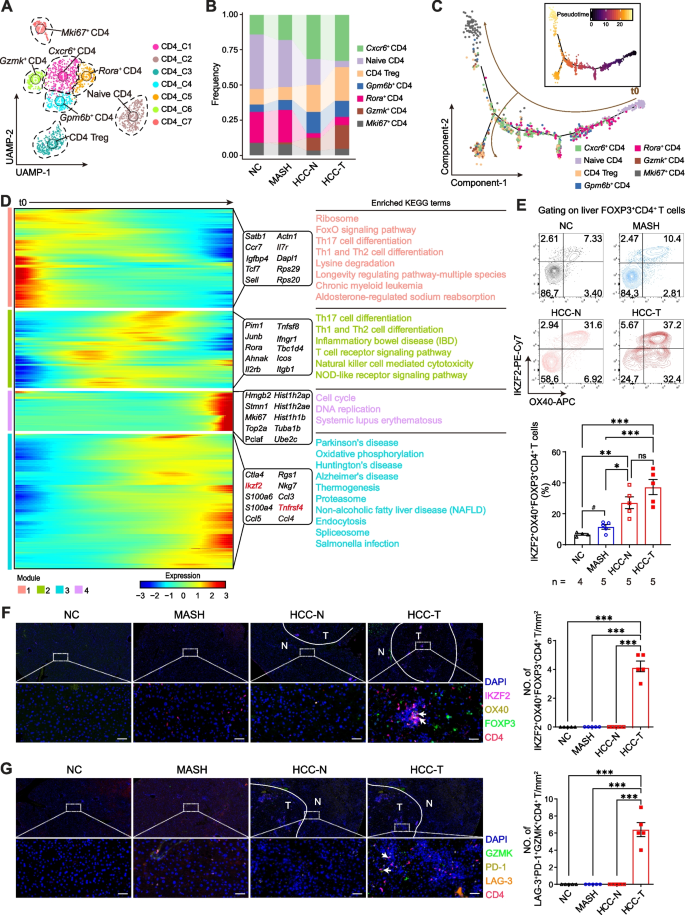
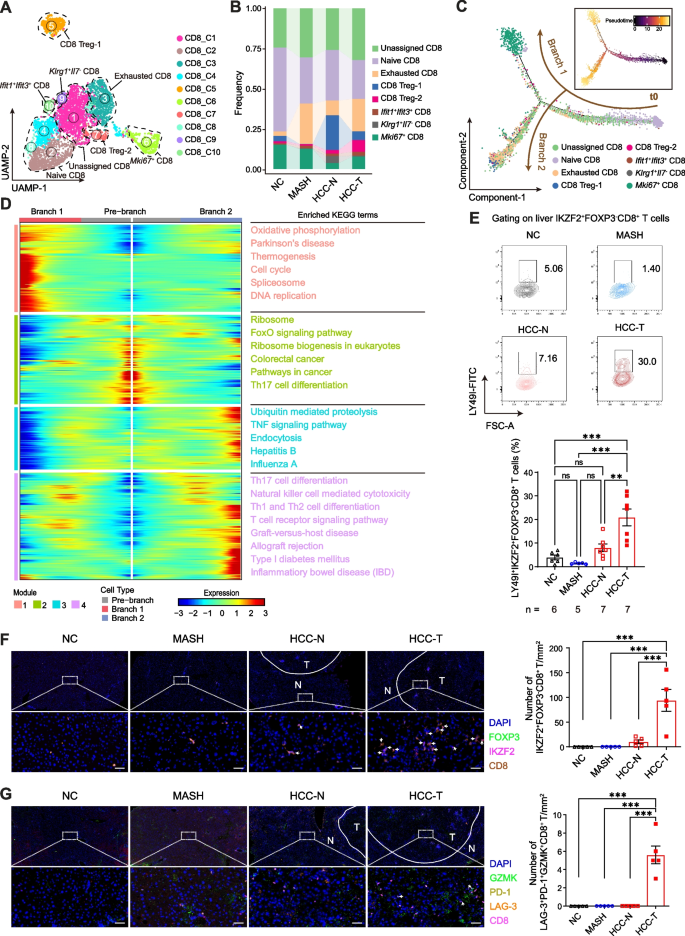
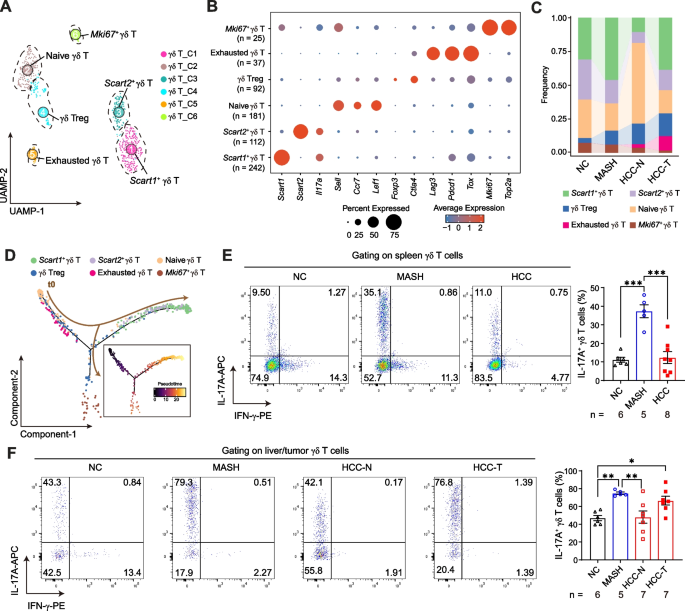
图2.MASH向HCC转变过程中,诱导产生免疫抑制和耗竭的T细胞
三、B细胞亚群动态变化
对B细胞进行亚群分析,可分为Gm31243hiB细胞、Gm31243loB细胞、Nid1+B细胞和浆细胞4种亚型。在 MASH向HCC转变过程中,B细胞主要分化为免疫抑制性浆细胞(IgA+)和Gm31243+B细胞。GSVA分析显示,浆细胞在非酒精性脂肪肝病(NAFLD)通路中表现突出,可能通过NAFLD等代谢通路推动肿瘤进展。Scenic分析表明,Gm31243+B细胞表达多种与B细胞活化相关的转录因子。表明在MASH向HCC转变过程中,B细胞可能通过免疫抑制及代谢通路调控等机制参与肿瘤进程。
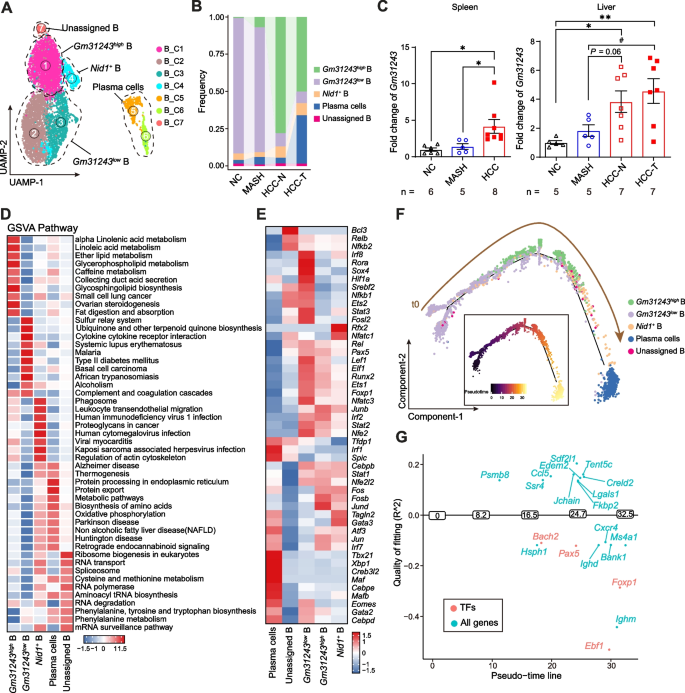
图3.MASH向HCC转变过程中,B细胞成熟并分化为免疫抑制细胞
四、NK细胞活化受到抑制,抗肿瘤能⼒减弱
对HCC组NK细胞进行亚群分析,发现其细胞组成发生显著改变:成熟NK细胞(mNK)数量呈下降趋势,未成熟NK细胞(iNK)数量则显著上升,表明NK细胞在HCC中的功能可能减弱,导致其杀伤癌细胞的能力下降。深入探究发现,NK细胞特征性激活受体LY49D/H表达水平明显降低,HCC肿瘤组织内LY49D+LY49H+NK细胞占比减少,表明在HCC阶段NK细胞的激活受到了抑制。更关键的是,具有肿瘤杀伤能力的GZMA+NK细胞比例随疾病进展持续降低。表明在MASH向HCC转变过程中,NK 细胞亚群组成及功能发生异常改变,可能通过削弱免疫杀伤与监视能力,参与HCC的发生发展。
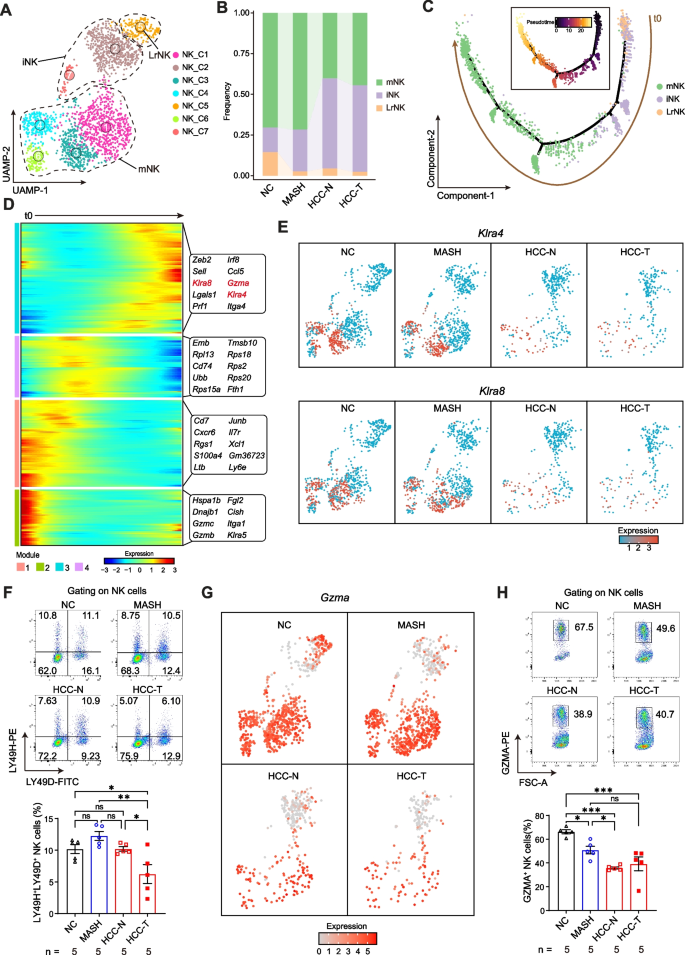
图4.MASH相关HCC中肝内浸润的NK细胞激活受抑制
五、ApoE 在MASH相关HCC中的关键作用
单细胞转录组结果表明,多种免疫细胞(T细胞、B细胞、巨噬细胞等)在HCC中高表达载脂蛋白E(ApoE),通过流式细胞术和westernblotting检测发现CD4+T、CD8+T和B细胞确实⾼表达ApoE蛋⽩,⽽肿瘤细胞⾼表达其受体。功能验证结果显示,ApoE缺失通过阻断PI3K-AKT-NF-κB/c-Jun通路抑制MASH驱动的HCC,重塑免疫微环境。因此ApoE可能作为MASH相关HCC的潜在治疗靶点。
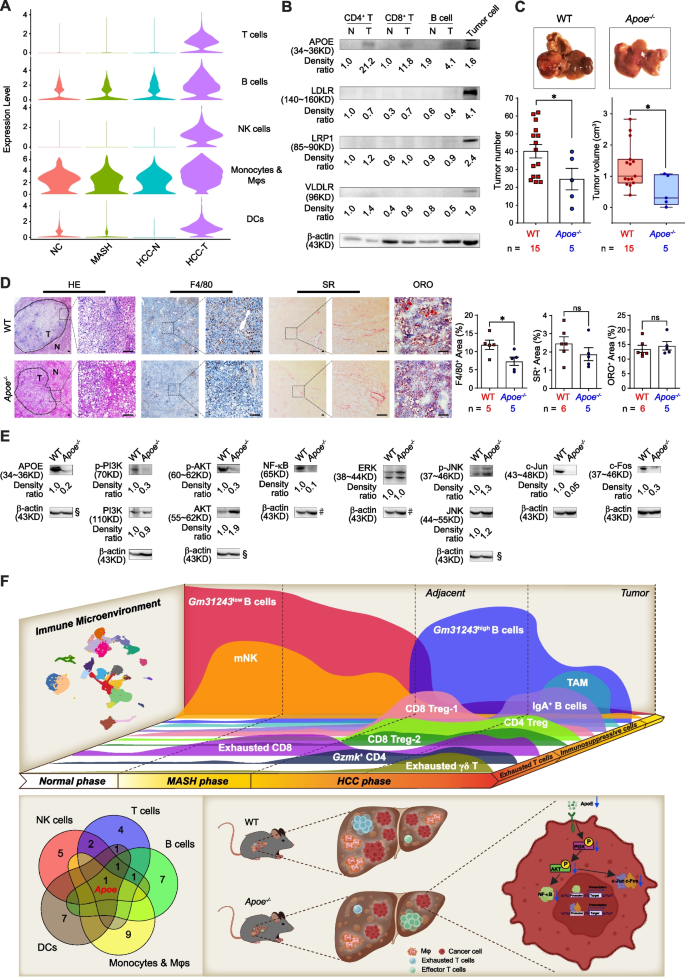
图5.ApoE缺失抑制MASH驱动的HCC发展
本研究通过单细胞转录组测序(scRNA-seq)结合STAM小鼠模型,系统解析了代谢功能障碍相关脂肪性肝炎(MASH)向肝细胞癌(HCC)转化过程中的免疫微环境动态变化:T细胞耗竭、免疫抑制性B细胞亚群扩增及NK细胞功能衰退的协同作用,共同构建了促肿瘤的免疫微环境。研究首次鉴定出载脂蛋白E(ApoE)在这一过程中的核心调控作用,其通过ApoE-PI3K-AKT-NF-κB/c-Jun信号轴促进肿瘤进展,而ApoE基因敲除可显著改善免疫抑制微环境并抑制肿瘤生长。这些发现不仅阐明了MASH相关HCC的发病机制,更为开发靶向ApoE的免疫代谢治疗策略提供了重要理论依据,对无肝硬化直接进展为HCC患者的临床治疗具有重要指导意义。
参考文献:
Huang, Y., Xie, Y., Zhang, Y., Liu, Z., Jiang, W., Ye, Y., Tang, J., Li, Z., Yin, Z., & Lin, X.-J.(2025).Single-cell transcriptome reveals the reprogramming of immune microenvironment during the transition from MASH to HCC.Mol Cancer. 2025;24:177. doi:10.1186/s12943-025-02370-2.






