2025年6月23日,四川大学华西医院牛挺教授、上海交通大学医学院附属瑞金医院赵维莅教授、四川大学华西医院陈俐娟和胡以国教授等共同合作,在Signal Transduction and Targeted Therapy(IF 52.7)上发表题为“Preclinical and first-in-human of purinostat mesylate, a novel selective HDAC I/IIb inhibitor, in relapsed/refractory multiple myeloma and lymphoma”的论文,完整的研究了新型选择HDAC I/IIb抑制剂PM在临床前和I期临床试验中对骨髓瘤和淋巴瘤的疗效、安全性和作用机制。为PM用于复发/难治性骨髓瘤和淋巴瘤的治疗提供了必要的支持。欧易生物为单细胞转录组测序和bulk-RNA测序和分析提供了技术支持。

发表期刊:Signal Transduction and Targeted Therapy
影响因子:52.7
涉及的欧易生物服务产品:单细胞转录组测序,bulk-RNA测序
多发性骨髓瘤(MM)和淋巴瘤发病率持续上升,复发/难治性(r/r)患者面临治疗困境。I类和IIb类HDACs在B细胞相关肿瘤发生中起关键作用,是潜在治疗靶点。现有HDAC抑制剂(HDACis)存在可能抑制免疫以及对关键亚型的选择性不足的问题。甲磺酸普利司他(Purinostat mesylate,PM)是一种新型选择性 HDAC I/IIb 抑制剂,其独特的非线性三角形帽状结构和刚性连接子显著增强了对I类和IIb类HDACs的亲和力与抑制活性。深入研究PM在临床前和I期临床试验中对MM和淋巴瘤的疗效、安全性和作用机制,有助于开发针对多发性骨髓瘤(MM)和淋巴瘤的治疗策略。
本研究报告了PM在临床前和I期临床试验中对MM和淋巴瘤的疗效、安全性和作用机制。临床前研究表明,PM比泛HDACi panobinostat和几种一线/二线多药联合方案具有更强的抗肿瘤活性。I期临床试验的结果证明了PM单药治疗在r/r MM和r/r淋巴瘤患者中的总体安全性和良好疗效。在机制上,作者通过bulk-RNA-seq和scRNA-seq分析发现PM显著抑制了肿瘤存活所必需的多种关键蛋白和信号通路,并可能增强抗肿瘤免疫反应。
Result 1 PM对MM和淋巴瘤的活性强于泛HDACi或多种多药联合方案
作者通过体外实验以及体内模型研究了PM对MM和淋巴瘤的抗肿瘤活性。体外实验显示,PM对8种MM和8种淋巴瘤细胞系的抗增殖活性(IC50均<5nM)全面超越panobinostat(图1a),并且5nM PM在原代MM细胞(患者A/B)和DLBCL细胞(患者C)中诱导更高凋亡率(92%/82.0%/82.1% vs panobinostat的54.5%/40.1%/20.49%,图1b)。体内模型进一步验证其优势:MM1S异种移植小鼠模型中,5 mg/kg PM的肿瘤抑制率(64.39%)优于10 mg/kg panobinostat(49.37%),且10 mg/kg PM单药疗效超越一线联合方案(Len+Bort+DXM)(71.76% vs 62.05%,图1c)。在 c-MYC/KRAS12V 诱导的 PCT 小鼠模型中,10 mg/kg PM疗效优于标准联合方案(中位生存期59天 vs Len+Bort+DXM的50.5天,P=0.0288,图1d),且对腹水肿瘤细胞抑制活性更强(图1e)。淋巴瘤PDX小鼠模型中,PM单药(5or10 mg/kg)在DEL模型实现100%完全缓解(R-CHOP组肿瘤抑制率76.9%,图1f),在r/r DLBCL模型肿瘤抑制率达77.14%,优于Pola-BR方案的57.91%(图1g)。这些数据共同证明PM单药在MM和淋巴瘤模型中具有卓越的抗肿瘤活性。
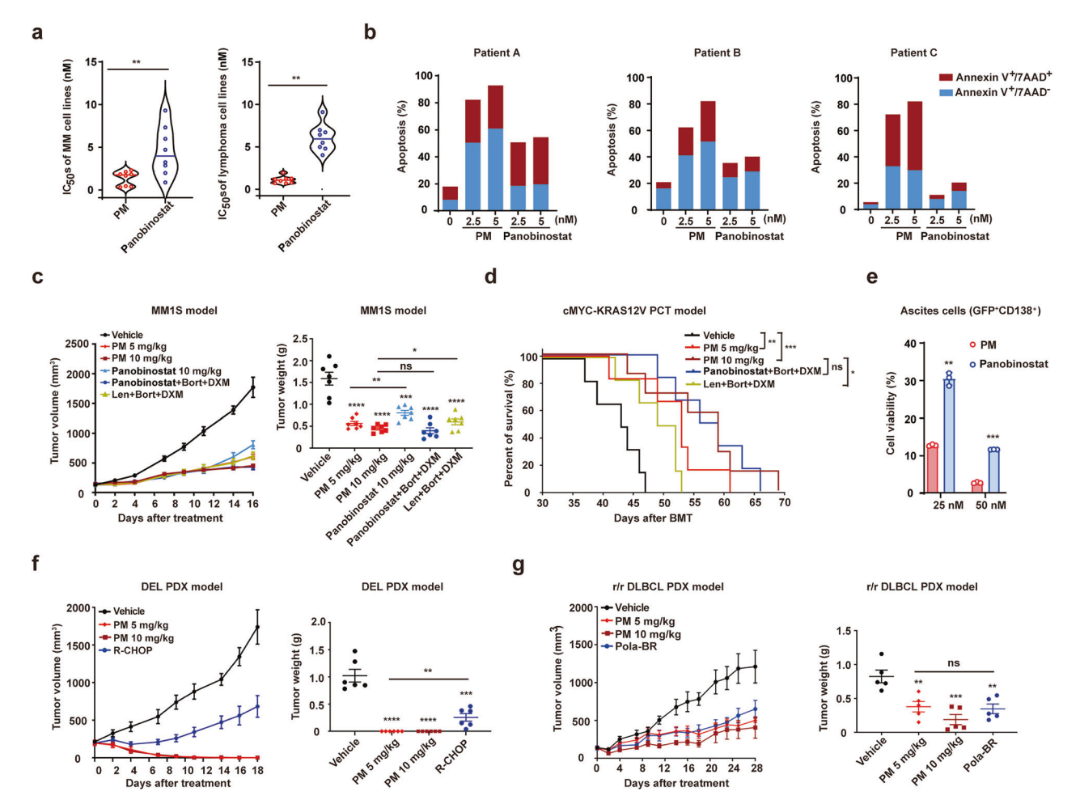
图1 PM对MM和淋巴瘤细胞和小鼠模型表现出有效的活性
Result 2 PM改变MM和淋巴瘤存活的多个关键因子并触发免疫相关炎症和干扰素反应
为了研究PM的治疗机制并确定其优于panobinostat的关键因素,作者对体外和体内经空白对照、PM 和panobinostat处理的MM1S细胞,以及DEL PDX 模型进行了bulk RNA-seq分析。GSEA分析显示PM处理样本显著下调"MYC_TARGETs"、"DNA_REPAIR"等7组促癌基因集(图2a),并降低EZH2、c-MYC、IKZF1/3、CDK6等关键基因的表达(图2b),同时显著上调 "INTERFERON_ALPHA_RESPONSE"、"TNFA_SIGNALING_VIA_NFKB"等4组免疫相关通路(图2a)。此外,PM特异性诱导干扰素响应(如TLR3、MX1等ISGs基因)和炎症通路(TNFA/NFκB、IL6/JAK/STAT3),而同等剂量的 phenobinostat 效果甚微(图 2c)。以上结果通过 RT-PCR 进一步得到证实(图 2d)。PM还以剂量依赖性方式增加MM1S细胞中TLR3和MX1的表达(图2e),并显著提升肿瘤组织中MHC-I和MHC-II的表达(图2f)。流式细胞术证实,PM处理后MM1S细胞的MHC-I和MHC-II呈浓度依赖性上调,而panobinostat无此作用(图2g)。综上所述,PM显著抑制了MM和淋巴瘤存活关键的多个基因的表达,并激活了免疫反应相关信号通路,而泛HDACi panobinostat对这些基因没有明显影响。
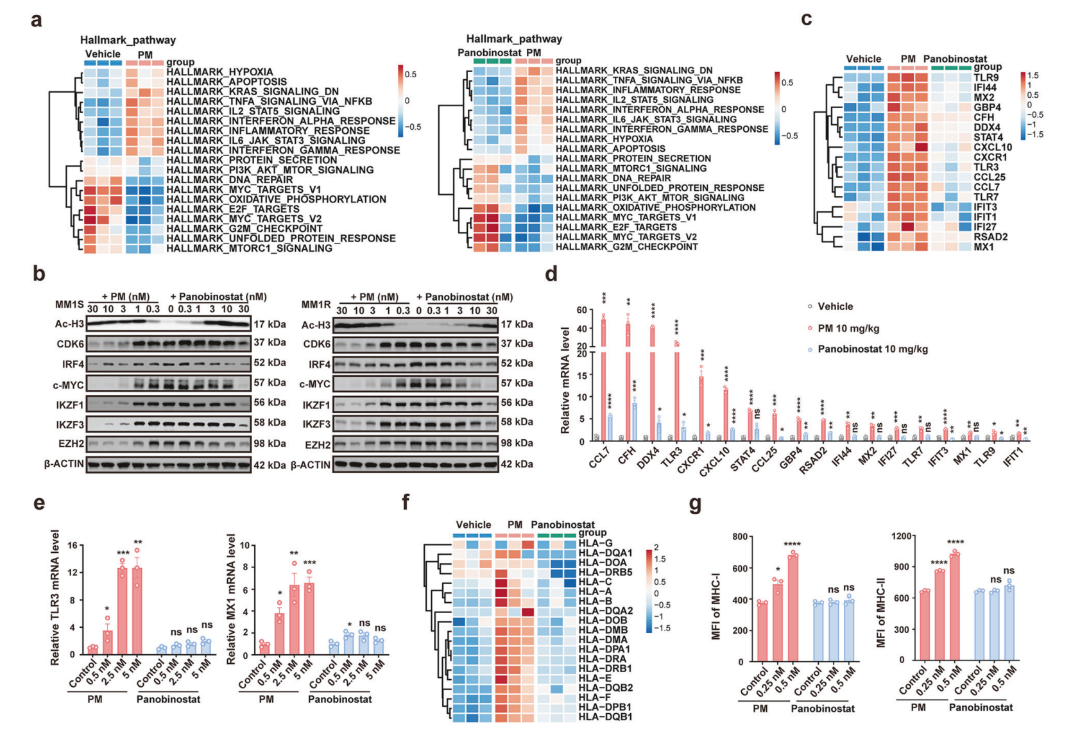
图2 PM在MM中改变了多个基因表达
Result 3 PM通过改善5TMM小鼠模型中的免疫微环境增强其抗肿瘤效果
为了全面研究PM对免疫系统和肿瘤微环境的影响,作者使用scRNA-seq分析了来自对照或PM处理的5TMM模型小鼠的骨髓 (BM) 细胞。对单核细胞进行亚群分析结果显示,对照组中的单核细胞主要分布在 MonoC1 和 MonoC10 中,而 PM 组中的单核细胞主要分布在 MonoC2 簇中(图 3b)。MonoC2 簇中差异表达基因 (DEGs) 的富集分析显示,PM 治疗影响了先天免疫反应和细胞因子产生信号通路,而在MonoC1和MonoC10中主要影响凋亡和DNA损伤信号通路(图 3c)。UMAP 聚类和拟时序分析表明,MonoC1和MonoC2可能代表相邻的单核细胞状态(图 3b,d,e)。与MonoC1相比,MonoC2簇中的DEGs干扰素响应基因集中表现出显著的上调富集(图 3f)。此外,PM增加了多种免疫细胞和浆细胞中Cxcl10、Cxcl12和Ccl7的基因表达水平(图 3g)。拟时序分析显示MonoC2激活免疫增殖/抗原呈递基因,而MonoC1上调凋亡相关基因(图3h)。这些结果表明PM治疗可能激活了5TMM模型小鼠骨髓微环境中的先天免疫反应。
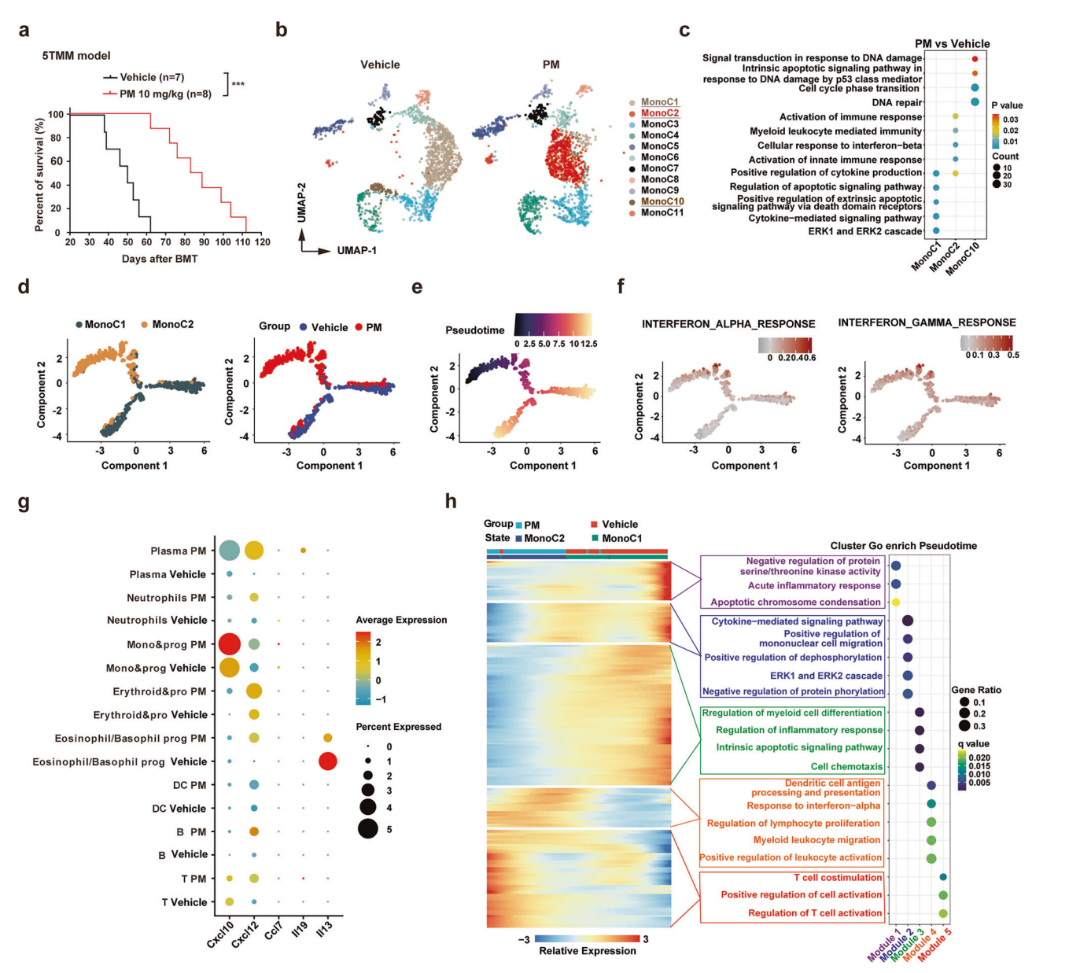
图3 5TMM小鼠模型经PM治疗后单核细胞群体及基因表达变化的scRNA-seq分析
为了进一步阐明PM治疗对MM治疗中适应性免疫反应的影响,作者分析了5TMM模型中T细胞亚群,通过UMAP分析将T细胞分为9个簇(图4a,b)。具体而言,PM提高了Ccr7+CD8+毒性T细胞的比例,同时减少了无效的Klrc1+CD8+γδT细胞(图4c),后者在抗肿瘤免疫中无效且富集免疫检查点阻断基因集(图4d)。此外,PM下调了T细胞免疫检查点受体(如Pd1、Prdm1、Ctla4、Tnfrs9)的基因表达水平,上调了细胞毒性T细胞标志物(Gzmk、Prf1),并降低了无反应性T细胞标志物(Itch、Nedd4、Rnf128)的表达(图4e)。PM还促进了其他免疫细胞的基因表达,如中性粒细胞中的Tnf、单核细胞/前体和DC细胞中的Irf5和Tap1、嗜酸性粒细胞/嗜碱性粒细胞前体细胞中的Il-6,以及各种细胞中的Isg15(图4f)。T细胞信号通路分析表明PM 治疗减少了T细胞凋亡,促进了细胞毒性T细胞的增殖和活性,增强了T细胞介导的免疫反应(图4g-j),而流式细胞术证实PM增加了外周血中效应记忆T细胞(TEM)的比例(图4k,l)。以上结果表明,PM不仅通过靶向肿瘤细胞直接阻止肿瘤进展,还激活了先天性和适应性免疫反应。
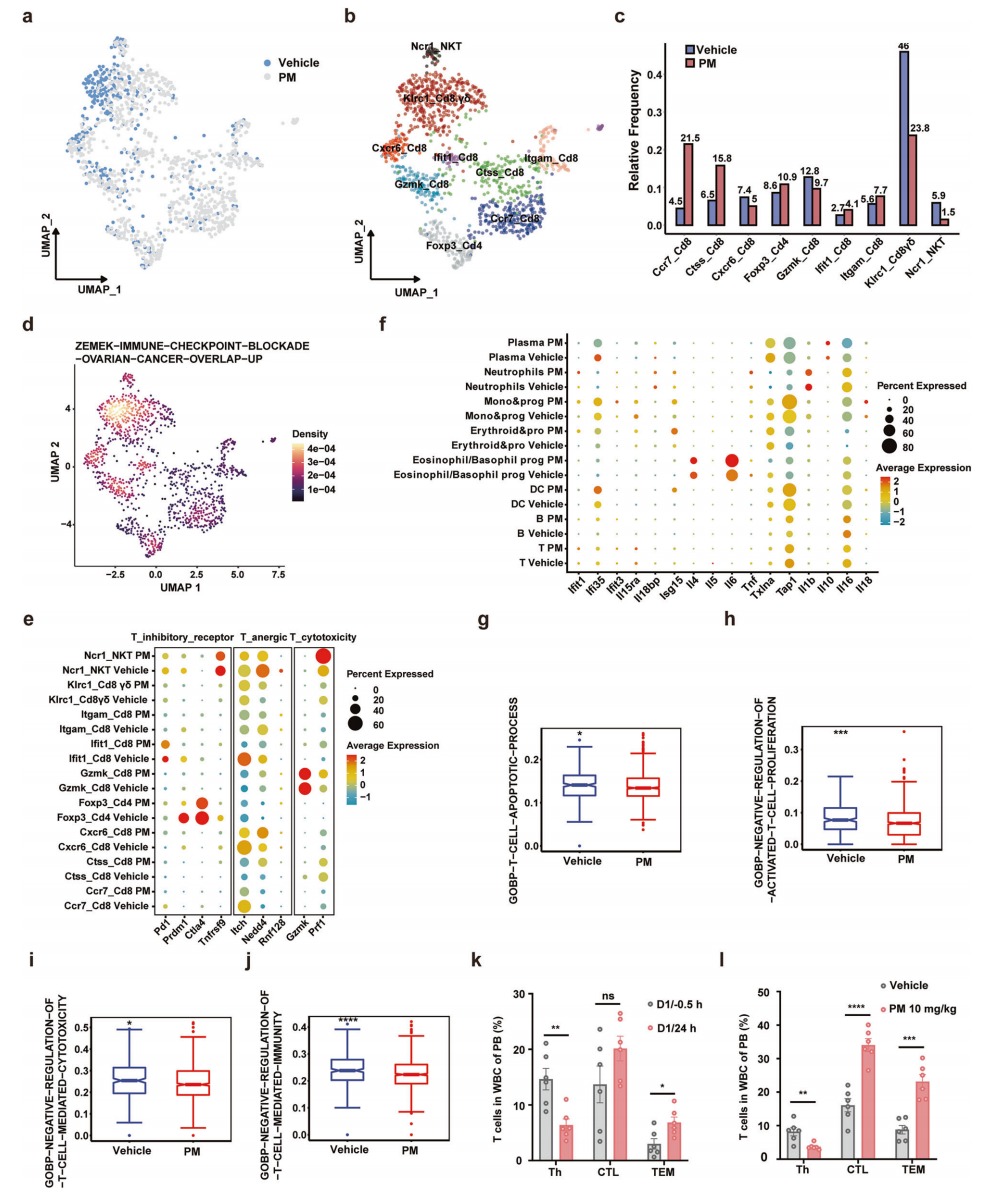
图4 PM处理的5TMM小鼠模型的T细胞特征
Result 4 PM阻断破骨细胞形成并抑制骨溶解
为了进一步研究PM治疗是否可以改善5TMM小鼠模型中的骨溶解,作者通过拟时序分析显示,PM抑制了破骨细胞分化关键基因(如 Csf1r、Fos、Nfatc1、Ctsk 等)在单核细胞分化各阶段的表达(图5a)。GSEA结果进一步证实PM降低了破骨细胞发育、分化和RANKL通路相关基因的表达(图5b),并抑制了巨噬细胞向破骨细胞分化的NF-κB和MAPK信号通路(图5c)。体外实验通过TRAP染色验证PM可显著抑制RANKL诱导的成熟破骨细胞形成(图5d)。Micro-CT成像显示PM治疗有效防止了股骨骨质破坏,改善了小梁骨参数(如Tb.N、Tb.Th、BMC等)(图5e,f)。综上,PM治疗可以改善MM中的溶骨性病变。
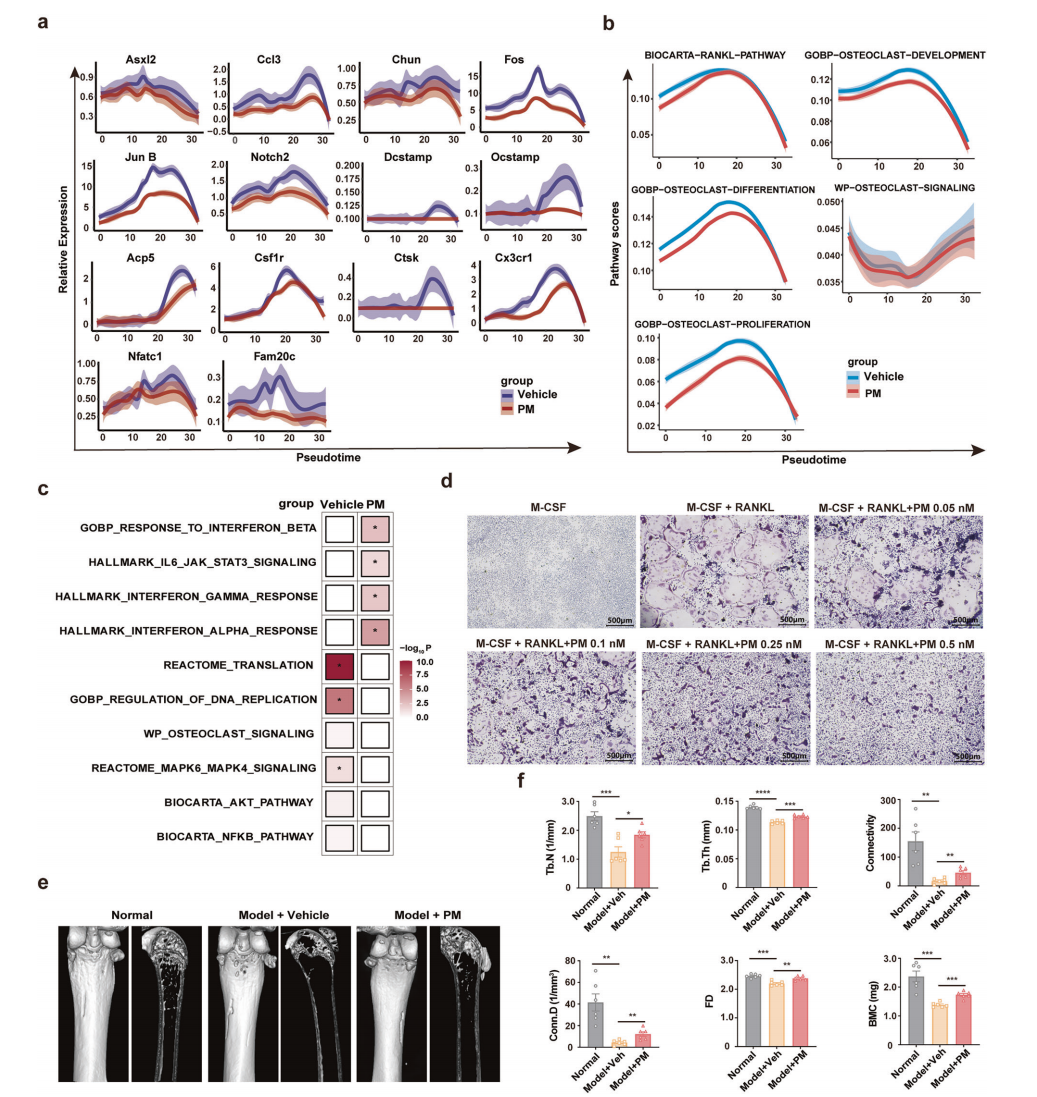
图5 PM在5TMM小鼠模式下抑制骨溶解
Result 5 PM在r/r MM和淋巴瘤的I期试验中表现出良好的耐受性和有希望的疗效
作者对29名r/r MM和淋巴瘤患者进行了临床试验(2020年8月至2022年8月),其中患者中位年龄53岁,多数处于高风险疾病阶段(91% MM为Durie-Salmon III期,94%淋巴瘤为Lugano III期或以上)(图 6a)。药代动力学分析显示,PM单次给药后血浆中的峰浓度(Cmax)在0.4-0.5小时内达到,半衰期(t1/2)约2.30-3.51小时(图6b),剂量比例在1.2-8.4 mg/m²范围内,但11.2-15.0 mg/m²略有超出。安全性方面(截至2023年7月7日),86.2%患者出现3-4级治疗相关不良事件,主要为可逆的血液学紊乱(如血小板减少),无剂量限制性毒性或严重心脏事件。疗效评估显示,r/r MM患者疾病控制率(DCR)为72.7%,其中一名患者达到微小缓解(MR)并持续6个月(图6a,c);r/r 淋巴瘤患者客观缓解率(ORR)为61.1%,DLBCL亚组ORR达63.6%,且完全缓解率(CR)为54.5%(图6c),包括一名患者持续CR超过18个月,此外一名在筛选期发现颈部、胸部、上肢淋巴结、腹部和肝脏存在多处结外病变的患者,经过四个PM疗程后达到部分缓解(PR),并且该PR维持了超过10个周期(图 6d)。生物标志物变化表明,有效患者血清细胞因子(如IL-6、IFN-γ)和外周血T细胞比例增加(图6e,f)。综上所述,PM是安全的,在r/r MM中疗效中等,在r/r淋巴瘤(尤其是 DLBCL)中疗效显著。
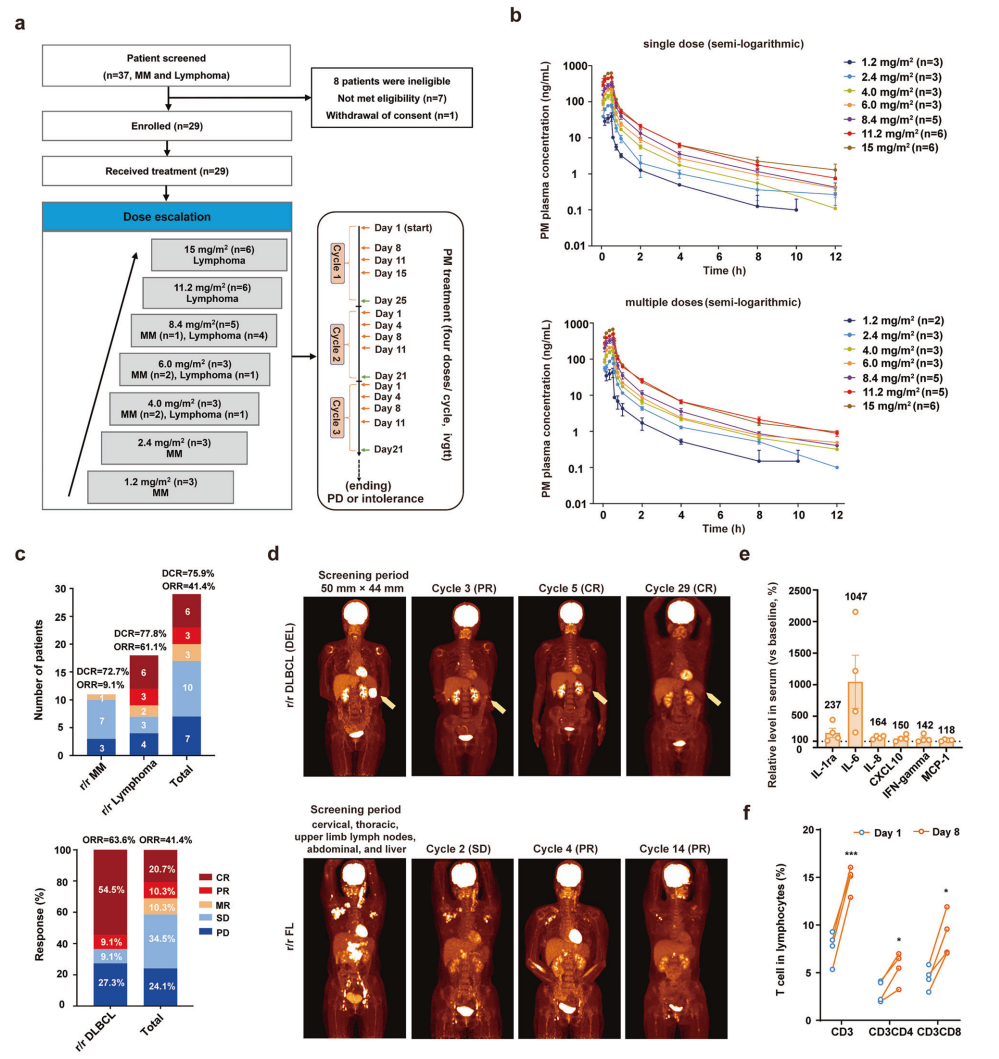
图6 PM在I期临床试验中,用于治疗R/R MM和R/R淋巴瘤患者
PM作为一种新型选择性HDAC I/IIb抑制剂,在复发或难治性(r/r)多发性骨髓瘤(MM)和淋巴瘤中展现出中等到高等疗效和可接受的安全性。这些发现支持了PM联合免疫调节剂治疗r/r MM的进一步开放标签、多中心Ib/IIa期试验,以及PM单药治疗r/r DLBCL和r/r T细胞淋巴瘤的II期试验。
参考文献:
Yang, L., Qiu, Q., Wang, J. et al. Preclinical and first-in-human of purinostat mesylate, a novel selective HDAC I/IIb inhibitor, in relapsed/refractory multiple myeloma and lymphoma. Sig Transduct Target Ther 10, 201 (2025). https://doi.org/10.1038/s41392-025-02285-w






