2025年5月21日,福建医科大学发表题为“Intratumoral Brevibacillus parabrevis enhances antitumor immunity by inhibiting NK cell ferroptosis in hepatocellular carcinoma”的研究论文,聚焦“瘤内细菌对NK细胞介导的抗肿瘤免疫的调控作用”,首次揭示了短小芽孢杆菌(Brevibacillus parabrevis, B. parabrevis)通过抑制NK细胞铁死亡、重塑肿瘤微环境(TME)的分子机制,为肝癌免疫治疗提供了新靶点和策略。

发表期刊:Cell Death and Disease
影响因子:9.6
涉及的欧易生物服务产品:2bRAD-M
目前研究证明肠道菌群可通过代谢产物影响NK细胞的数量与功能,进而调控肿瘤对化疗或免疫治疗的响应,但瘤内细菌是否参与NK细胞介导的抗肿瘤免疫,此前相关研究较少。铁死亡是铁离子依赖的独特程序性细胞死亡形式,与凋亡、坏死等不同,可通过释放损伤相关分子模式、激活树突状细胞、促进 T 细胞介导的抗肿瘤活性等增强抗肿瘤免疫,还能影响肿瘤相关巨噬细胞极化,但免疫细胞铁死亡的选择性抑制仍需深入研究,且部分免疫细胞或肿瘤细胞可能对铁死亡存在抗性,其机制有待探索。肿瘤组织中存在大量微生物,部分微生物可通过代谢产物或分泌物造成DNA损伤、参与信号通路转导、影响免疫应答等,改变肿瘤微环境并参与肿瘤发生发展,但目前不清楚是否存在能增强细胞毒性免疫细胞功能的瘤内细菌,也未明确移植特定菌群能否改善免疫治疗效果。既往研究已证实肠道菌群可调控肝癌浸润T细胞和NK细胞的浸润与功能,在此基础上,研究团队进一步探索瘤内细菌与免疫细胞的关系,以明确特定瘤内细菌对NK细胞抗肿瘤免疫的调控作用。
本研究以瘤内短小芽孢杆菌(Brevibacillus parabrevis,B. parabrevis)为切入点,探究其在 NK 细胞介导的免疫应答中的作用:
(1)首先,研究发现B. parabrevis可上调NEDD4L的表达,而NEDD4L通过促进铁转运体SLC39A14、SLC39A8和STEAP3的泛素化,从而抑制NK细胞铁死亡。
(2)研究指出,B. parabrevis 能抑制NK细胞铁死亡,促进NK细胞向细胞毒性/适应性/热休克表型转化,抑制其终末分化,并增强对肝癌(hepatocellular carcinoma,HCC)细胞的杀伤作用。
(3)最后,研究表明 B. parabrevis 可促进脂解作用、生成乙酰辅酶A(acetyl-CoA)、增加RORC乙酰化水平、增强RORC与NEDD4L启动子的结合能力,进而上调NEDD4L的转录。因此,B. parabrevis 被用作一种新型佐剂,以改善肝癌中 NK 细胞的抗肿瘤应答。
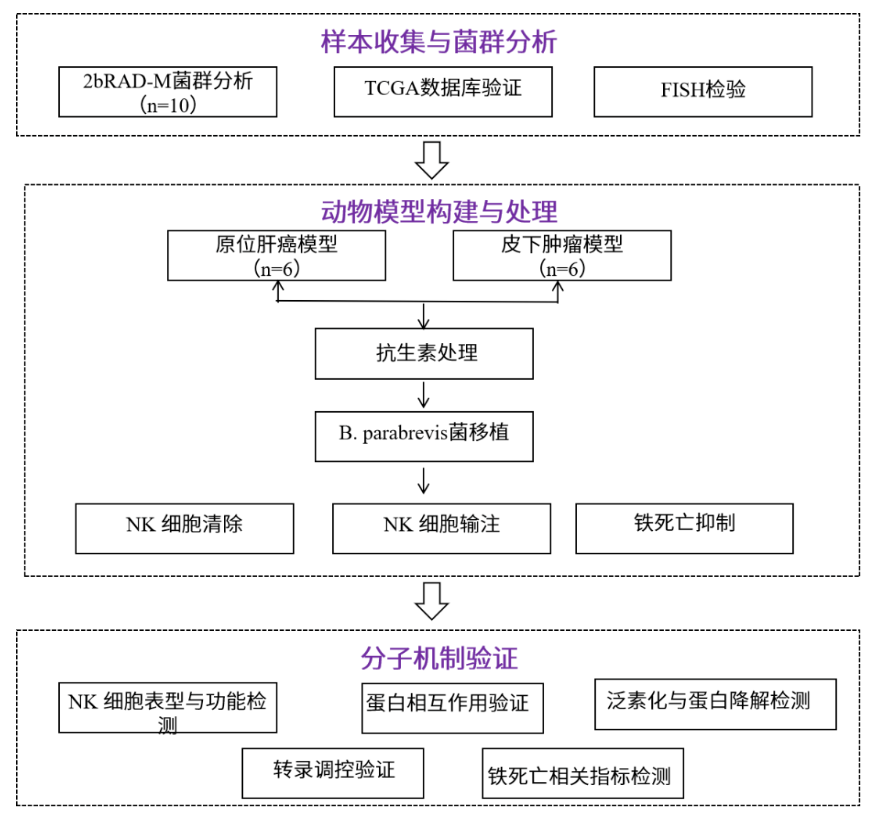
Result1 患者HCC肿瘤内细菌的特征
研究发现患者肝癌组织中的NK细胞浸润受损(Fig S1A),因此选取了10对患者癌组织(Tumor)与配对组织(Normal)进行2bRAD-M分析,以确定哪种微生物调控NK细胞的抗肿瘤免疫功能。PCOA结果显示癌组织与配对组织的微生物群落组成存在明显差异(Fig S1B)。KEGG富集分析表明,相较于配对组织,肝癌组织中的微生物群落特征与受损代谢通路相关(Fig S1C),其中K02015(铁复合物转运系统渗透酶蛋白)在癌组织中占比低于配对组织(Fig S1D)。基于种水平差异物种的结果显示:Anoxybacillus A rupiensis、Bradyrhizobium sp003020075、 B. parabrevis、 Methylobacterium rhodesianum、 Ralstonia sp021173085相对丰度正常组织均低于癌组织(Fig S1E)。
为验证样本推导结论的普适性,采用TCGA数据库中的BIC数据集进行外部验证。分析显示,在患者肝癌组织中,B. parabrevis的丰度低于配对组织(属水平),而Anoxybacillus 、Bradyrhizobium、Methylobacterium和Ralstonia则无显著差异(Fig S1F)。为探究B. parabrevis与肝癌微环境(TME)的关联,将TCGA转录组数据导入CIBERSORT计算免疫细胞比例,发现高B. parabrevis组活化NK细胞比例显著高于低组(Fig S1G)。通过荧光原位杂交(FISH)检测发现,肝癌组织及配对组织中B. parabrevis含量较低(Fig S1H)。为进一步探究B. parabrevis丰度与NK细胞功能的关系,研究发现相较于低感染组,高感染组患者肿瘤浸润的NK细胞中,细胞毒性标志物和适应性标志物NKG7的表达水平显著升高(Fig S1I、J)。为精确模拟患者肝细胞癌组织中B. parabrevis的实际丰度(Fig S1H),通过小鼠实验进行验证:对原位肿瘤小鼠口服给予5×106 CFU菌体,或对皮下肿瘤小鼠进行5×105 CFU瘤内注射,无论是原位癌模型还是皮下肿瘤模型中,均观察到B. parabrevis能促进NK细胞的瘤内浸润(Fig S1L)。
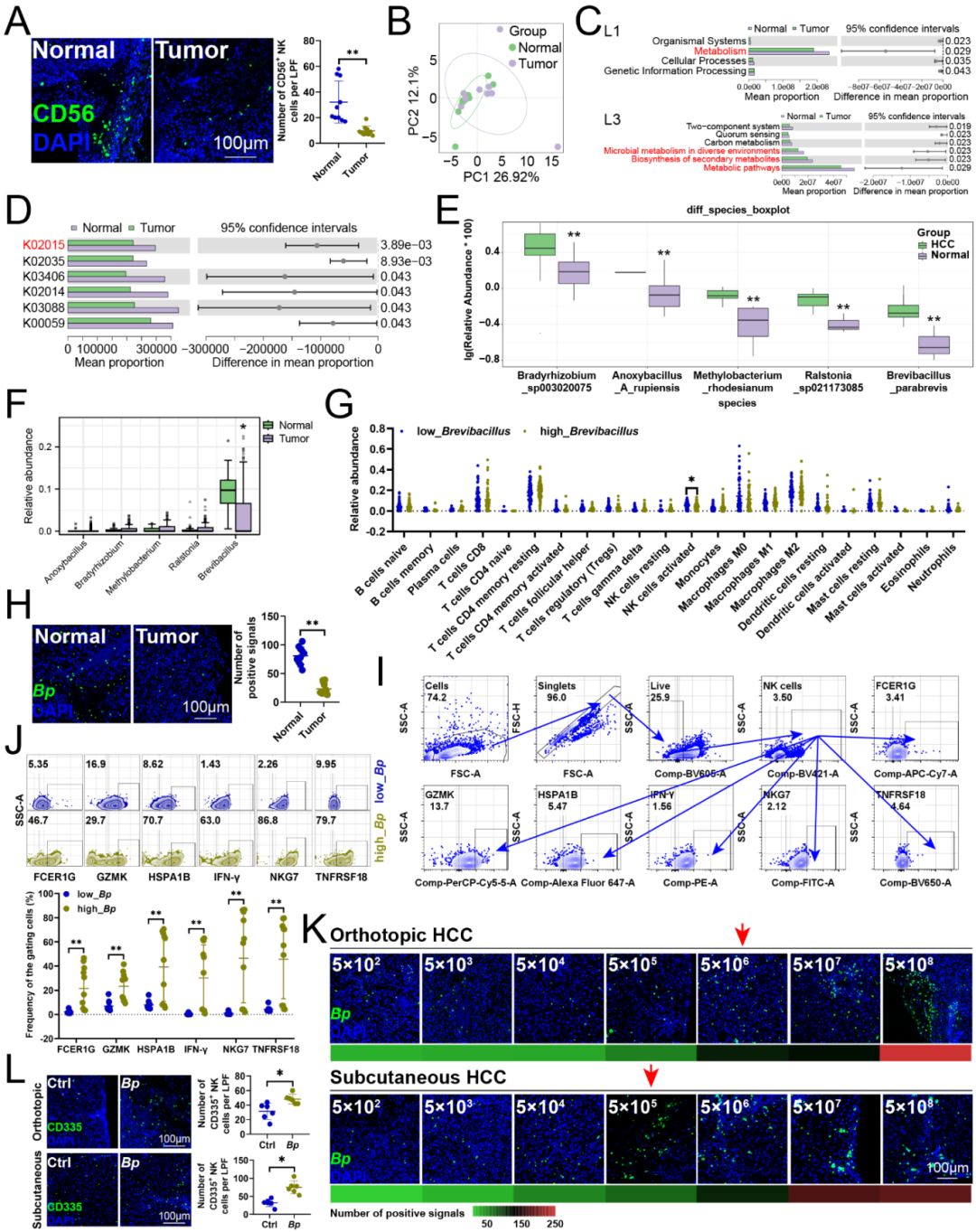
Fig. S1 肝癌肿瘤患者瘤内菌特征
Result2 B. parabrevis增强NK细胞抗肿瘤活性
为研究B. parabrevis对NK细胞介导抗肿瘤免疫的特异性功能及分子机制,向肝癌小鼠体内接种该菌株,并通过质谱流式细胞术检测NK细胞的特异性变化。体内实验发现,B. parabrevis可抑制小鼠原位肿瘤及皮下肿瘤的生长,同时延长其存活时间(Fig1A-D)。使用抗NK1.1抗体在体内清除NK细胞会显著促进肿瘤进展并影响预后(Fig1E–I)。此外,在缺乏NK细胞的情况下,B. parabrevis的抗癌效果完全消失(Fig1E–I)。利用质谱流式技术进一步反映了,B. parabrevis能重塑NK细胞功能亚群,抑制其铁死亡,增强抗肿瘤免疫(Fig1K–O)。
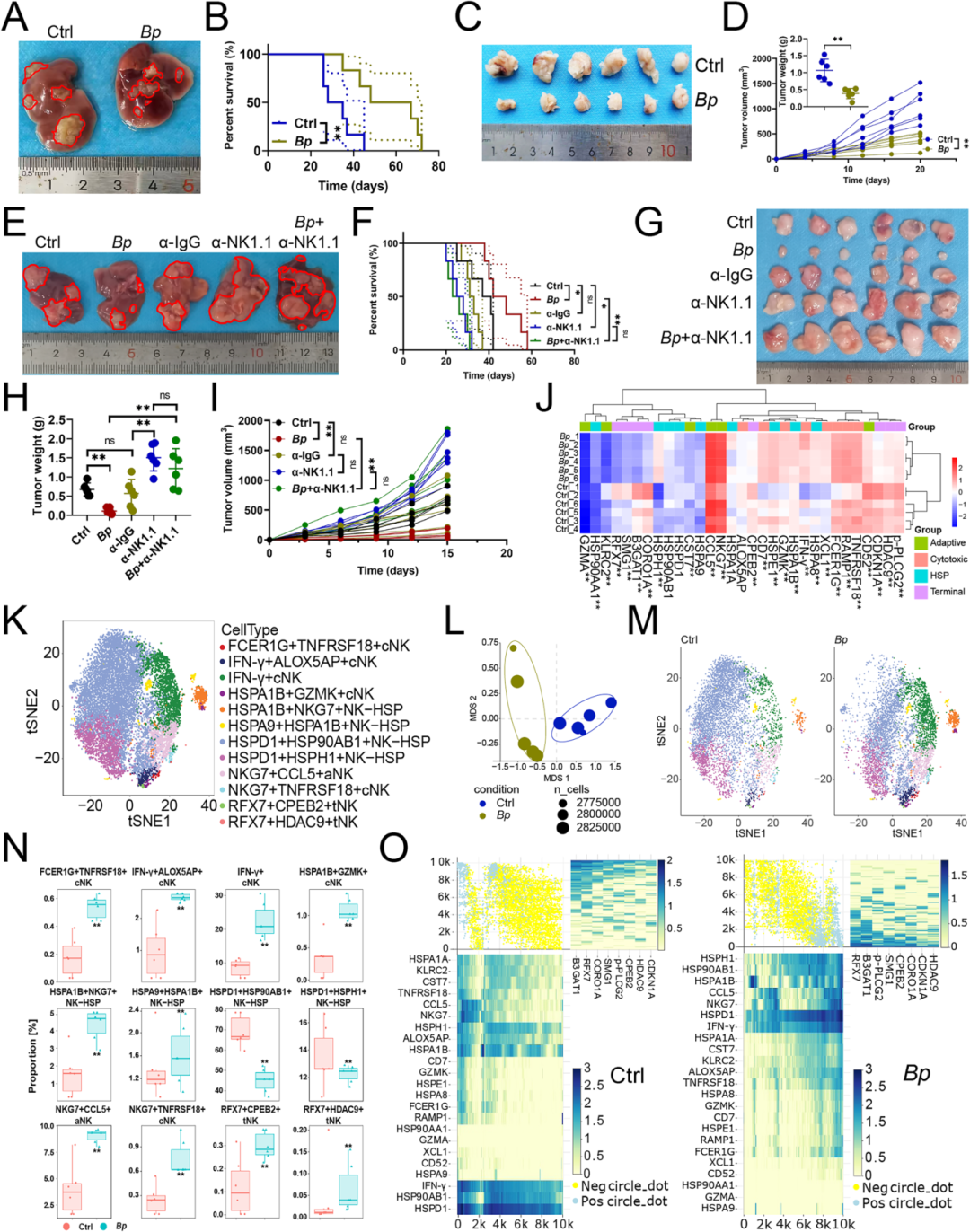
Fig. 1 B. parabrevis增强了NK细胞的抗肿瘤活性
Result3 B. parabrevis抑制NK细胞铁死亡,提高抗肿瘤免疫
由于肝细胞癌(HCC)与其配对组织间的细菌组成差异与铁复合物转运系统渗透酶蛋白密切相关,通过调控NK细胞的铁死亡来探究短芽孢杆菌是否影响其功能。使用铁死亡抑制剂 Liproxstatin-1 处理肿瘤浸润性NK细胞后,NK细胞的细胞毒性标志物(FCER1G、GZMK、IFN-γ、TNFRSF18)、热休克蛋白(HSPA1B)和适应性标志物(NKG7)表达均显著上调,表明抑制铁死亡可增强NK细胞功能(Fig 2B)。将B. parabrevis 移植到小鼠原位肝癌组织后,NK细胞内的亚铁离子和活性氧(ROS)水平明显降低,线粒体变小、膜密度增加、嵴减少并出现外膜断裂 —— 这些都是铁死亡被抑制的典型特征(Fig 2C-D)。铁死亡激动剂会抑制NK细胞效应分子(FCER1G、TNFRSF18、IFN-γ、HSPA1B、GZMK、NKG7、CCL5)的表达,而B. parabrevis 能够上调这些分子的水平。当激动剂与 B. parabrevis 同时存在时,激动剂会削弱 B. parabrevis 的促进作用,进一步证明B. parabrevis 是通过抑制铁死亡来增强NK细胞抗肿瘤功能的(Fig 2E-I)。
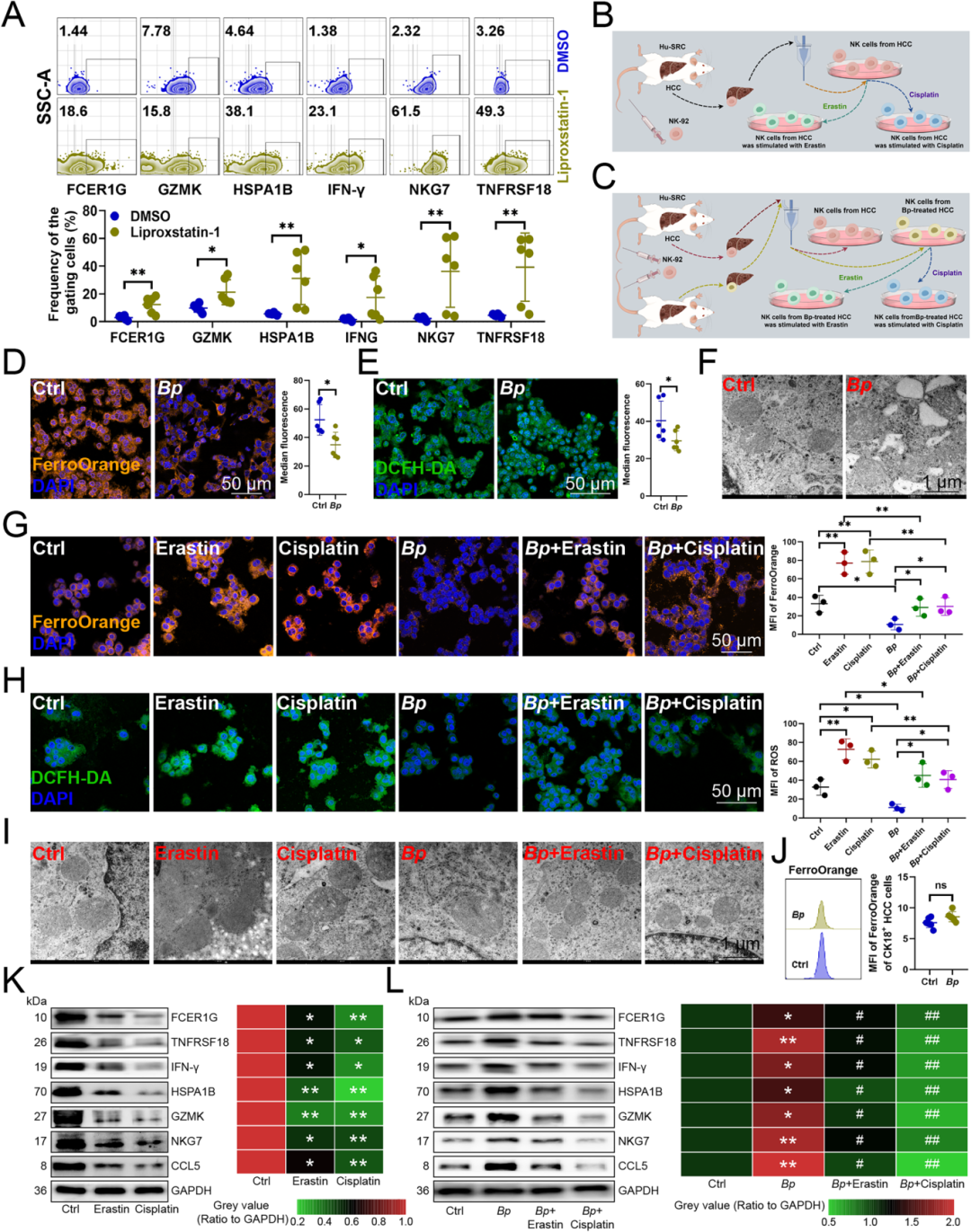
Fig. 2 B. parabrevis抑制NK细胞铁死亡,提高抗肿瘤免疫
Result4 B. parabrevis抑制NK细胞铁死亡依赖于上调NEDD4L
研究人员进一步分析B. parabrevis是否通过影响铁复合物转运系统渗透酶蛋白的表达来调控NK细胞的铁死亡。研究表明:B. parabrevis 降低了 NK 细胞中 SLC39A14、SLC39A8 和 STEAP3 的蛋白水平(Fig 3A),但不影响它们的转录水平(Fig 3B),提示存在翻译后调控,数据库分析发现 NEDD4L 是这三种蛋白的共同 E3 泛素连接酶(Fig 3C)。NEDD4L过表达降低了这三种铁转运蛋白的表达(Fig 3D)。而NEDD4L敲除则提高了它们的水平(Fig 3E),此外,还发现B. parabrevis 促进了NEDD4L的表达(Fig 3F),环己酰亚胺实验显示 NEDD4L 敲除减缓了这三种蛋白的降解(Fig 3G)。进一步研究发现:NEDD4L 过表达降低了 NK 细胞内亚铁离子和 ROS 水平(Fig 3H-I),导致线粒体变小、膜密度增加、嵴减少并出现外膜断裂(Fig 3J)而NEDD4L敲除则产生相反效果。在Hu-SRC 小鼠模型中,B. parabrevis的铁死亡抑制作用在NEDD4L 敲除后被消除(图 3K-N)
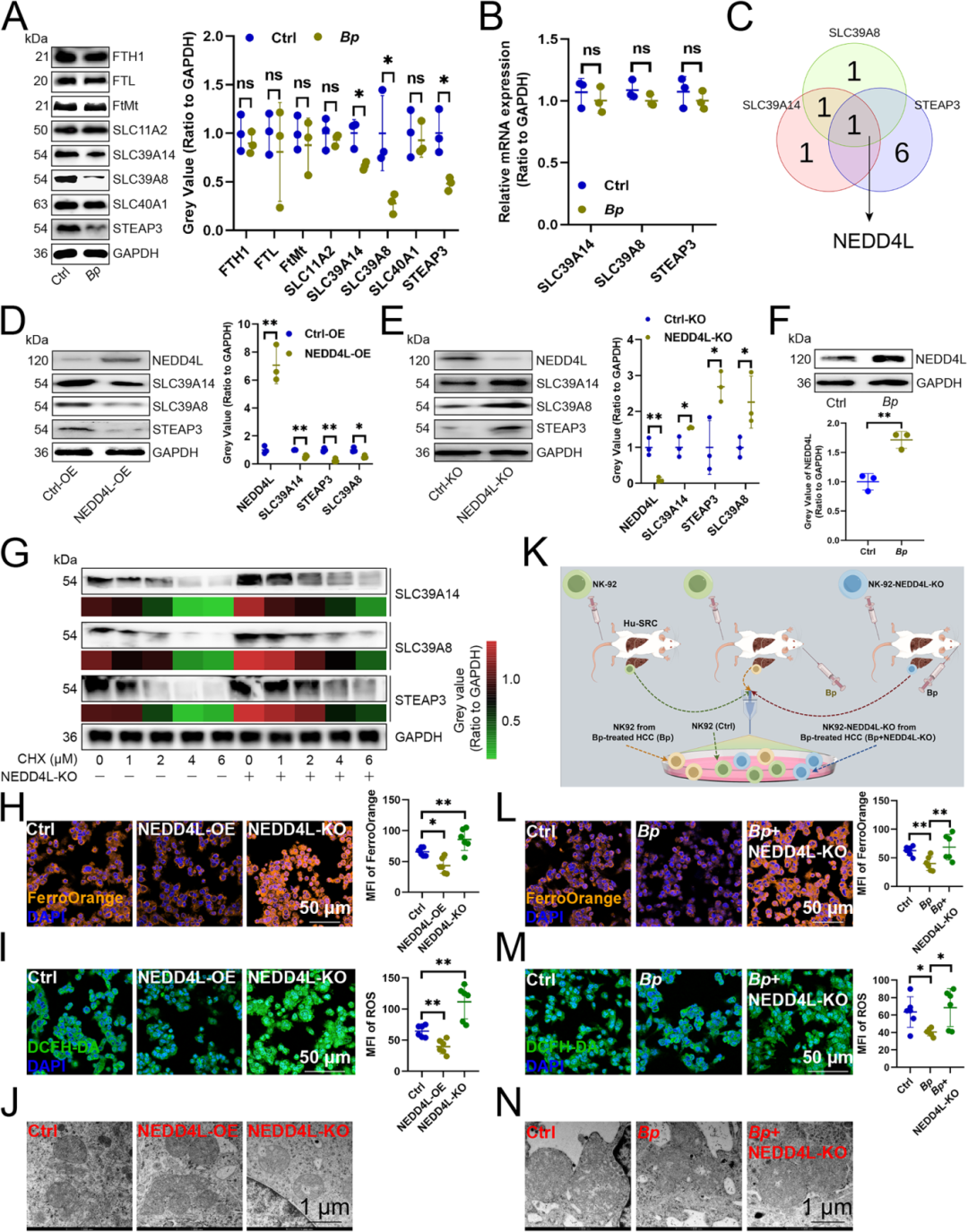
Fig. 3 B. parabrevis抑制NK细胞铁死亡依赖于上调NEDD4L
Result5 NEDD4L与SLC39A14、SLC39A8和STEAP3结合
研究人员通过通过多种实验方法证明了NEDD4L 能够直接结合三种关键铁转运蛋白,并确定了它们的结合区域。分子对接分析显示NEDD4L 通过氢键和盐桥与SLC39A14、SLC39A8和STEAP3结合(Fig 4A-C)。免疫共沉淀实验证实NEDD4L能与SLC39A14(Fig 4D)、SLC39A8(Fig 4E)和 STEAP3(Fig 4F)直接相互作用。通过构建一系列缺失突变体,研究人员确定了:NEDD4L的HECT结构域是与三种铁转运蛋白结合的关键区域。具体结合位点:与SLC39A14的ZIP结构域结合(Fig 4K-L);与SLC39A8的ZIP结构域结合(Fig 4M-N);与STEAP3的CTR结构域结合(Fig 4O-P)。
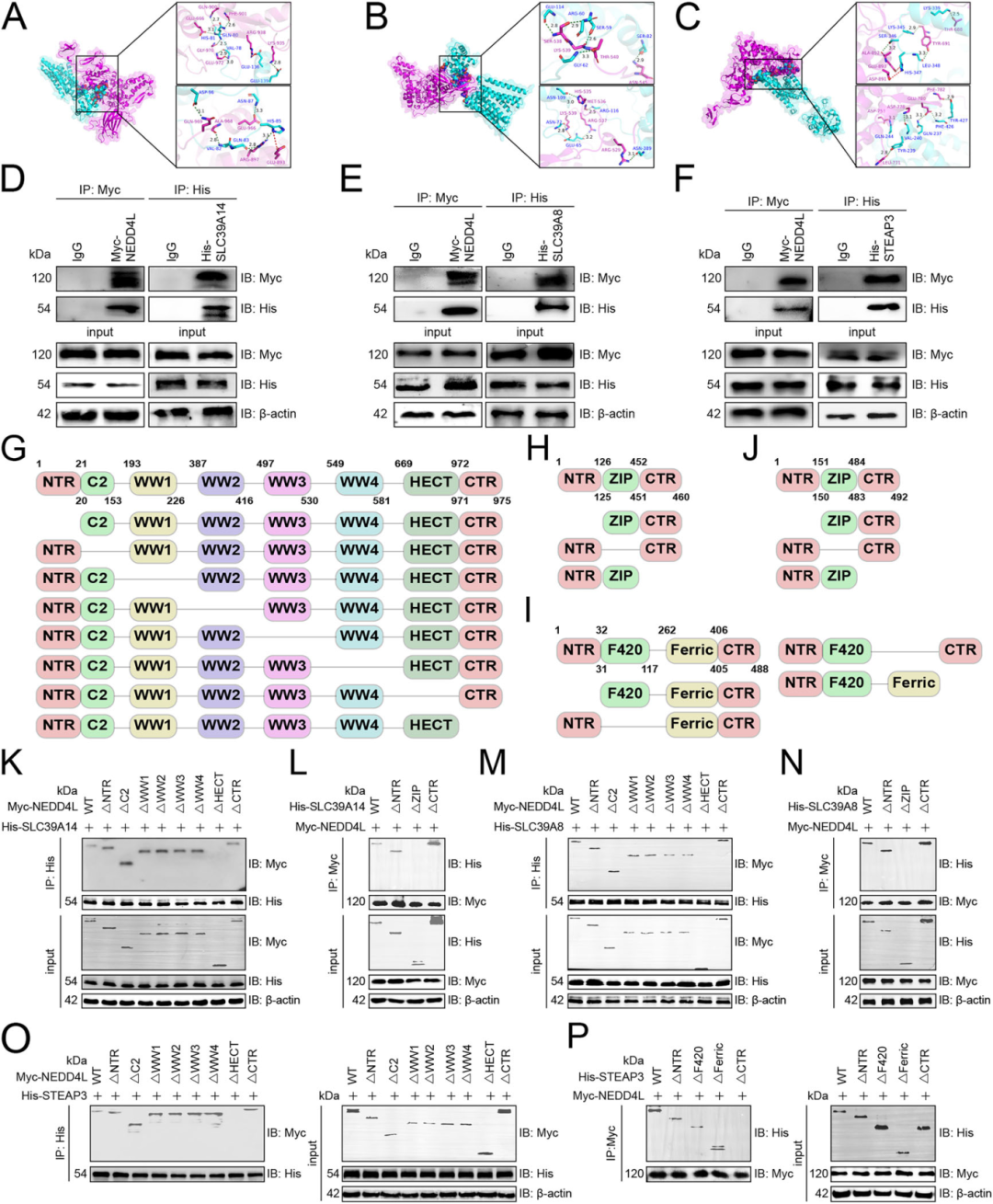
Fig. 4 NEDD4L与SLC39A14、SLC39A8和STEAP3结合图
Result6 NEDD4L促进SLC39A14、SLC39A8和STEAP3的泛素化
NEDD4L过表达显著增加了SLC39A14(Fig 5A)、SLC39A8(Fig 5B)和STEAP3(Fig 5C)的泛素化水平,NEDD4L敲除则明显降低了这三种蛋白的泛素化(Fig 5D-F)。通过对结构域的分析,HECT结构域:对NEDD4L介导的泛素化至关重要(Fig 5G-I),C2结构域:抑制NEDD4L 的酶活性,其缺失增强了泛素化(Fig 5J-L)。通过药物抑制实验发现:使用HECT结构域抑制剂Heclin后,NEDD4L介导的三种铁转运蛋白泛素化被完全阻断(Fig 5M-O)。通过构建赖氨酸突变体,确定了关键泛素化位点:SLC39A14 的 K267 位点(Fig 5P),SLC39A8的K284位点(Fig 5Q),STEAP3的K484位点(Fig 5R)。这些位点在进化上高度保守图(Fig 5S),突变后显著抑制了NEDD4L 介导的蛋白降解(Fig 5T)。通过泛素链接类型分析发现,SLC39A14和SLC39A8:主要通过K48和K63连接的泛素链降解,STEAP3:主要通过K63连接的泛素链降解(Fig 5U-X)。
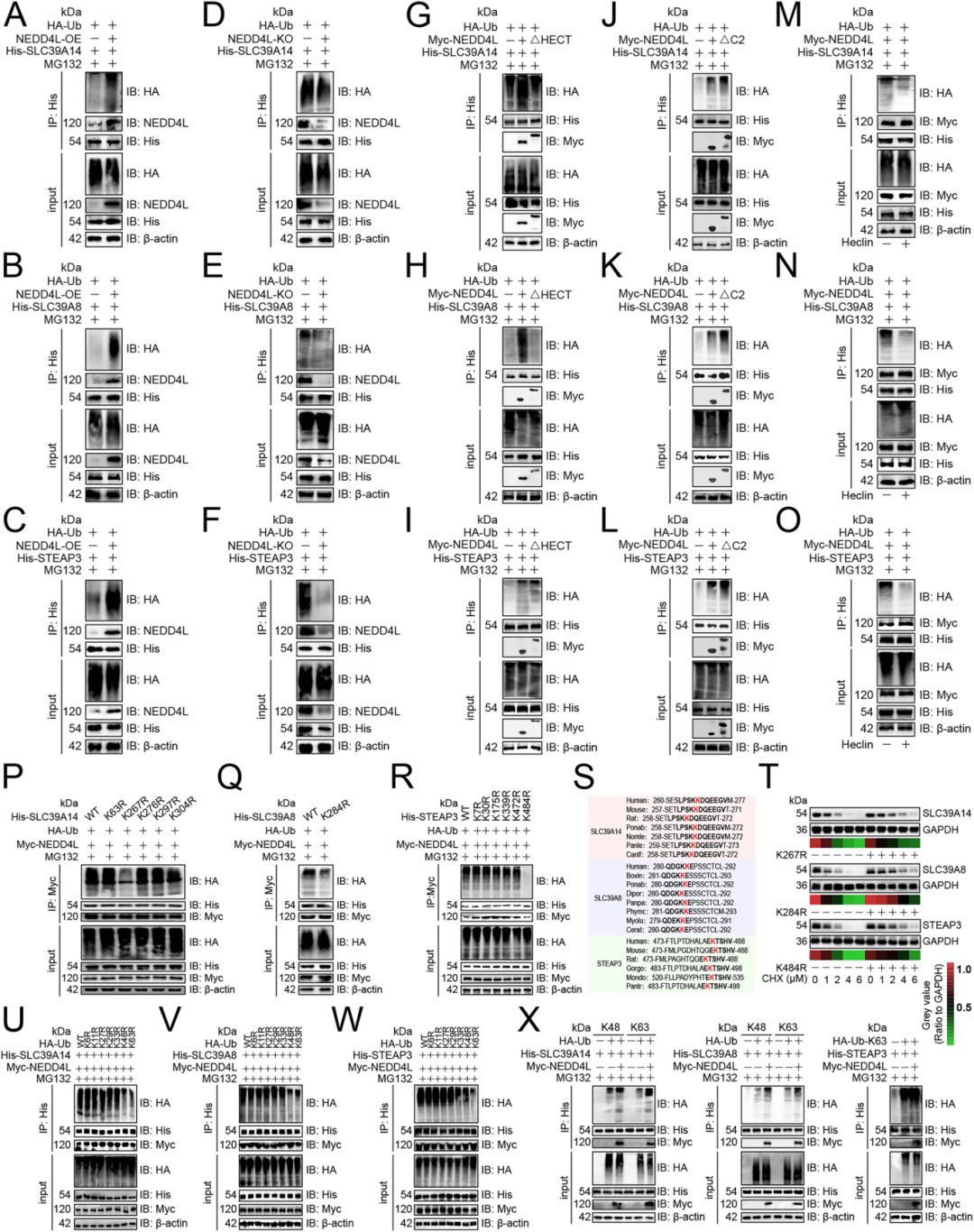
Fig. 5:NEDD4L促进SLC39A14、SLC39A8和STEAP3的泛素化
Result7 NEDD4L抑制NK细胞铁死亡,增强抗肿瘤免疫
研究人员通过NK 细胞输注实验、流式细胞术、免疫印迹、无监督聚类热图、NMDS分析和One-SENSE分析等方法,在Hu-SRC小鼠肝癌模型中验证了 NEDD4L的功能。结果显示,过表达 NEDD4L或移植B. parabrevis均能抑制原位和皮下肿瘤生长、延长小鼠生存期(Fig S3A-D),上调 NK 细胞的适应性标志物(CCL5、NKG7)、细胞毒性标志物(CD7、FCER1G、GZMK、IFN-γ、TNFRSF18)和热休克标志物(HSPA8、HSPE1、HSP90AA1),同时下调终末分化标志物(B3GAT1、CDKN1A等)(Fig S3E);无监督聚类热图分析识别出13个NK细胞亚群(Fig S4A),并明确各亚群定义(Fig S4B),NEDD4L过表达和B. parabrevis处理减少了CORO1A⁺HDAC9⁺终末型NK细胞(tNK)、B3GAT1⁺RFX7⁺tNK 等多种终末型NK亚群,增加了 HSPE1⁺GZMK⁺热休克型 NK 细胞(NK-HSP)比例(Fig S4D-E);NMDS分析表明过表达NEDD4L及其底物或移植B. parabrevis 均能改变NK细胞功能(Fig S4C);One-SENSE分析显示,以NKG7(适应性标志物)和GZMK(细胞毒性标志物)为依据将NK细胞分为双阳性与双阴性细胞后,NEDD4L 过表达或B. parabrevis 移植组的双阳性功能型NK细胞比例较对照组显著升高,而过表达三种铁转运蛋白后该比例较NEDD4L过表达组降低(Fig S4F);此外,当三种铁转运蛋白(SLC39A14、SLC39A8、STEAP3)过表达时,NEDD4L 对肿瘤生长的抑制作用、对NK细胞标志物表达的调控作用及对NK细胞亚群比例的影响均被逆转,证明NEDD4L 通过促进这些铁转运蛋白降解,抑制NK细胞铁死亡,从而增强其抗肿瘤免疫功能(Fig S3A-E、Fig S4D-F)。
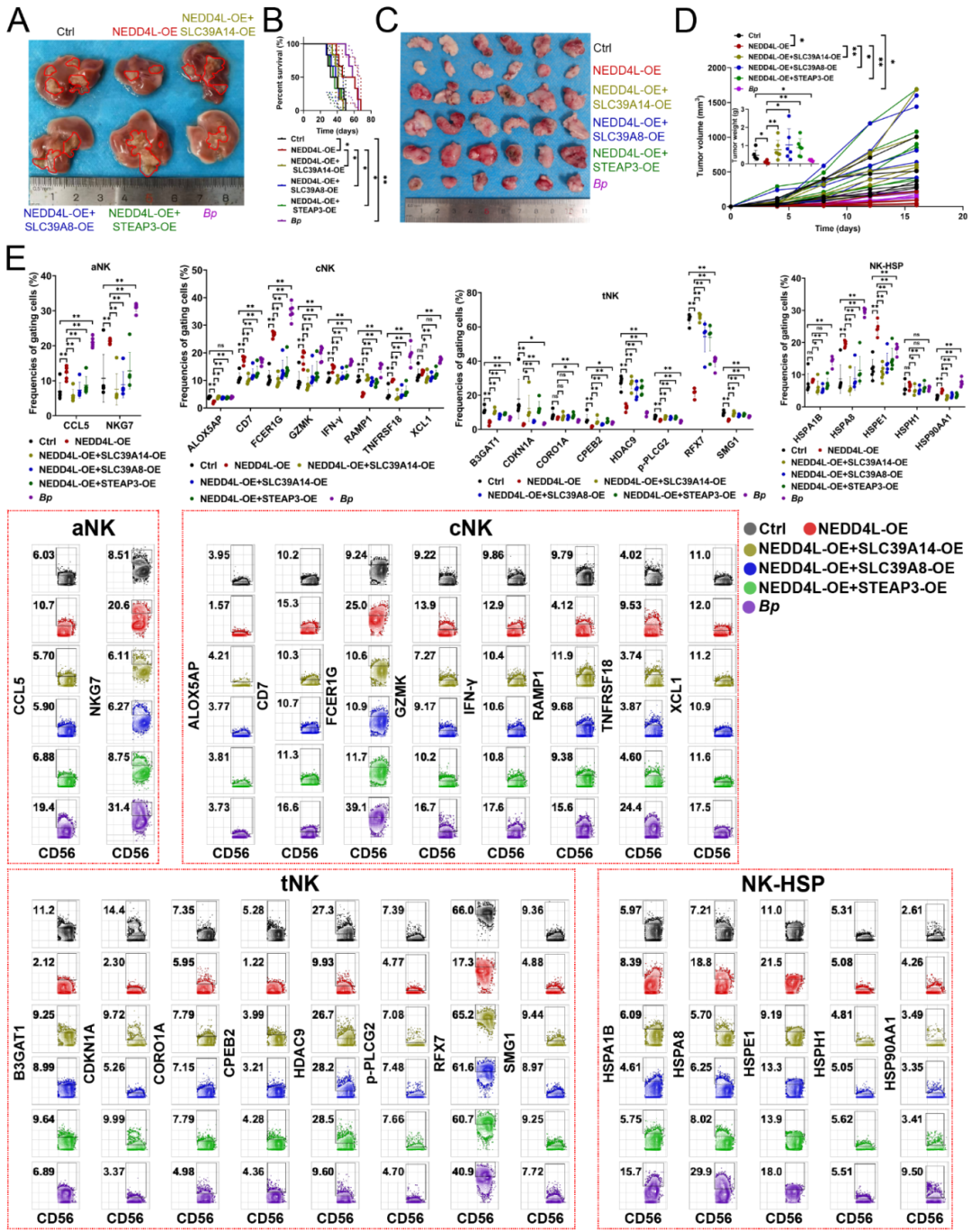
Fig. S3 NEDD4L抑制NK细胞铁死亡并增强抗肿瘤免疫
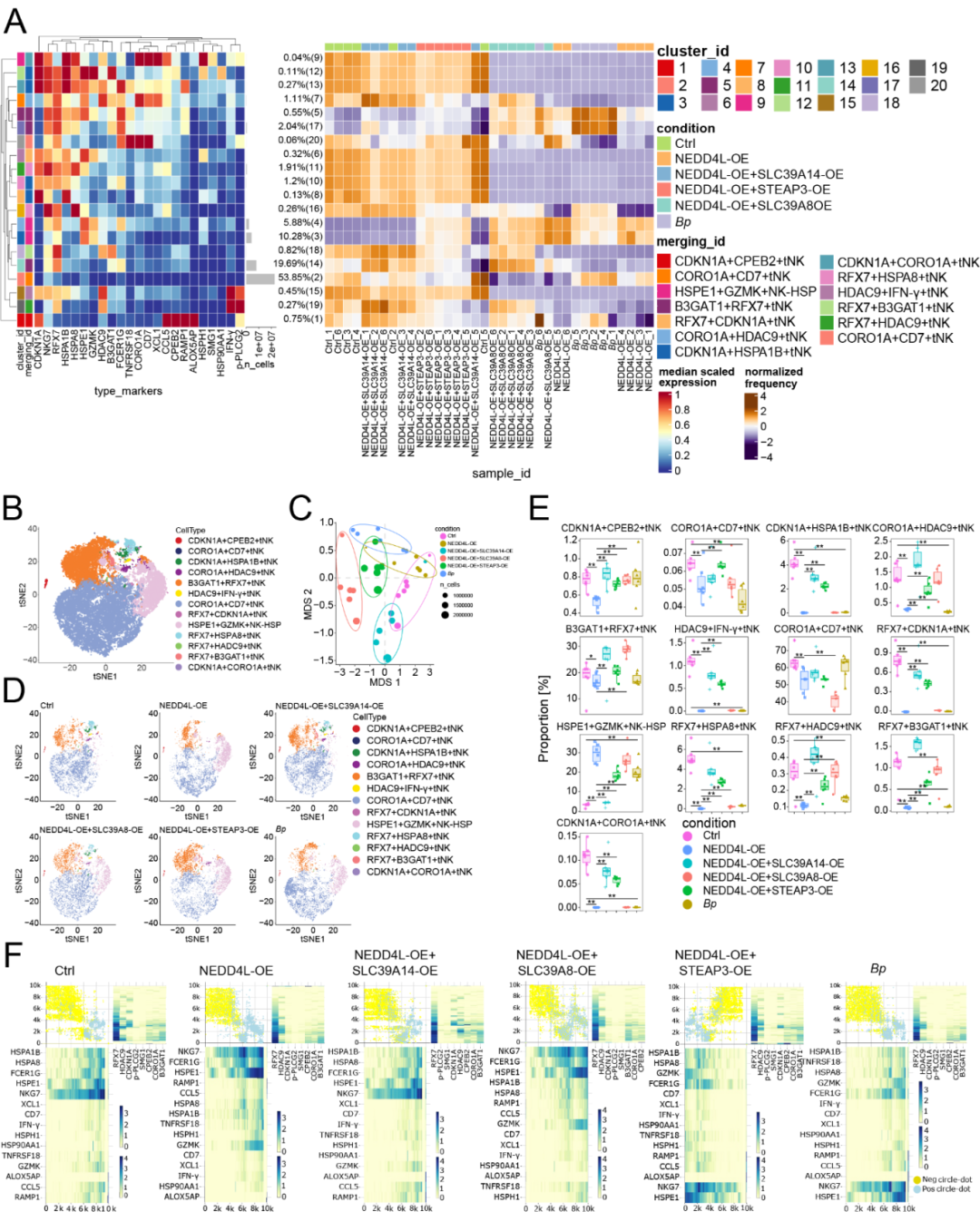
Fig. S4 NEDD4L抑制NK细胞铁死亡并增强抗肿瘤免疫
Result8 NEDD4L抑制NK细胞铁死亡,增强抗肿瘤免疫
为了确定B. parabrevis如何促进NEDD4L的表达,通过DNA pull-down 实验、质谱分析、分子对接、RT-qPCR、免疫印迹、流式细胞术、脂质代谢检测及动物模型实验等方法,探究RORC 乙酰化对NEDD4L转录的调控作用。结果显示,DNA pull-down 结合质谱分析发现 RORC 可结合 NEDD4L 启动子(Fig 6A),分子对接与 DNA pull-down 验证表明RORC通过TYR444等氨基酸与 NEDD4L启动子的AAAGGGGTCT序列形成氢键结合,该序列缺失会抑制二者结合并下调 NEDD4L 的转录与蛋白表达(Fig 6B-D);B. parabrevis 可增强 RORC与NEDD4L启动子的结合(Fig 6G),且其能上调NK细胞中甘油三酯、甘油及乙酰 - CoA 含量(Fig 6M),乙酰 - CoA 可促进NEDD4L表达,而RORC敲低会削弱该促进作用(Fig 6N-O)。进一步实验证实,B. parabrevis 通过促进 RORC 乙酰化(Fig 6Q),且 RORC 的 K120 位点为关键乙酰化位点(Fig 6R-S),该位点乙酰化可增强 RORC 与 NEDD4L 启动子的结合(Fig 6U);动物实验中,NK细胞过表达野生型NEDD4L启动子可抑制小鼠原位及皮下肿瘤生长、延长生存期并上调NK细胞效应基因表达,而预用铁死亡诱导剂FIN56处理或过表达含AAAGGGGTCT缺失序列的NEDD4L 启动子则会削弱上述效应(Fig 6H-L),过表达野生型RORC可抑制肿瘤生长,RORC的K120R突变体(模拟去乙酰化)会减弱该抑瘤作用,K120Q 突变体(模拟乙酰化)则维持抑瘤作用,且 FIN56 预处理会削弱野生型 RORC 的抑瘤效果(Fig 6V-Y),最终证明RORC乙酰化可促进NEDD4L转录。
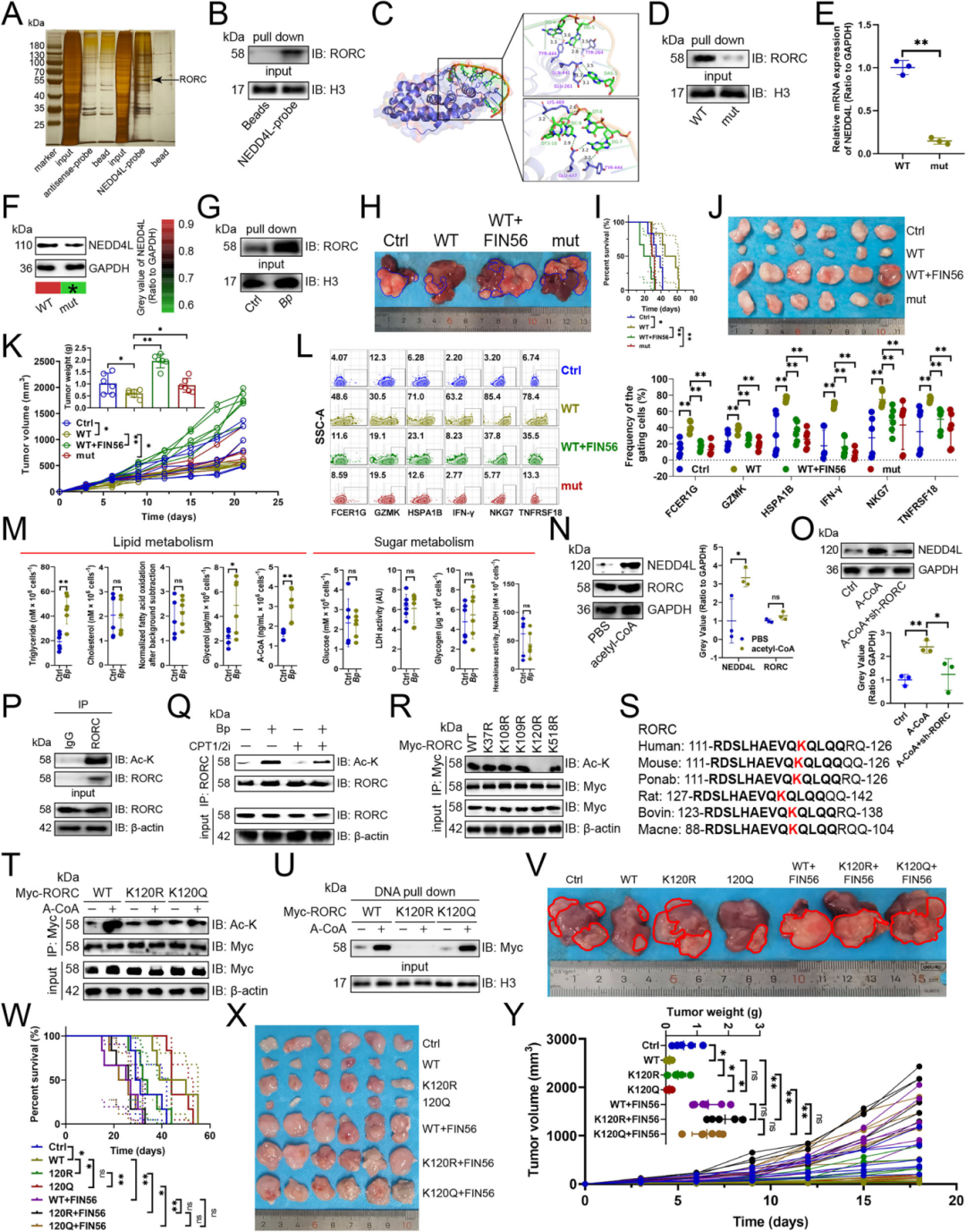
Fig. 6:RORC乙酰化促进NEDD4L转录
Result9 RORC被p300和HDAC1或SIRT3乙酰化和去乙酰化
研究人员又通过通过质谱分析、免疫共沉淀、免疫印迹、基因敲降/过表达实验及特异性抑制剂处理实验等方法,明确了调控RORC乙酰化与去乙酰化的关键酶(Fig 7)。结果显示,质谱分析发现RORC可与乙酰转移酶p300、CBP及去乙酰化酶HDAC1、SIRT3结合(Fig 7A),免疫共沉淀与免疫印迹验证表明,p300和CBP均能与RORC结合,但仅p300可促进RORC乙酰化,p300抑制剂(A485、B026)或基因敲降会下调RORC乙酰化,p300过表达则相反(Fig 7B-F);进一步研究去乙酰化酶发现,HDAC抑制剂(曲古抑菌素 A)和SIRT抑制剂(烟酰胺)均能增加RORC乙酰化(Fig 7G),免疫共沉淀与免疫印迹显示仅HDAC1和SIRT3可与RORC结合并调控其乙酰化——HDAC1抑制剂(SB-429201)或基因敲降会增强RORC乙酰化,HDAC1过表达则抑制;SIRT3抑制剂(Chlopynostat)或基因敲降会提高RORC乙酰化,SIRT3过表达则降低(Fig 7H-Q),最终证实RORC可被p300乙酰化,同时被HDAC1或 SIRT3 去乙酰化。
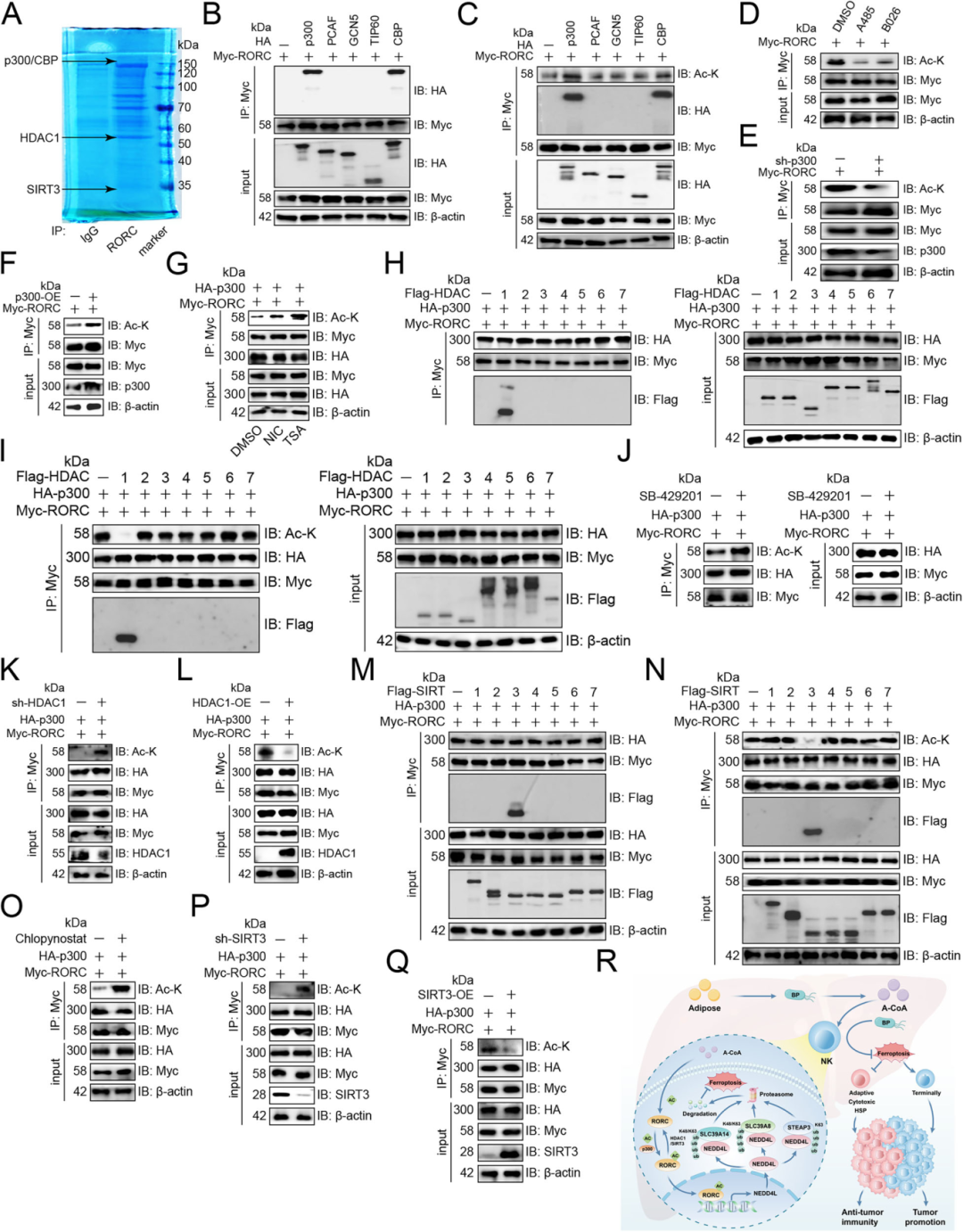
Fig. 7: RORC被p300和HDAC1或SIRT3乙酰化和去乙酰化
该研究通过对肝癌患者组织分析、Hu-SRC 等小鼠模型构建,结合 2bRAD-M分析、质谱流式细胞术、免疫共沉淀、免疫印迹、分子对接等实验方法发现,肿瘤内短小芽胞杆菌(B. parabrevis)可通过促进脂解产生乙酰 - CoA,催化RORC乙酰化并增强其与NEDD4L启动子的结合能力,进而上调NEDD4L 表达;NEDD4L作为E3泛素连接酶,能靶向铁转运蛋白SLC39A14、SLC39A8、STEAP3并诱导其泛素化降解,减少NK细胞内亚铁离子积累与活性氧生成,从而抑制NK细胞铁死亡;同时,B. parabrevis 还可诱导NK细胞向适应性、细胞毒性及热休克表型分化,抑制其终末分化,最终增强NK细胞的抗肿瘤免疫应答,为肝癌临床治疗中利用肿瘤内细菌提供了新策略。
2bRAD-M®高灵敏微生物组是一项微生物组检测技术,像 16S 和宏基因组一样实现样本中微生物的定性和定量。该技术可以同时检测细菌、真菌和古菌;鉴定分辨率达到“种水平”;能应对痕量、降解和高宿主污染样本。

2bRAD-M®技术由中国科学院青岛生物能源与过程研究所、中国海洋大学和欧易生物联合研发,于 2022 年 1 月 26 日发表于 Genome Biology(IF 17.906)。技术起源于 2bRAD 高灵敏基因组测序技术(Nature Methods, Wang et al. 2012)。
【参考文献】
Pan B, Zhang X, Ye D, Yao Y, Zhang Z, Luo Y, Wu H, Wang X, Tang N. Intratumoral Brevibacillus parabrevis enhances antitumor immunity by inhibiting NK cell ferroptosis in hepatocellular carcinoma. Cell Death Dis. 2025 May 21;16(1):407.






