肝癌,尤其是肝细胞癌,素来有“沉默杀手”之称,多数患者一发现便是晚期,治疗选择有限。但您可能从未想过,在我们与癌症斗争的战场上,一群意想不到的“微观盟友”正潜伏在肿瘤内部。
今年7月,一项发表在权威肝病期刊《JHEP Reports》上的研究,为我们揭开了肝癌肿瘤内部一个隐秘的世界——肿瘤内微生物组,并从中发现了一位潜在的“抗癌战士”:Ralstonia菌。

一、肿瘤不是无菌的,里面住着一个“微生物社会”
我们都知道肠道里有菌群,但科学家们发现,肿瘤组织也并非无菌的“荒地”,而是存在着一个复杂的“微生物社会”。
这项研究应用2bRAD-M微生物测序技术(欧易生物提供),对113例人体组织样本进行精密测序后,绘制出肝癌的微生物图谱,发现:
肿瘤里的微生物会“拉帮结派”:根据主导菌群的不同,肝癌可分为两种亚型:
RT型(Ralstonia主导型):由潜在的“好细菌”Ralstonia主导。
nRT型(非Ralstonia主导型):由其他如克雷伯菌等细菌主导。
好细菌在退化:与正常组织相比,肿瘤组织中的微生物多样性显著降低,其中Ralstonia的含量更是明显减少。
这提示我们,肿瘤的发生和发展,可能伴随着内部微生物生态的“失衡”。
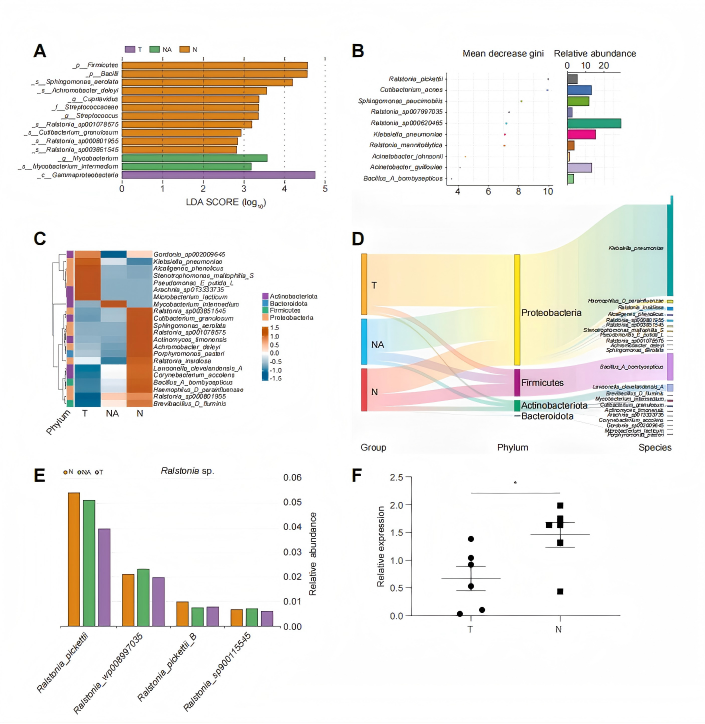
(肿瘤内微生物群落组成及病理组间丰度差异。(A)条形图展示通过LEfSe分析(结合Kruskal-Wallis和Wilcoxon秩和检验与线性判别分析)识别的优势菌种 LDA 评分。紫色、绿色和橙色条形分别表示在T组(肿瘤)、NA组(邻近正常组织)和N组(正常组织)中相对丰度较高的菌种。(B)随机森林分析评估了三组间相对丰度存在显著差异的前10种菌种。(C)热图呈现了区分三组的关键细菌菌种平均丰度分布。(D)桑基图展示了正常对照组(N组)向 HCC 病例(T组和NA组)转移的细菌分类群流动路径及相对比例。(E)Ralstonia属菌种相对丰度特征。(F)通过qPCR分析从T组和N组随机选取的组织样本(每组n=6)验证了Ralstonia属菌种的丰度。统计学差异通过独立样本t检验进行评估。)
二、谁是Ralstonia?它为何是“好人”?
Ralstonia并非外来客,它本就存在于我们的人体环境中。在这项研究中,它展现出了诸多“正义”的特性:
它多在健康组织中:在正常肝组织和癌旁组织中,它的含量远高于肿瘤核心区域。
它与病情较轻相关:它的丰度与较低的肿瘤标志物CA199水平、更轻的肝硬化程度显著负相关。
这些线索都指向一个可能性:Ralstonia可能是一个不利于肿瘤生长的“抑制者”。
三、实验室验证:它不仅在场,更在“战斗”
光有关联性还不够,科学家们必须用实验证明它的能力。
体外细胞实验:
抑制增殖:将Ralstonia与肝癌细胞共同培养,能显著抑制癌细胞活力,减少细胞克隆形成。
阻止扩散:Transwell实验表明,它能有效降低癌细胞的迁移和侵袭能力。
促进凋亡:它能诱导癌细胞走向程序性死亡。
动物体内实验:
抑制肿瘤:将活菌直接注射到小鼠的肿瘤内,可以明显抑制肿瘤生长,且效果优于另一种常用的益生菌。
安全性高:在整个治疗过程中,小鼠的体重及肝肾功能指标均未出现异常,显示出良好的安全性。
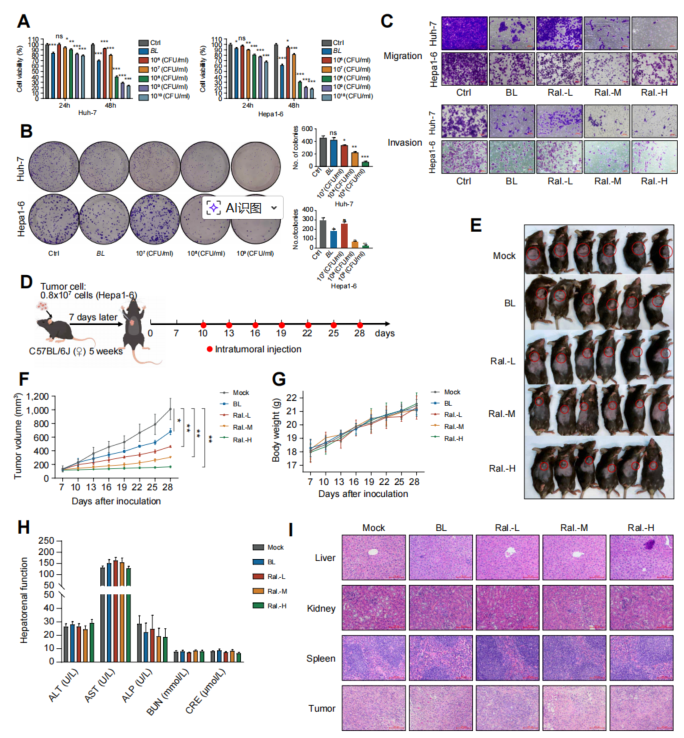
(体外和体内实验均证实Ralstonia sp.对 HCC 细胞具有抑制作用。(A) CCK -8实验显示Huh-7和Hepa1-6细胞与Ralstonia sp.共培养48小时后的存活率(每组5孔)。(B) HCC 细胞共培养48小时后的克隆形成实验(每组3孔)。(C)评估 HCC 细胞与Ralstonia sp.共培养48小时后迁移和侵袭能力的Transwell实验(每组3孔)。(D)小鼠实验示意图(由Figdraw生成)。瘤内注射每3天进行一次,具体剂量为:PBS(对照)、长双歧杆菌(1×10⁸ CFU),以及低(1×10⁷ CFU)、中(1×10⁸ CFU)、高(1×10⁹ CFU)剂量的Ralstonia sp.。(E)皮下移植瘤的代表性图像(每组6只)。(F)动物实验过程中肿瘤体积变化。(G)治疗期间小鼠体重变化(每组6只)。(H)血清ALT、AST、ALP(肝功能)及BUN、CRE(肾功能)水平(每组6只)。(I)小鼠肝、肾、脾及肿瘤组织的H&E染色(每组3只)。数据以均值±标准误表示。统计比较采用非配对双尾Stud法。)
四、它如何做到的?揭秘“代谢-免疫”连环计
Ralstonia是如何实现这些抗癌效果的?深入研究后,科学家发现了其精巧的作用机制:
它的“必杀技”在于调控“甘油磷脂代谢”。
简单来说,Ralstonia通过影响肿瘤细胞周围的脂质代谢环境,间接地重塑了肿瘤内部的免疫微环境。具体表现为:
召唤“正义之师”:在Ralstonia存在的环境中,能杀伤癌细胞的M1型巨噬细胞、记忆性CD8+ T细胞等抗肿瘤免疫细胞的数量明显增加。
改变“土壤”性质:其代谢特征与正常组织更相似,可能创造了一个不利于肿瘤生长的微环境。
也就是说,Ralstonia像一位深谋远虑的“指挥官”,通过调节代谢这个核心环节,成功“唤醒”并“武装”了体内的免疫系统,对肿瘤发起了一场里应外合的精准打击。
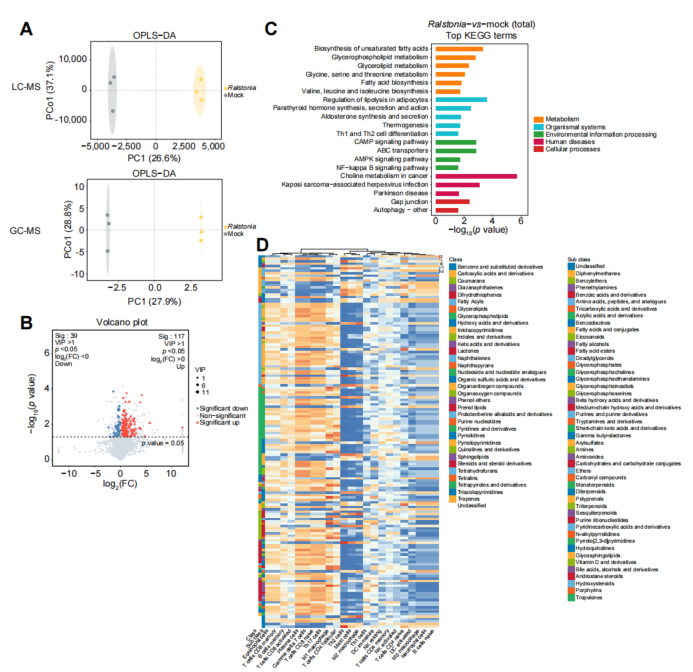
(HCC 中代谢变化与免疫浸润的关联分析。(A) 代谢物的 OPLS -DA分析数据(上图: UPLC -MS;下图:GC-MS),VIP值>1的代谢物视为显著。(B) 火山图分析显示模拟组与Ralstonia sp.组间差异表达代谢物(p<0.05且VIP>1)。(C) KEGG 富集分析基于超几何检验(p<0.05)筛选出前20个显著通路。(D) 层级聚类热图揭示代谢变化与免疫浸润的相关性。GC-MS:气相色谱-质谱; HCC :肝细胞癌; OPLS -DA:正交偏最小二乘判别分析; UPLC -MS:超高效液相色谱-质谱;VIP:投影变量重要性。)
五、未来展望:从诊断到治疗的无限可能
这项研究的发现,为肝癌的诊疗开辟了全新的道路:
新型诊断工具:研究构建的“微生物-代谢物”联合诊断模型,区分肝癌与正常组织的准确率(AUC=0.91)远超传统肿瘤标志物。未来,我们或许能通过检测肿瘤的微生物特征,实现更早期的诊断和更精准的分型。
创新疗法曙光:“瘤内注射活菌”可能成为一种全新的癌症免疫疗法。利用人体内天然存在的、安全的细菌直接对抗肿瘤,无疑为我们提供了一种充满想象力的武器。
六、结语
这项研究彻底改变了我们对肿瘤微环境的认知——微生物不仅是“居民”,更可以是积极的“参与者”和“治疗师”。尽管从实验室走向临床还有很长的路要走,但这项发现无疑点亮了一盏明灯。
未来,我们对抗癌症的武器库中,或许将增添一支由微观生命组成的“奇兵”。
原文信息:
Liqiu Li, Mingxuan Wang, Zhaodi Jiang, Changhua Yi ,Yongxiang Yi .Intratumoral microbial heterogeneity in HCC reveals a potential therapeutic target. JHEP Reports, 2025, 7, 1–16






