
抗生素既影响肠道微生物组成,也影响免疫调控,但具体机制尚未明确。本实验通过建立自身免疫性前列腺炎(EAP)小鼠,探讨了抗生素对小鼠肠道微生物菌群以及免疫炎症的影响。通过整合16S rRNA测序和基于质谱的代谢组学分析,对EAP小鼠因抗生素暴露而引起的肠道微生物群变化及代谢物谱进行了研究。抗生素混合疗法(ABX)可减轻EAP,改变肠道微生物群组成,并影响胆汁酸代谢。

2025年11月,安徽医科大学第一附属医院泌尿外科梁朝朝教授团队在Gut Microbes期刊(IF:11)发表题为“Antibiotic cocktail-induced changes in gut microbiota drive alteration of bile acid metabolism to restrain Th17 differentiation through the FXR–NLRP3 axis”的研究成果,通过Olink蛋白组学+LC-MS全谱代谢组学+LC-MS靶向胆汁酸检测+16S rRNA微生物测序等多组学技术研究方法,发现抗生素诱导的肠道菌群失调会降低胆汁酸代谢物脱氧胆酸(DCA),进一步抑制Th17细胞通过核受体(FXR)/NLRP3轴的分化,从而缓解自身免疫性前列腺炎。
欧易生物提供Olink蛋白组学+LC-MS全谱代谢组学+LC-MS靶向胆汁酸检测+16S rRNA微生物测序服务。


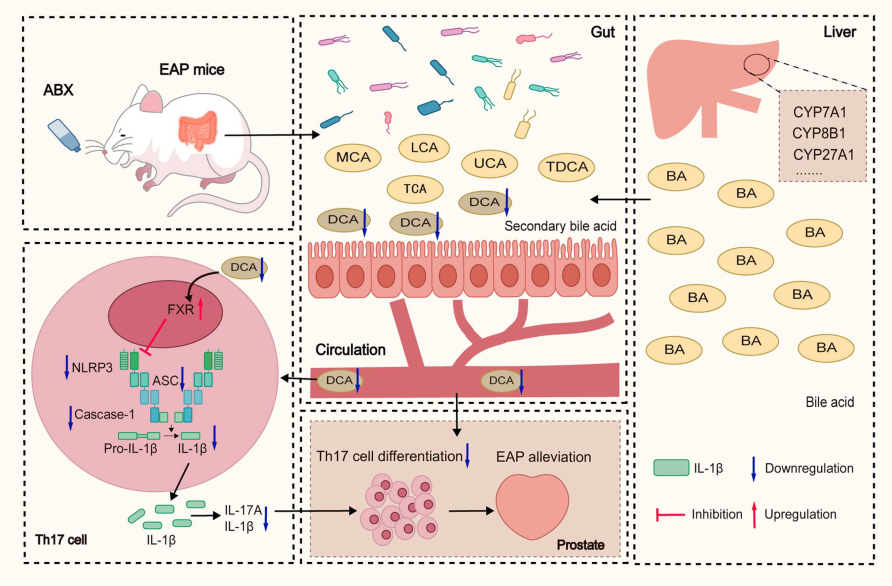

1、抗生素疗法可改变肠道微生物群并缓解自身免疫性前列腺炎的症状
为了探讨肠道微生物在EAP中的作用,作者通过抗生素干预重塑了EAP模型小鼠的肠道菌群。结果显示,抗生素治疗后菌群的α多样性均显著降低,拟杆菌属相对丰度升高;KEGG通路显示Th17细胞分化与IL-17信号通路富集。此外,抗生素处理后小鼠疼痛行为减轻,前列腺炎症浸润减少,脾脏和前列腺中CD4+IL-17A+细胞与CD4+RORγt+细胞比例下降,前列腺组织中IL-17A与RORγt的mRNA表达降低,血清炎症因子水平亦下降。结果表明,肠道微生物群通过调节Th17细胞反应,影响EAP的炎症进程。
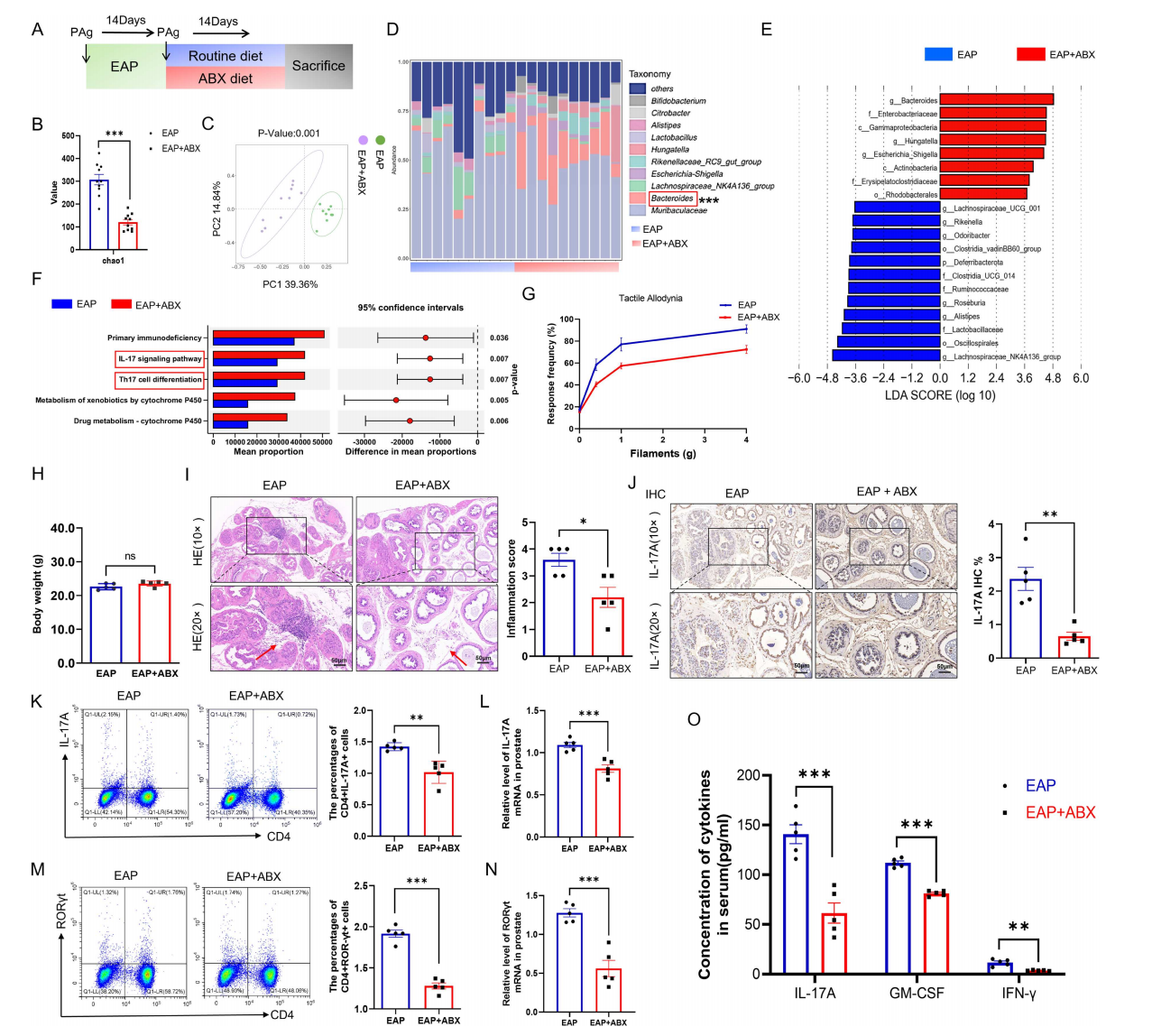
图1 抗生素疗法可改变肠道微生物群并缓解自身免疫性前列腺炎的症状
2、胆汁酸代谢与自身免疫性前列腺炎小鼠的抗生素治疗状态相关
LC-MS全谱代谢组学分析发现,抗生素处理显著改变了EAP小鼠的粪便代谢谱,差异代谢物富集于胆汁酸等代谢途径。LC-MS胆汁酸靶向分析显示,抗生素处理组小鼠血清及前列腺组织中多种胆汁酸(如DCA)水平显著降低。相关性分析进一步揭示,胆汁酸水平(如DCA)与肠道菌群(如Bacteroides、Hungatella)丰度呈负相关,而与另一些菌群(如Lachnospiraceae NK4A136)呈正相关。网络分析将DCA等确定为关键代谢物,且肝脏胆汁酸合成相关基因表达发生改变。结果表明,抗生素通过重塑肠道菌群,干扰了胆汁酸代谢(尤其是DCA),这可能介导了其对前列腺炎症的缓解作用。
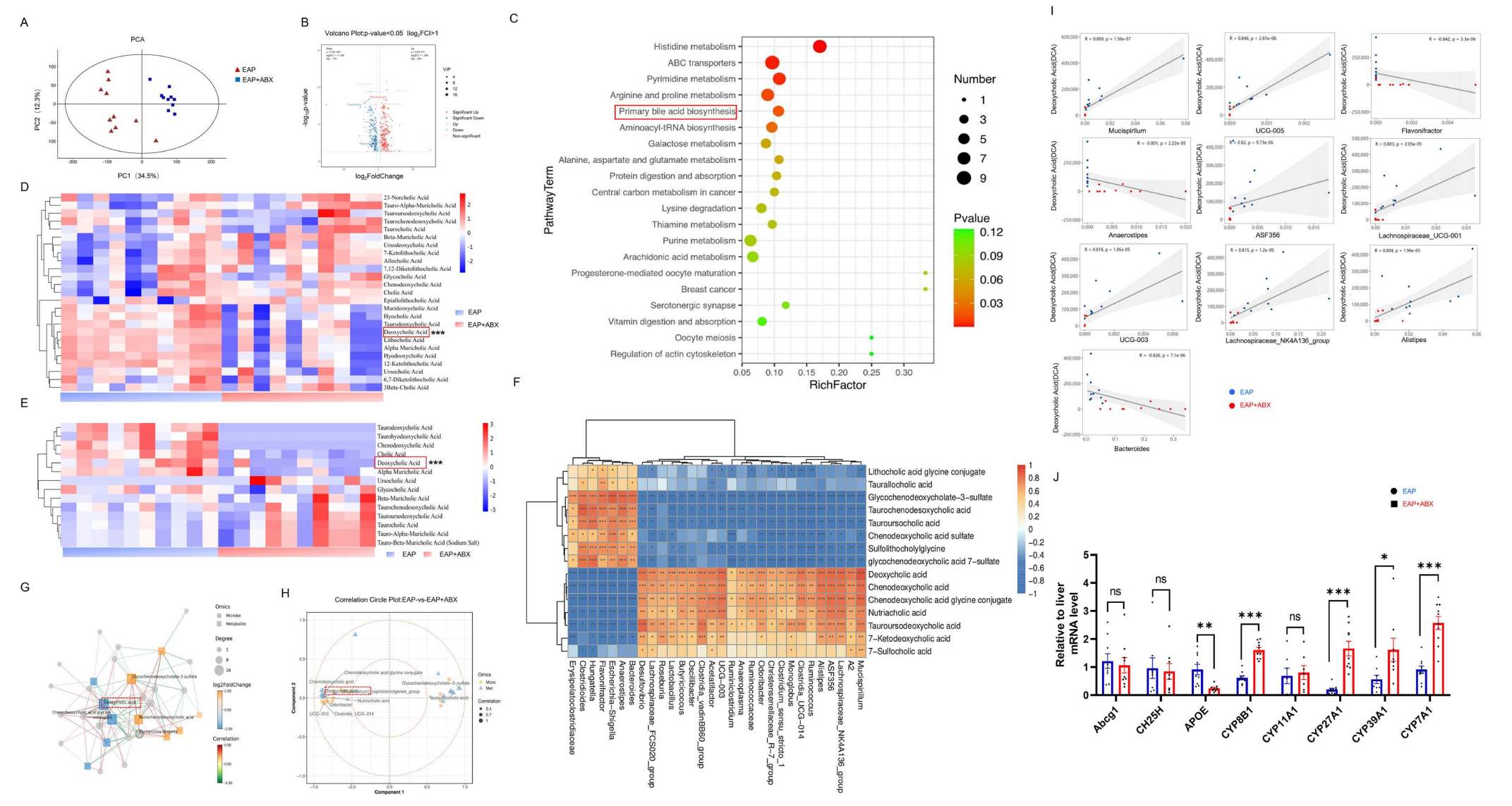
图2 胆汁酸代谢与自身免疫性前列腺炎小鼠的抗生素治疗状态相关
3、抗生素治疗后小鼠的粪便微生物,改变疾病小鼠的肠道微生物群并缓解了其前列腺炎症状
为了确认抗生素治疗后菌群对炎症模型小鼠的治疗效果,作者通过粪便微生物移植(FMT)实验进行了验证。将抗生素治疗的EAP小鼠的菌群移植给EAP小鼠后,其肠道菌群β多样性发生显著改变,Bacteroides、Muribaculum、DSSF69丰度上升,KEGG通路显示IL-17信号通路富集,这些结果显示粪菌移植效果与抗生素治疗一致。体内结果显示,接受抗生素菌群移植的小鼠盆腔疼痛减轻,前列腺炎症浸润减少,脾脏和前列腺中CD4+IL-17A+细胞及CD4+RORγt+细胞比例下降,前列腺组织IL-17A与RORγt的mRNA表达以及血清、组织中促炎因子水平均降低。以上结果说明,抗生素重塑后的菌群特征可通过FMT传递,并同样能缓解EAP炎症,进一步明确了肠道微生物群在调节Th17免疫反应中的关键地位。
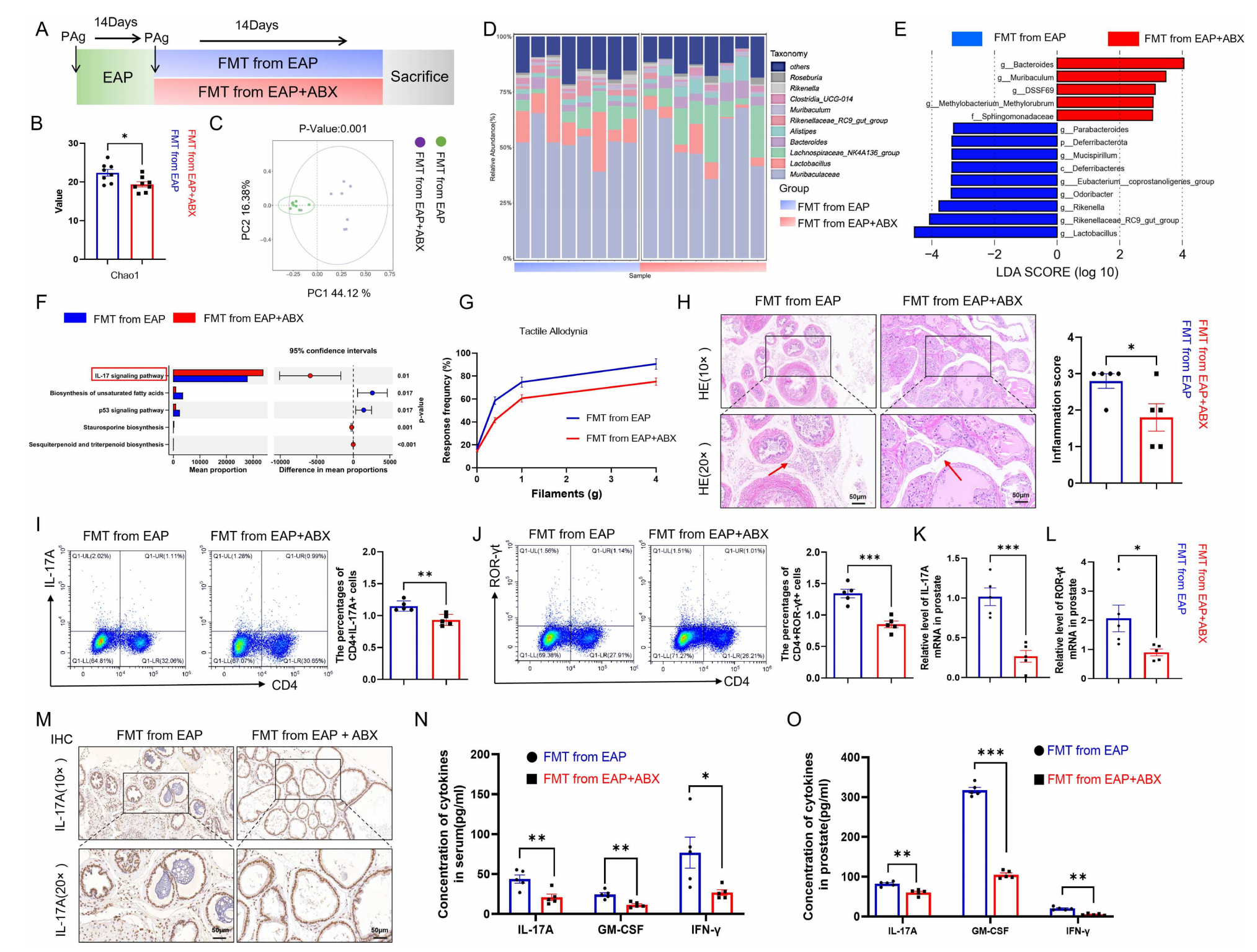
图3 抗生素治疗后小鼠的粪便微生物,改变疾病小鼠的肠道微生物群并缓解了其前列腺炎症状
4、粪菌移植改变了疾病小鼠的肠道内容物的胆汁酸代谢
作者进一步分析代谢组学数据发现,接受FMT的EAP受体小鼠,其粪便代谢谱与疾病模型小鼠的粪便代谢谱存在显著差异。尽管KEGG富集未在初级胆汁酸合成通路发现显著变化,但靶向代谢组学检测证实,接受抗生素菌群移植的小鼠,其血清和前列腺组织中的关键次级胆汁酸DCA水平仍持续显著降低。相关性分析显示,DCA水平与特定肠道菌群(如与Bacteroides和Muribaculum负相关,与Lactobacillus和Rikenella正相关)丰度密切相关,网络分析亦将DCA确定为最核心的差异代谢物。肝脏胆汁酸代谢相关基因的表达改变进一步印证了该通路被重塑。结果表明,FMT介导的EAP缓解作用与DCA水平的降低密切相关,提示DCA是肠道菌群调控前列腺炎症的关键代谢介质。
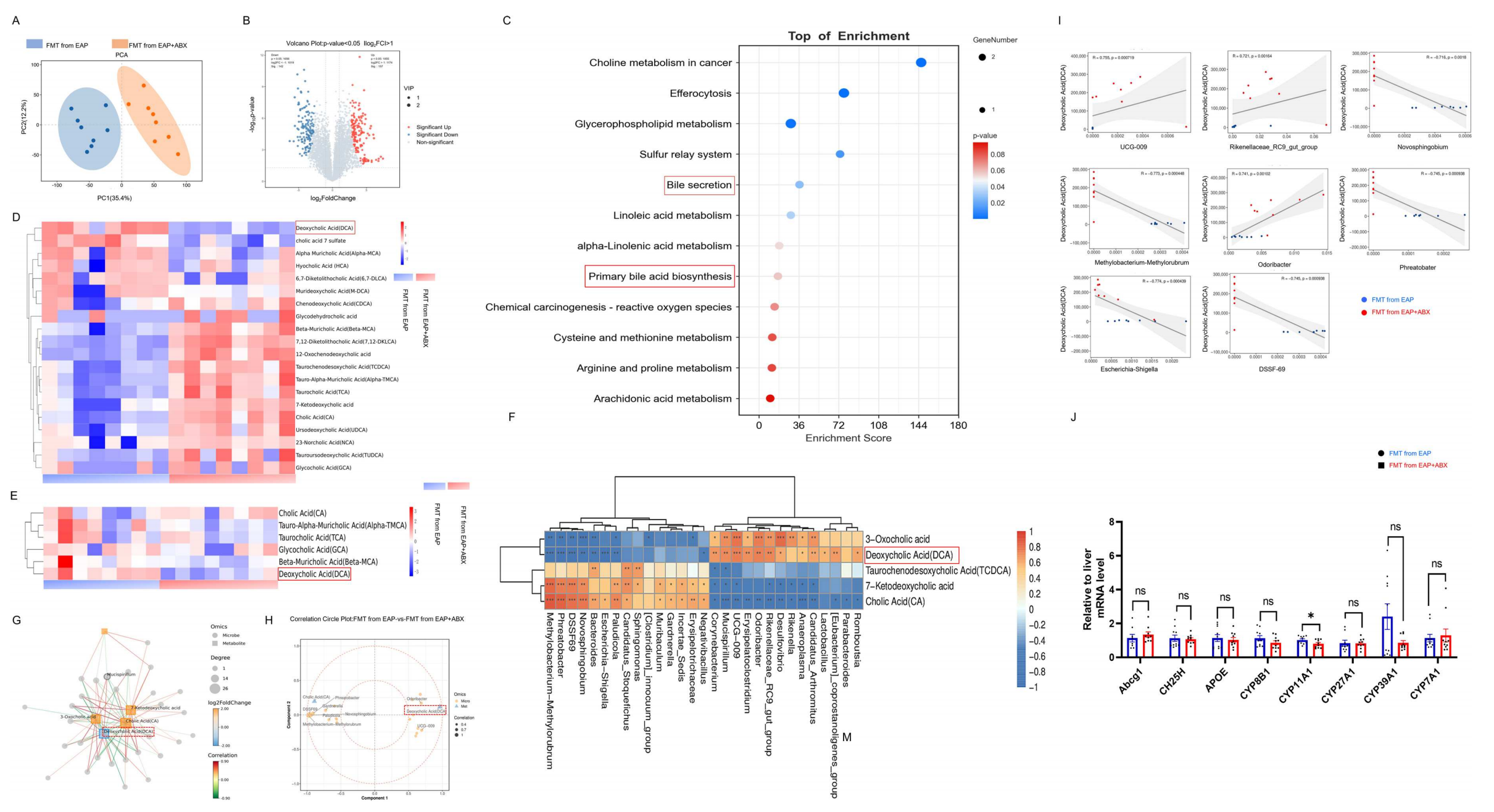
图4 粪菌移植改变了疾病小鼠的肠道内容物的胆汁酸代谢
5、DCA通过抑制FXR的表达来促进Th17细胞的分化
为了确认DCA在抗生素治疗和粪菌移植中的作用,作者把外源性补充胆汁酸DCA+抗生素与常规饮食+抗生素两种治疗方式的炎症治疗效果进行了对比分析。在已接受抗生素治疗的EAP小鼠中,补充DCA逆转了抗生素的保护效应,导致腹痛敏感性回升,前列腺炎症浸润加剧,脾脏和前列腺中Th17细胞(CD4+IL-17A+及CD4+RORγt+细胞)比例及其相关细胞因子水平显著升高。体外实验进一步证实,DCA能直接促进初始CD4+T细胞向Th17细胞分化。机制上DCA可能通过抑制胆汁酸受体FXR的表达,并激活IL-17信号通路来发挥作用。该部分结果确立了DCA作为一种关键的促炎代谢物,能够驱动Th17免疫应答,从而加重前列腺炎症。
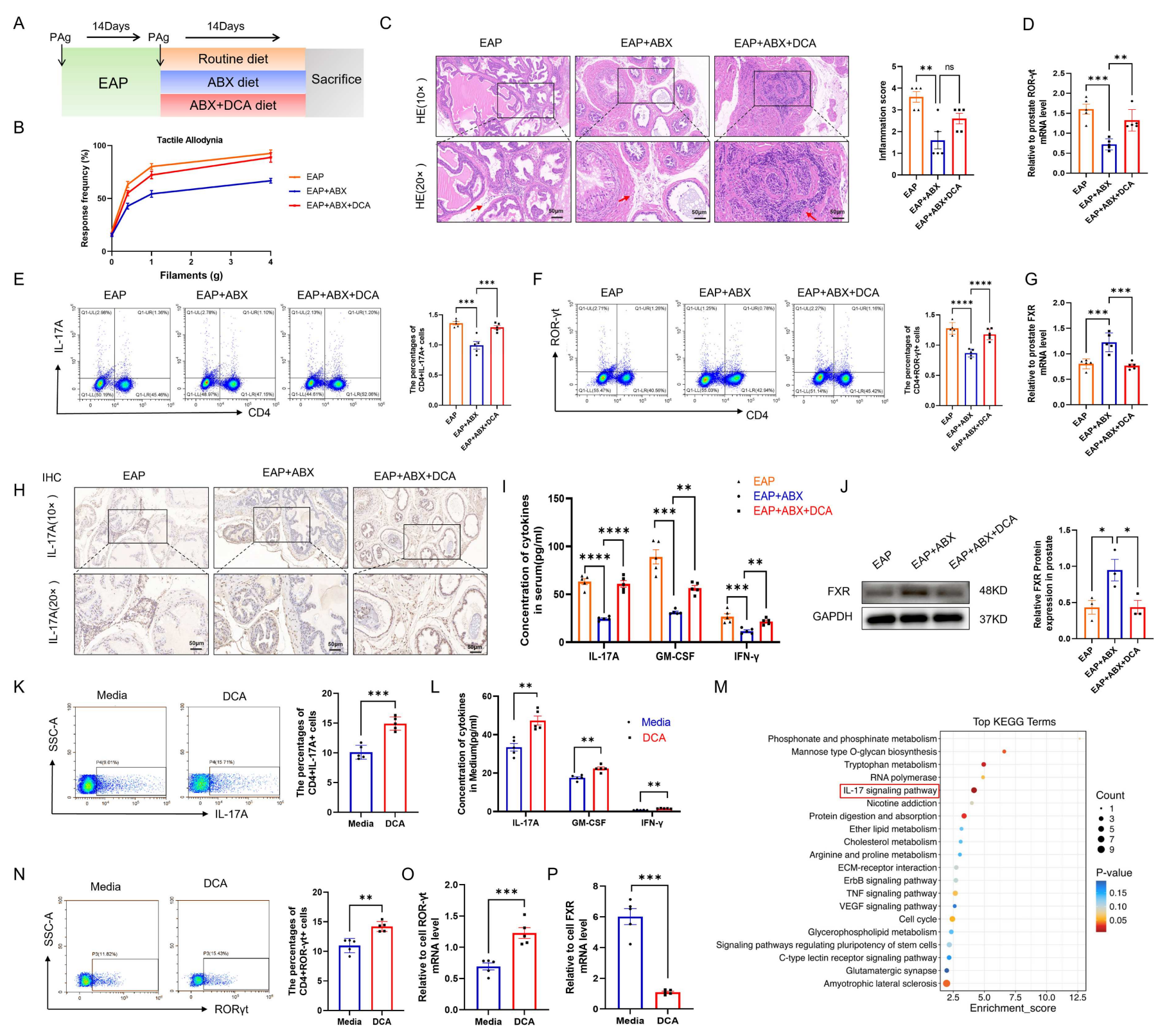
图5 DCA 通过抑制 FXR 的表达来促进 Th17 细胞的分化
6、DCA启动NLRP3-IL17A通路以促进Th17分化
为了深入了解DCA对免疫分子的影响,作者通过使用NLRP3特异性抑制剂MCC950,解析了DCA促进Th17分化与前列腺炎症的具体分子机制。体内实验表明,在DCA处理的EAP小鼠中,联用MCC950能显著缓解腹痛、减轻前列腺免疫细胞浸润、降低脾脏和前列腺中Th17细胞(CD4+IL-17A+及CD4+RORγt+)的比例,并下调血清炎症因子水平。组织染色显示,DCA升高了前列腺中NLRP3与IL-17A的表达,而MCC950则逆转了这一效应。体外实验进一步证实,MCC950可抑制DCA诱导的初始CD4+T细胞向Th17细胞的分化,并降低NLRP3通路相关蛋白(如NLRP3、ASC、IL-17A)的表达。机制上,研究证实胆汁酸受体FXR可作为转录因子直接结合NLRP3的启动子区域以调控其表达。综合结果表明,DCA通过抑制FXR,解除了其对NLRP3的转录抑制,从而激活NLRP3炎症小体及其下游的IL-17A信号通路,最终驱动Th17细胞分化并加重前列腺炎症。
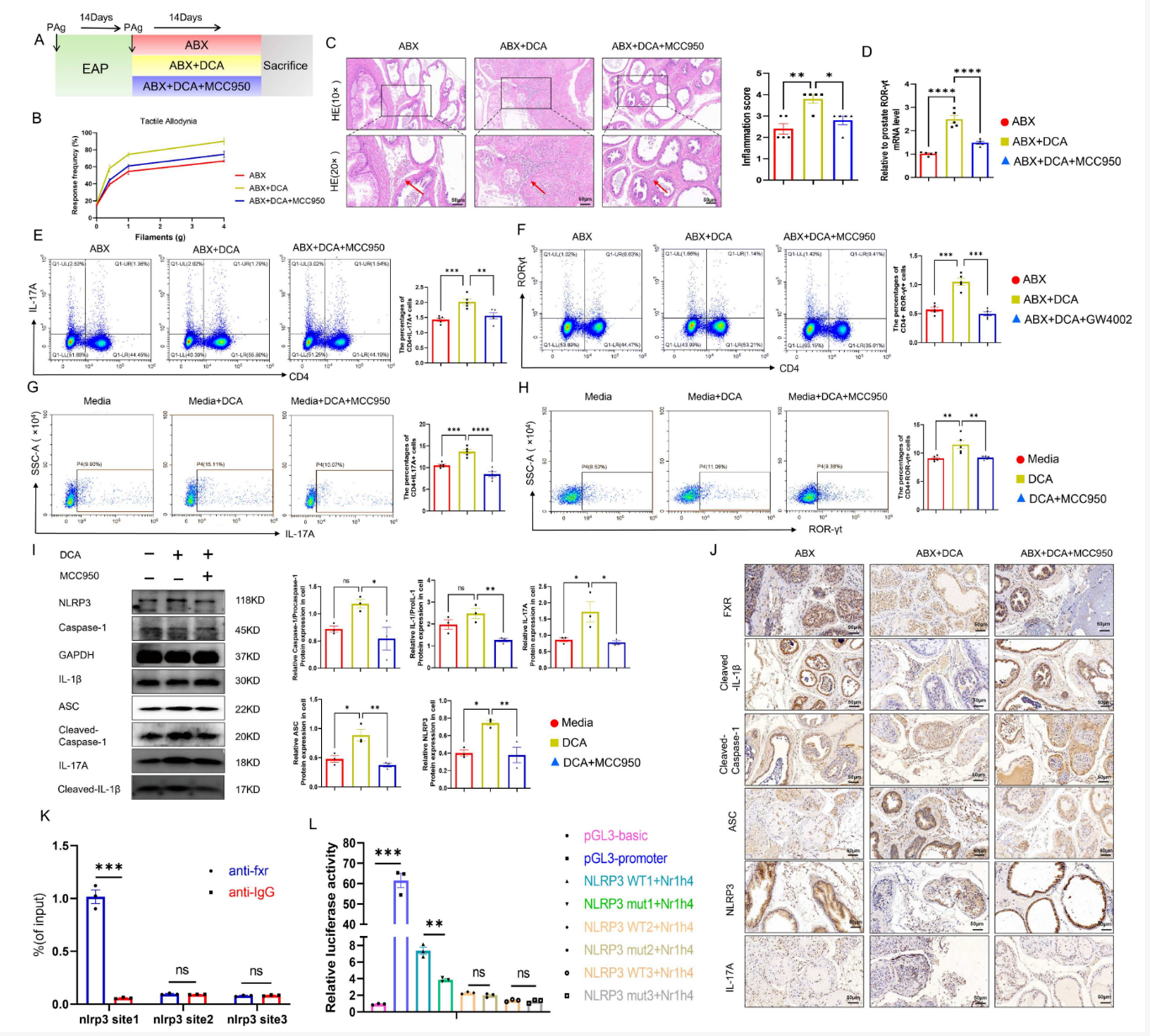
图6 DCA 启动 NLRP3-IL17A 通路以促进 Th17分化
7、DCA 抑制NLRP3-IL17A信号通路的FXR激活,促进Th17细胞分化
为了确认DCA的作用机制,作者通过联合使用FXR激动剂GW4064与NLRP3抑制剂MCC950,进一步阐明了DCA加剧EAP的完整分子轴。体内实验表明,在DCA处理的基础上,给予GW4064或MCC950均能显著减轻小鼠的腹痛敏感性、前列腺炎症浸润、降低脾脏及前列腺中Th17细胞(CD4+IL-17A+与CD4+RORγt+)的比例,并下调血清炎症因子水平。体外实验证实,抑制FXR表达可促进初始CD4+ T细胞向Th17分化,并上调NLRP3、ASC、IL-17A等蛋白表达,而激活FXR或抑制NLRP3均可逆转此效应。关键验证显示,在抗生素治疗或FMT受体小鼠的前列腺中,提高FXR表达均能有效抑制NLRP3-IL17A通路的激活。综上所述,本研究确立了“DCA—抑制FXR—激活NLRP3炎症小体—促进IL-17A产生/Th17分化”的核心通路,阐明了肠道菌群代谢物通过FXR/NLRP3轴调控前列腺炎症的精确机制。
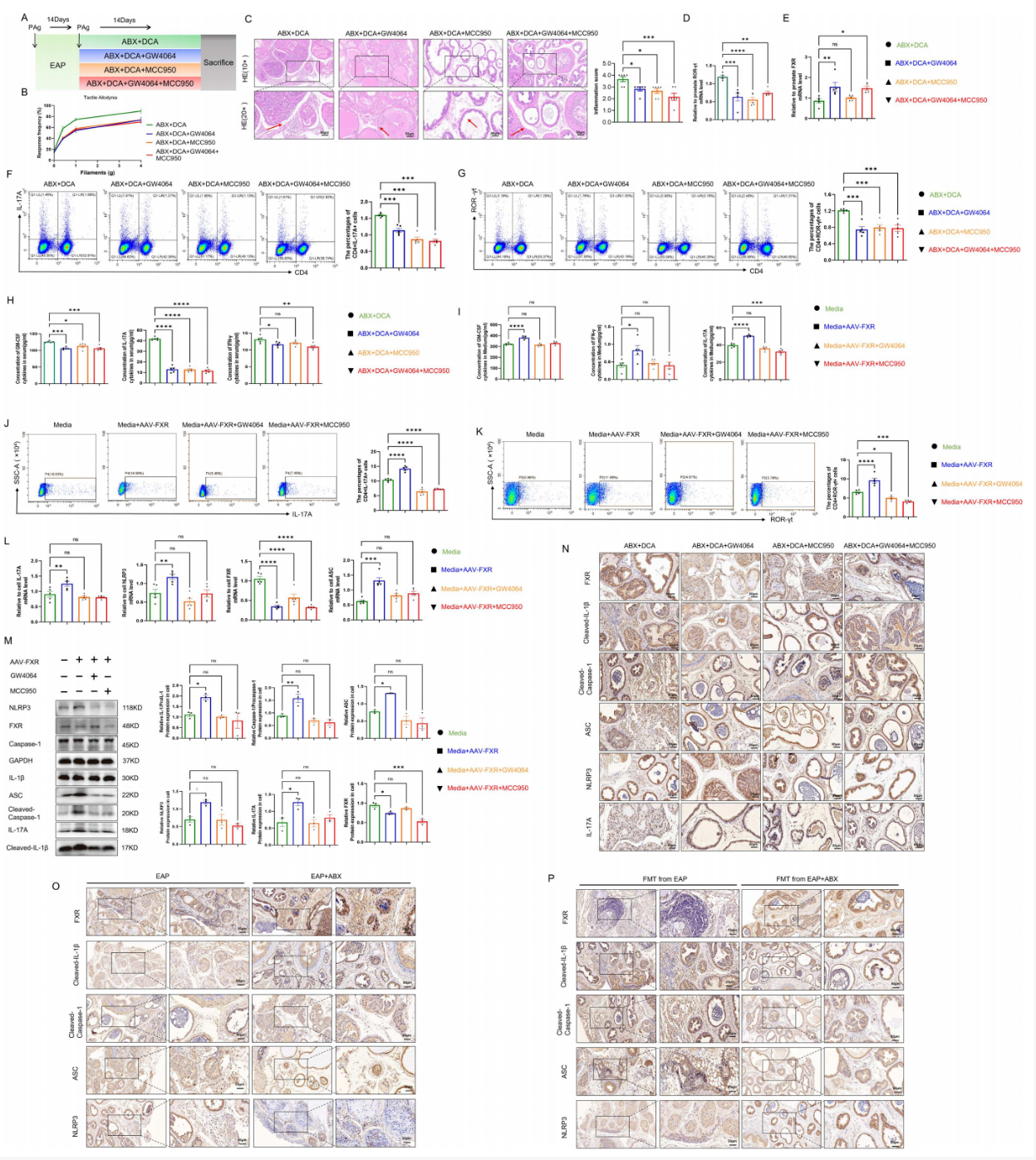
图7 DCA 抑制 NLRP3-IL17A 信号通路的 FXR 激活,促进 Th17 细胞分化
8、抗生素治疗改变慢性前列腺炎症患者的胆汁酸代谢和肠道微生物群
通过对未使用过抗生素的CPPS 患者进行为期14天的氟喹诺酮类抗生素治疗,采集其治疗前后的粪便与血清样本,结合代谢组学与16S rRNA基因测序分析,探讨抗生素是否通过调节肠道菌群及胆汁酸代谢缓解患者症状。结果显示:抗生素治疗后,患者粪便代谢组发生显著改变,其中初级胆汁酸合成增加,而粪便及血清中的次级胆汁酸DCA水平均显著下降。肠道菌群分析表明,抗生素治疗后菌群α多样性部分指标发生变化,β多样性呈现显著差异;属水平上Bacteroides丰度下降。进一步整合分析发现,DCA的变化与肠道菌群组成相关,但其与Sulfurovum等特定菌属无显著相关性。综上所述,抗生素治疗可显著扰动CP/CPPS患者的肠道菌群结构,引起胆汁酸等代谢物谱的改变,尤其可能通过调节DCA代谢途径对疾病产生影响。
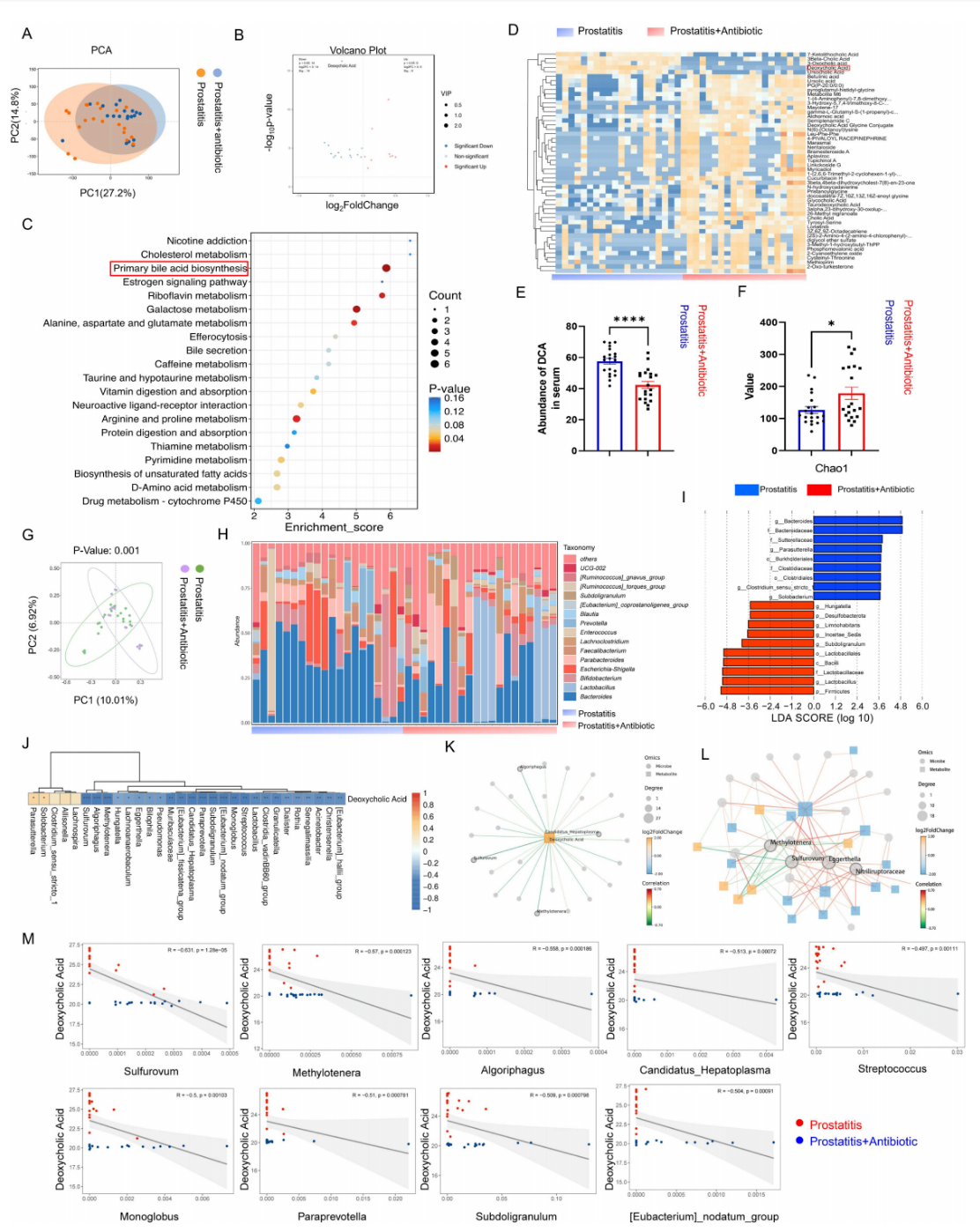
图8 抗生素治疗CPPS患者的胆汁酸代谢和肠道微生物群
9、抗生素治疗降低CP/CPPS患者的血清炎症因子水平
由于无法获取前列腺组织进行病理诊断,作者通过Olink蛋白质组学分析患者血清,评估了抗生素治疗对全身炎症状态的影响。PCA分析显示治疗前后总体血清炎症蛋白谱无显著差异,但在严格筛选中仍鉴定出部分发生显著变化的炎症蛋白。进一步分析发现,IL-17A等蛋白在IL-17信号通路中表达下降,KEGG富集分析提示IL-17信号通路和Th17细胞分化显著富集。蛋白质互作网络分析中,IFN-γ与IL-17A处于核心地位。结果表明,抗生素治疗能够降低CP/CPPS患者血清中特定的促炎细胞因子水平,可能通过抑制Th17细胞分化和IL-17信号通路发挥作用。
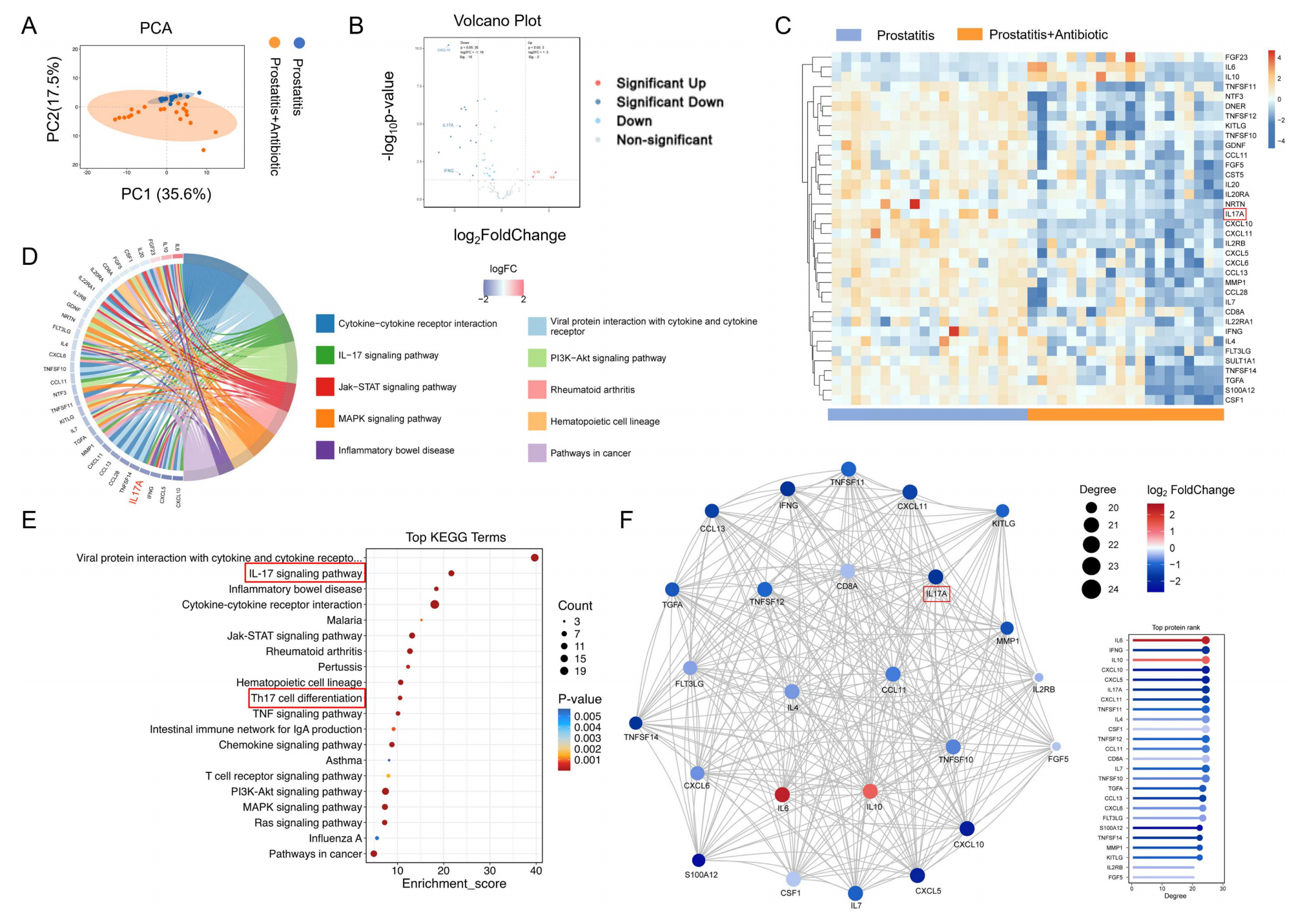
图9 抗生素治疗降低 CP/CPPS 患者的血清炎症因子水平

将ABX治疗后粪便中的微生物群移植到EAP小鼠体内,可有效改变肠道微生物群组成并缓解疾病症状,表明微生物群干预可减轻自身免疫性炎症,并降低小鼠体内的脱氧胆酸(DCA)。后续实验表明,脱氧胆酸(DCA)抑制法尼醇X受体(FXR)的表达,从而能够抑制NLRP3-IL17A轴,促进Th17细胞的发育,加剧前列腺的炎症细胞浸润。我们对前列腺炎患者的初步临床检查以及抗生素治疗表明,抗生素治疗会影响胆汁酸代谢和Th17细胞的发育。
这项研究揭示了抗生素诱导的肠道菌群失调会降低胆汁酸代谢产物DCA,进一步通过FXR-NLRP3轴抑制Th17细胞分化,从而缓解自身免疫性前列腺炎。我们的研究结果揭示了抗生素、肠道菌群、胆汁酸代谢和免疫调节之间相互关联的动态变化,对针对免疫介导性疾病的治疗具有潜在意义。

通过Olink蛋白组学+LC-MS全谱代谢组学+LC-MS靶向胆汁酸检测+16S rRNA微生物测序等多组学技术研究方法,本文研究了EAP小鼠肠道微生物群和代谢物谱中抗生素驱动的改变。抗生素混合物(ABX)治疗减轻了EAP,改变了肠道微生物组成,并影响胆汁酸代谢。使用ABX处理粪便中的微生物群进行粪菌移植(FMT)到EAP小鼠中,有效改变了肠道微生物组组成并缓解了疾病症状,表明微生物组干预可减少自身免疫性炎症并降低小鼠脱氧胆酸(DCA)水平。
原文链接:
https://doi.org/10.1080/19490976.2025.2582944






