单细胞转录组测序技术自推广至今已有几年的时间,各大期刊对单细胞文章的要求也越来越高,多组联合、大样本量、特殊样本甚至深入的功能验证,已成为文章发表不可或缺的重要因素。下面这篇文章,探究利用单细胞转录组、Smart-seq2、单细胞ATAC-seq,结合大量的功能验证实验共同探究肾脏纤维化中肌成纤维的起源问题,一起来了解一下吧。

样本类型:人、小鼠肾脏
发表期刊:nature
影响因子:42.778
发表年份:2020.11
慢性肾脏疾病 (CKD) 影响着超过 10% 的世界人口,而肾损伤的最终共同途径是肾脏的纤维化,目前还没有很好的治疗方法。本文作者使用单细胞 RNA 测序 (scRNA-seq),对处在稳态和纤维化期间的大约 135,000 个人和小鼠的肾脏细胞进行了分析,在高分辨率下揭示细胞外基质 (ECM) 的异质性,发现了与人类肾脏纤维化相关的几个间质细胞亚群。小鼠的遗传命运追踪和时间过程的 scRNA-seq 和 ATAC-seq 实验,以及人类肾脏纤维化的空间转录组学,证实了这次发现,并阐明了人类肾脏肌成纤维细胞的起源。此外,作者使用这一策略筛选了 NKD2 作为人肾纤维化中肌成纤维细胞特异性靶基因,可作为潜在的治疗靶标。
主要内容
1. CKD 患者的肾脏单细胞图谱和细胞外基质的起源
为了了解在稳态和 CKD 期间,哪种肾脏细胞分泌细胞外基质 (ECM),作者对来自 13 个 CKD 患者的肾脏组织进行单细胞转录组测序分析,绘制了人类肾脏细胞图谱(重点是肾小管间质细胞),并通过 CD10-(非近端小管)和 CD10+(近端小管)分别对两种细胞进行后续分析 (Fig1 a-e)。通过对 CD10+ 细胞的 KEGG pathway 和 GO 分析,发现 CKD 中 CD10+ 细胞的脂肪酸代谢增加(Fig1 f),表明可能引起小管细胞去分化和纤维化。
为了确定在肾纤维化中有助于 ECM 产生的细胞类型,作者分析了包括胶原蛋白、糖蛋白和蛋白聚糖在内的基因在健康和 CKD 中的表达评分,发现 CKD 中,ECM 表达高的细胞明显增加 (Fig1 g),而间质细胞表现出最高的 ECM 表达,并且在 CKD 中进一步增加 (Fig1 h, i)。此外,CKD 中成纤维和肌成纤维也发生显著扩增 (Fig1 j),通过拟时序分析,作者发现肌成纤维细胞来源于周细胞和成纤维细胞 (Fig1 k)。
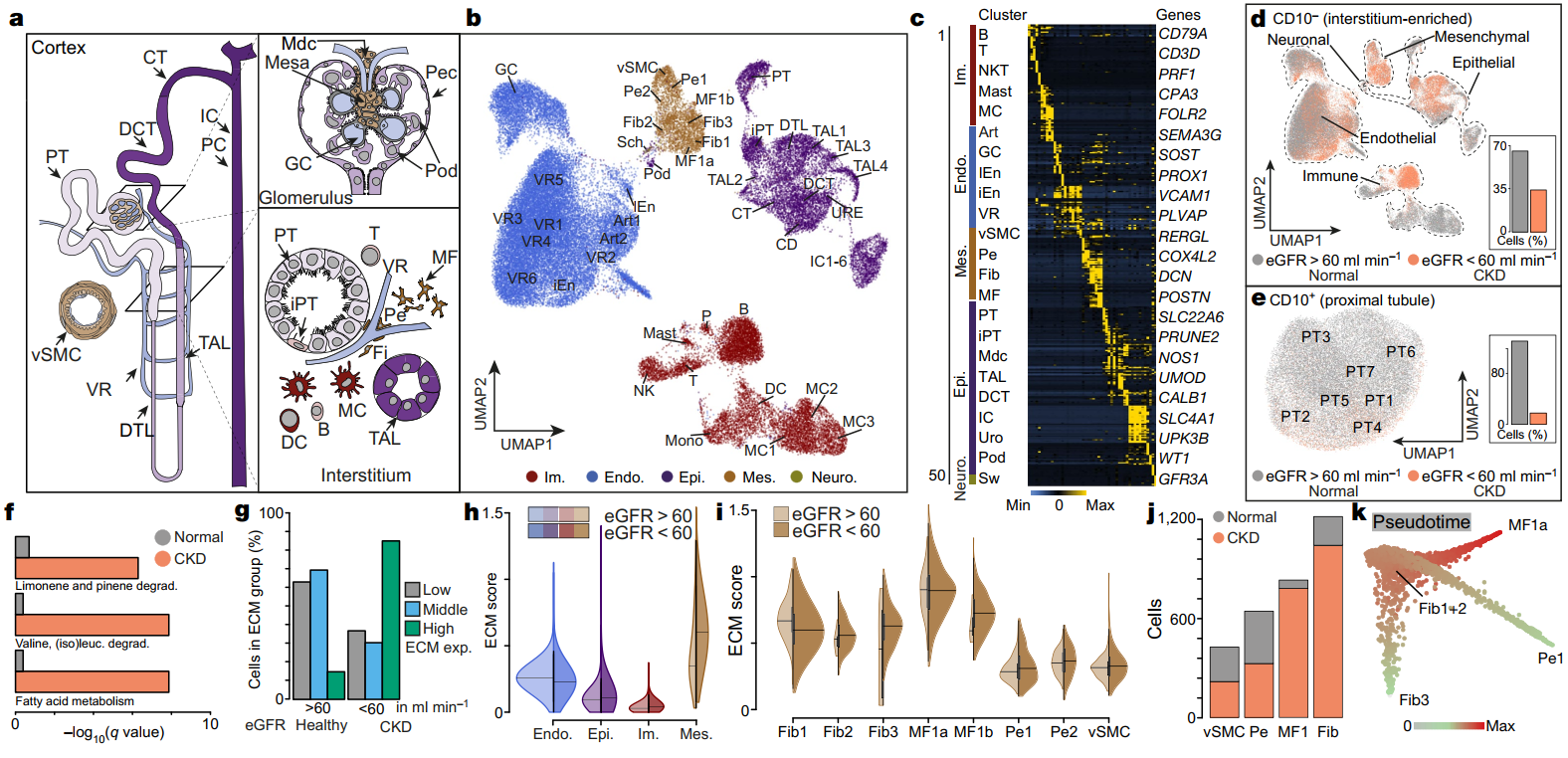
Fig1 人类 CKD 的肾脏单细胞图谱
上皮细胞中 ECM 基因轻度上调 (Fig1 h),表明了上皮-间质转化的轻微作用。在对受损伤的近端小管的分析中,发现在 CD10- 上皮中表现出最高的 ECM 基因表达,各种表达基因和 GO 分析表明小管细胞存在去分化 (Fig2 e-j)。在 CD10+ 的近端小管中,ECM表达在 CKD 中略有增加 (Fig2 k-n)。综上,在人类肾脏纤维化中,大多数 ECM 来源于间质细胞,少量来自近端去分化小管细胞。
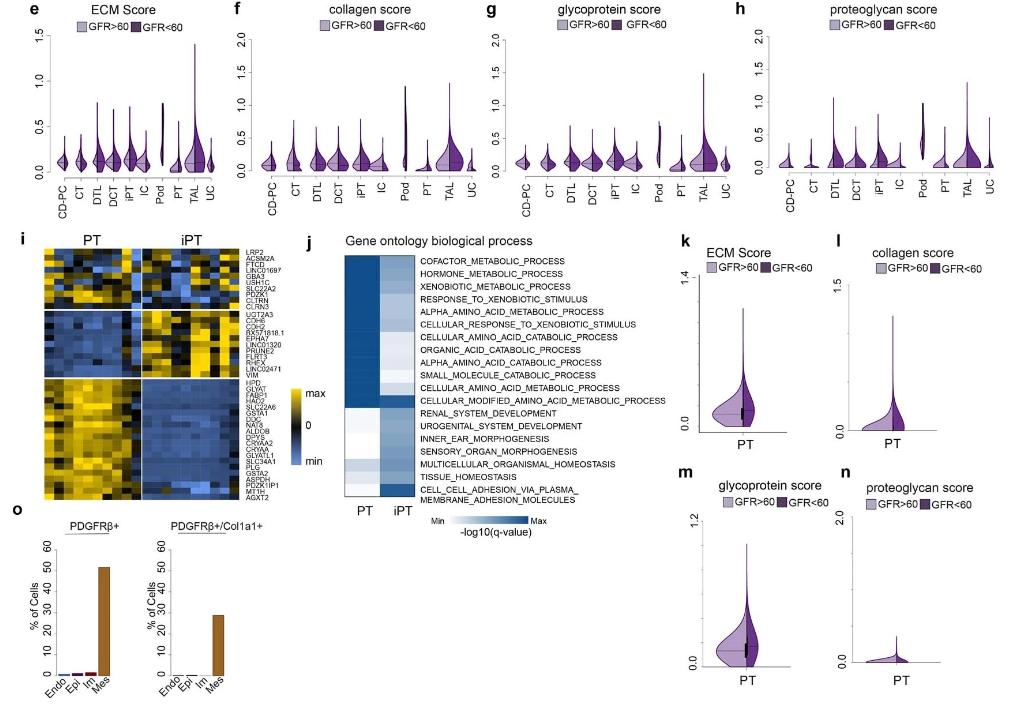
Fig2 ECM 来源于近端去分化小管细胞
2. 人类肾脏中肌成纤维的起源
作者从来自 8 个(4 个正常,4 个疾病)人类肾脏的 CD10- 细胞中筛选大多数表达 COL1A1 的细胞,记为 PDGFRβ+ cells (Fig3 a, b),对 PDGFRβ+ cells 分别进行 Pseudotime trajectory 和 diffusion map 分析,发现人肾肌成纤维细胞主要有三个来源:NOTCH3+RGS5+PDGFRβ+ 周细胞、MEG3+PDGFRβ+ 成纤维细胞和 COLEC11+CXCL12+ 成纤维细胞,且其分化轨迹是从低 ECM、非 CKD 周细胞和成纤维细胞,到高 ECM 的 CKD 肌成纤维细胞(Fig3 c-e)。
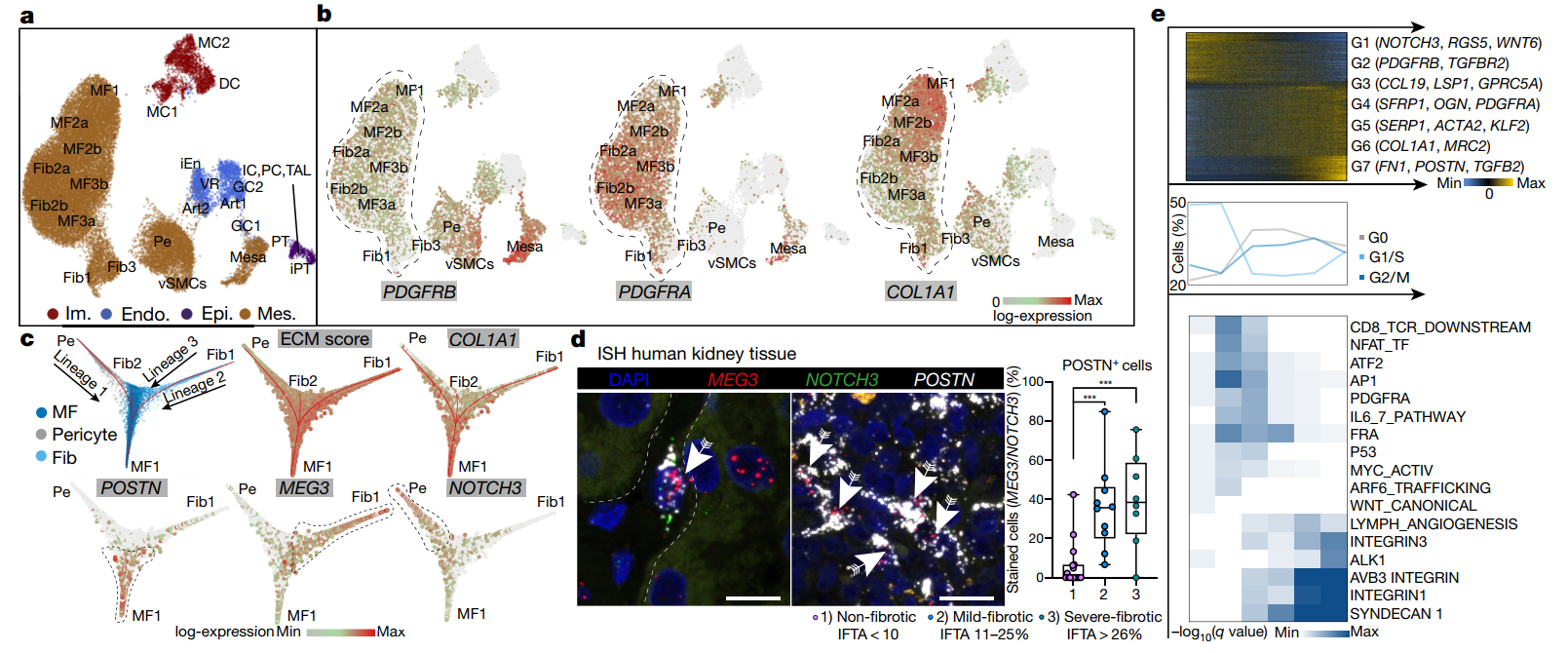
Fig3 人类肾脏肌成纤维的起源
3. PDGFRα+ PDGFRβ+ 标记 ECM 表达细胞
为了更好的证明肾脏中肌成纤维的来源,作者利用小鼠模型,通过 ISH 和免疫组化进行验证 (Fig4 a, c)。通过 Smart-Seq2 在小鼠模型中进行探究,发现单侧输尿管梗阻 (UUO) 后,平滑肌细胞和周细胞的丰度下降,而系膜细胞和 COL1α1+PDGFRα+ 基质细胞明显增加,与人类肾脏相似,主要表达 ECM 的细胞表达 Pdgfra,Pdgfrb 和 Postn (Fig4 d-g)。结果表明 PDGFRα+PDGFRβ+ 间质细胞可以代表大多数 ECM 表达的细胞。
此外,作者分选小鼠肾纤维化样本中的 PDGFRα+PDGFRβ+细胞进行 scRNA-seq 分析,发现与间质细胞相比,非间充质细胞的细胞外基质和胶原蛋白表达水平明显降低 (Fig4 h-k),与人类肾脏的分析结果类似。此外,对成纤维细胞和肌成纤维细胞进行拟时序分析,揭示成纤维向肌成纤维的转变关系,发现 Fib1 和 MF2 为肾纤维化小鼠中集成纤维的主要来源 (Fig4 l-n)。UUO 后小鼠肾脏 PDGFRα+PDGFRβ+细胞的 ATAC-seq 分析进一步证实了上述分析 (Fig4 o)。
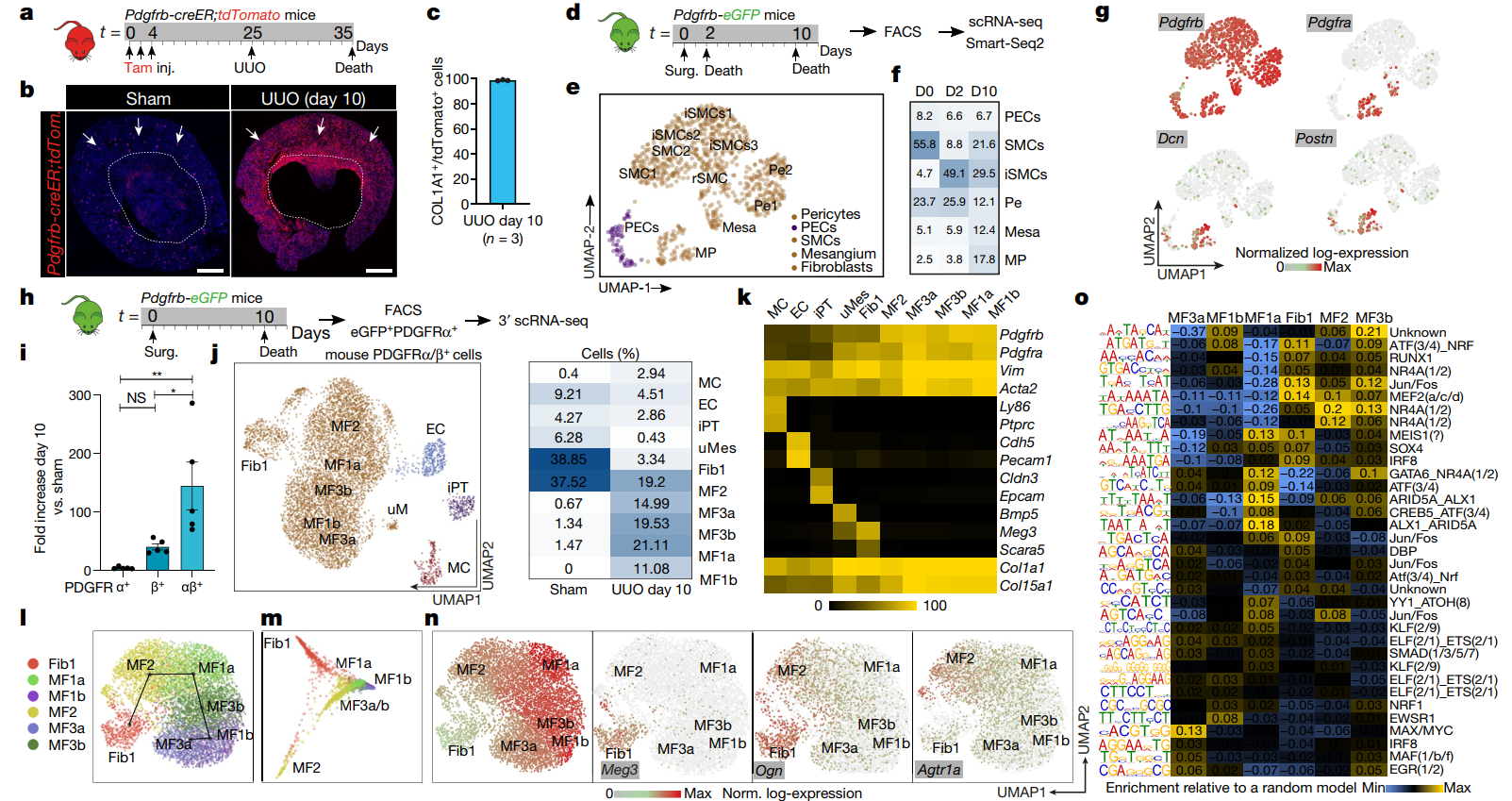
Fig4 小鼠肾脏肌成纤维的起源
4. NKD2 为潜在的肾纤维化治疗的靶基因
在对前面的数据进行分析中作者发现,NKD2 在 PDGFRα+PDGFRβ+终末分化的肌成纤维细胞中特异性表达 (Fig5 a, b),并通过 ISH 进一步验证了 NKD2 在 PDGFRα+PDGFRβ+细胞中表达,且在纤维化过程中持续增加 (Fig5 d, e)。在人的 PDGFRβ 细胞系和肾脏的类器官中,均验证了 NKD2 可作为肾脏纤维化的潜在治疗靶基因 (Fig5 f-l)。
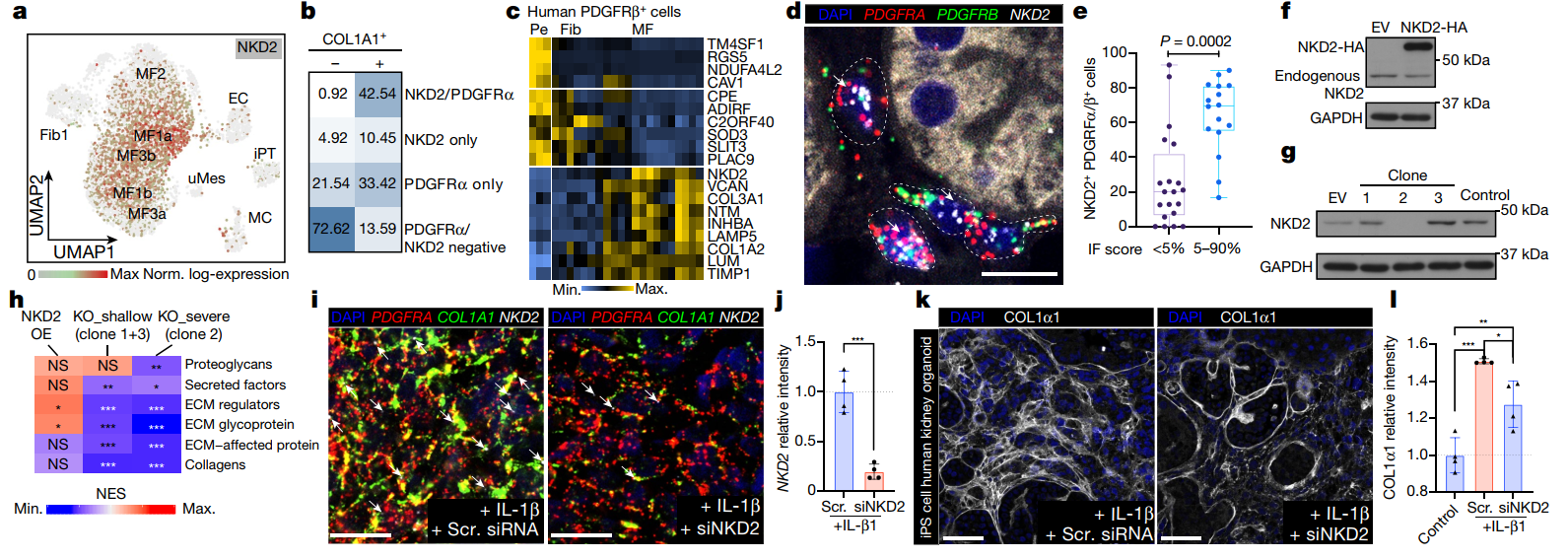
Fig5 NKD2 为肾纤维化治疗的潜在靶基因
结论
肌成纤维细胞是肾纤维化过程中 ECM 的主要来源,但其细胞来源一直存在争议。本文作者利用单细胞转录组测序对小鼠的遗传命运追踪数据分析,并结合人类组织的组织学分析表明,上皮细胞、内皮细胞、造血细胞和间充质细胞都有助于肾脏纤维化。提出大多数疤痕组织起源于双阳性PDGFRα+PDGFRβ+ 成纤维细胞和肌成纤维细胞;在人类和小鼠中,这些肌成纤维细胞主要来自周细胞和成纤维细胞;筛选出 NKD2 作为肾纤维化治疗的潜在靶基因,这项工作突出了涉及纤维化的复杂的细胞分化机制,并为肾脏疾病的未来临床研究提供参考了重要价值。
参考文献
Kuppe C, Ibrahim MM, Kranz J, et al. Decoding myofibroblast origins in human kidney fibrosis. Nature. 2021;589(7841):281-286. doi:10.1038/s41586-020-2941-1.






