
2021 年 3 月,东南大学肾脏病研究所刘必成和吕林莉教授为共同通讯作者,在 Theranostics (IF: 8.579) 杂志发表了题为“Exosomal miR-125b-5p deriving from mesenchymal stem cells promotes tubular repair by suppression of p53 in ischemic acute kidney injury”的研究论文,深入探讨了间充质干细胞来源的外泌体在急性肾损伤治疗过程中的分子机制。
东南大学博士生曹婧媛、王彬、汤涛涛为文章的并列第一作者,文章中small RNA 测序和分析由欧易生物协助完成。
研究背景
急性肾损伤(acute kidney injury, AKI)是一种临床急性危重症,存在于约 10%-15% 的住院患者及超过 50% 的重症患者中。肾脏替代治疗可用于重度 AKI 的支持治疗,但目前仍无确切有效的疗法能持续促进肾功能恢复。
间充质干细胞来源的外泌体(MSC-exos)可能成为治疗 AKI 的新策略。然而,MSC-exos 在缺血性急性肾损伤中的体内生物分布尚未确定,MSC-exos 在促进肾小管修复中的潜力及其潜在机制仍有待深入研究。
研究内容
本研究表明,MSC-exo 可以有效归巢至损伤的肾脏,并定位于近端肾小管,这种归巢过程是由 MSC-exo 表明的整合素 VLA-4、LFA-1 与损伤肾小管的 VCAM-1、ICAM-1 结合所介导的。体内和体外实验表明,MSC-exo 可以显著抑制肾小管上皮细胞(TEC)的细胞周期阻滞和细胞凋亡。分子机制上,MSC-exos 富含 miR-125b-5p,并将 miR-125b-5p 递送至 TEC 细胞,通过下调细胞中 p53 的蛋白表达,进而起到抑制 G2/M 细胞停滞和细胞凋亡的作用。
本研究为 MSC-exo 在肾小管修复中的作用提供了新的见解,并强调了 MSC-exo 作为急性肾损伤治疗策略的潜力。
研究结果
1. MSC-exos 归巢至损伤的肾脏
从培养的人脐带间充质干细胞上清液中分离外泌体 MSC-exos(图 A-C),DiD 标记后注到缺血再灌注(I/R)模型小鼠体内,结果显示 MSC-exos 主要分布于肾脏(图 D),尤其是近端小管中(图 E)。
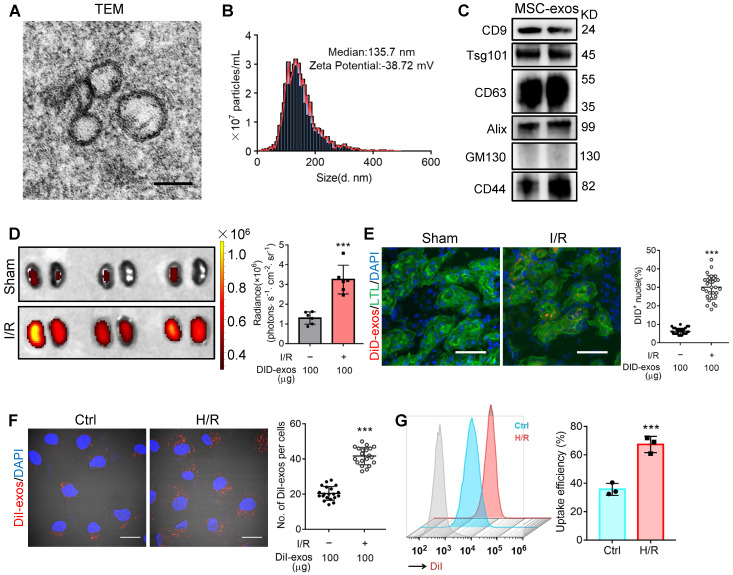
图 1 | MSC-exos 归巢至损伤的肾脏
Western blot 检测显示,在损伤的肾脏中,MSC-exos 表面的整合素 VLA-4、LFA-1 和其对应的在肾小管上的受体 VCAM-1、ICAM-1 均显著升高(下图 A-C);干扰 ICAM-1、VACM-1,或者封闭 MSC-exos 表面的整合素 VLA-4、LFA-1,均会影响 MSC-exo 向损伤肾脏的归巢(图 D-E)。以上结果表明外泌体表面的整合素 VLA-4 和 LFA-1 介导 MSC-exos 向损伤肾脏的归巢。
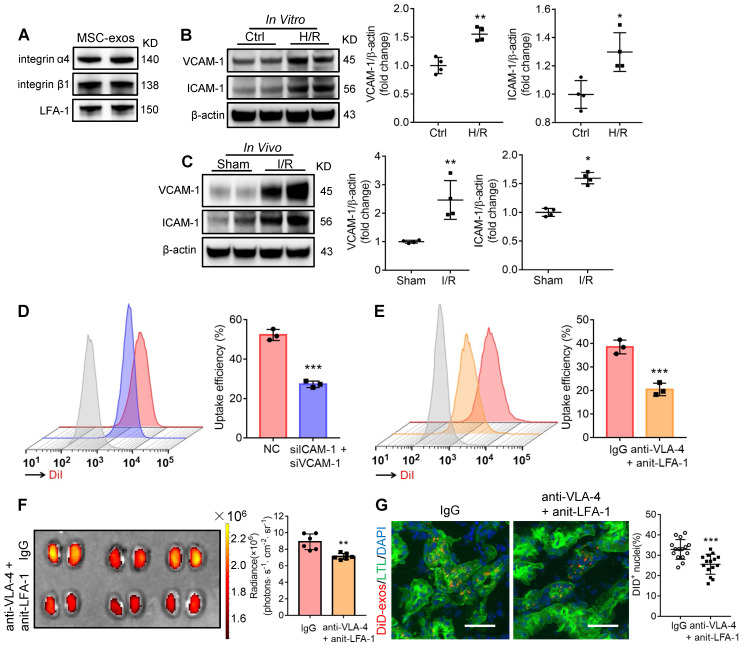
图 2 | 整合素 VLA-4 和 LFA-1 介导 MSC-exos 向损伤肾脏的归巢
2. MSC-exos 可以减缓 I/R 小鼠的肾损伤
为进一步研究 MSC-exo 的治疗效果,对 I/R 模型小鼠在不同时间注射 MSC-exo(图 A),结果显示 MSC-exo 可以剂量依赖性方式显著减缓 I/R 模型小鼠的肾损伤(图 B-D)、及近端肾小管的损伤(图 E-J)。
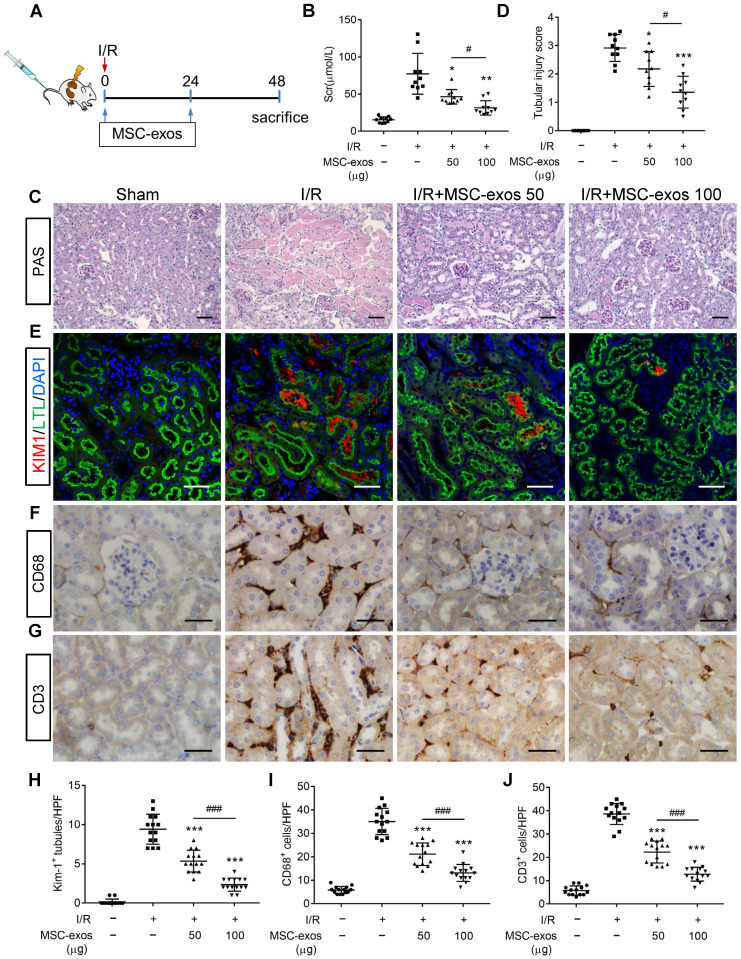
图 3 | MSC-exos 可以减缓 I/R 小鼠的肾损伤
缺血性 AKI 后,肾脏修复的细胞标志是肾小管上皮细胞(TECs)的显著增殖。体内/体外检测结果显示,I/R 小鼠模型中,MSC-exo 治疗使得停滞于 G2/M 期的 TECs 细胞比例下降,显著促进了 TECs 细胞的增殖(图 A-D);同时 MSC-exo 治疗显著抑制了 TECs 的细胞凋亡。
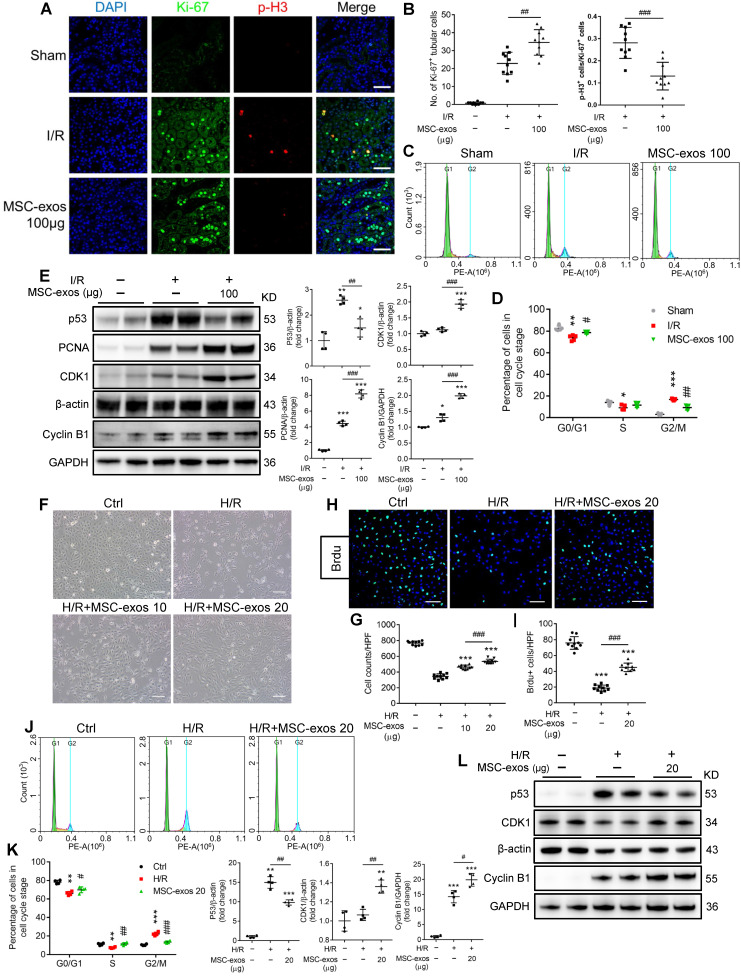
图 4 | MSC-exo 可以拯救 G2/M 期阻滞,促进肾小管上皮细胞增殖
3. MSC-exo 显著富集 miR-125b-5p 并递送至 TECs
为进一步研究 MSC-exo 治疗的分子机制,对 MSC-exo 进行了 small RNA 测序并通过 RT-PCR 验证,结果显示其中 miR-125b-3p 相对含量最高(图 A-C)。
同时,MSC-exo 治疗的小鼠肾脏组织中 RT-PCR 显示 miR-125b-3p 显著上升(图 D),肾组织中 FISH 检测显示 miR-125b-3p 在肾小管中表达显著上升(图 E)。利用 Cy3 标记示踪表明,miR-125-5p 可以通过 MSC-exo 运输至 HK-2 细胞中(图 F)。
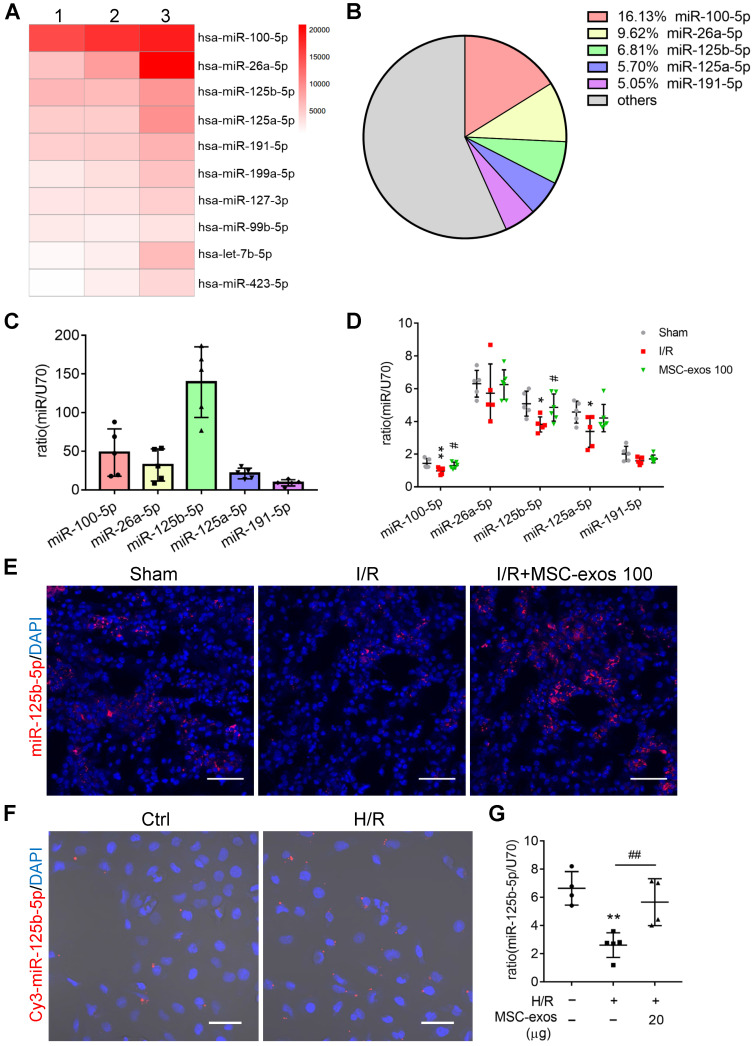
图 5 | MSC-exo 显著富集 miR-125b-5p 并递送至 TECs
4. MSC-exos 通过抑制 p53 信号传导以抑制 G2/M 停滞和细胞凋亡
接下来研究 miR-125-5p 的作用。通过多个软件预测显示,p53 是 miR-125b-3p 的一个候选靶基因(图 A)。荧光素酶报告实验证实,miR-125b-5p 可以直接调控 p53 的表达(图 B)。
与对照相比,在 HK-2 细胞中过表达 p53,可以显著促进 G2/M 期细胞比例和凋亡细胞的比例。
与正常 MSC-exo 对比,利用 knockdown miR-125-5p 的 MSC-exo 对 HK-2 细胞进行处理,可以逆转 p53 的下调(图 C-F),并且 knockdown miR-125-5p 同样可以减轻对 G2/M 细胞停滞和细胞凋亡的抑制作用(图 H-I)。
以上结果表明,MSC-exo 通过 miR-125b-5p 抑制 p53 信号通路,进而抑制了 G2/M 细胞停滞和细胞凋亡。
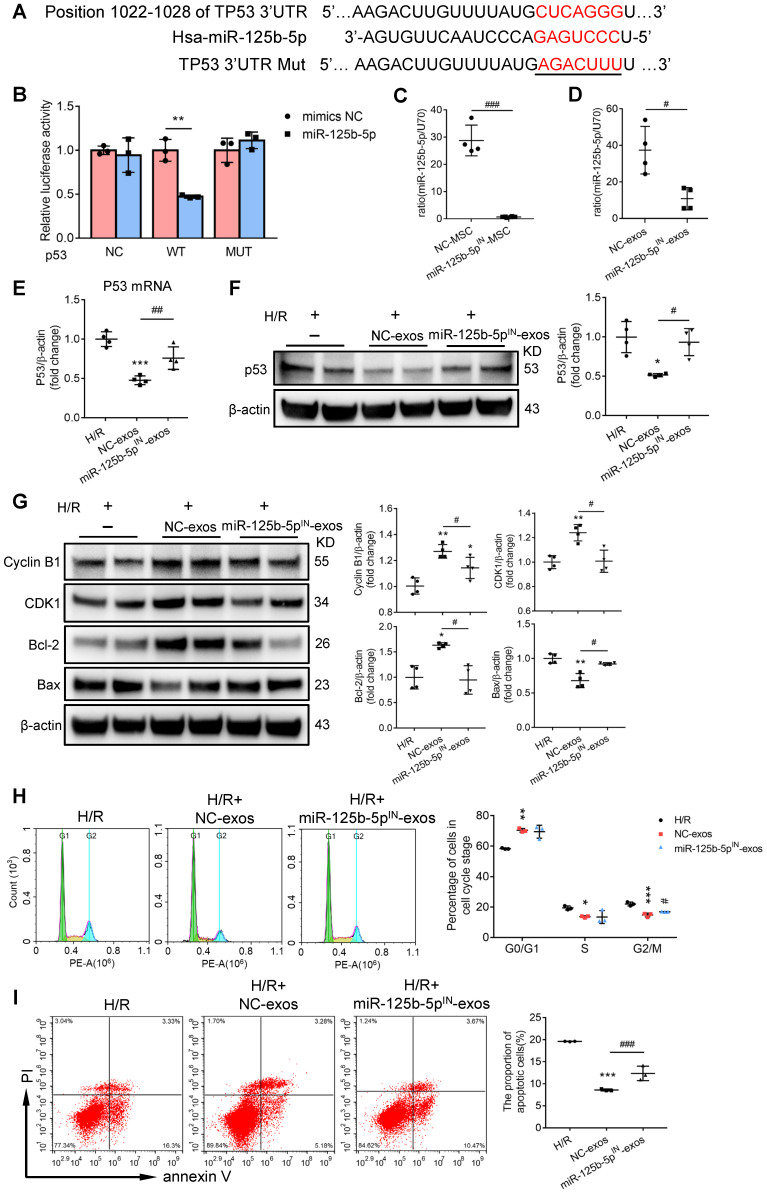
图 6 | MSC-exos 通过抑制 p53 信号传导以抑制 G2/M 停滞和细胞凋亡
5. 抑制 miR-125b-5p 会削弱 MSC-exo 对 I/R 小鼠的保护作用
进一步在体内验证以上结论。与正常 MSC-exo 对比,利用 knockdown miR-125-5p 的 MSC-exo 注射,结果显示 p53 表达上升、肾损伤程度加重(图 C-E)、G2/M 期细胞比例和凋亡细胞的比例上升(图 F-G)。
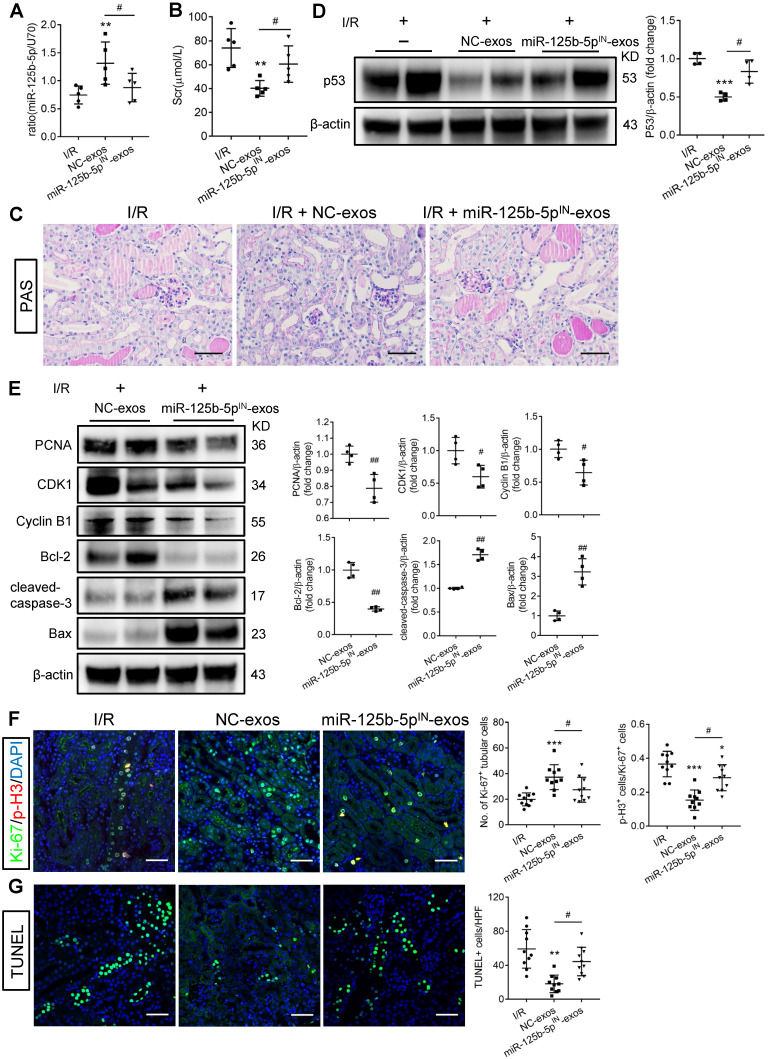
图 7 | 抑制 miR-125b-5p 会削弱 MSC-exo 对 I/R 小鼠的保护作用
研究结论
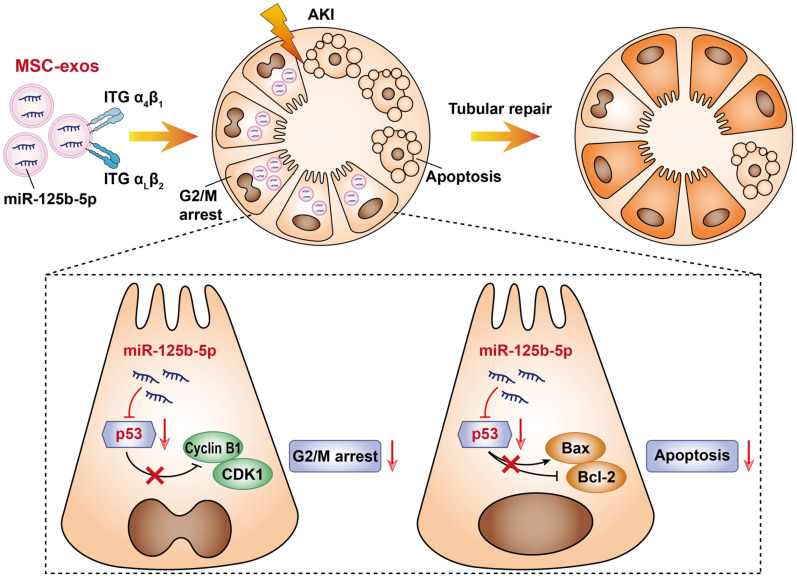
本研究表明,MSC-exo 可以有效归巢至损伤的肾脏,并定位于近端肾小管,这种归巢过程是由 MSC-exo 表明的整合素 VLA-4、LFA-1 与损伤肾小管的 VCAM-1、ICAM-1 结合所介导的。体内和体外实验表明,MSC-exo 可以显著抑制肾小管上皮细胞(TEC)的细胞周期阻滞和细胞凋亡。分子机制上,MSC-exos 富含 miR-125b-5p,并将 miR-125b-5p 递送至 TEC 细胞,通过下调细胞中 p53 的蛋白表达,进而起到抑制 G2/M 细胞停滞和细胞凋亡的作用。
参考文献
Cao J, Wang B, Tang T, et al. Exosomal miR-125b-5p deriving from mesenchymal stem cells promotes tubular repair by suppression of p53 in ischemic acute kidney injury. Theranostics 2021; 11(11): 5248-5266.






