不知各位读者是否常常遇到这种情况:在阅读单细胞文章的时候,发现别人的细胞图谱如此好看,细胞种类如此丰富,可当分析自己的数据时,却发现细胞类型屈指可数,细胞亚型更是分辨不出,那么究竟是细胞的表达谱太过相似,还是我们有限的认知限制了对这些细胞的解读能力呢?下面分享一篇文章,看看作者如何鉴定出 12 种肠神经元亚型,或许可以提供一些神经元亚型的分类思路,又或许有一些 marker 基因我们也可以借鉴哦~
基本信息

材料:不同时间点的小鼠小肠肌间神经丛(n=12)
期刊:Nature Neuroscience
方法:10x Genomics 单细胞转录组测序
影响因子:20.071
研究背景及研究目的
肠道的自主调节需要肠神经系统(ENS)中不同功能的神经元联合作用。然而,肠神经元类型的多样性以及它们在发育过程中是如何出现的仍然未知。本研究作者通过单细胞转录组测序详细描绘了小鼠小肠肌间神经丛内 12 种肠神经元亚型,为小肠肌间神经丛的神经元亚型提供了分子标记物,随后探究了肠神经元的分化过程,提出全新的分化理念。本研究结果为解析 ENS 神经元亚型和预测不同肠神经元类别定向分化的关键调节因子提供新的思路和分子资源。
研究结果
1. 单细胞转录组测序描绘小鼠小肠肌间神经丛 12 种肠神经元类型
作者认为在以往的研究中并未能够详细地描绘出肠道神经系统中神经元的多样性,可能是受到捕获的神经元数量的限制。因此在本研究中,作者利用泛神经元 Baf53b-Cre 小鼠与 R26R-Tomato 报告小鼠交配特异性标记肠内神经元,随后通过特定分选的方式来提高神经元的占比。具体方式为:量化神经元标记物 HUC/D 和肠胶质细胞标记物 SOX2/SOX10 的 TOM 报告基因在小肠肌间神经丛的共表达,流式细胞术分选 TOM+ 进行单细胞转录组分析。通过这种方式,最终捕获的细胞中有 90% 为肠内神经元,而以往的检测方式仅能捕获 10% 左右的肠内神经元(Fig. 1e),大大提高了神经元的占比。
单细胞转录组测序共捕获了 9141 个细胞,去除低质量及非神经元细胞后,保留 4892 个高质量的肠神经元进行后续分析,降维聚类后共产生 12 个肠神经元(ENC)类群。基于此聚类结果,确认了 4 个已发现的神经元亚群,重新定义了 6 个亚群,并命名了2个新的亚群。
亚型注释两步走
①根据每个 cluster 的基因表达特征进行定义
一些 cluster 可根据其特异表达的 marker 来注释,例如 ENC5 特异表达生长激素抑制素(somatostatin; Sst),ENC6 特异表达神经调节肽(neuromedin U; Nmu),ENC7 特异表达肠促胰酶肽(cholecystokinin ; Cck)和尿皮素(urocortin 3; Ucn3)等;其他 cluster 可通过基因组合表达的方式区分,例如 ENC1-4 共表达 Tac1,而对 Calb2、Ndufa4l2、Gda、Penk、Fut9 呈现独特的表达特征;ENC8 和 ENC9 共表达 Nos1 和 C1ql1,而 Npy 和 Cox8b 在 ENC9 中较低;ENC11 高表达 Npy 低表达 Nos1(Fig. 1g)。
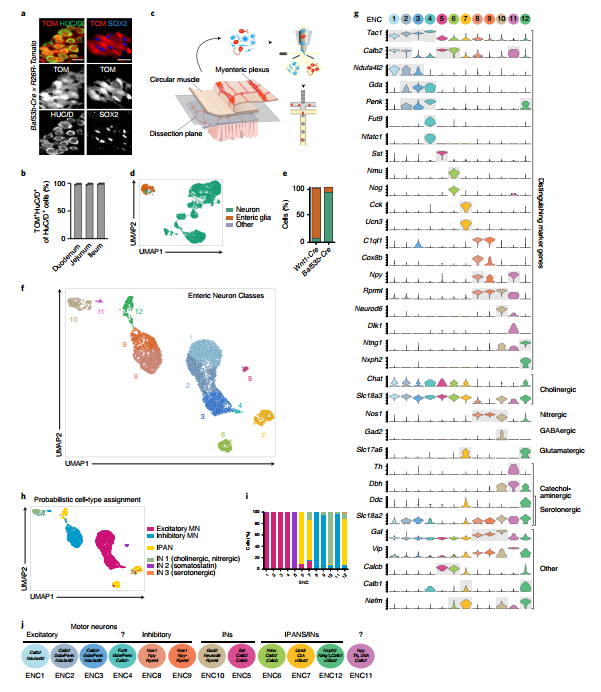
Fig. 1 小鼠小肠肌间神经丛 12 类肠神经元的分子特征
②使用文献已报道的 marker 基因进行匹配
在描述了每个 cluster 独特的基因表达特征后,作者使用已报道的功能性肠神经元 marker 基因对这些 cluster 进行匹配,将神经元亚群分为兴奋和抑制性运动神经元、中间神经元、内在初级传入神经元等 4 个大类(一大波marker基因来袭,请注意查收):
ENC1-4:兴奋性运动神经元 excitatory motor neurons(Tac1/Calb2);
ENC8/9:抑制性运动神经元 inhibitory motor neurons (Nos1/Gal/Vip/Npy);
ENC6/7/12:内在初级传入神经元 intrinsic primary afferent neurons(IPANs) (Calca/Calcb/Nfem/Calb1/Calb2);
ENC10:IN1,同时具有氮能(NOS1)和胆碱能(Slc18a3;低表达 Chat)特性;
ENC5:IN2(Sst/Calcb/Calb2),ENC12 的某亚群具有血清素能中间神经元特征:IN3(Ddc/Slc18a2/Slc6a4)。
2. 独特的通迅特征定义肠神经元不同的亚型
突触输入-输出的通迅特征可以用来表征神经元类型之间的基本区别,而这种通讯特征是由神经递质/肽的连接、反应和释放决定的。因此作者探索了控制这些功能的基因家族,发现它们在不同的神经元细胞群之间存在差异表达(Fig. 2a-d),认为这 12 种神经元亚群都有其各自独特的功能特征。
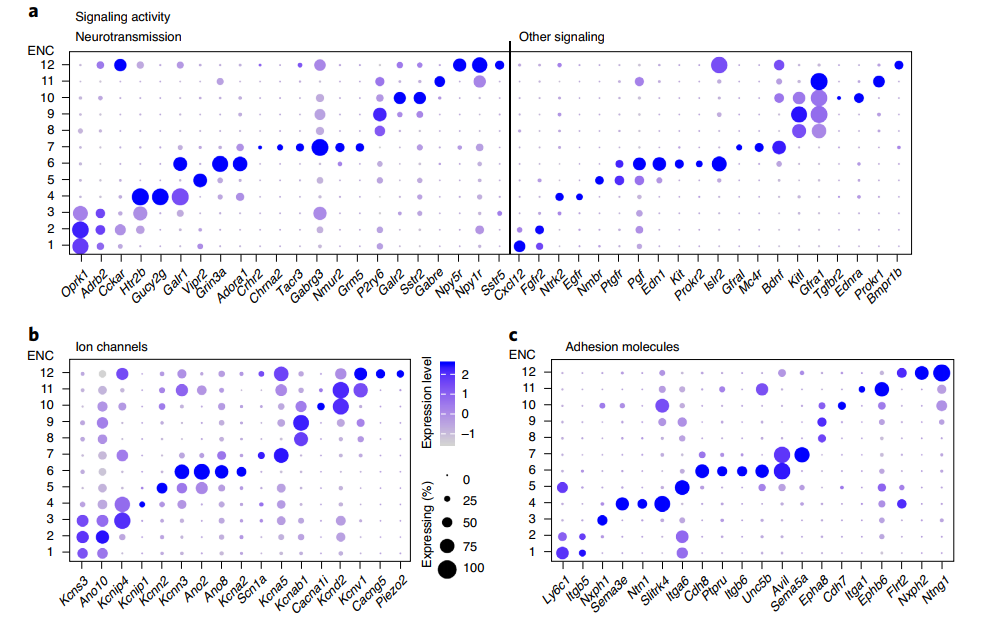
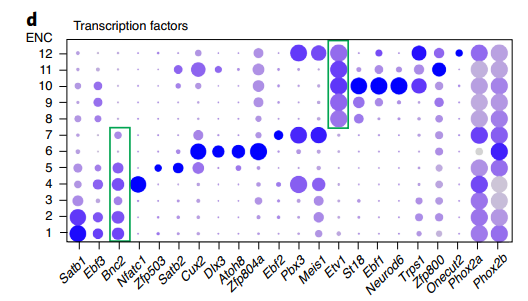
Fig. 2 不同基因家族在神经元亚群中的表达情况
3. 免疫组织化学标记物鉴定
为了证实鉴定到的神经元亚型确实存在,作者进行了免疫组化验证,根据新定义的神经元亚型,共分析了 23 种蛋白质,通过不同蛋白质的组合表达来确认具体的神经元亚型(Fig. 3)。
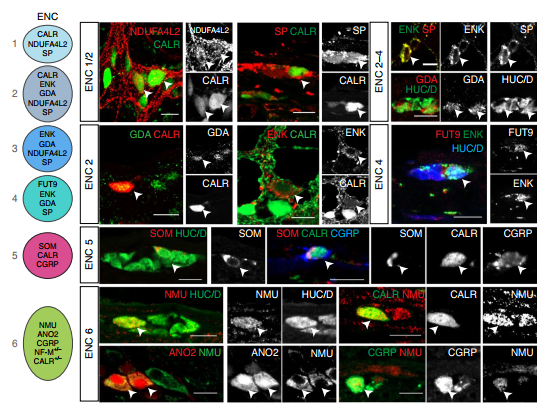
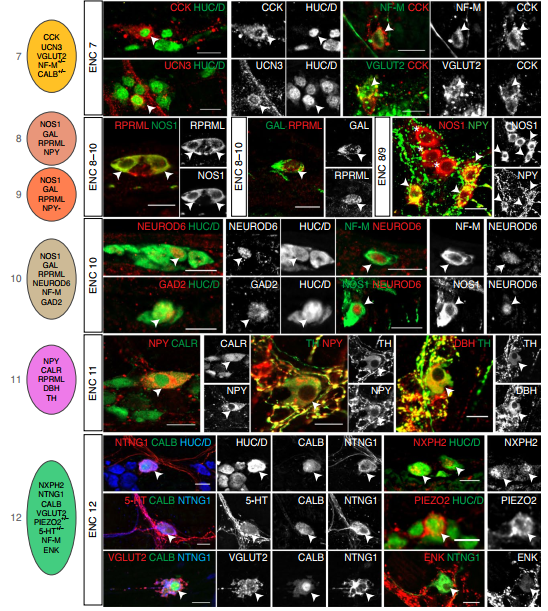
Fig. 3 肠神经元分类标记基因的免疫组化验证
4. 单细胞RNA测序揭示神经元发育过程的转录特征
为了了解 ENC1-12 在发育过程的共性及特异性分化过程,作者分别取了胎龄 E15.5 和 E18.5 的小鼠肠神经进行单细胞转录组测序。每个阶段共捕获约 3000~3500 个细胞,剔除低质量的细胞后,E15.5 和 E18.5 期分别剩余 3260、2733 个细胞进入后续分析。首先得到两个时期的细胞图谱(Fig. 4a),使用 SOX10 来标记祖细胞,Elavl4 高表达的区域为成熟的神经细胞,在 Sox10+ 和 Elavl4 High 之间的 Ascl1 High 细胞群被认为是经历神经发生过渡期的神经母细胞,并通过 RNA velocity 分析(Fig. 4e)证实了从祖细胞到成熟神经元的方向。随后对不同细胞状态的差异基因进行分析,探究在干细胞维持、神经发生和神经元分化中可能具有重要功能的转录因子或关键基因(Fig. 4f-i),发现 Notch 信号通路似乎与 ENS 的发育密切相关。
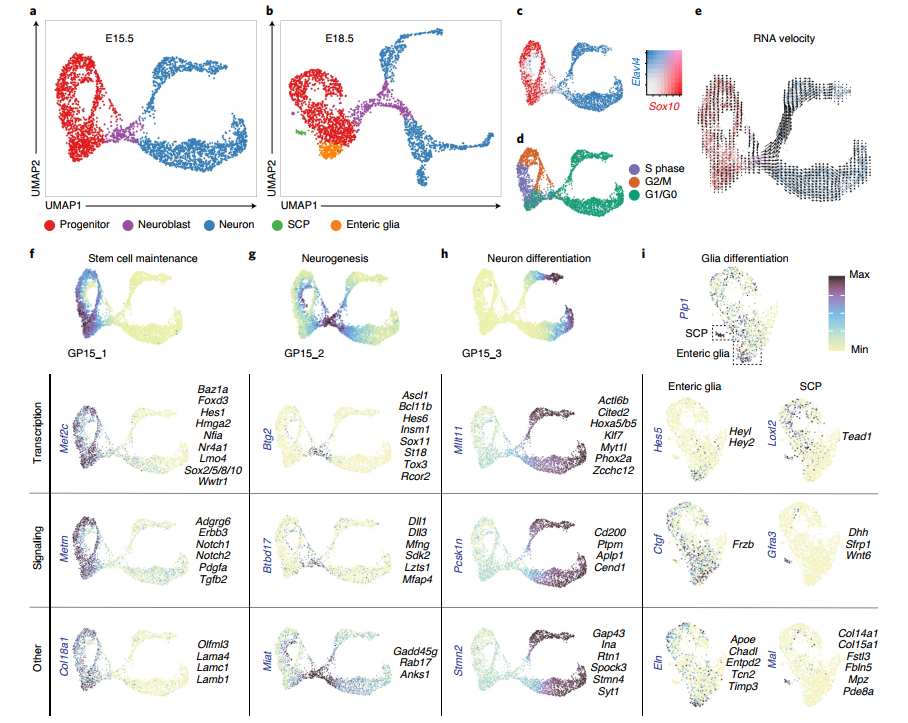
Fig. 4 神经元分化过程的基因表达特征
最后作者将前期鉴定的 12 种神经元映射到分化轨迹上,试图定位到具有 ENC1-12 特征的细胞,如下图中 C 8-12 通过分支 A 产生,ENC 1-7 通过分支 B 产生。在这里,作者提出了一种“二元命运”的想法,认为在肠神经元分化过程中,存在两种分化途径,一类神经元是由干细胞神经系统直接分化而来,还有一群神经元细胞通过其他细胞的二次分化得到。
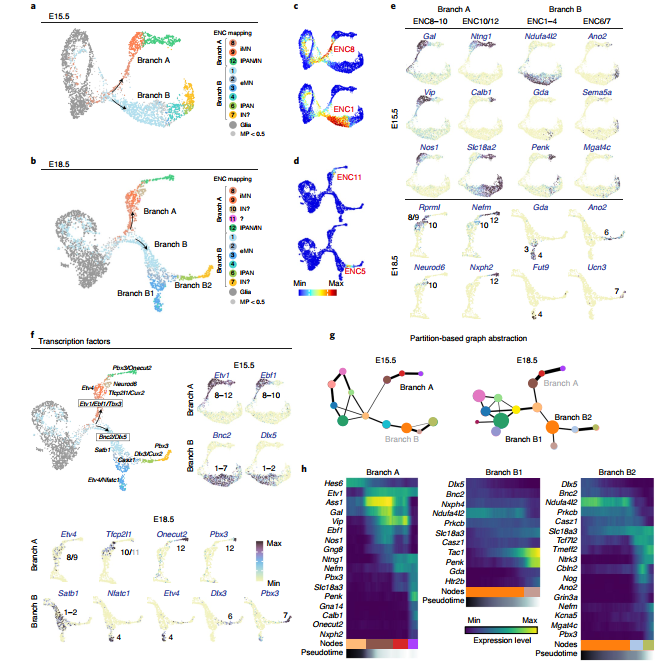
Fig. 5 ENCs 多样化的分化路径
本文亮点
1. 优化取样方式,提高肠神经元的有效捕获;
2. 详细描述了 12 种肠神经元类型,包括运动神经元、中间神经元和内在初级传入神经元,极大地细化了神经元亚型特征;
3. 详细探究神经元分化发育过程,提出了神经元分化路径的新思路。
参考文献
Morarach K, Mikhailova A, Knoflach V, et al. Diversification of molecularly defined myenteric neuron classes revealed by single-cell RNA sequencing[J]. Nature Neuroscience, 2021, 24(1):1-13.






