欧易单细胞测序继续发力!近日,欧易生物合作客户广州中医药大学第一附属医院鲁路团队在Cardiovascular Research(IF 10.787)期刊发表的关于主动脉缩窄模型小鼠心脏巨噬细胞异质性及CD72阳性促炎巨噬细胞功能研究的相关成果,欧易生物提供了该项目单细胞转录组测序相关工作,下面我们一起学习这篇文章的具体内容。

基本信息
材料:5只主动脉缩窄模型小鼠和5只对照小鼠CD45+免疫细胞;
期刊:Cardiovascular Research
发表时间:2021年6月8日
方法:欧易生物10X Genomics scRNA-seq
研究背景和目的
心力衰竭(HF)作为全球性疾病,正在威胁越来越多患者的健康,由于缺少有效的治疗手段,死亡率一直居高不下,为临床治疗和经济带来巨大的负担。巨噬细胞参与HF发生发展的所有阶段,并通过不同的表型和功能如分泌促炎和抗炎分子影响其进展。与M1/M2极化不同,心脏巨噬细胞的异质性更为复杂,巨噬细胞亚集是否密切参与HF仍存在争议,特别是关于它们在心血管中的功能。因此,这项研究作者旨在通过单细胞测序研究主动脉缩窄(TAC)小鼠中与心脏损伤相关的巨噬细胞,并进一步验证其来源和在疾病进展中的功能,为未来HF治疗提供潜在的靶点。
研究内容
经过CD45+细胞筛选和测序质控在对照组和TAC模型组各获得8223和5652个细胞进行下游分析,针对心脏巨噬细胞(CMφ)进行降维聚类和富集分析,发现了一类CD72hi促炎CMφ。拟时序和CHIP-Seq分析发现Rel是诱导CMφ分化的关键转录因子。利用Rel敲低和敲除的骨髓嵌合体小鼠进行TAC模型构建,发现与对照相比,其心脏损伤减轻,细胞因子和ROS水平降低,从而抑制了心肌细胞的死亡。将Rel过表达单核细胞和CD72hi CMφ的转移注射到TAC模型的小鼠内则会直接加重其心脏损伤。同样,在心肌梗死模型的小鼠内也发现CD72hi CMφ相似的功能。而在临床病人中,扩张型心肌病(DCM)和缺血性心肌病(ICM)心力衰竭患者中也发现CD72hiCMφ水平升高。以上结果表明这群骨髓来源的Rel介导的CD72hiCMφ具有促炎作用,能够诱导心脏损伤,并可能作为多种心血管疾病的潜在治疗靶点。
研究结果
1. CD72hiCMφ与炎症表型紧密相关
作者首先对5只雄性小鼠构建TAC模型诱导心力衰竭,降低心脏低射血分数(HFrEF,左心室射血分数(LEVF),13%-15%),5只小鼠作为对照(Sham)。单细胞测序和质控之后,Sham和TAC组各8223和5652个CD45+免疫细胞进行下游分析。针对巨噬细胞,作者进行亚型聚类分析将其分为8个亚群(Figure 1A)。随后,作者基于促炎基因集(包含25个促炎基因)对每个基因表达亚群进行GSEA分析,结果表明cluster 4、5和1中的基因排名与促炎基因集中的基因呈正相关,并且cluster 4和5中的细胞主要属于TAC组(Figure 1B)。韦恩图分析发现42个基因同时展现在cluster 4和膜蛋白基因集(GO:0016020)富集(Figure 1C)。在这些基因中,与Sham组相比,TAC组中CD72在cluster 4(AUC=0.801)和5(AUC=0.760)中表现出更高的表达(Figure 1D)。相关性分析发现CD72的mRNA水平与促炎细胞因子(Tnf,Il1b),趋化因子(Ccl2,Ccl4)和纤维生成因子(Tgfb1)同时相关(Figure 1E)。CD72hi巨噬细胞的GO_BP富集分析发现,巨噬细胞的两个基因集(巨噬细胞趋化性和巨噬细胞迁移)在CD72hi巨噬细胞中高表达(Figure 1F)。为了验证以上的结果,作者在两种不同的HF模型(TAC和 chronic Ang II infusion)中评估了CMφs的CD72表达,发现与对照组相比,CD72在两种模型心脏巨噬细胞中均高表达(Figure 1G),LVEF与巨噬细胞中的CD72水平呈负相关(Figure 1H)。以上结果表明CD72hi CMφ与HF模型中压力损伤和炎症表型密切相关。
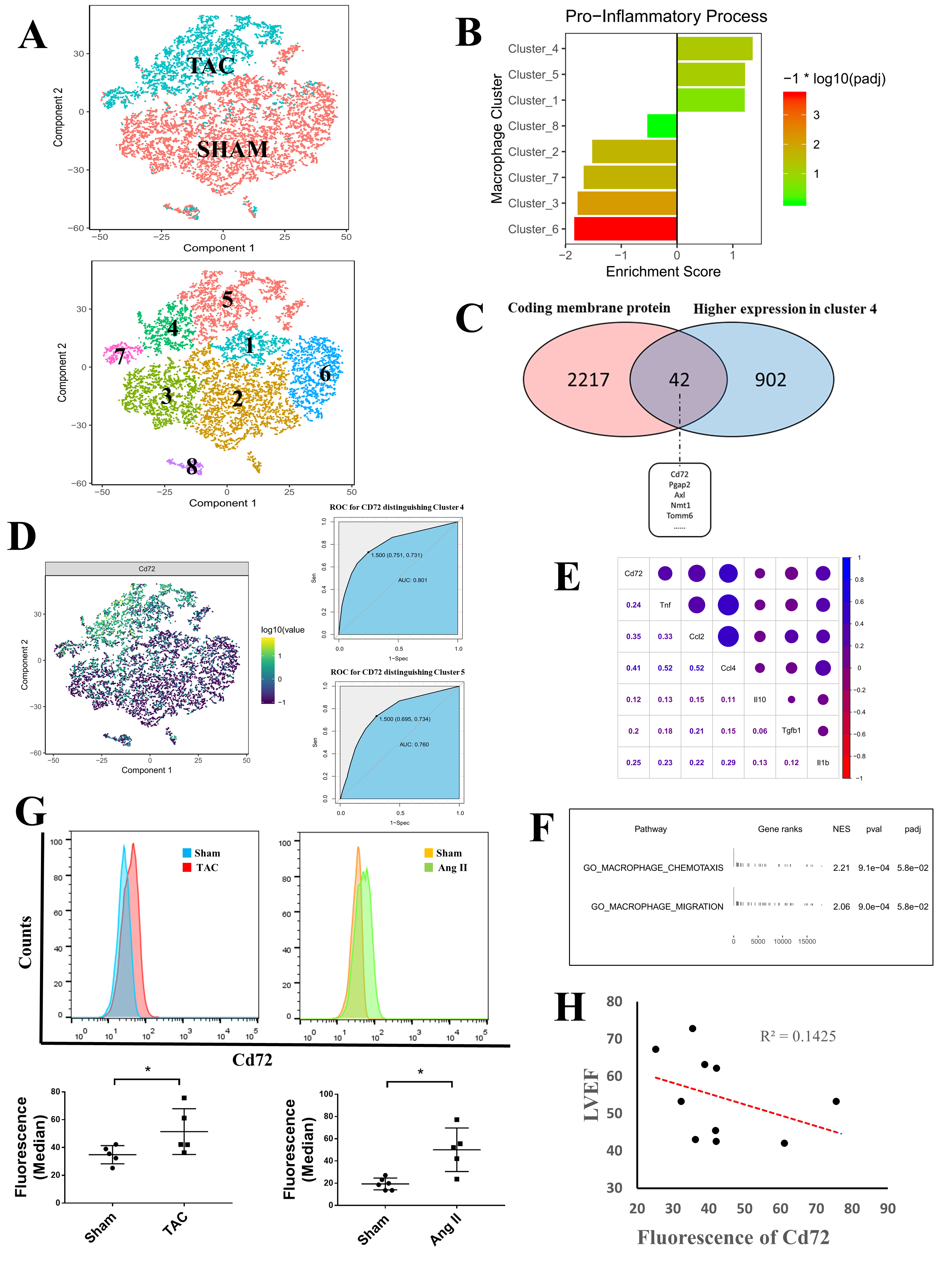
Figure 1. CD72hi巨噬细胞的发现和其促炎表型的验证
2. Rel是驱动巨噬细胞CD72表达的关键转录因子
为了研究CD72hi巨噬细胞的来源,作者对CD72和CMφ标志物进行了相关性分析。结果发现Ccr2与CD72的表达密切相关(Figure 2A),表明CD72hi CMφ属于CCR2+巨噬细胞并来源于髓系细胞。巨噬细胞和单核细胞的拟时序分析发现在单核细胞分化为巨噬细胞的过程中CD72的表达水平呈现出增长趋势(Figure 2B),并且在这个过程中Rel与CD72的表达趋势一致(Figure 2D)。韦恩图分析表明转录表达至少增加了2倍基因中Rel和Rbpj同时与CD72高度正相关(Figure 2C)。这些结果表明Rel驱动了CMφ中CD72的表达。为了进一步验证这个结果,作者进行了单核细胞/巨噬细胞细胞系(THP-1和 RAW 264.7)的ChIP-Seq分析,发现ChIP-Seq peaks主要定位在CD72的调控区域(Figure 2E),motif预测也在CD72启动子鉴定出与Rel motif一致的5个位点。体外在BMDMs中的实验发现通常用来激活巨噬细胞极化的LPS和IL10对CD72的表达影响较低,而IFN-g和小鼠心肌细胞中的细胞质提取物则能有效的诱导CD72表达(Figure 2F),这些结果表明心肌细胞损伤可直接诱导CD72阳性的巨噬细胞产生。在BMDMs中过表达Rel也会导致CD72水平的升高(Figure 2G),同样的,小鼠体内移植Rel过表达的骨髓也会诱导巨噬细胞的CD72表达升高(Figure 2H)。这些结果表明Rel可能是一个驱动CD72hi巨噬细胞的关键因子。
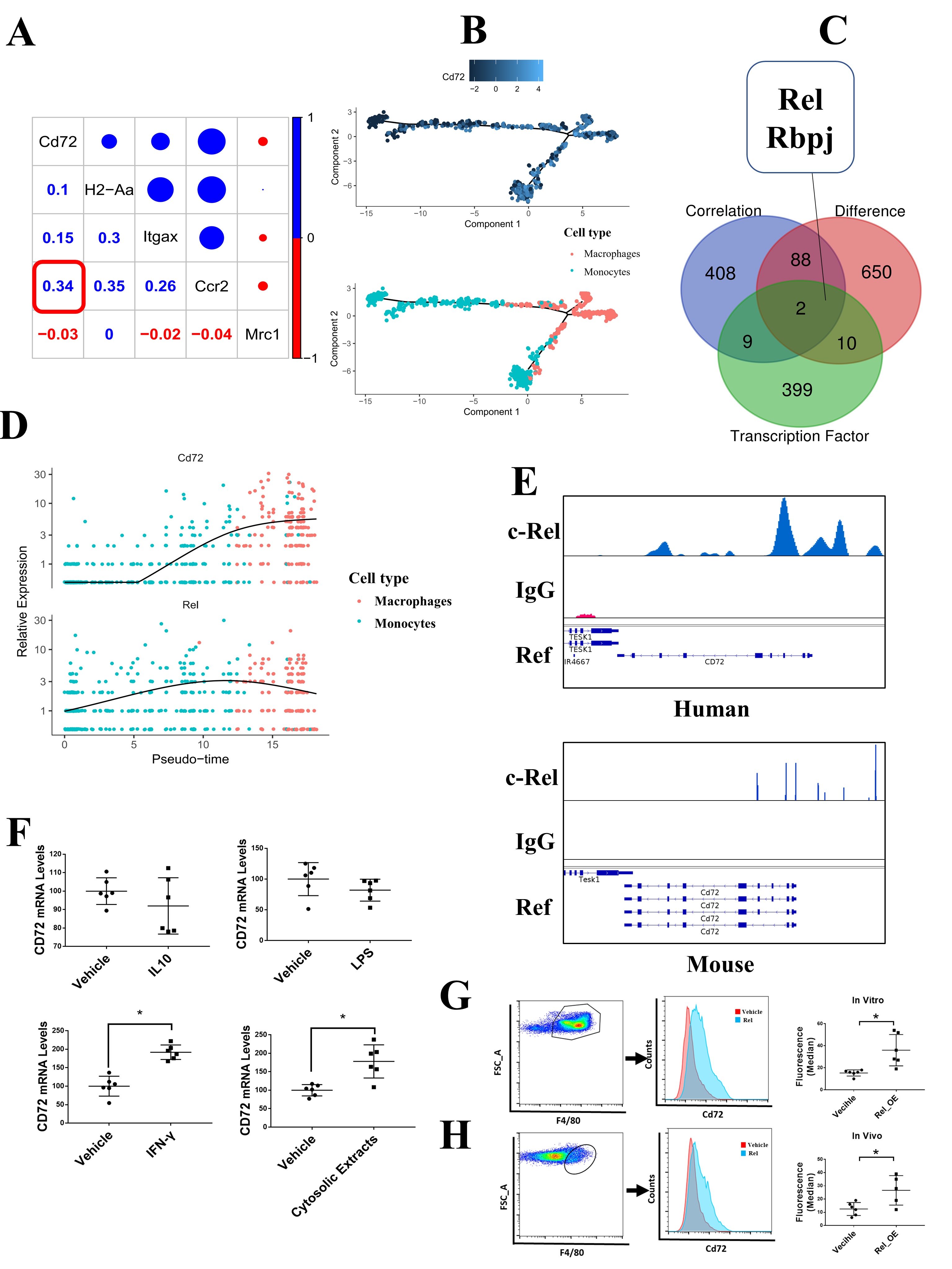
Figure 2. Rel是驱动CD72hi巨噬细胞的关键因子
3. Rel驱动的BMDMs以CD72表达依赖性的方式诱导心肌细胞损伤
为了研究巨噬细胞与心肌细胞间的相互作用,作者利用了小鼠心肌细胞和BMDMs共培养模型,发现在与Rel过表达BMDMs共培养时心脏负荷marker(Anp和Bnp)和氧化酶类(Cybb、Sod2、Gsr和Prdx5)在心肌细胞中高表达,而与CD72过表达BMDMs共培养时则不会表达升高(Figure 3A),心肌细胞的大小则在共培养过程中并没有明显的改变(Figure 3B)。与Rel过表达BMDMs共培养的心肌细胞也发现细胞质ROS水平的升高(Figure 3C),线粒体含量提升,但ATP产生量下降(Figure 3D)。有趣的是,尽管CD72过表达BMDMs对心肌细胞的有害影响较小,但CD72敲低明显的减轻了Rel诱导的ATP减少和细胞死亡(Figure 3E和F),表明Rel的对细胞的有害影响依赖于CD72的表达。在共培养体系中利用抗Tnf或抗IL6抗体处理后,心肌细胞的死亡数量也会下降,表明死亡细胞的诱导产生与促炎因子相关(Figure 3G)。这些结果表明Rel驱动的CD72hi BMDMs能够诱导心肌细胞的凋亡和ATP产生减少,这种驱动效应依赖于CD72的表达。
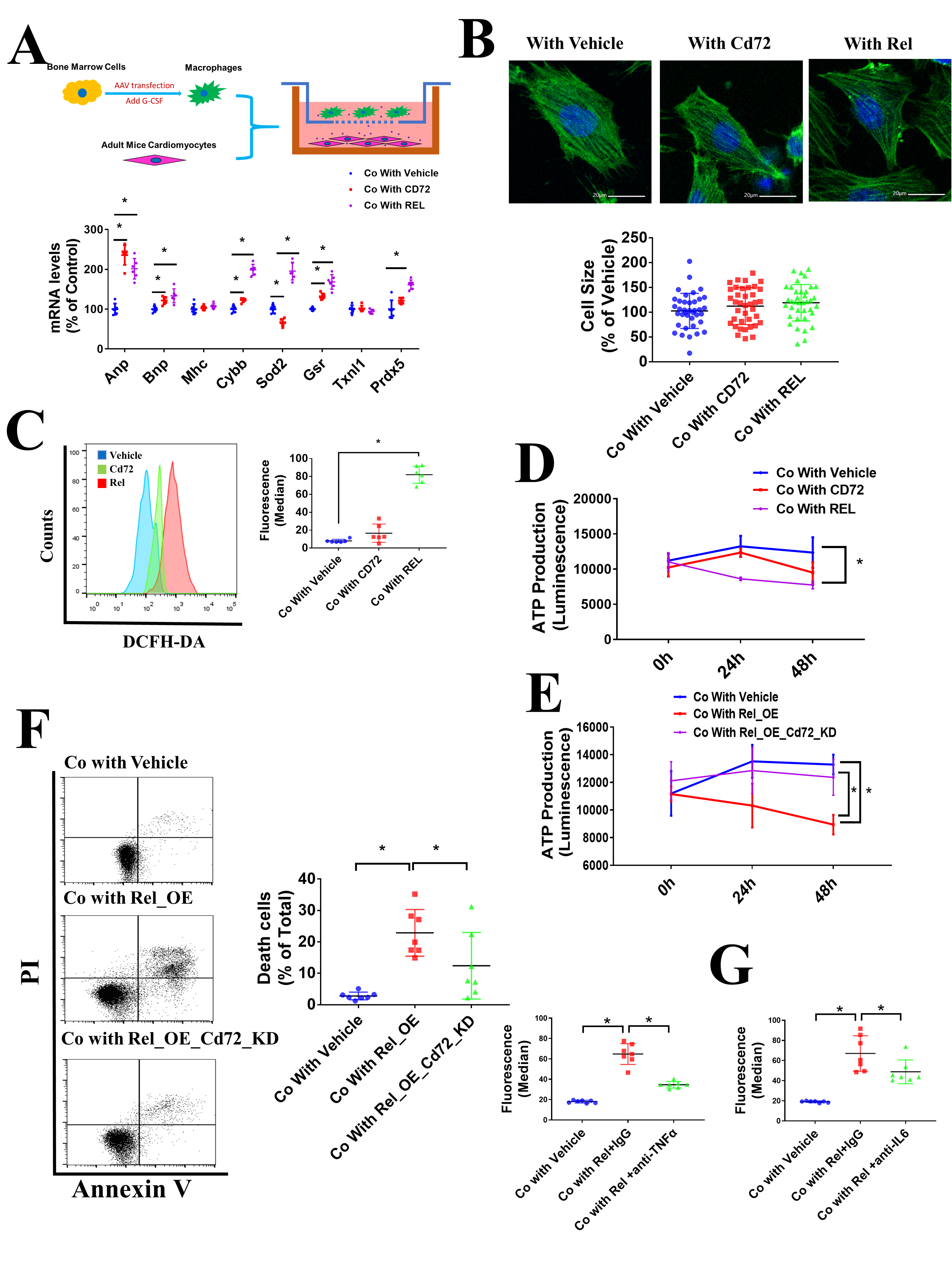
Figure 3. Rel驱动的CD72hi BMDMs能诱导心肌细胞凋亡和降低ATP的产生
4. Rel敲除降低了CD72hi巨噬细胞水平并减缓了TAC小鼠模型的心脏损伤
作者进一步研究了Rel敲除骨髓嵌合体小鼠的CD72水平,流式结果发现Rel敲除小鼠在Sham和TAC模型中均表现出低CD72水平(Figure 4A)。为了验证Rel敲除小鼠心脏表达特征,作者对巨噬细胞CD72表达特征进行了分析。结果发现Rel敲除小鼠CD72高表达的特征与野生型小鼠相比降低(Figure 4B)。在Rel敲除小鼠的CCR+ CMφ中,CD72表达水平急剧降低,表明Rel可能是CD72hi CMφ分化的主要调控因子(Figure 4C)。超声心动图的结果显示,在TAC模型中,Rel敲除减缓了LVEF(Figure 4D)并降低了心肌细胞死亡数量(Figure 4E)。另外,Rel敲除也增加了MDA的水平(Figure 4F)并降低了TAC组中IL6、IL1b和Tnf的表达水平(Figure 4G)。这些结果揭示了Rel可能是潜在的CD72hi CMφ形成调控因子,Rel的敲除能缓和心脏损伤、氧化压力和促炎因子水平。
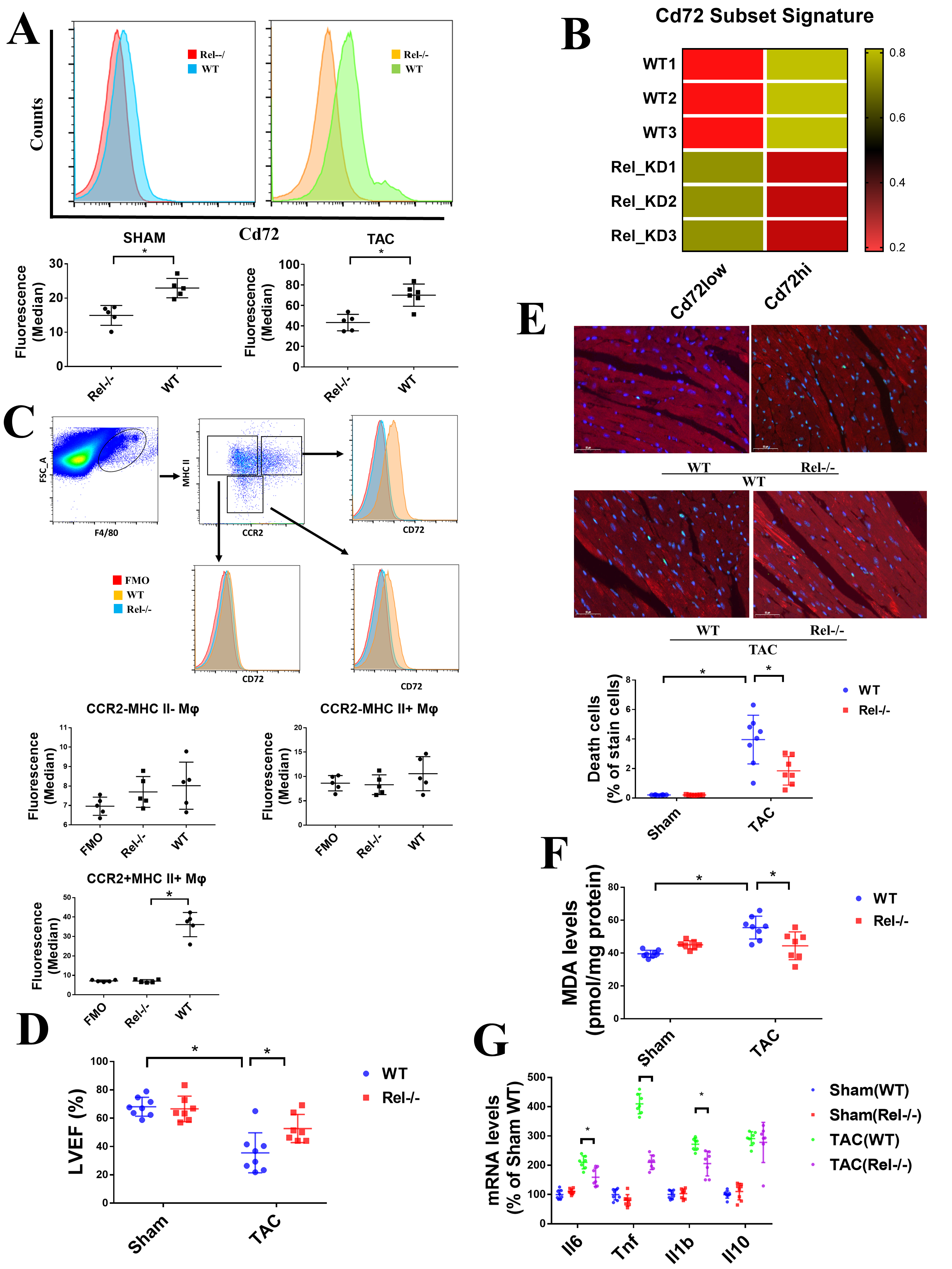
Figure 4. Rel敲除降低了CD72hi巨噬细胞水平并减缓了TAC小鼠模型的心脏损伤
5. Rel增加了TAC小鼠模型中CD72hi巨噬细胞的水平并促进了心脏损伤
为了研究Rel驱动的CD72hi巨噬细胞对TAC模型小鼠的影响,作者进行了单核细胞移植实验。在Sham和TAC模型中,移植3天后,与移植对照组(Vehicle Mo)相比,移植Rel过表达单核细胞(Rel Mos)的小鼠其CMφ表现出高的CD72水平(Figure 5A)。超声心电图结果显示TAC模型Rel Mos组小鼠LVEF显著的恶化(Figure 5B)。WGA染色发现了Rel Mos组和Vehicle Mo组小鼠心肌细胞大小并无明显差异(Figure 5C)。TUNEL染色表明Rel Mos的移植增加了TAC模型细胞的死亡数(Figure 5D)。Rel Mos的移植也增加了TAC模型中MDA的水平(Figure 5E)以及Mcp1的表达水平,Sham组中IL6和IL1b以及Sham和TAC组Tnf的表达水平(Figure 5F)。这些结果说明Rel在体内能够增加CD72的水平,Rel驱动的CD72hi巨噬细胞能够通过氧化压力、促炎反应和诱导心肌细胞凋亡进而促进心脏损伤。
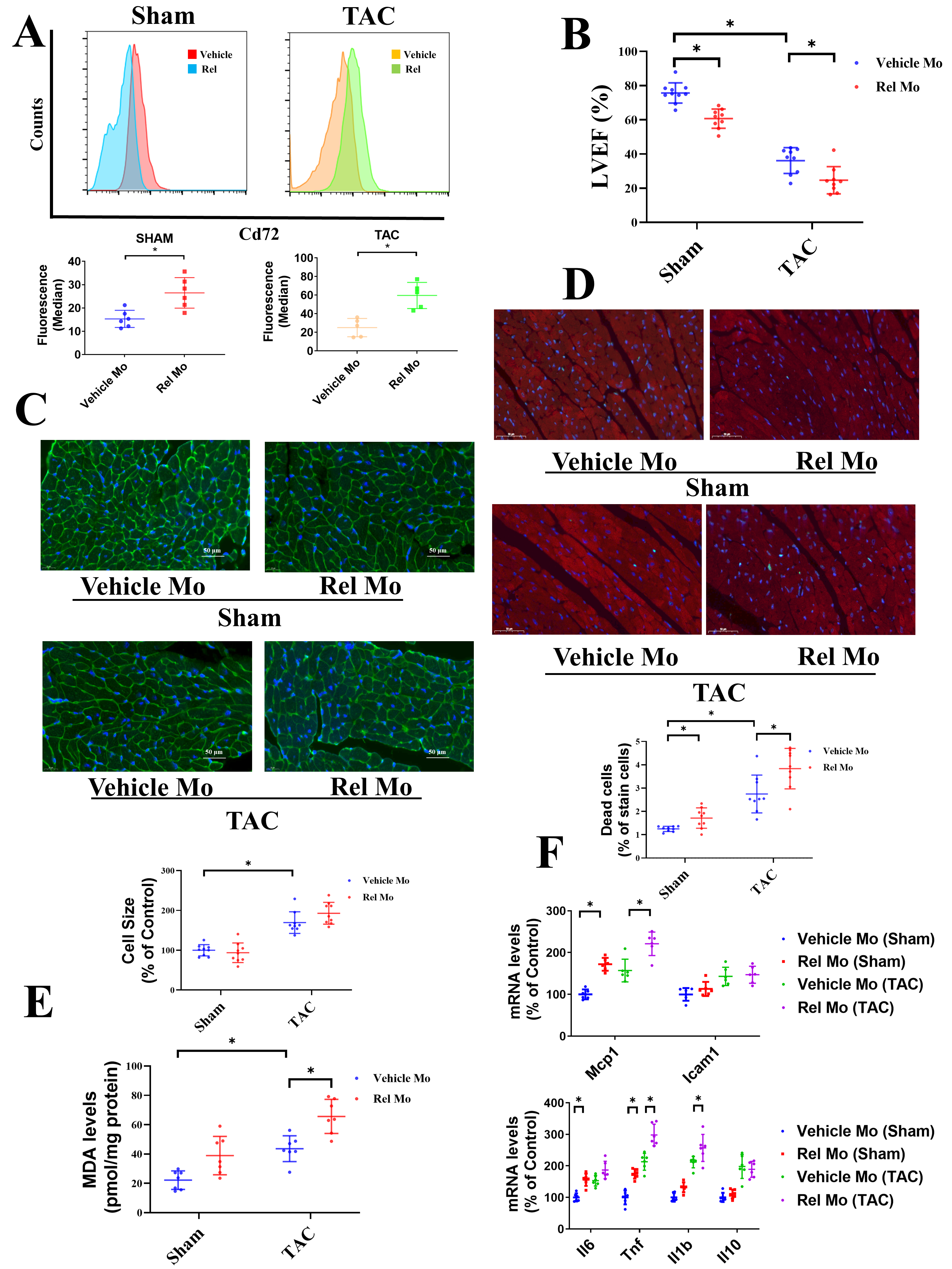
Figure 5. Rel增加了TAC小鼠模型中CD72hi巨噬细胞的水平并促进了心脏损伤
6. CD72hi巨噬细胞的移植能够抵消Rel敲除的效应
为了进一步探究CD72hi巨噬细胞对TAC进展的影响,作者将来源于Rel敲除小鼠的骨髓移植到受体小鼠中,然后对受体小鼠心肌注射CD72hi巨噬细胞并进行TAC模型构建(Figure 6A)。流式结果表明CD72hi巨噬细胞的注射增加了CD72hi巨噬细胞在心脏组织的水平(Figure 6B)。超声心动图分析表明Rel敲除减缓了心力收缩期功能障碍,而CD72hi巨噬细胞的注射则抵消了这个作用(Figure 6C),在Rel敲除的骨髓移植小鼠中死亡心肌细胞的数量和MDA水平会降低,但在CD72hi巨噬细胞的注射后则会升高(Figure 6D和E)。并且,qPCR的结果表明TAC模型中Rel敲除的骨髓移植会导致Mcp1、Tnf、IL6和IL1b表达水平显著降低,而CD72hi巨噬细胞的注射同样也会导致这些基因的升高(Figure 6F)。这些结果表明在TAC小鼠中,Rel敲除的骨髓移植的保护效应能够被CD72hi巨噬细胞的注射所抵消。
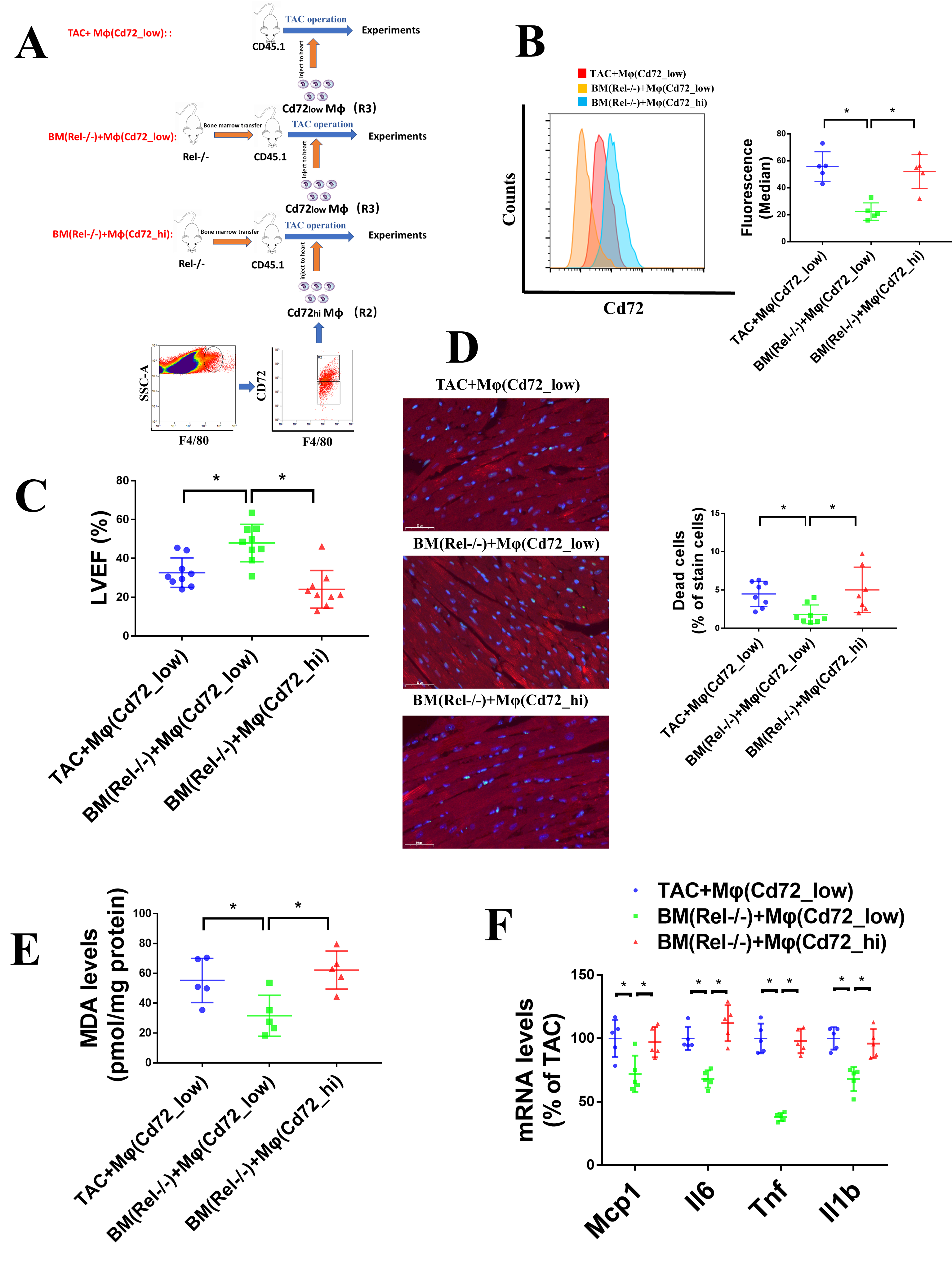
Figure 6. CD72hi巨噬细胞的移植能够抵消Rel敲除的效应
7. Rel驱动的CD72巨噬细胞在心肌梗死小鼠中起着负面作用
最后,作者对CD72hi巨噬细胞在心肌梗死(MI)过程中起到的作用进行了探究。使用已发表的单细胞转录组测序数据,作者发现在心肌梗死小鼠中,CD72hi巨噬细胞的数量在小鼠心脏中从1到3天增加,5到7天降低(Figure 7A)。拟时序分析表明在单核细胞向巨噬细胞的分化过程中CD72和Rel的mRNA水平表现出一致的趋势(Figure 7B)。相关性分析结果表明CD72的表达水平与一些促炎因子和标志物的表达水平相关(Figure 7C)。利用GSEA分析心肌梗死模型的巨噬细胞基因表达情况,结果发现CD72阳性巨噬细胞与CD72相关基因集显著相关,表明CD72hi巨噬细胞在MI和TAC模型中的高度相似性(Figure 7D)。为了验证以上的发现,作者也构建了MI小鼠模型,并跟上述一样进行Rel Mo移植,流式和TUNEL结果发现Rel Mo移植诱导心肌巨噬细胞CD72的高表达以及心肌细胞的凋亡(Figure7E和F),qPCR结果也表明Rel Mo移植显著的提升了IL6和Tnf的表达(Figure7G)。
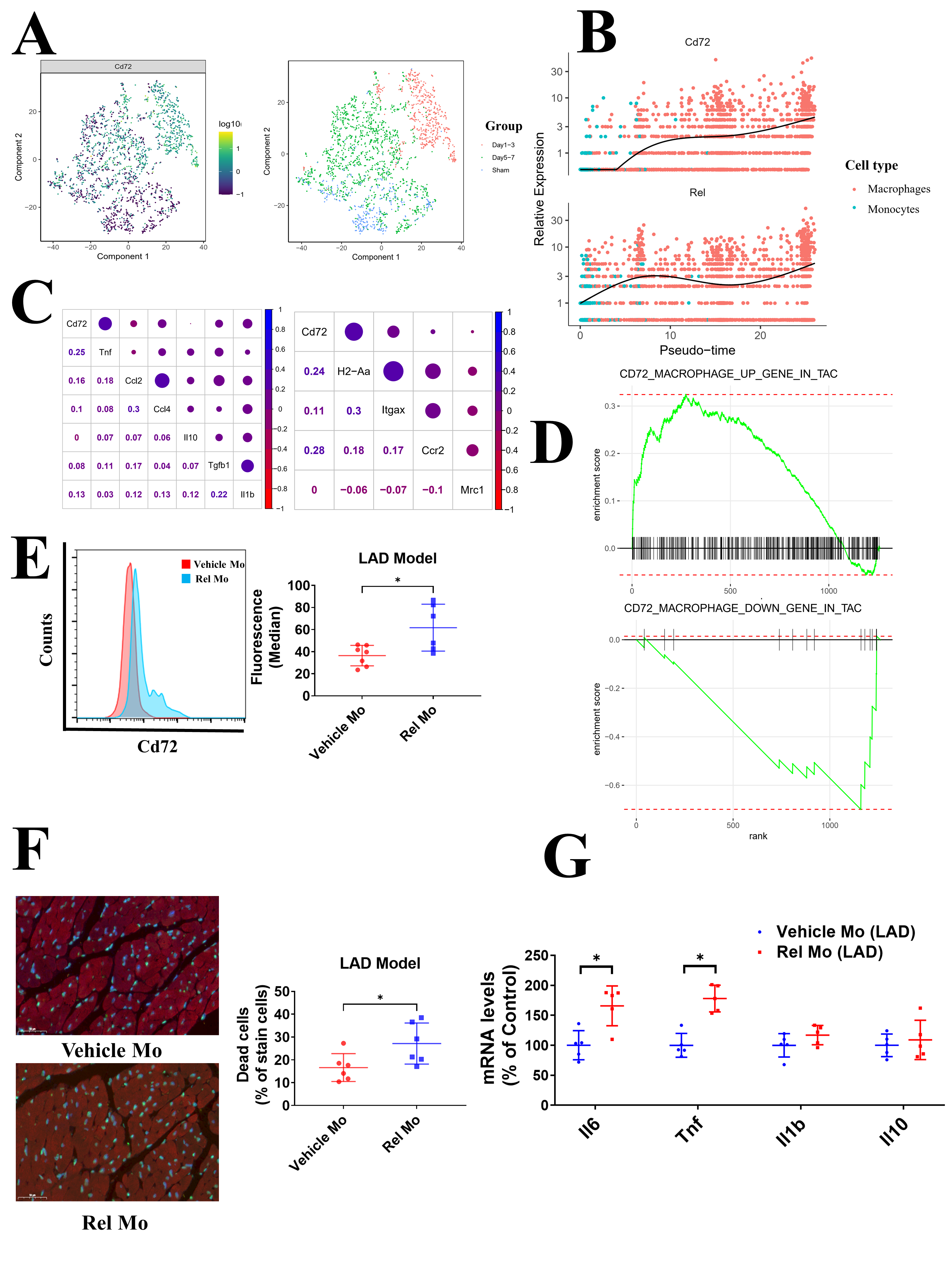
Figure 7. Rel驱动的CD72巨噬细胞在心肌梗死小鼠中起着负面作用
结论
1. CD72高表达巨噬细胞能够诱导心肌细胞氧化压力和凋亡;
2. Rel转录因子是驱动CD72hi巨噬细胞的关键调控因子;
3. Rel驱动的CD72hi巨噬细胞能够通过氧化压力、促炎反应和诱导心肌细胞凋亡进而促进心脏损伤;
4. MI和TAC模型中CD72hi巨噬细胞的表达和功能的高度相似性,证明CD72hi巨噬细胞在多种模型中的重要性。
参考文献
Shi-Hao Ni, Jin-Dong Xu, Shu-Ning Sun, Yue Li, Zheng Zhou, Huan Li, Xin Liu, Jian-Ping Deng, Yu-Sheng Huang, Zi-Xin Chen, Wen-Jun Feng, Jia-Jia Wang, Shao-Xiang Xian, Zhong-Qi Yang, Sheng Wang, Ling-Jun Wang, Lu Lu, Single-cell transcriptomic analyses of cardiac immune cells reveal that Rel-driven CD72-positive macrophages induce cardiomyocyte injury, Cardiovascular Research, 2021;, cvab193,
https://doi.org/10.1093/cvr/cvab193.
近期活动

《报名开启 | 2021“单细胞与空间多组学技术应用”主题学术研讨会》(点击标题来报名参加吧~)






