前言
2022年12月3日,在头颈肿瘤的PD-1/L1靶向治疗研究领域,南京大学医学院附属口腔医院丁亮副研究员、泥艳红教授和王志勇教授合作团队在国际肿瘤学期刊British Journal of Cancer(影响因子: 9.075,中科院一区)上在线发表题为“IL-33/ST2 signaling promotes constitutive and inductive PD-L1 expression and immune escape in oral squamous cell carcinoma”的研究论文。该研究发现了一类具有较高临床响应率的口腔鳞癌(OSCC)亚型,从基因层面揭示了患者PD-1/L1治疗应答的差异,并提出了依据IL-33/ST2信号对OSCC进行分子分型,利用人源化小鼠模型以期筛选潜在的具有较高PD-L1免疫治疗应答率的肿瘤类型,指导临床治疗策略制定及疗效预测。

研究背景
程序性死亡受体1(programmed cell death protein 1,PD-1)是一种重要的免疫抑制分子,基于PD-1/PD-L1制备的免疫抑制剂已经彻底改变了晚期头颈部鳞状细胞癌(HNSCC)的系统性治疗。但关于肿瘤PD-L1调控的分子作用机制目前还未研究清楚。研究团队长期致力于肿瘤微环境的解析及靶向治疗研究,前期研究揭示了肿瘤间质成纤维细胞(CAFs)异质性是OSCC患者进展和术后复发的重要影响因素(Carcinogenesis. 2018;39(3):397-406. Nature Communications. 2022;13(1):5124.)。在此基础上,前期作者报道过成纤维细胞(CAF)来源的白细胞介素-33(IL-33,IL-1家族成员)可促进口腔鳞癌患者中间质成纤维细胞的活化和肿瘤细胞的增殖从而促进OSCC的进展,其作用是通过与IL-33受体ST2的相互作用来激活免疫系统以应对组织损伤,而通过PD-1/L1调节T细胞应答的CAFs/肿瘤细胞相互作用是免疫抑制的关键调控因子。然而,目前对于IL-33/ST2信号轴在OSCC微环境中的免疫调节作用尚不清楚。
本研究旨在通过体外分离人外周血单核细胞建立ST2 OSCC/T细胞共培养系统,体内构建人源化小鼠模型,探究IL-33及其受体ST2信号在PD-L1阳性OSCC患者中的免疫调节作用,检验ST2是否可作为PD-L1/PD-1治疗OSCC患者的潜在疗效预测因子。
研究结果
1. OSCC组织中IL-33/ST2高表达与原位和血液中CD8 T细胞浸润较少有关
通过TNMplot数据库分析了IL-33和ST2在HNSCC和OSCC患者肿瘤组织和正常组织中的表达情况,发现在HNSCC患者中,肿瘤组织中ST2的表达明显高于正常组织(图1a);IL-33在OSCC的肿瘤组织中也表达上调,并在肿瘤转移生态位中富集(图1b);进一步分析IL-33和ST2对HNSCC患者预后的影响时发现ST2高表达的患者,其总生存期较短(图1d),而IL-33高表达患者的总生存期比IL-33低表达的患者更短(图1e)。免疫组化IHC染色证明ST2和IL-33并在癌变细胞中表达上调而在正常上皮细胞中表达缺失,在OSCC中,ST2主要在肿瘤细胞中表达,IL-33则在CAFs和血管内皮细胞中显示出更多的基质表达(图1c)。此外,基于TIMER2.0数据库进一步评估HNSCC患者中IL-33/ST2表达与CD4或CD8 T细胞表达的相关性,结果显示:在肿瘤微环境中,ST2/ IL-33的表达与CD4 T细胞和CD8 T细胞的浸润呈显著负相关(图1f,g)。分析OSCC患者血液中关键免疫细胞比例和数量时显示:高表达ST2的患者血液中CD3CD8 细胞毒性 T细胞的比例和数量相对较低(图1h-j)。
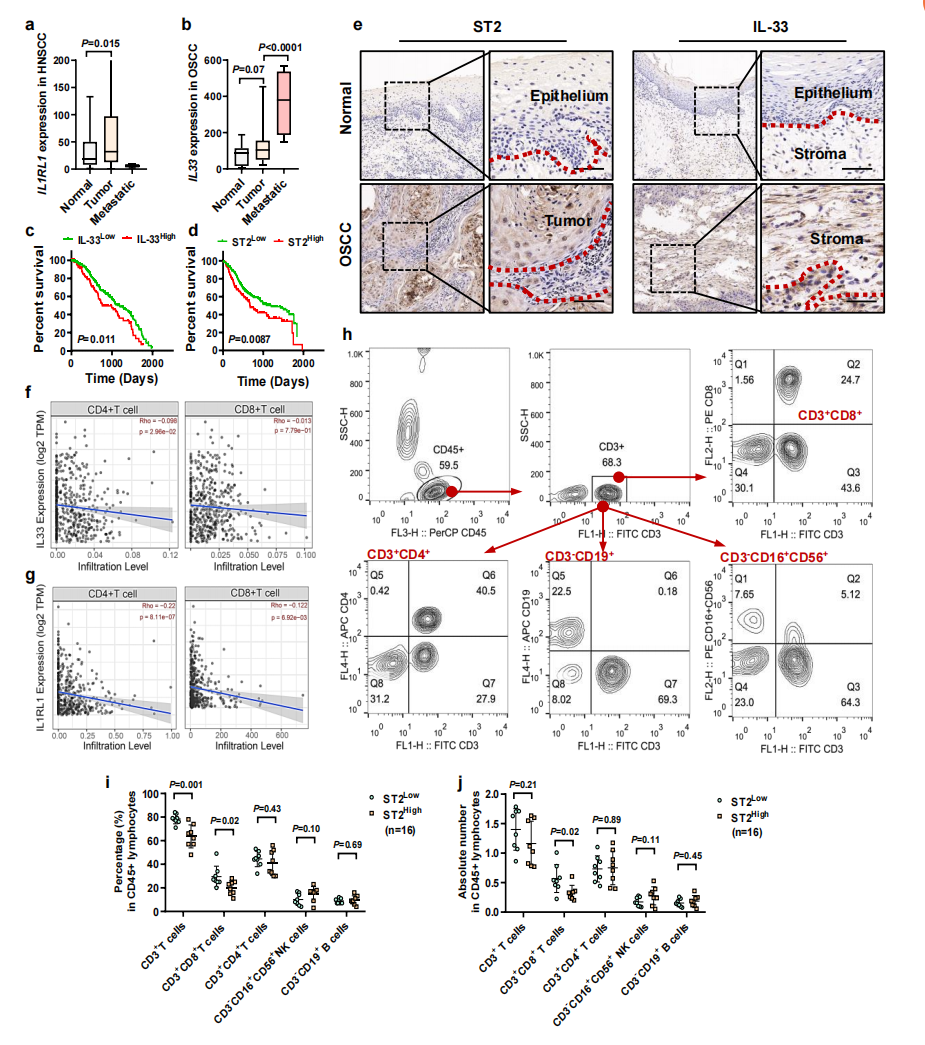
图1 I L-33/ST2与T细胞原位活化和血液活化的相关性
2. IL-33/ST2信号促进口腔鳞癌细胞中PD-L1的表达
为了揭示ST2与活化T细胞减少之间的潜在联系,通过慢病毒-shRNA-ST2转染Cal27、HN6和Hsc3 OSCC细胞系,获得了3个ST2稳定敲除的细胞系。通过WB验证了基因敲除效率(图2a);通过构建含有PD-L1启动子区域的荧光素酶质粒,发现在ST2敲低的肿瘤细胞中,荧光素酶活性显著降低(图2b);3个细胞系的转录组测序结果显示CD274(编码PD-L1)在ST2敲低细胞系中显著降低(图2c);与先前研究结果一致,ELISA实验也证实了CAFs中IL-33的表达显著高于正常成纤维细胞(图2d)。在重组人源IL-33细胞因子刺激后,过表达ST2(ST2OE)HN6细胞系的CD274表达显著上调,说明ST2的激活对于PD-L1表达来说是必需的(图2e)。为了进一步明确ST2和PD-L1在OSCC组织中的原位共表达关系,对10个冷冻的OSCC组织切片进行了免疫荧光染色,pan- keratin肿瘤细胞显示ST2和PD-L1阳性均被染色并共定位(图2f)。
通过cBioPortal数据库对HNSCC患者的IL-33、ST2 和PD-L1 进行相关性分析发现IL-33和ST2分别与PD-L1的表达量呈显著正相关(图2g)。通过从45个OSCC组织中提取RNA进行qPCR证实ST2的患者同样也有较高的PD-L1水平(图2h)。通过流式细胞术根据PD-L1低表达和PD-L1高表达对3种OSCC细胞系(Cal27、Scc9和Hsc3)进行了分类,结合qPCR分析显示,ST2在PD-L1细胞中的表达量明显低于PD-L1high的细胞(图2i)。这些结果表明,IL-33/ST2信号可促进口腔鳞癌细胞中PD-L1的表达。
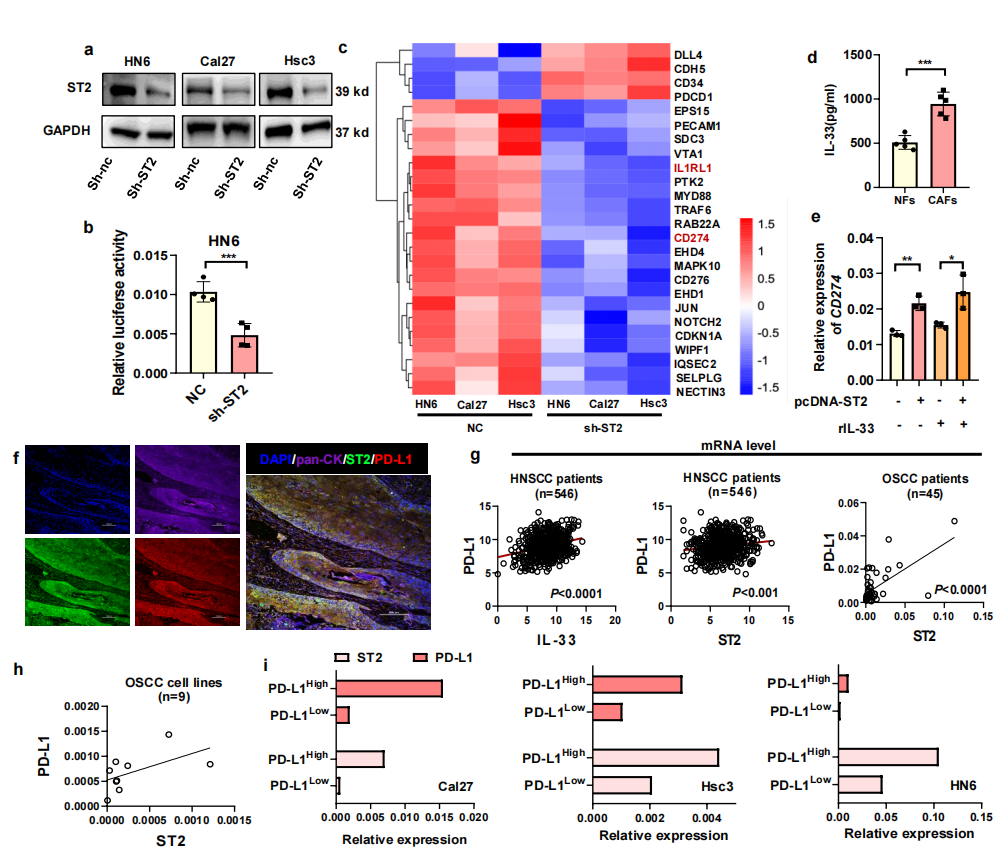
图2 | OSCC中的IL-33/ST2信号调控PD-L1的表达
3. IL-33/ST2信号通路通过JAK/STAT3通路促进PD-L1的构成型表达
为进一步确定在ST2肿瘤中调节PD-L1表达的关键通路,基于GTRD数据库进行分析发现在CD274启动子中存在几个预测的转录因子(TFs)结合位点。通过对这些转录因子进行KEGG富集分析发现JAK/STAT通路显著富集(图3a)。通过WB检测ST2敲低细胞中JAK2和STAT3的激活状态,发现ST2被抑制后,JAK2和STAT3的磷酸化水平均降低(图3b),而刺激IL-33细胞因子可以显著提高JAK2和STAT3的磷酸化水平,而敲低ST2可以直接抑制JAK2/STAT3通路的激活(图3c);另外,在ST2过表达的OSCC细胞系中,JAK2/ STAT3的磷酸化水平增强(图3d)。为了证实JAK/STAT通路在PD-L1转录中的作用,用JAK2抑制剂AG490对细胞进行了处理,结果显示,AG490抑制剂的加入逐渐降低了JAK2和STAT3的磷酸化水平,同时PD-L1的表达下调(图3e)。
免疫荧光结果显示,IL-33刺激增强了PD-L1的表达和p-STAT3的细胞核染色(图3f)。为了进一步研究IL-33/ ST2/PD-L1通路,将HN6 OSCC细胞系与IL-33在超低粘附环境中进行共培养,形成3D肿瘤类器官(图3g),免疫荧光染色结果表明,激活IL-33/ST2信号可激活p-STAT3的核定位,从而增加PD-L1的表达(图3h)。
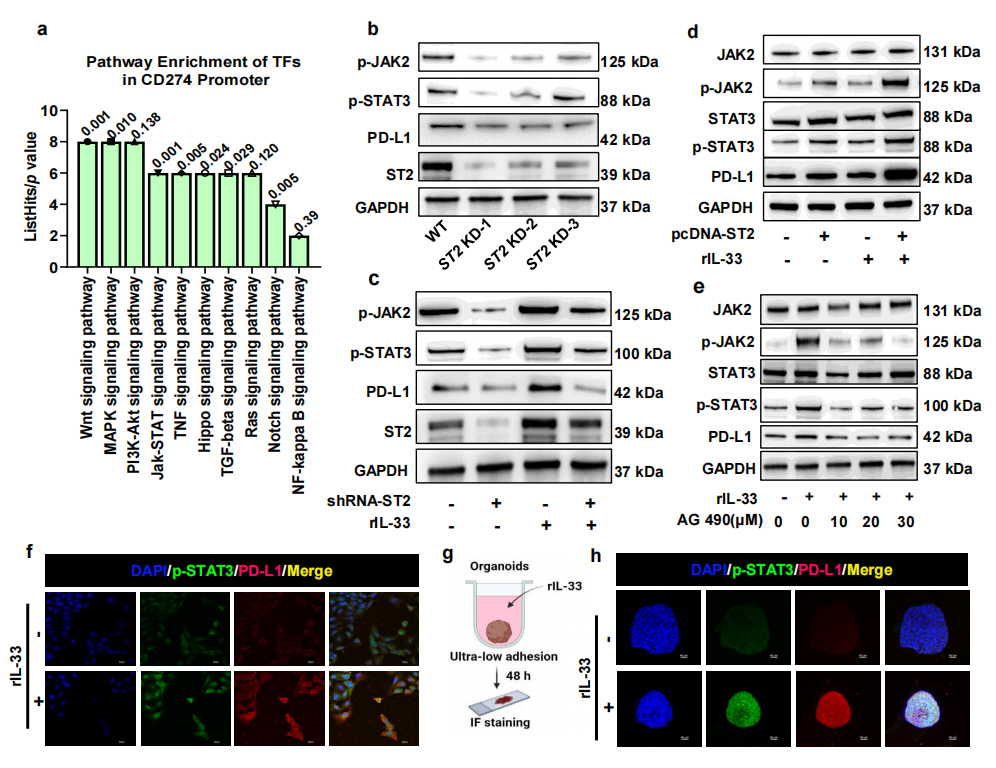
图3 | JAK2/STAT3通路在IL-33/ST2调控PD-L1表达中的作用
4. IL-33/ST2信号通过MyD88上调IFN-γR的表达,从而促进IFN-γ介导的PD-L1表达
基于cBioPortal数据库中泛癌和HNSCC患者队列的临床数据进行分析,发现CD274与IFNGR呈正相关(图4a)。RNA-seq数据表明在OSCC细胞系中ST2的敲低可下调IFNGR(图2c)。据报道,在靶向治疗过程中,PD-L1可诱导激活IFN-γ/IFN-γR,因此推测IL-33/ST2信号可能通过IFN-γR间接激活IFN-γ/PD-L1通路。qPCR结果证明ST2过表达增强了IL-33诱导的IFNGR上调表达(图4b)。通过免疫组化和免疫荧光实验也证实了IL-33/ST2激活对于IFN-γR水平的影响(图4c,d)。通过qPCR实验进一步验证ST2下游信号分子时发现IL-33/ST2的激活促进了下游MYD88和TRAF6的表达(图4e-f),通过WB实验在蛋白层面也证实了这一点(图4g)。另外,ST2过表达和IFN-γ刺激联合诱导PD-L1基因和蛋白表达水平进一步升高(图4h,i),并且这种升高与STAT3和p65的激活有关(图4j)。因此,这些数据表明,ST2信号可以通过JAK-STAT3通路直接促进PD-L1的表达,并间接通过促进IFN-γR的表达,进一步增强IFN-γ介导的PD-L1诱导反应(图4k)。
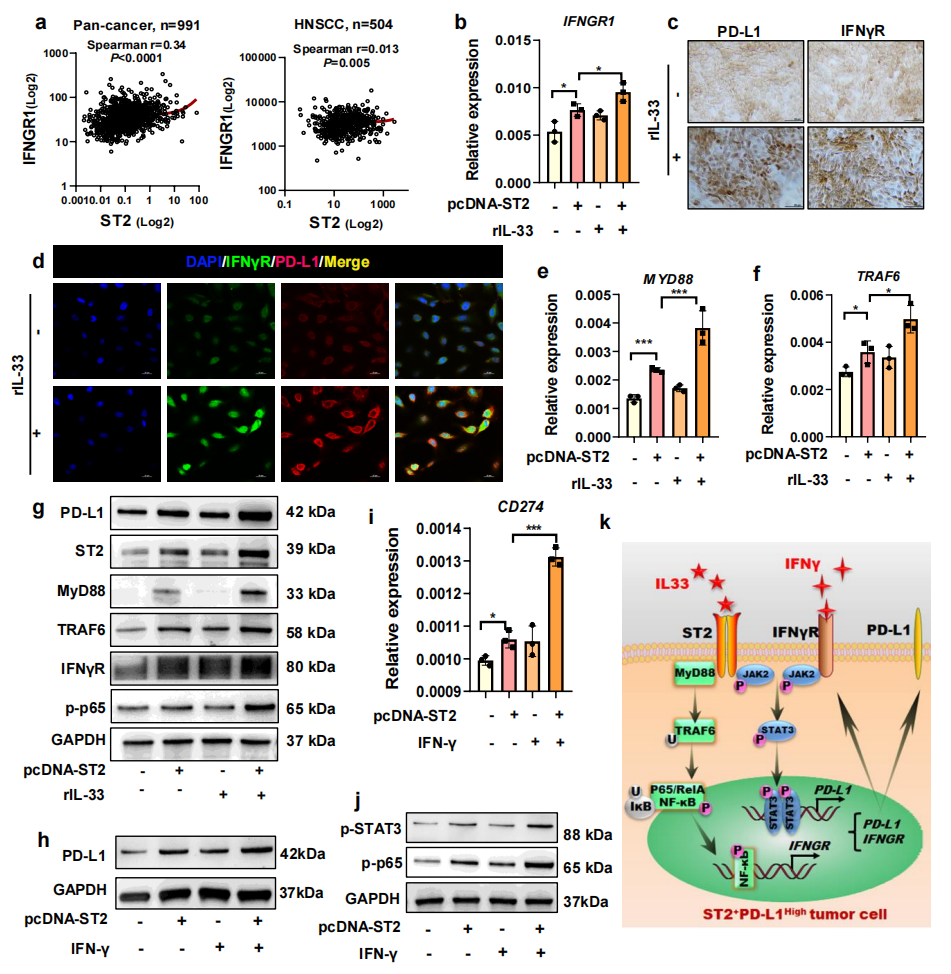
图4 I L-33/ST2信号对肿瘤细胞IFN-γR/PD-L1表达的影响
5. ST2肿瘤细胞通过PD-L1抑制人CD8+ T细胞的肿瘤杀伤功能
为了评估ST2 肿瘤细胞在免疫逃逸中的作用,建立了肿瘤/免疫细胞共培养系统,使用磁珠、CD3/CD28激活因子和IL-2细胞因子对人外周血单核细胞中的CD8+ T细胞进行分类,刺激CD8+ T细胞增值并诱导细胞毒性T细胞(CTLs)的活化(图5a)。T细胞介导的肿瘤细胞杀伤试验显示,活化的CD8+ T细胞能有效促进ST2+ 肿瘤细胞凋亡,而ST2敲低能进一步增强了ST2+ 促进的肿瘤凋亡。相反的,在HN6细胞中过表达ST2又能使肿瘤细胞对人源细胞毒性T细胞(CTLs)具有更强的抗性(图5b,c)。同时,采用流式细胞术检测上清中T细胞的活化率,结果显示,与对照组相比,敲低ST2的HN6组,其CD3 CD8 T细胞和CD8IFN-γ T细胞比例显著上调(图5d,e)。将人外周血单核细胞(PBMCs)注射到NCG小鼠体内建立人源化PBMC小鼠模型(hu-PBMC)(图5f)进行进一步的体内验证实验,10天后通过流式细胞术分析重建效率,结果显示小鼠外周血中CD45 细胞的平均比例约为20-30%,人源CD45CD3T细胞富集约占80%(图5g,h)。分别在NCG小鼠和hu-PBMC小鼠舌头上注射人OSCC细胞系HN6进一步诱导OSCC的原位模型,发现只有Hu-PBMC小鼠检测CD8+ T细胞在肿瘤中有浸润(图5i),采用ST2 HN6细胞进行注射时,肿瘤体积明显小于对照组(图5j,k);免疫组化染色结果也显示,ST2组肿瘤中CD3 T细胞和CD8 T细胞的浸润率均高于对照组(图5n)。
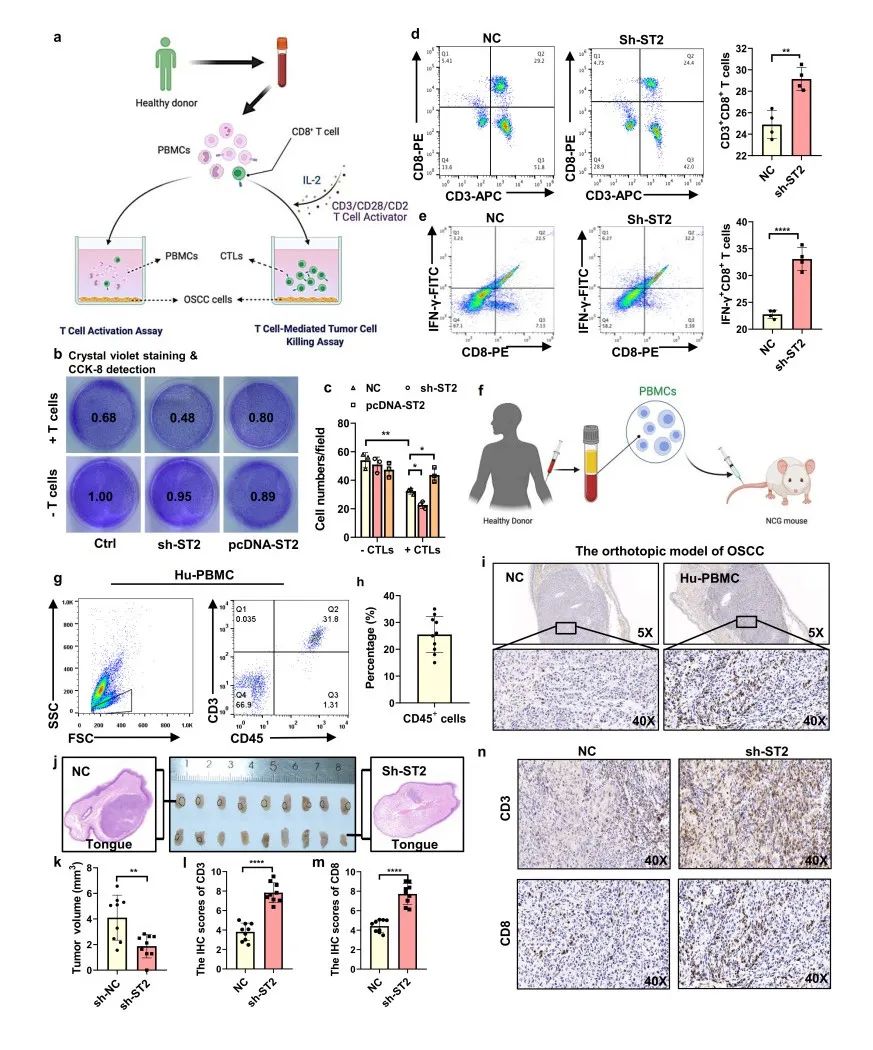
图5 | ST2敲除促进了Hu-PBMC小鼠模型的体内外人源CTL杀伤功能
6.ST2敲除联合抗PD-L1治疗在OSCC中显示出优越的抗肿瘤作用
以无免疫缺陷的C57BL/6小鼠为实验对象,进一步评估抗PD-(L)1阻断抗体存在时,IL-33/ST2信号对CD8+ T细胞的免疫抑制作用,发现在IL33/ST2激活的肿瘤中,抗PD-L1治疗可显著诱导肿瘤退缩,并消除ST2/PD-L1诱导的免疫抑制。对口腔鳞癌患者进行抗PD-1治疗前后的转录组分析,发现经过PD-1阻断治疗后,有治疗应答的患者其肿瘤表达更高水平的CD8和ST2(图6a),通过测量肿瘤体积、统计细胞占比(CD8 T细胞增加和Foxp3 treg细胞减少)及免疫组化实验进一步证明ST2敲低联合抗PD-L1治疗显示出更优的抗肿瘤作用(图6b-e)。最后通过免疫组化验证了OSCC患者原位ST2、PD-L1、IFN-γR蛋白的表达位置,结果显示ST2高表达与PD-L1、IFN-γR高表达显著相关(图6f,g)。
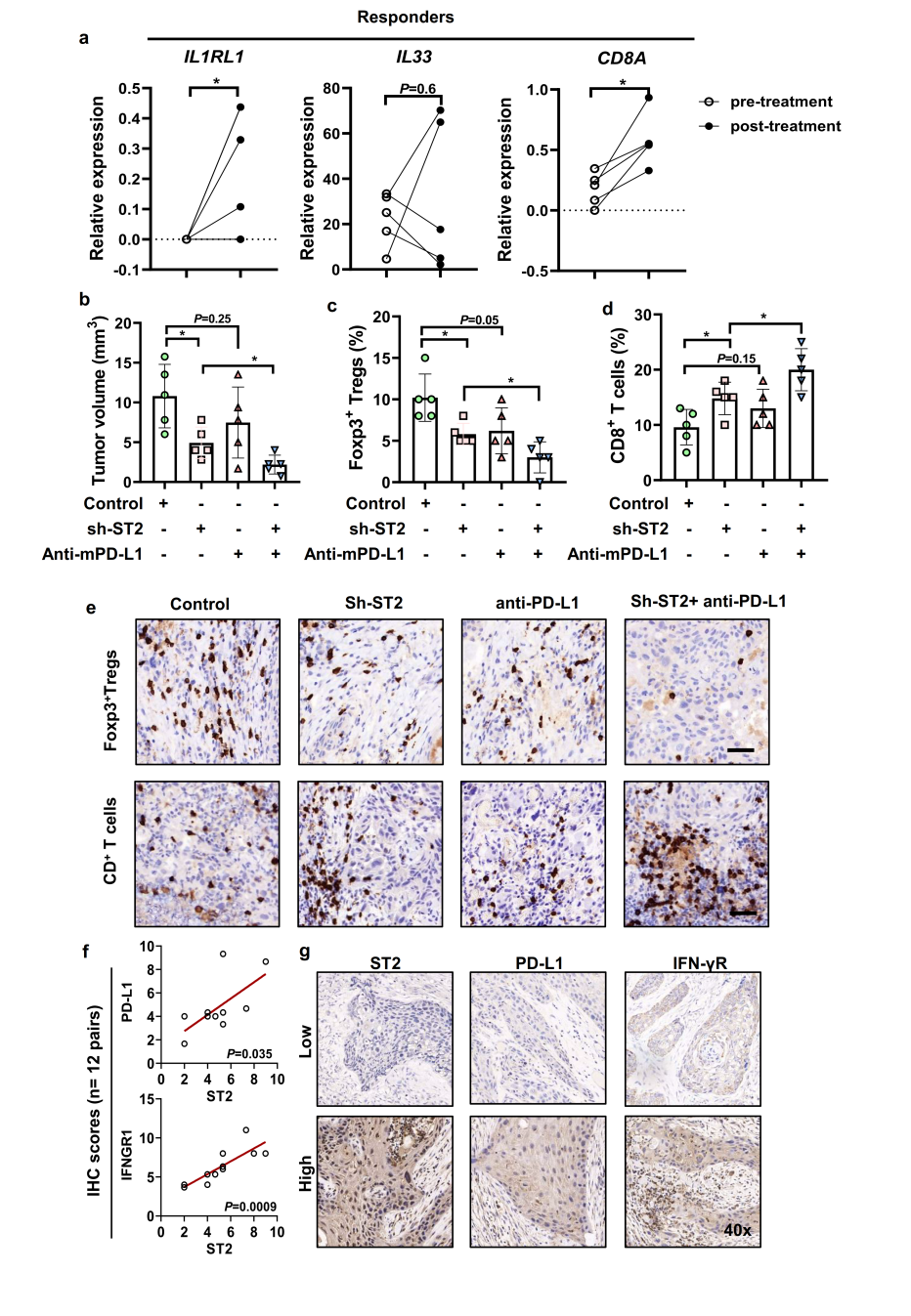
图6 ST2敲除联合抗PD-L1治疗在OSCC中显示出优越的抗肿瘤作用
研究结论
本研究通过细胞、人源化小鼠模型和OSCC及HNCSS患者的体内外实验,结合临床数据共同阐明了OSCC中一个基于IL-33/ST2/PD-L1的免疫调节模型,发现间质IL-33可以激活ST2 肿瘤细胞的JAK2/STAT3磷酸化,从而促进PD-L1的表达。另外,IL-33/ST2也可以通过MyD88/TRAF6/NF-κB信号轴激活IFN-γR的表达,从而间接刺激IFN-γ诱导的PD-L1的表达。这些结果表明IL-33/ST2信号增强了PD-L1介导的免疫逃逸,抑制ST2信号可能有益于OSCC患者的抗PD-1/L1治疗。
原文链接:
https://doi.org/10.1038/s41416-022-02090-0
DOI:10.1038/s41416-022-02090-0
详细技术请访问欧易生物官网
⬇
百度搜索欧易生物(oebiotech)
⬇
了解更多多组学技术






