2024年6月7日,四川大学张舒羽教授团队,第一作者耿凤豪博士在免疫学权威学术期刊《Cellular & Molecular Immunology》(IF=24.1)上发表了题为“Chaperone- and PTM-mediated activation of IRF1 tames radiation-induced cell death and the inflammatory response ”的研究文章。本文揭示了干扰素调节因子1(IRF1)在结构细胞中的激活机制,以及其在辐射诱导的皮肤组织细胞死亡和组织炎性损伤进展中的重要调控作用,为放射性皮肤损伤防治提供了新的救治策略。
欧易生物助力了该项目的单细胞转录组、普通转录组等多组学测序实验和分析工作。
此研究涉及到了多组学测序分析和大量功能实验,内容丰富。感兴趣的老师可公众号后台回复”CMI“获取原文详细阅读。

发表期刊:Cellular & Molecular Immunology
影响因子:24.1
发表年月:2024年06月
研究材料:收集暴露辐射后第7、14、28、60天的皮肤组织进行scRNA-seq测序、一份取自一位患者手部的辐射皮肤样本进行scRNA-seq测序;
辐照后的大鼠肺和皮肤组织以及IRF1-KO小鼠皮肤组织进行RNA-Seq检测
研究方法:10x Genomics单细胞转录组测序;
DOI:10.1038/s41423-024-01185-3

遭遇紫外线辐射、电离辐射等这些损伤时,哺乳动物和人类的防御系统被激活,招募激酶和酶来修复受损的基因组,并激活炎症信号通路来减轻组织损伤。炎症反应传统上被认为是由免疫细胞执行的,研究显示,结构细胞(包括上皮细胞、内皮细胞和成纤维细胞)表现出复杂的免疫相关基因活性,它们通过感应DNA损伤并激活相应的信号通路来响应这些基因毒性压力,进而参与抵抗外源性损伤的免疫应答反应。
干扰素调节因子1(IRF1)是一种关键的转录因子,既往研究表明,骨髓巨噬细胞中IRF1激活对于调节炎症反应至关重要。但目前尚缺乏针对结构细胞中IRF1激活以响应DNA损伤机制的探究。探索结构细胞感知基因毒性应激进和调节细胞炎症应答的分子机制不仅有助于我们理解细胞如何维持基因稳定性和应对外界压力,也为开发相关病损的新的防治策略提供了科学基础。

IRF1主要表达于皮肤结构细胞(特别是角质基底细胞)而非免疫细胞中;高表达IRF1皮肤结构细胞与免疫细胞间有更强的通讯联系;单次或分割照射均可特异性引起皮肤结构细胞IRF1转录激活,该过程受其核定位序列丝氨酸磷酸化和赖氨酸乙酰化介导的翻译后修饰调控的影响;线粒体单链DNA结合蛋白SSBP1可通过影响STING/P300与IRF1结合抑制IRF1核定位序列翻译后修饰;IRF1激活可促进Caspase1依赖的组织炎症性损伤的进展;研究筛选出两种特异性IRF1抑制剂,不仅可有效减轻受照皮肤组织炎性损伤,也可抑制新冠假病毒感染介导的肺泡上皮细胞IRF1转录激活。
综上,本研究通过多组学方法揭示了IRF1在结构细胞免疫应答中的重要作用及调控机制,为临床相关疾病防治提供了新的干预策略。


1. 皮肤照射后IRF1表达的动态变化
基于最近的一些研究结果,作者发现在辐照处理后,相比于胃或肺组织,IRF1特异性富集于大鼠皮肤组织和人类永生化表皮细胞(HaCaT)细胞中(图1A)。且这些研究中的差异基因功能富集分析结果显示出干扰素相关免疫反应激活。因此,作者推测电离辐射下IRF1的特异性激活可能导致皮肤炎症损伤。
为了阐明IRF1在放射性皮肤损伤进展中的作用,作者首先通过免疫组化(IHC)监测了辐照小鼠、大鼠和猴皮肤样本中的IRF1蛋白水平。结果显示,用20 Gy照射3天或7天,照射的皮肤组织中IRF1的染色比未照射的更明显(图1B)。然而,在意外暴露于铱-192辐射160天和经过部分放射治疗的患者的人类皮肤样本的滤泡间表皮基底(IFE-B)细胞中,IRF1的表达显著减少(图1C)。

图1 照射后皮肤结构细胞中IRF1的动态表达
对角质形成细胞进行亚型分析,进一步观察IRF1在不同角质形成细胞簇中的表达。IRF1主要集中表达在IFE和IFE-B细胞(cluster3和1、5、10),且这些亚群比例在辐照处理后下降(图1G-I)。作者对单细胞数据GSE193807进行信息挖掘,探究IRF1在暴露于铱-192辐射250天患者皮肤组织的不同细胞类型中的表达,发现辐射后,IRF1在成纤维细胞群中表达减少(图1J)。此外,另一项scRNA-Seq数据(GSE210170)显示,辐射逐渐降低了人类永生化表皮细胞细胞中IRF1的转录水平(图1K)。
综上,皮肤结构细胞,特别是IFE-B细胞中IRF1表达的波动变化可能反映了哺乳动物和人类辐射损伤的常见迹象。IRF1在哺乳动物和人类细胞对辐射损伤的响应中起着复杂的作用,其表达的波动变化可能与细胞的存活、死亡和炎症反应密切相关。
2. 核易位是辐射诱导IRF1激活的关键,IRF1核定位序列的翻译后修饰决定了其转录激活,SSBP1鉴定为IRF1的抑制性分子伴侣
以上实验揭示了结构细胞中IRF1的表达与辐射的关系。作者进一步基于单细胞数据,对辐照大鼠皮肤组织角质形成细胞簇cluster3-IFE进行转录因子分析,CSI关联特异性结果揭示了辐照处理后IFE细胞中转录调控因子IRF1的表达显著富集(图2A)。作者进行了一系列实验验证,数据综合表明,辐照均能触发皮肤结构细胞中IRF1的瞬时转录激活(图2B-E)。
为了进一步探究IRF1的瞬时转录激活具体体现在哪个层面,分别进行了Western blot分析、qRTPCR、免疫荧光染色实验。结果表明辐射诱导的IRF1核易位是其在皮肤结构细胞中短暂激活的原因(图2G,H)。

图2 SSBP1和PTMs决定了辐射诱导的IRF1核易位和瞬时激活
为了阐明IRF1的激活机制,作者通过质谱(MS)测定了辐照HaCaT细胞中核和胞质IRF1蛋白的翻译后修饰(PTMs),并基于免疫沉淀(IP)检测辐照对蛋白修饰的影响。结果显示辐射诱导的IRF1核定位序列(NLS)翻译后修饰(PTMs)决定了其转录激活(图2J-M)。
分子伴侣对蛋白质的易位和转录调控至关重要。为了研究参与辐射诱导的IRF1核易位和激活过程中重要的分子伴侣,作者随后进行了免疫共沉淀(co-IP)和基于质谱(MS)的蛋白质组学分析(图2J)。作者进一步详细研究了SSBP1在IRF1激活中的作用。结果揭示:SSBP1的沉默或敲低促进了IRF1的核转位,且导致IRF1的磷酸化和乙酰化水平提高,进而增强了IRF1的转录活性,说明SSBP1可能通过抑制这些PTMs来调控IRF1(图2Q-S)。研究首次将SSBP1鉴定为IRF1的抑制性分子伴侣,揭示了SSBP1在辐射响应中的新角色。
3. IRF1决定受辐照皮肤细胞的命运
根据前面的探究,IRF1已被指出为皮肤组织接受电离辐射后特异激活的转录因子,接下来作者进一步研究了在辐射反应中,IRF1起到的具体作用。
作者开展了一系列的功能实验,结果显示:IRF1过表达促进了未辐照皮肤细胞的死亡和衰老,限制了细胞自我更新、增殖和迁移;IRF1通过调节多种基因的表达,参与了细胞对辐射损伤的响应,包括促进DNA修复、诱导细胞周期停滞等;IRF1的激活导致促进细胞死亡的基因表达增加(图3A-M)。这些结果提示IRF1一定程度上影响了受损皮肤组织细胞的命运。

图3 IRF1在辐射的皮肤细胞中触发了多种类型的细胞死亡
为了证实这一发现,作者对辐照的HaCaT细胞的scRNA-Seq数据进行了深入挖掘。使用了特定的生物标志物来识别和区分不同类型的细胞死亡,如凋亡、坏死、焦亡等情况(图3O)。通过单细胞调控网络的推理和聚类(SCENIC)分析,鉴定出330多个IRF1的靶向基因,这些基因参与了细胞死亡相关的多种生物学途径。此外,对这些靶基因进行基因集变异分析(GSVA),结果显示IRF1转录调控细胞凋亡、坏死、衰老和铁死亡等信号通路基因(图3Q)。通过拟时序分析可视化了与细胞死亡相关的生物标志物在细胞分化过程中的表达变化,揭示了IRF1在调控细胞对辐射反应中的复杂性。
综上,这些结果揭示了辐照后IRF1如何通过调节特定基因的表达来影响细胞的死亡方式,改变细胞的命运。
4. IRF1调控辐射诱导的细胞死亡和炎症反应的潜在机制及IRF1抑制剂临床应用潜力
为了了解IRF1调控辐射诱导的细胞死亡和炎症反应的潜在机制,及探究IRF1潜在的临床应用价值,作者开展了一系列的实验,结果表明(原文对此块实验内容的描述很详细,感兴趣的老师可以下载原文详细阅读):
1)在接受辐射的皮肤细胞中,IRF1-AIM2/ASC信号通路对Caspase 1激活具有调节作用,IRF1可能通过调节Caspase 1的活性控制皮肤细胞的炎症细胞死亡 (图4);
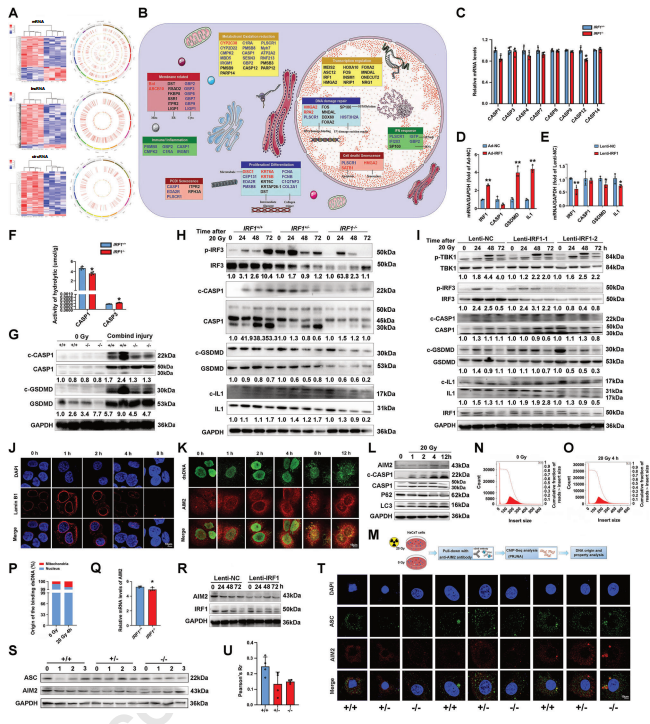
图4 Caspase 1的激活有助于IRF1诱导细胞的炎症性死亡
2)IRF1影响免疫细胞的激活、增殖和分化。辐射诱导后结构细胞中IRF1的改变影响了其与免疫细胞的相互作用,从而影响组织炎症反应(图5);

图5 IRF1影响辐射诱导的炎症性皮肤损伤
3)小分子药物靶向IRF1(干扰素调节因子1)的DNA结合域(DBD)可以减轻辐射诱导的炎症性皮肤损伤。作者筛选出了两种小分子化合物I-2和I-19,这些化合物能够通过靶向IRF1的DBD来抑制其转录活性,在体外和体内实验中显示出对辐射诱导的皮肤损伤的保护作用(图6);
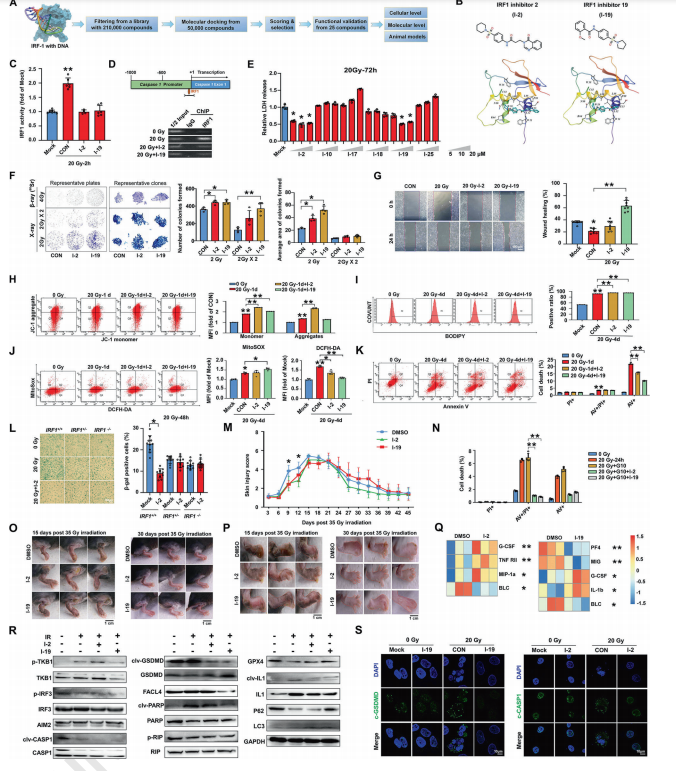
图6 靶向IRF1的DBD的小分子可以减轻辐射诱导的炎症损伤

这篇文章的核心内容集中在探讨干扰素调节因子1(IRF1)在结构细胞中的激活机制,以及其在辐射诱导的细胞死亡和炎症反应中的作用机制。
1. IRF1特异性表达:基于scRNA-seq,揭示了IRF1在不同细胞类型中的表达模式:IRF1在成纤维细胞、角质形成细胞、内皮细胞和其他非免疫细胞中较高表达,而在免疫细胞中的表达相对较低。
2. 细胞群动态变化:揭示了辐射后细胞群体的变化,特别是表达IRF1的表皮基底层细胞(IFE-B),在辐射后其比例有所下降。
3. 细胞死亡相关基因的表达:scRNA-Seq数据揭示了与细胞死亡相关的生物标志物的表达情况。
4. 转录因子分析:转录因子分析,鉴定出330多个IRF1的靶向基因
5. 细胞死亡信号通路的可视化:GSVA分析,揭示了IRF1转录调控的基因富集到不同的细胞死亡通路。
6、IRF1介导细胞通讯网络构建:基于scRNA-Seq数据中IRF1表达情况划分亚群,构建了IRF1高低表达细胞与免疫细胞间通讯网络,探究IRF1如何影响受照皮肤组织结构细胞与免疫细胞之间的交流。
参考文献:Geng F, Chen J, Song B, Tang Z, Li X, Zhang S, Yang T, Liu Y, Mo W, Zhang Y, Sun C, Tan L, Tu W, Yu D, Cao J, Zhang S. Chaperone- and PTM-mediated activation of IRF1 tames radiation-induced cell death and the inflammatory response. Cell Mol Immunol. 2024 Jun 7. doi: 10.1038/s41423-024-01185-3.






