蜡质是覆盖于苹果枝干、叶片、果实等器官表面的强疏水层,是果树抵御生物和非生物胁迫的第一道屏障,也是决定果实光泽品质的重要成分。N是植物必需的矿质元素之一,在苹果的生长发育和器官构建中发挥着重要作用,适量的N不仅可以提高产量还可以增强果树的抗性。研究发现蜡质积累可能与N供应有关,N和蜡质之间可能存在未知的调节机制。
近期,山东农业大学李媛媛研究团队在植物学权威期刊《Nature Plants》上发表了题为“MdBT2 regulates nitrogen-mediated cuticular wax biosynthesis via a MdMYB106-MdCER2L1 signalling pathway in apple”的研究论文,发现高N抑制苹果表皮蜡质的积累,揭示了N素对苹果表皮蜡质的调控机制。
欧易生物对该项目的酵母文库构建提供了支持

发表期刊:Nature Plants
影响因子:15.8
研究材料:“Royal Gala”苹果种子(WT),T3代MdMYB106转基因苹果种子,8年生“Gala/M26/M. Hupehensis”苹果树。
研究结果
1. N素通过负调控植物中蜡质的生物合成来影响植物表型
在前期研究基础中已经发现N素含量与蜡质生物合成呈负相关,本研究中作者对这一结论进行了进一步的验证,并在此基础上展开更深入的研究。
以8年生“Gala/M26/Malus hupehensis”苹果树为研究对象,分别用LN (0.1 mM), NN (1 mM)和HN (10 mM)处理一年,待果实成熟后采摘叶子和果实,进行蜡质含量分析和扫描电子显微镜(SEM)观察发现,LN和NN处理的苹果皮表面的水滴粘附性更强,表明LN和NN处理对果皮表面的疏水性强于HN处理(图1a-c),证实了随着N施用量的增加,蜡含量逐渐降低;采用SEM方法分析了不同N处理的苹果叶蜡发现HN处理抑制了叶蜡的形成(图1f);提取处理后的叶片和果实总蜡发现LN和NN处理下的总蜡含量高于HN处理(图1d、g);通过气相色谱-质谱(GC-MS)对蜡质组分进行定量分析发现LN处理下C29和C31长链烷烃含量最高,HN处理下C27长链烷烃含量高(图1e、h),结果表明N对C27–C31烷烃含量的影响最为显著;过量施N导致苹果中C27含量升高,但未能改变苹果中C29占主导地位的烷烃含量。
为验证N对苹果抗旱性和茎秆直立程度的影响是否完全或部分取决于蜡质含量的变化,作者对自然条件下的苹果活砧木进行了LN、NN和HN处理,结果发现,在干旱条件下,LN处理的植株长势变弱;添加VLCFAs之后HN处理植株较弱的表型得到部分恢复,表明LN处理可以提高苹果的抗旱性,而且N对植物抗旱性的影响部分取决于蜡质含量(图1i)。茎秆直立性试验表明,茎秆弯曲角度随N浓度的增加而逐渐增大,其中HN处理的弯曲程度最大;施加VLCFA后弯曲恢复,结合处理植株表皮蜡质含量测定结果,表面受N影响的茎弯曲部分依赖于蜡质含量(图1j-l)。
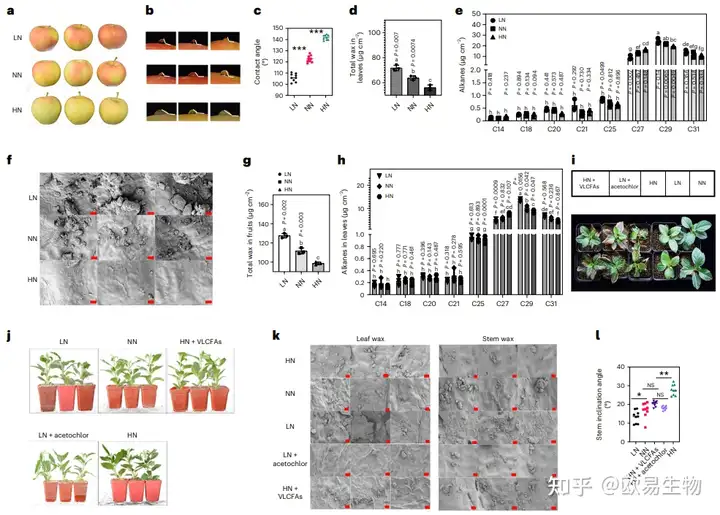
图1 N素负调控苹果中的蜡质积累
综上所述,基于受N含量影响的植株表型至少部分依赖于蜡质的积累。
2. MdBT2 通过MdMYB106负调控植物蜡质的生物合成
前人研究表明,BTB支架蛋白MdBT2的表达受N信号的诱导(图2a),基于此作者在苹果中研究了其潜在的机制,以确定N诱导的蜡质积累是否与MdBT2活性有潜在的联系。作者对antiMdBT2(抑制MdBT2基因表达的转基因材料)的叶片和果实蜡质形貌、晶体、含量和成分分析发现,GL3(WT)和antiMdBT2叶片的蜡质形貌相似,抑制MdBT2的表达增加了苹果叶片和果实中的总蜡含量(图2c-e);
然后通过GC-MS进一步分析蜡质成分发现,与GL3相比,antiMdBT2叶片和果实中大多数烷烃含量增加(图2c、e);最后对antiMdBT2、MdBT2-OE(MdBT2过表达材料)和GL3苹果幼苗叶片中的蜡晶体、含量和成分进行分析,结果与苹果树叶片和果实相似。这些结果表明,MdBT2负调控苹果中的大多数蜡成分。接下来作者检测了MdBT2-OE、WT和antiMdBT2叶片中蜡相关基因的表达发现,MdBT2过表达显著抑制了促进蜡生物合成的基因的表达,如结构基因MdACBP1、MdCERs等;总之,这些结果表明,MdBT2可以通过调节蜡质合成相关基因表达来负调控苹果蜡质含量。
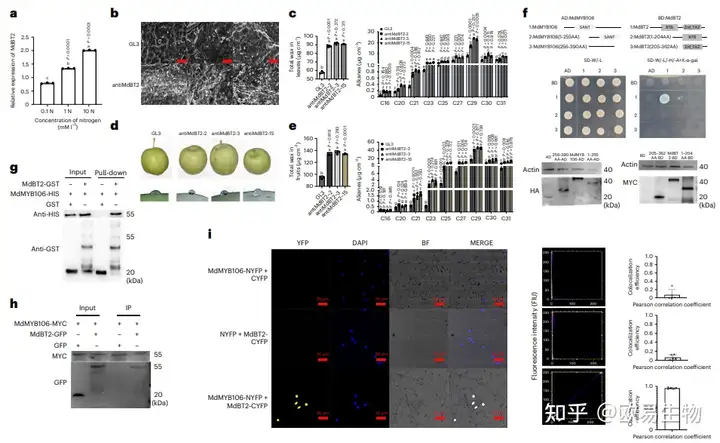
图2 MdBT2通过与MdMYB106互作来负调控蜡质的生物合成
作者通过Y2H筛选发现与MdBT2相互作用的蛋白MdMYB106,根据它们的基因亚结构和结构域将这两个基因划分为多个片段,其中MdMYB106分为两个片段,MdMYB106(1–255AA)(包含SANT官能团),MdMYB106(256–390AA)(缺乏SANT官能团),MdBT2分为 MdBT2(1–204AA)(包含BTB-BACK结构域)和MdBT2(205–362AA)(包含TAZ结构域),分别构建重组载体并利用Y2H检测其相互作用,同时采用蛋白质印迹法检测不同酵母菌株中的蛋白质水平,结果表明,全长MdBT2和全长MdMYB106之间存在较强的相互作用。
3. N素通过MdBT2-MdMYB106途径来调节苹果蜡质含量
作者将MdMYB106基因分别在烟草和拟南芥中瞬时过表达,经过人为干旱胁迫后测定相关生理指标后发现,与对照(WT)相比,过表达MdMYB106植株的蜡质含量和耐旱性明显提高,基于此,作者采用病毒诱导的基因沉默(VIGS)方法测试了MdBT2和MdMYB106在调控蜡质积累方面的功能。
将构建的载体侵染到苹果果实中获得5种瞬时转化果实:antiMdBT2-TRV+MdMYB106-IL60、MdBT2-IL60+MdMYB106-IL60、antiMdBT2-TRV+antiMdMYB106-TRV、MdBT2-IL60+antiMdMYB106-TRV和IL60+TRV。观察苹果表皮颜色发现,MdBT2负调节植物中花青素的积累(图3a);蜡质含量和水滴分析表明,MdBT2-IL60 + MdMYB106-TRV果实的蜡质含量最低,水滴与果实表面接触角最大,antiMdBT2-TRV + MdMYB106-IL60果实的总蜡含量最高,接触角最小(图3b-d)。
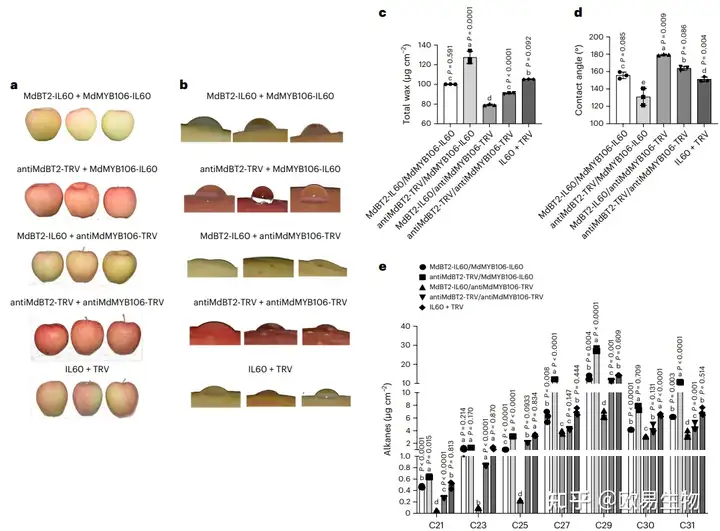
图3 MdBT2通过调节MdMYB106的表达来影响苹果蜡质的积累
为了阐明N含量是否通过降低MdMYB106的蛋白水平来负调控蜡质合成,作者首先在用HN、NN和LN处理的叶片中测定MdMYB106的基因表达水平发现MdMYB106基因表达随着N浓度的增加而降低,表明N影响MdMYB106的转录(图4a)。为了排除N对基因表达的影响,采用不同N浓度处理35S::MdMYB106-MYC过表达的苹果愈伤组织,在LN、NN和HN条件下MdMYB106表达水平并未发生显著变化(图4b)。随后对MdMYB106蛋白水平进行检测发现MdMYB106的蛋白含量随着N浓度的增加而显著降低,表明N通过降低MdMYB106的蛋白水平来负调控蜡质的合成(图4c)。
为了进一步阐明该过程是否依赖于MdBT2,作者通过无细胞降解试验在蛋白质水平上研究MdBT2和MdMYB106之间的关系,先获得35S::MYC(对照)、35S::MdBT2-MYC(MdBT2-OX)和MdBT2-Anti转基因苹果愈伤组织,从每条品系中提取总蛋白,与MdMYB106-His混合,22°C孵育0、2、4和6 h后通过抗His抗体的蛋白质印迹显示,MdBT2-Anti提取物中的MdMYB106蛋白质降解速度比对照提取物和MdBT2-OX提取物慢得多;添加MG132(蛋白酶体抑制剂)后,三种混合物中MdMYB106蛋白的降解率均较低,表明MdBT2通过26S蛋白酶体途径促进MdMYB106的降解(图4d、e)。综上所述,N通过MdBT2介导MdMYB106蛋白的稳定性来负调控蜡质的积累。
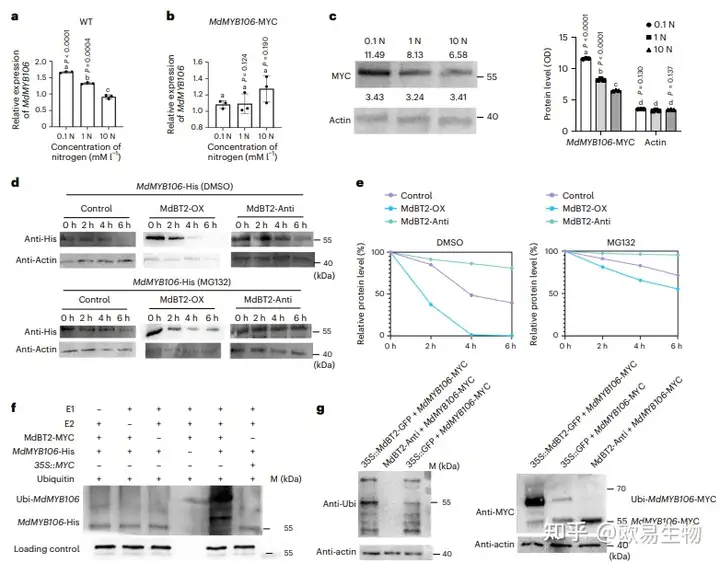
图4 MdBT2通过26S蛋白酶体途径介导MdMYB106的泛素化和降解
4. MdMYB106与MdCER2和MdCER2L1的启动子相互作用
为了明确MdMYB106参与调控蜡质合成的下游基因的表达,研究了MdMYB106过表达苹果愈伤组织中参与蜡质合成相关基因的表达水平发现,在MdMYB106过表达的苹果愈伤组织中,大多数蜡质相关基因差异上调,其中最显著上调的基因有:MdCER2、MdCER2L1、ECERIFERUM6(MdCER6)、ECERIFERUM10(MdCER10)和β-酮酰辅酶A合成酶 (MdKCS1),这些基因的启动子中都含有MYB结合元件(图5a)。进行EMSA试验验证发现MdCER2和MdCER2L1启动子是MdMYB106的潜在靶标(图5b)。
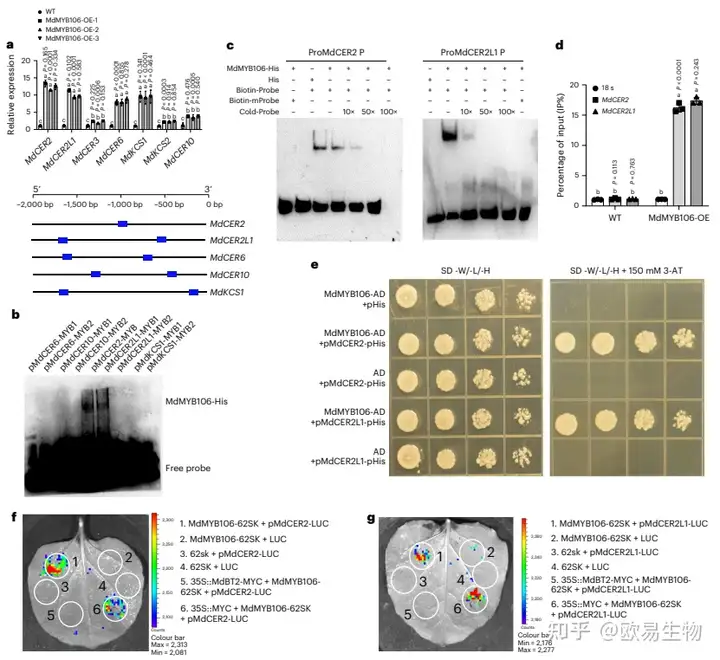
图5 MdBT2调节MdMYB106介导的MdCER2和MdCER2L1转录
由于MdCER2和MdCER2L1包含序列相同的 MYB 结合位点,作者将MYB顺式作用元件从TAACTG突变为CCGACT,并使用未标记的探针与生物素标记的探针进行竞争实验,结果表明,MdCER2和MdCER2L1启动子上MYB结合元件的突变消除了与MdMYB106的结合(图5c)。接下来,作者通过Y1H和ChIP实验测定证实MdMYB106能够与MdCER2和MdCER2L1启动子结合(图5d、e)。此外,作者通过荧光素酶测定分析进一步证实MdMYB106能够与MdCER2和MdCER2L1启动子结合,且在添加MdBT2时能够显著降低两种反应的荧光强度(图5f、g)。
综上所述,MdBT2抑制MdMYB106与MdCER2和MdCER2L1启动子相互作用,从而抑制MdCER2和MdCER2L1的表达。
5. MdCER2L1通过与MdCER6互作将VLCFA从C28扩展到C30
基于前人的研究,CER2与CER6共同参与C28以上VLCFA的合成,在这篇文章中,作者通过表型验证实验发现N处理后的苹果中C28以上VLCFA的含量显著增加(图1e、h),在D-LUC和Co-IP测定分析中发现MdCER2和MdCER2L1都能够与MdCER6互作(图6a)。为进一步阐明CER2和CER2L1对VLCFA合成的影响,作者分别构建了MdCER2和MdCER2L1的突变体∆fae,并采用GC–MS检测VLCFA的含量及组成,结果表明,单独表达的MdCER2和MdCER2L1均不能显著促进C30 VLCFA的合成;同时表达MdCER6和MdCER2L1使C30 VLCFA的含量显著增加;同时表达MdCER6和MdCER2时,C30 VLCFA的含量不变(图6b)。
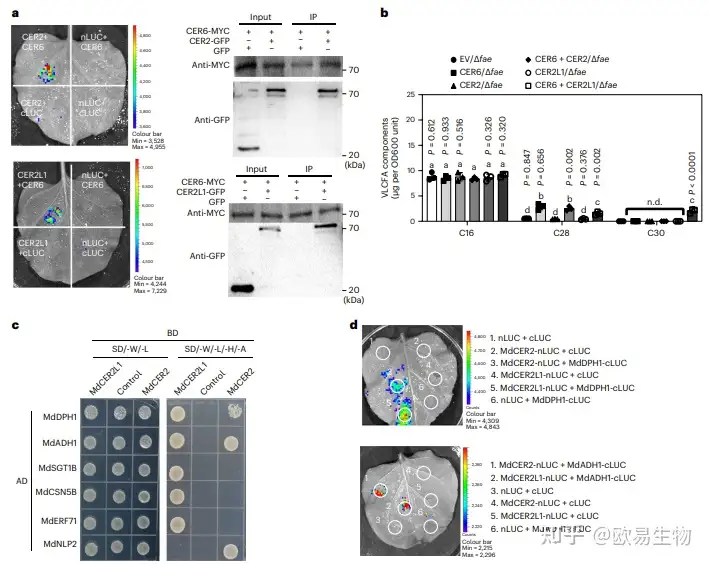
图6 MdCER2和MdCER2L1的作用机制研究
为进一步阐明MdCER2和MdCER2L1的调控机制,作者通过Y2H文库筛选发现MdCER2和MdCER2L1都能与MdDPH1和MdADH1互作,通过D-LUC实验验证发现MdCER2和MdCER2L1与MdDPH1和MdADH1之间分别存在相互作用,表明MdCER2和MdCER2L1的功能相似但彼此独立发挥作用(图6d)。
研究结论
在这篇文章中作者发现,HN水平能够诱导MdBT2蛋白的表达,该蛋白与MdMYB106蛋白相互作用,这种相互作用会抑制MdMYB106与MdCER2L1启动子的结合,从而抑制内质网中C28到C30 VLCFA的合成。然而,在LN和NN条件下,MdBT2蛋白的表达被显著抑制,阻止了MdMYB106的降解,因此,MdCER2L1的功能不受抑制,C28 VLCFAs可以正常合成为C30。
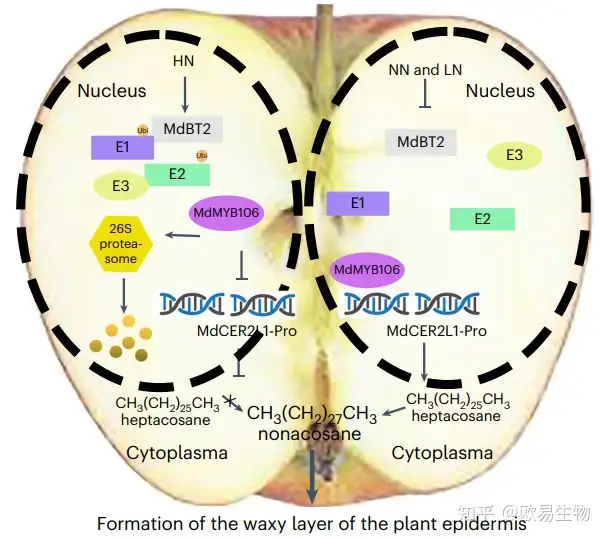
图7 苹果中N介导的蜡质生物合成模型
山东农业大学李媛媛教授为本文的通讯作者,山东省农业技术推广中心高文胜研究员参与了该研究工作。该研究得到了山东省自然科学基金省优秀青年基金项目(ZR2022JQ14),国家万人计划青年拔尖人才项目,国家自然科学基金(32072539),泰山学者青年专家项目,山东省青年自然科学基金项目(ZR2022QC112)的资助。






