根合成的次生代谢物是食品、植物源性药物和饮料中重要的品质成分。然而,单细胞水平上关于根特异性次生代谢的信息在很大程度上仍未被探索。茶氨酸是茶叶中一种重要的品质成分,它主要是在根中合成的,然后从根转运到地上部新梢中。
近期,安徽农业大学茶树生物学与资源利用国家重点实验室张照亮团队在eLife (IF=7.7)在线了题为“Root-specific secondary metabolism at the single-cell level: a case study of theanine metabolism and regulation in the roots of tea plants (Camellia sinensis)”的研究论文,该研究在单细胞水平上对茶氨酸代谢和调控提供了新的见解,并为研究其他植物系统中的根特异性次级代谢提供思路。
欧易生物提供10×Genomics单细胞转录组测序服务。
发表期刊:eLife
影响因子:7.7
涉及的欧易生物服务产品:10×Genomics单细胞转录组测序
单细胞样本情况:茶树(Camellia sinensis var. sinensis cv.Shuchazao)根尖区
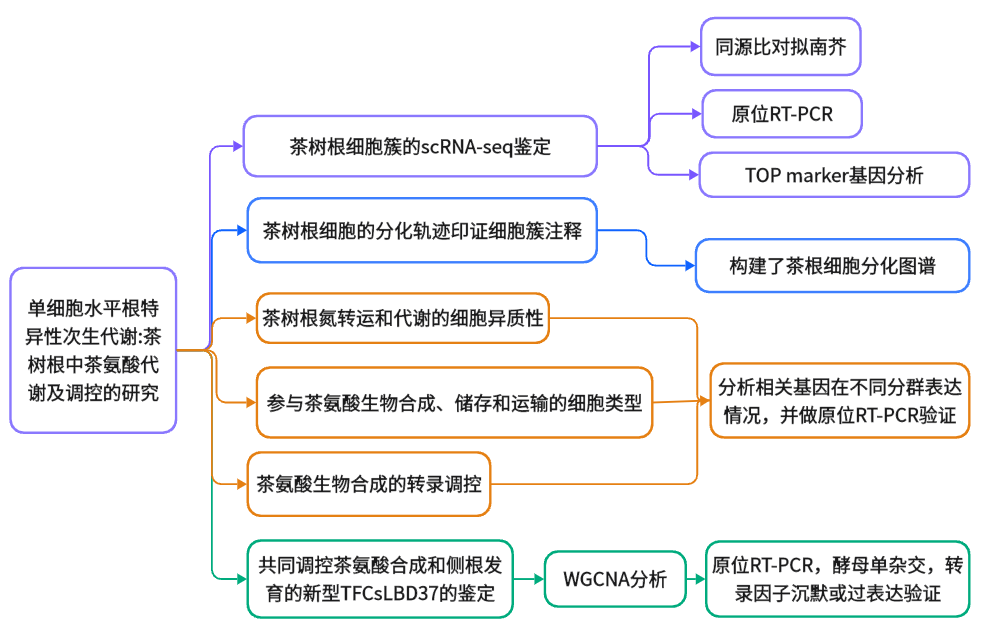
研究结果
1. 茶树根细胞簇的scRNA-seq鉴定
茶树根系可以合成和积累大量的茶氨酸(图1A和1B)。茶树根的细胞类型,包括皮层(Co)、木质部(Xy)、韧皮部(Ph)、形成层(Ca)、中柱鞘(Pe)、内皮层(En)、表皮(Ep)和根毛(RH)(图1C)。为了了解茶氨酸在茶树根部生物合成的细胞特性,作者从“舒茶早”茶树品种的幼苗根部(图1A)分离原生质体。使用10x Genomics平台(图1D)对这些原生质体进行scRNA-seq,并在细胞和基因水平上对测序数据进行预过滤。
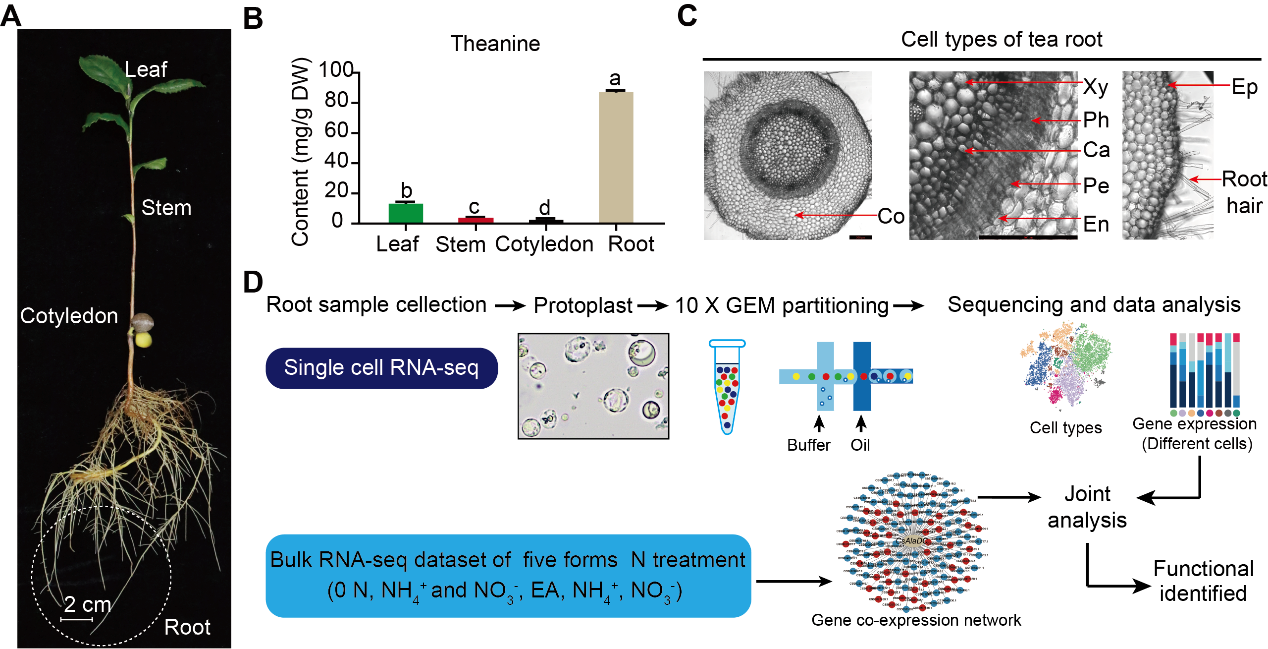
图1 茶树根系scRNA测序流程
质控后的细胞被分为8个细胞簇(图2A)。作者首先根据已报道的一些经典的细胞类型的Marker基因,通过同源比对,对细胞类型进行初步注释,这些Marker基因在多数物种中的功能较为保守。在簇2中检测到CsGL3转录本,表明表皮细胞的存在。CsSCR转录本主要在簇3和4中检测到,这表明皮层和内皮层细胞分裂发生在这两个簇中。在簇4中检测到CsAAP1转录本,表明该簇可能包含皮层或内皮层细胞群。在簇8中检测到CsLHW转录本,该细胞簇可能包含中柱鞘细胞群。在簇1和簇3中检测到高水平的CsWATI转录本,以及簇3中存在的CsIRX9转录本,说明这两个细胞簇可能为茶树根中维管系统或木质部相关细胞。在簇7中有大量CsPP2转录本的存在,这与韧皮部细胞位于簇7一致(图2B)。
为了确认这些细胞簇的注释,作者进行了原位RT-PCR实验。实验结果显示,上述基因在各自细胞类型中的表达与细胞簇的注释一致(图2C)。鉴于茶树中缺乏更多的Marker基因,作者接下来采用细胞簇富集的基因作为标记来注释细胞簇。作者分析了每个细胞簇表达水平Top 10基因的表达模式(图2D),如在簇3和簇5中有CsNRP1和CsTIM11的富集等。基于公共的单细胞数据库中其它物种同源基因的分析结果,作者将簇3和簇5分别注释为根尖顶端分生区SCN细胞和根冠RC细胞。
根据上述结果,簇1、2、4和7分别被注释为木质部、表皮、皮层/内皮层和韧皮部细胞(图2E)。此外,簇6被注释为原形成层或在分化过程中的过渡型细胞,簇8被注释为中柱鞘细胞,而簇3主要包含细胞分化的初始细胞群(图2E)。
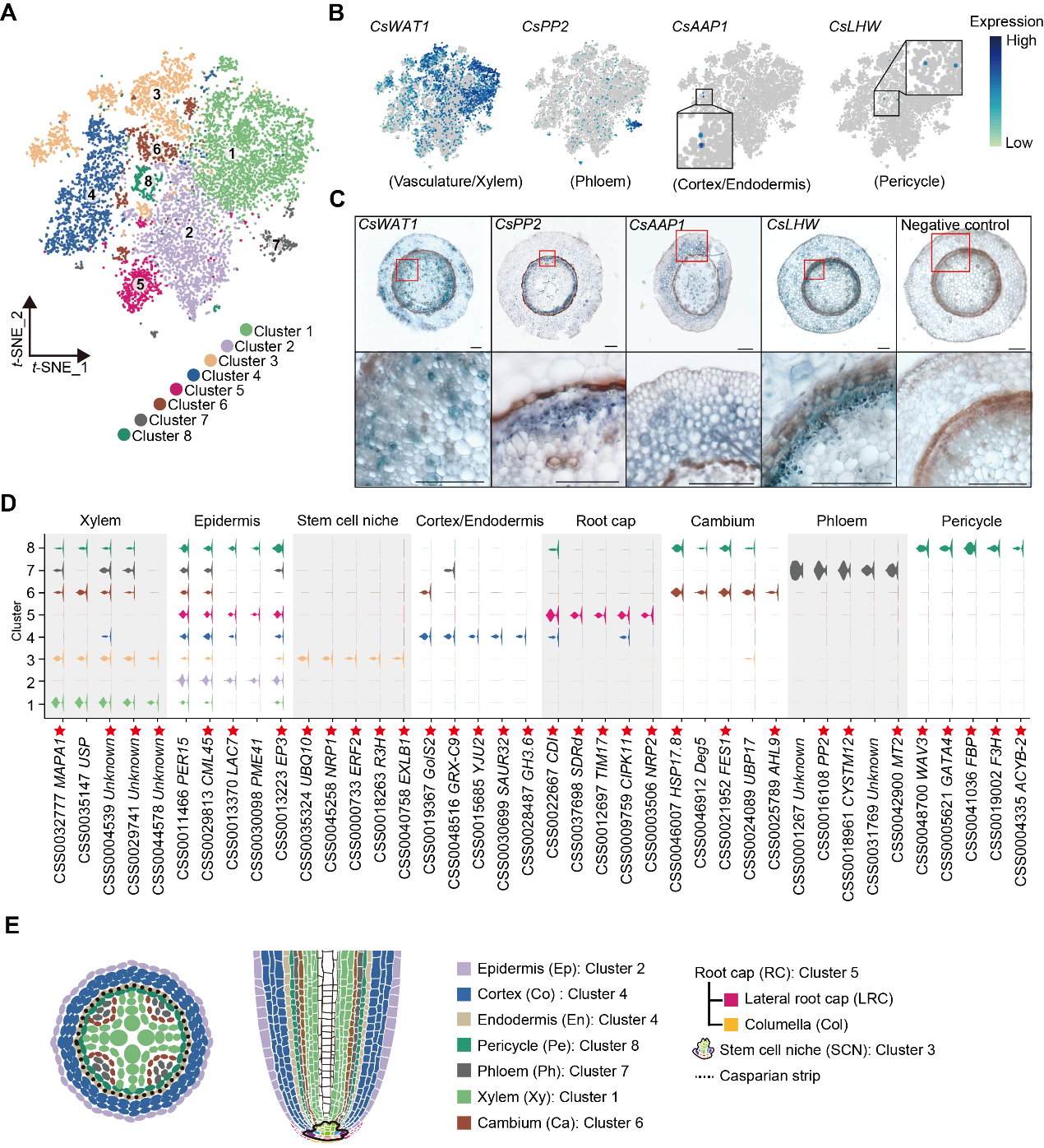
图2 基于scRNA-seq分析的茶树根系细胞簇标注
2. 茶树根细胞的分化轨迹印证细胞簇注释
进一步分析发现簇3可以分为4个亚细胞簇,包括静止中心(QC)、中柱初始(SI)细胞、皮层/内皮层初始(CEI)细胞和表皮/侧根冠初始(ELI)细胞(图3A)。接下来作者进行细胞分化轨迹分析,簇3(细胞分化的初始细胞群)主要位于分化轨迹的起点,并且这些细胞的分化轨迹分为两个主要分支(外细胞层和内细胞层)和一个次要分支(中间细胞层),如图3B所示。作者的伪时间分析结果与细胞簇的注释结果吻合。接着,作者构建了木质部和表皮细胞的分化热图(图3C),并对分化过程的差异表达基因做功能富集分析。差异基因富集的生物学过程与这些注释细胞簇扮演的功能角色相符。这些根细胞的分化轨迹分析进一步印证了细胞簇注释的合理性。随后,作者构建了基于单细胞测序结果的茶树根系图谱(图3D)。
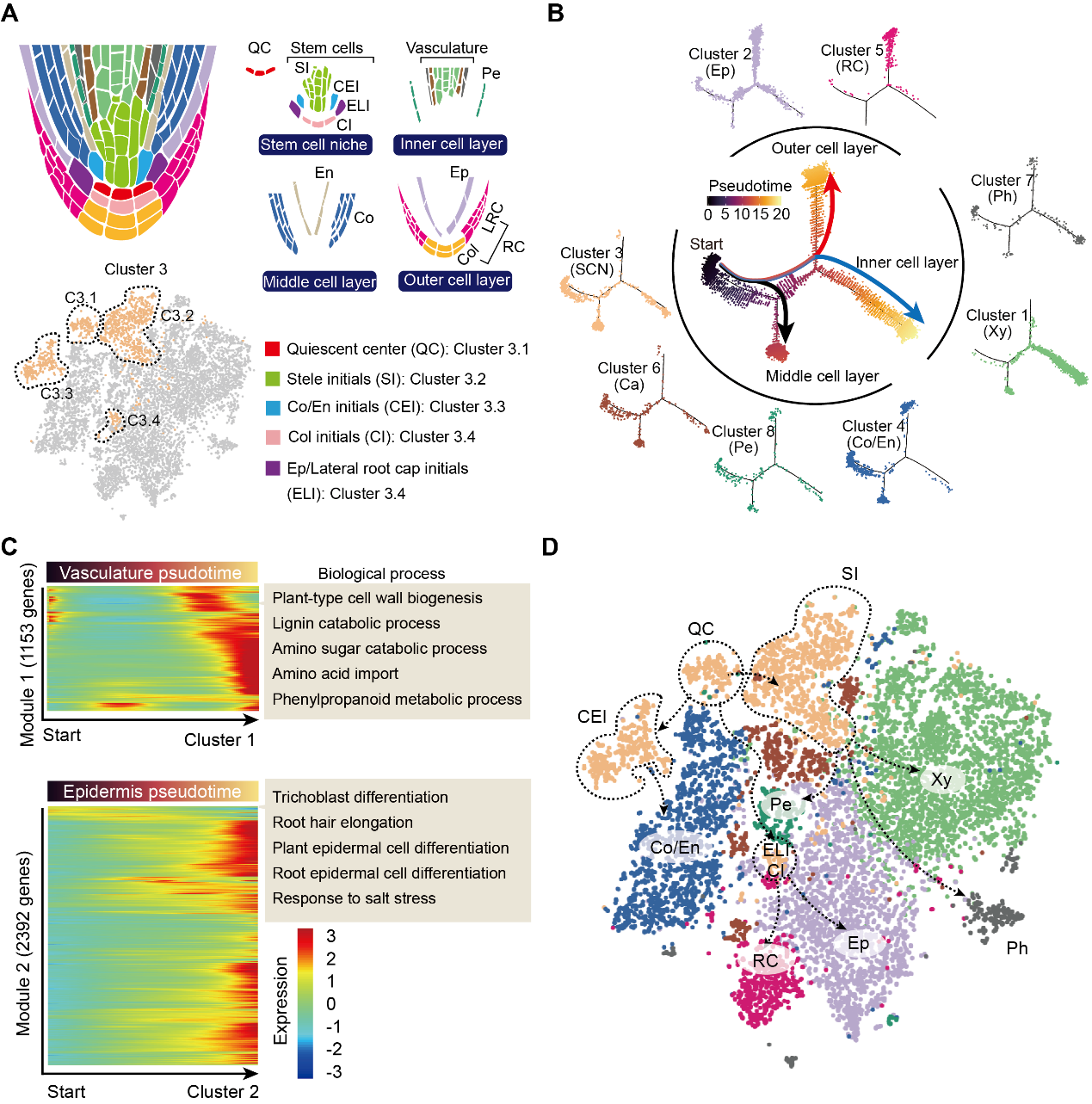
图3 茶根细胞分化轨迹
3. 茶树根氮转运和同化的细胞异质性
在茶树根中,茶氨酸约占游离氨基酸总量的60%~80%。氮(N)以硝酸盐和铵盐的形式被根系吸收,在根内运输,经氮同化过程并合成氨基酸。这些过程是茶氨酸生物合成的先决条件(图4A)。因此,作者通过分析scRNA-seq数据来研究这些过程的细胞异质性。
硝酸盐转运体(CsNRTs)和铵盐转运体(CsAMTs)介导茶树根系氮吸收过程(图4A)。相对表达热图显示,大部分CsNRTs和CsAMTs主要表达于簇4(皮层/内皮层),一些成员也在表皮(簇2)和中柱系统的细胞簇(簇6,7,8)表达(图4B)。而氮同化相关基因CsNRs和CsNiRs则主要在簇8(中柱鞘细胞)和簇1(木质部细胞)表达。同时,这些基因的原位RT-PCR结果证实了scRNA-seq结果(图4C)。这些结果与先前对拟南芥和水稻的同源基因的结果相似,并且也支持了茶树根中的氮同化主要发生在中柱细胞内的观点。
此外,作者发现在氨基酸代谢途径中,不同细胞簇合成氨基酸的能力也有所差异。与谷氨酸(Glu)代谢途径相关酶的编码基因在所有这些细胞簇中表达水平最高,与丙氨酸(Ala)代谢途径相关酶的编码基因表达水平也很高(图4D)。这些发现表明,Glu和Ala代谢途径是茶树根中主要的氨基酸代谢途径,为茶树根中能大量合成茶氨酸奠定基础。
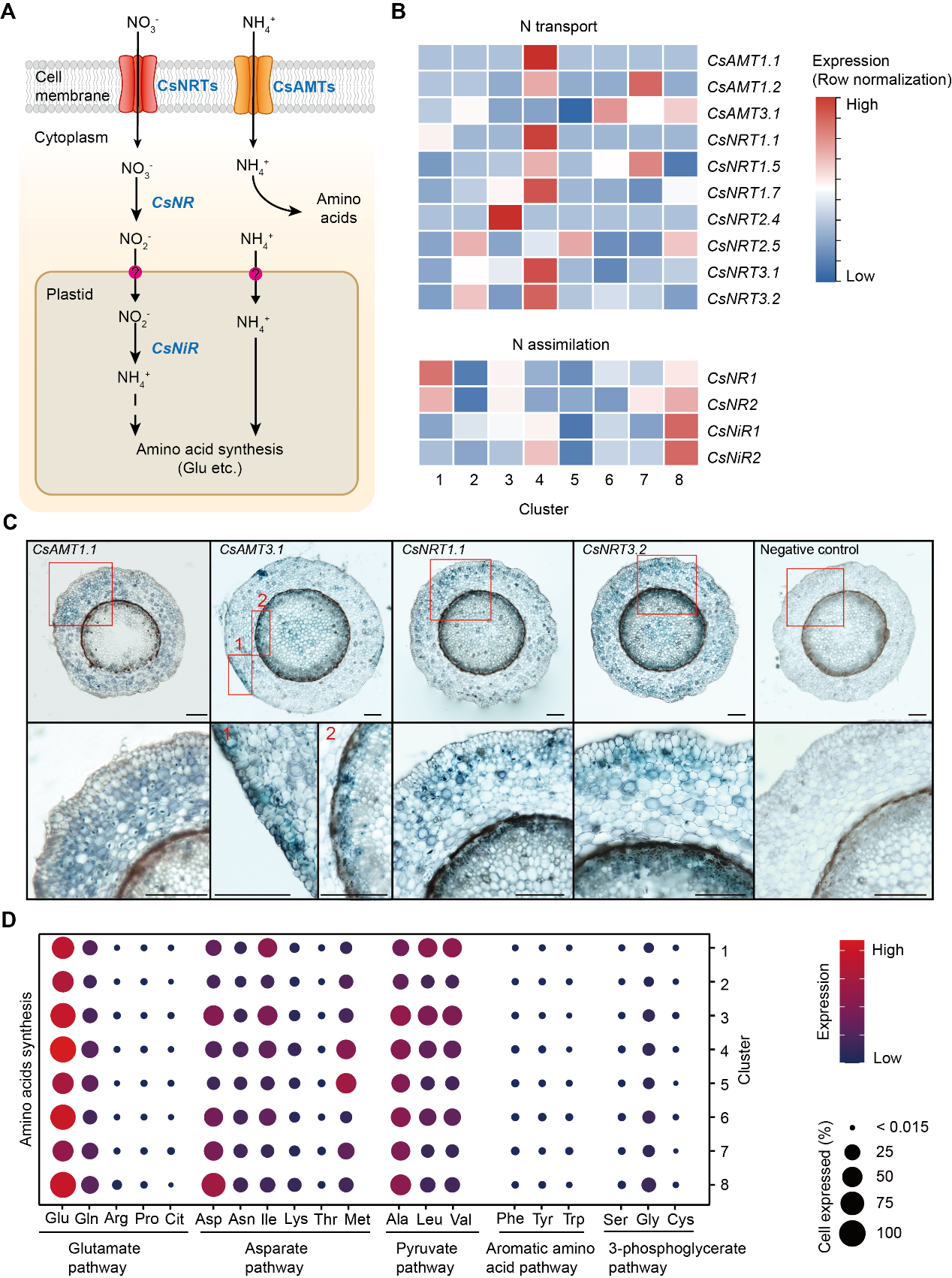
图4 茶树根中氮转运和同化的细胞异质性
4. 参与茶氨酸生物合成、储存和转运的细胞类型
先前的研究已鉴定了茶氨酸生物合成途径中关键酶、茶氨酸转运蛋白和调节茶氨酸生物合成的转录因子的编码基因(图5A)。这项研究中,作者进一步分析了这些编码基因表达的细胞类型。研究发现,尽管茶氨酸合成酶酶编码基因CsTSI在所有细胞簇中表达水平都较高(图5C),但它在簇8(中柱鞘)中的富集程度最高(图5B),原位RT-PCR分析也显示CsTSI主要在中柱鞘细胞表达(图5D)。同样,Glu生物合成基因(CsGOGATs和CsGDHs)在簇 8中也有较高的表达水平(图5B),但同Glu相比,茶氨酸在簇8中的生物合成更特异。
作者观察到CsTSI和丙氨酸脱羧酶(催化Ala产生茶氨酸合成前体乙胺)的编码基因CsAlaDC高表达的细胞簇不完全相同(图5B和5C),原位RT-PCR检测证实了这一点(图5D)。通过代谢途径相关酶的编码基因表达的细胞类型,可以推测乙胺主要在维管木质部细胞中合成,而茶氨酸在中柱鞘中合成活性更活跃。这些结果表明,茶氨酸生物合成途径具有多细胞区室化,可能通过合成前体和代谢物的细胞区隔,调控茶氨酸生物合成。
CsAAPs和CsCAT2最近被鉴定为茶氨酸转运蛋白。CsCAT2与CsTSI一样在簇8中表达最高,而CsCAT2在簇4中也有相对高的表达(图5B)。这表明液泡定位的CsCAT2可能在中柱鞘、皮层和内皮层中的茶氨酸储存中起作用。其他CsAAPs的表达也显示出高度的细胞簇特异性,表明这些CsAAPs在介导茶氨酸运输中具有细胞类型特异的特点。
5. 茶氨酸生物合成的转录调控
茶树根特异性表达的转录因子CsMYB6通过激活CsTSI表达促进茶氨酸的生物合成。作者发现CsMYB6在簇3、簇6和簇1中表达,而不是在簇8(CsTSI高表达的细胞簇)中表达(图5B)。在CsAlaDC的转录调控方面也观察到类似的情况。
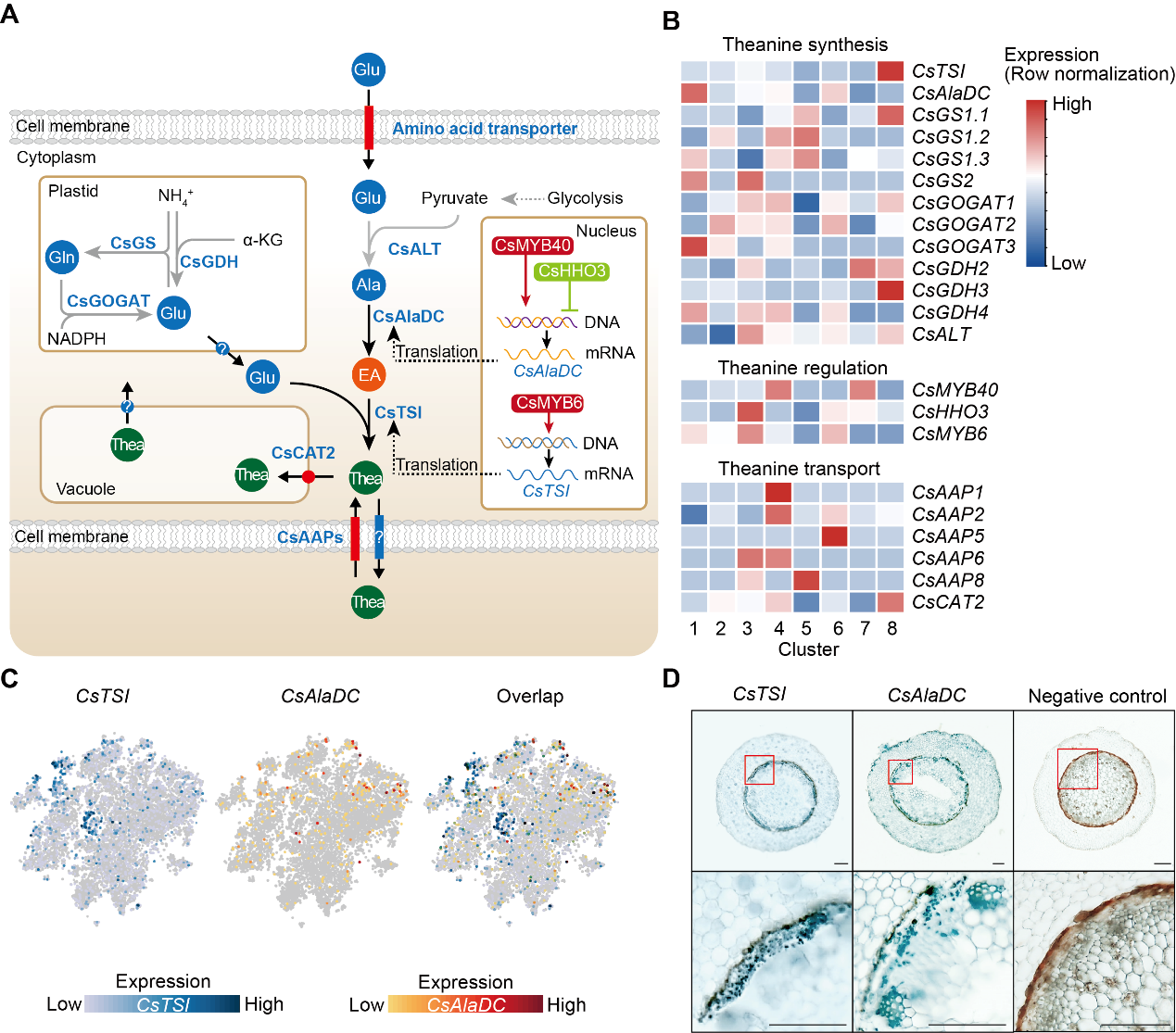
图5 茶树根系中茶氨酸合成、运输和调控的细胞异质性
基于这些发现,作者推测,对于茶氨酸生物合成的调节,转录因子(TF)和靶基因不一定总是在同一细胞簇中同时高表达。在茶氨酸生物合成途径中,CsAlaDC进化出了一种在茶树中特异的催化乙胺生物合成的活性,这对茶氨酸的生物合成至关重要。CsAlaDC在茶树根系中特异性高表达,其表达水平与不同茶树品种根系中茶氨酸含量高度相关,且受TF调控。因此,作者接下来以CsAlaDC的转录调控为例,分析了与CsAlaDC共表达的TF来验证这一假设。
6. 协同调控茶氨酸合成和侧根发育的转录因子CsLBD37的鉴定
作者使用先前获得的不同N形式处理茶树根的转录组数据,构建了包含133个基因的CsAlaDC基因共表达网络,分析了与CsAlaDC共表达的基因(图6A)。
基于茶树综合转录组数据,作者评估了这些CsAlaDC共表达基因的组织表达模式。鉴于CsAlaDC的表达具有根特异性,作者选择了34个根特异的共表达基因(RSCGs)进行进一步分析(图6B)。与CsAlaDC表达呈正相关的基因多数是由N诱导的,尤其是乙胺(EA),负相关基因多数是由0N胁迫处理诱导的(图6C)。然而,这些与CsAlaDC高度相关的基因中的大多数在簇1中没有高表达(图6D)。
在这34个根特异的基因中,有7个基因可能编码TFs (图6C)。其中CsLBD37 与CsAlaDC的正相关程度最高,受N诱导,在簇1中表达不高(图6C和6D)。已有的研究预测CsLBD38(本研究命名为CsLBD37)是一个高度可信的调节茶氨酸合成的TF,处于茶和非茶物种中茶氨酸相关调控模块(TARM)的进化节点。因此,CsLBD37可能调控茶树CsAlaDC的表达,且其细胞类型表达模式与CsAlaDC有所不同,可作为验证作者“假设”的候选转录因子。
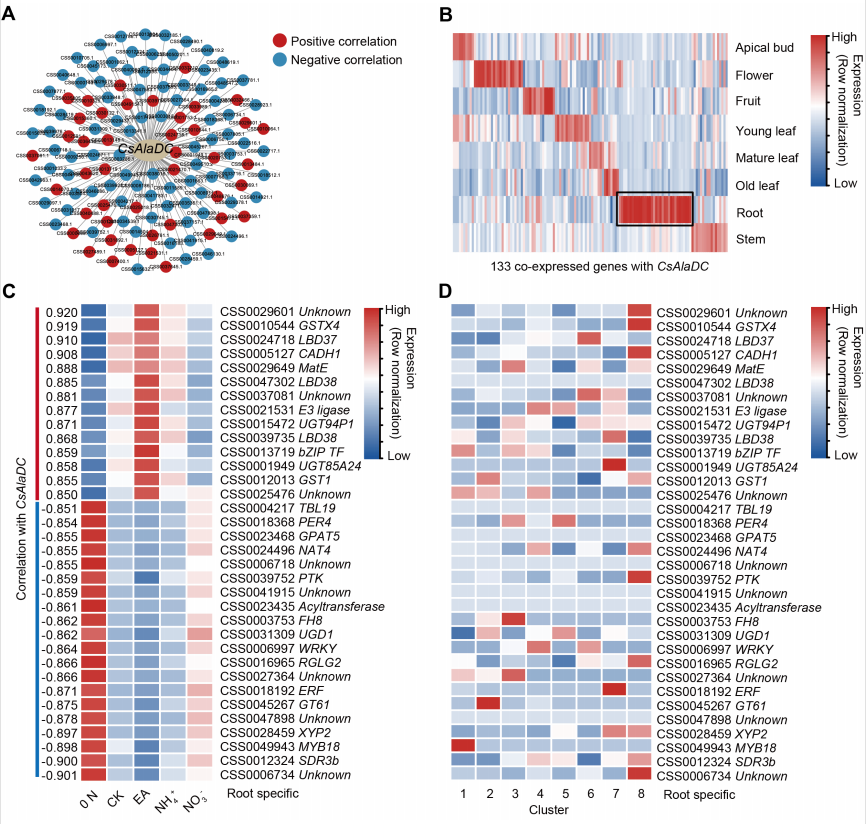
图6 基因共表达网络预测CsAlaDC的关键调控因子
作者首先确认了CsLBD37根中表达的特点(图7A和7B)。原位RT-PCR分析表明CsLBD37主要在形成层和中柱鞘细胞表达,与CsAlaDC的表达模式不完全相似(图5C和图7C)。亚细胞定位结果表明CsLBD37定位于细胞核(图7E)。酵母单杂交(Y1H),凝胶电泳迁移试验(EMSA)试验和CsAlaDC启动子-Luc试验表明CsLBD37直接结合并抑制CsAlaDC启动子的活性(图7F-H)。
为了检验CsLBD37是否能够在茶树体内抑制CsAlaDC的表达,作者进行了反义寡核苷酸(asODN)瞬时沉默(图7I)和过表达转基因毛状根的实验(图7K)。结果表明,在这些asODN处理的茶树根中,CsLBD37表达下调,CsAlaDC表达上调(图7I),而乙胺和茶氨酸水平升高(图7J)。相比之下,在CsLBD37过表达的转基因毛状根中,CsLBD37上调,CsAlaDC下调(图7K), 乙胺和茶氨酸水平降低(图7L)。这些结果支持了CsLBD37通过调控CsAlaDC表达来调节乙胺和茶氨酸合成。此外,作者推测CsLBD37可能作为“刹车”因子,在高水平N的情况下,将CsAlaDC的表达水平控制在一定范围内,以维持茶氨酸合成的稳健性,这或许是CsLBD37作为抑制因子而与CsAlaDC正相关的原因。同时,作者还阐述了CsLBD37在氮充裕条件下,协同调控茶氨酸生物合成和侧根发育。
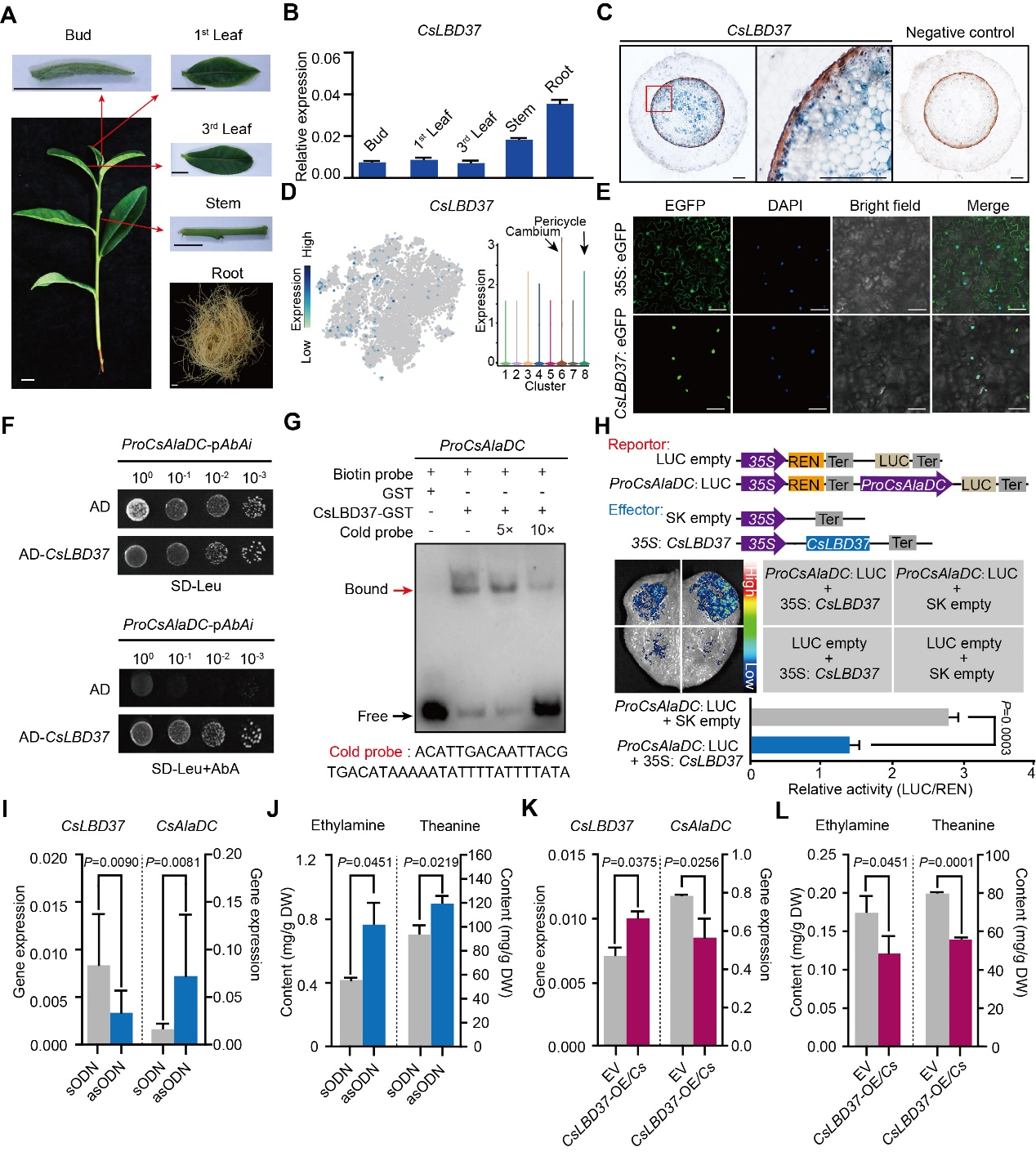
图7 转录因子CsLBD37调控茶氨酸合成
在这项研究中,作者提出了一个单细胞RNA测序(scRNA-seq)衍生的茶树根图谱,该图谱能够对谷氨酸和乙胺的代谢以及茶氨酸的生物合成、储存和运输进行细胞类型特异性分析。作者的研究结果支持了一个模型,即茶氨酸生物合成途径通过多细胞区隔发生,转录因子调控基因不意味着需要二者在同一细胞簇中同时高表达,这一点在随后CsLBD37对CsAlaDC的表达调控中得到验证。该研究在单细胞水平上对茶氨酸代谢和调控提供了新的见解,并为研究其他植物系统中根特异性次级代谢提供了一个例子。
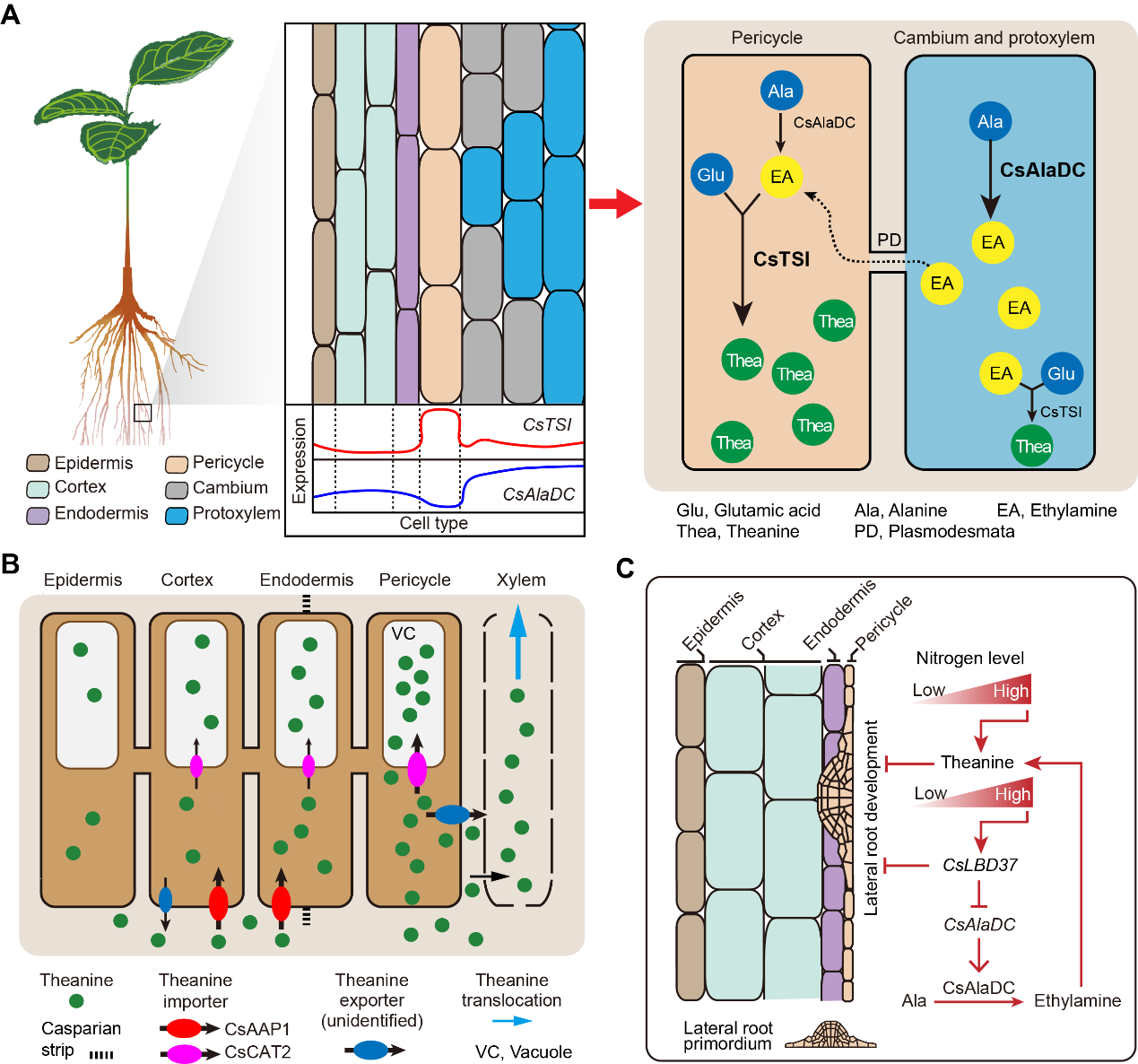
图8 单细胞分辨率下茶氨酸生物合成、运输和调控的模型
该研究以安徽农业大学为第一完成单位,茶树生物学与资源利用国家重点实验室博士生林世嘉和已毕业硕士张懿雯为本文的共同第一作者,张照亮教授为论文的通讯作者。安徽农业大学宛晓春教授、杨天元副教授、夏恩华教授以及来自美国加州大学戴维斯分校William J. Lucas教授也参与了论文的发表工作。






