代谢功能障碍相关性脂肪肝病(Metabolic dysfunction-associated steatotic liver disease,MASLD)是一种慢性肝脏疾病,包括一系列的脂肪变性、非酒精性脂肪性肝炎和纤维化。MASLD的全球发病率已超过25%,且目前尚缺乏有效的治疗方案。研究表明,饮食限制/节食(dietary restriction,DR)和袖状胃切除术(sleeve gastrectomy,SG)可以缓解脂肪肝的进展,但尚不清楚这些是否诱导了MASLD肝脏中不同的代谢或免疫学变化。
2024年8月,由留德学者刘寒旸博士主持,南京医科大学第三附属医院普外科、德国柏林夏里特医学院消化病中心、巴黎城市大学病理学实验室和美国杰克森实验室等国际团队合作开展的一项题为“Multiomics analyses decipher intricate changes in the cellular and metabolic landscape of steatotic livers upondietary restriction and sleeve gastrectomy”的研究成果在International Journal of Biological Sciences期刊(IF:8.2)发表。本研究通过空间代谢组学及单细胞/单核转录组以及人工智能算法模型等分析方法,揭示了DR和SG对于肝细胞空间分布特性的调控,并首次提出了SG通过髓系细胞浸润增强肝脏的代谢能力的概念。本研究为减重手术治疗MASLD提供了新的证据和研究思路。
欧易生物提供空间代谢组学及单细胞转录组服务与支持。

技术路线

研究结果
1.SG诱导体重减轻,同时降低了MASLD疾病的内源生物标志物
作者分析了18例接受SG的患者的BMI和血清学指标(图1A)。与SG前一日基线相比,SG后6个月患者的体重指数(BMI)、血糖等均显著下降,而总胆汁酸和纤维细胞生长因子有上升趋势(图1B-D)。这些数据表明,手术干预可以显著减轻患者的体重,并改善血糖、血脂等代谢指标,同时降低肝脏脂肪堆积和纤维化程度。而饮食限制也能有效缓解肥胖进程,但效果相对较弱。
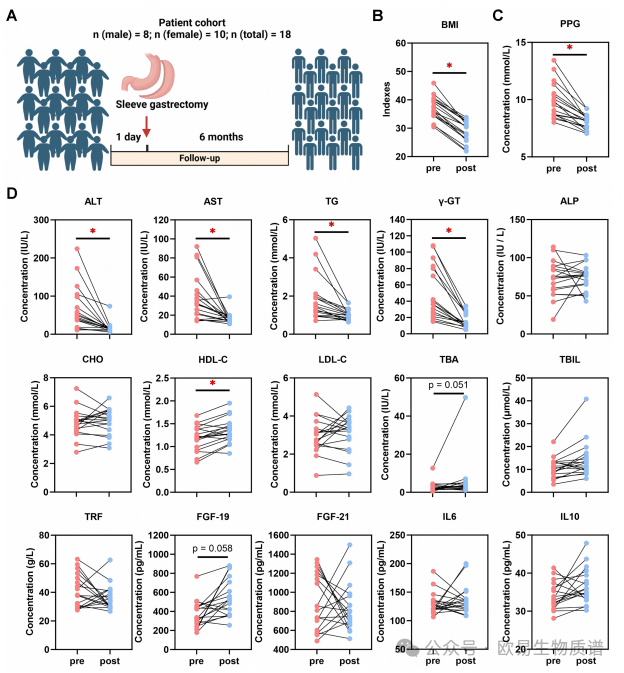
图1 袖胃切除术能减轻患者体重并改善MASLD
此外,该研究还发现男性患者在手术干预方面受益更大。这些结果为进一步探索肥胖相关疾病的治疗方法提供了重要参考。为了进一步研究肝脏对SG反应所涉及的细胞机制,作者使用高脂饲料喂养雄性大鼠来再现对肥胖相关的MASLD模型的干预(图 2A)。结果发现Sham + DR组和SG组大鼠在干预后的8周内体重增加较少。DR和SG显著抑制了大鼠在13至17周内的体重增加(图 2B)。血清的结果表明,Sham + DR可抑制低密度脂蛋白水平,但可提高高密度脂蛋白水平;SG可显著抑制总胆固醇、低密度脂蛋白等的水平,但可提高高密度脂蛋白等的水平(图 2C)。高脂喂养加剧了肝脏脂质积累,而DR和SG都能显著减少肝脏脂质积累(图 2F和G)。结果表明,DR和SG都能改善肥胖的进展、肝脏脂肪变性和纤维化,而SG是改善全身脂质代谢水平和胆汁酸产生的最有效干预措施。
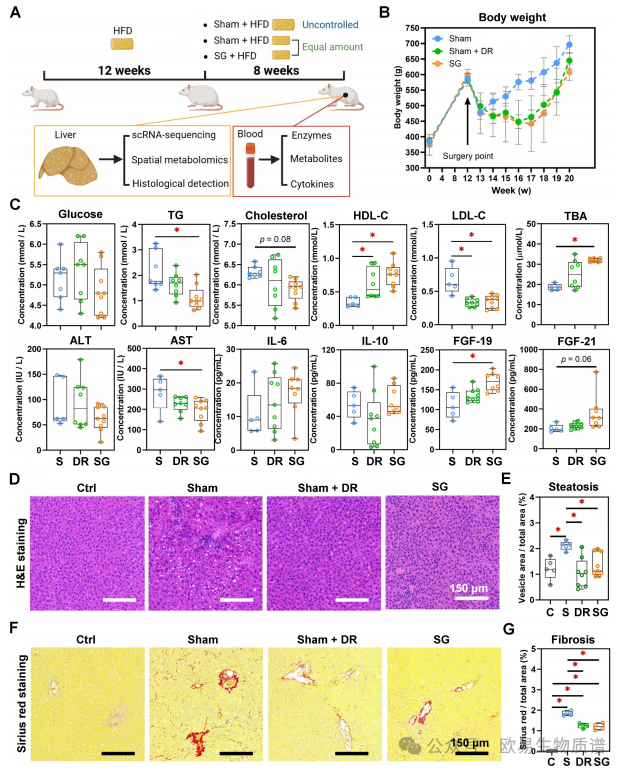
图2 袖状胃切除术和饮食限制可诱导大鼠模型体重减轻和MASLD改善
2.转录分析结果表明DR和SG术后肝细胞的代谢模式改变
为了研究限制饮食和袖状胃切除术对于肝脏组织和细胞的影响,作者使用sc/sn RNA测序分析对大鼠肝脏样本进行分析。结果发现,与sham组相比,Sham + DR组中NK细胞、B细胞、中性粒细胞和胆管细胞数量较多,导致肝细胞和肝星状细胞比例较低。相反,SG干预导致巨噬细胞比例增加,而DR导致NK细胞比例增加,但肝细胞和星状细胞(HSC)比例下降(图3A)。通过肝细胞及免疫细胞标志物发现,Sham + DR组和SG组中Pnpla3和Gcg的基因表达均被抑制(图 3B)。而与Sham + DR相比,SG组中Cyp2e1、Ppara和Nr1h4(在非肝细胞中)的基因表达增加(图 3C)。通过免疫组化实验发现,在Sham + DR组和SG组中PNPLA3蛋白显著下调,而SG组中表达PPARα的肝细胞增加(图 3D和E),从而证实了SG后肝细胞中蛋白质水平对有益代谢途径的深刻调节。

图3 根据sc/sn转录组表明袖状胃切除术可改善肝脏代谢
随后,作者比较了不同组中实质细胞(图 4A)和免疫细胞(图 4B)中的差异基因。并独创了彩虹图的可视化方法以展示肝脏中不同细胞类型在Sham + DR和SG作用下的转录组影响,即离原点越远的细胞类型受影响越大(图 4C)。结果显示SG对基因上调和下调影响最大的细胞类型是肝细胞,这意味着SG主要通过改变肝细胞功能来影响肝脏脂肪变性。

图4 Sc/sn 转录组分析显示了不同肝细胞中的差异表达基因
随后通过富集分析发现,脂肪酸降解相关基因的表达不仅在肝细胞中有所增加,而且在胆管细胞和内皮细胞(SG vs. Sham)中也有所增加。此外,在Sham + DR和SG的干预下,PPAR信号通路、脂肪酸降解和胆固醇代谢更加明显。而且PPAR信号通路在胆管细胞、内皮细胞和骨髓细胞群中得到了促进(图 5A)。此外,细胞通讯分析发现,与Sham不同的是,Sham + DR和SG都提高了中性粒细胞从免疫细胞接收配体的能力,而SG则提高了胆管细胞向其他细胞释放配体的能力。值得注意的是,与Sham + DR组相比,SG提高了非肝细胞实质细胞(胆管细胞、造血干细胞和内皮细胞)以及免疫细胞(主要是巨噬细胞和中性粒细胞)的相互作用水平(图 5B)。这些结果表明Sham + DR和SG均改善脂肪肝中的肝脏脂质代谢(PPAR相关过程),SG广泛触发肝细胞(包括肝细胞、胆管细胞、内皮细胞和骨髓细胞)的代谢增强。
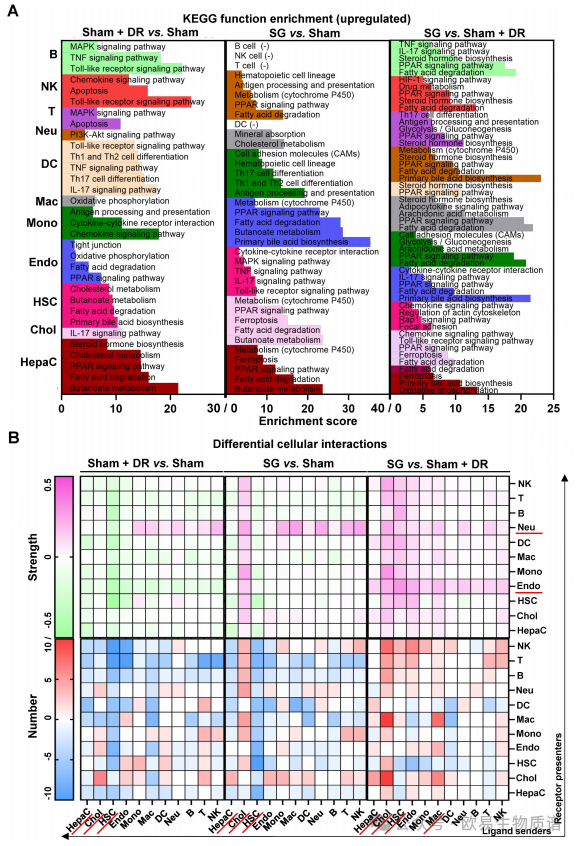
图5 Sc/sn转录组分析显示了不同肝细胞中上调的丰富通路和细胞相互作用
3.SG通过髓系细胞积聚促进肝脏代谢能力
为了探索肝脏的代谢景观,作者从Sham、Sham + DR和SG组中分别获取了3个代表性的新鲜大鼠肝组织样本,并使用空间代谢组学技术进行分析(图6A)。肝组织的形态特征以及空间分布的代谢物丰度显示,在进行DR或SG处理的脂肪肝中,总代谢物的产生显著减少,表明肝脏代谢活动得到缓解(图3B)。相反,基于不同上调代谢物的总丰度的功能富集分析揭示,与Sham组相比,Sham + DR和SG均增强了脂肪肝中的脂类代谢,可能减轻了肝脏中的脂肪性肝病。

图6 袖状胃切除术和饮食限制提高了脂肪肝的脂质代谢能力
与Sham+DR相比,SG显著提高了亚油酸代谢、脂肪消化吸收和胆固醇代谢的能力(图6C)。因此,本研究基于病理专家的细胞注释(肝细胞、淋巴细胞和髓系细胞)建立了一个深度学习模型进行病理切片图像分析(图7A)。根据该模型对总共18只大鼠肝脏样本中的肝细胞、淋巴细胞和髓系细胞的数量进行了评估。值得注意的是,不同干预措施下总肝细胞中肝细胞的比例没有显著变化(图7B)。在高脂饮食对照组中,与健康对照相比,淋巴细胞比例在Sham组中显著增加,但在Sham+DR和SG组中下降(图7B)。同时,SG增加了髓系细胞的浸润(图7B)。这些结果表明,SG可能通过增强髓系细胞的浸润来改善肝脏代谢能力和修复过程,但也增加了纤维化的潜在风险。

图7 袖状胃切除术促进了与肝脏髓系细胞浸润有关的脂质代谢

图8 袖状胃切除术会诱导髓系细胞的表型改变
SG大鼠肝脏中巨噬细胞的大量积累、体重增加以及代谢谱的改善,表明手术可以诱导髓系细胞驱动肝脏的修复。为了进一步评估肝细胞的表型变化,作者探索了一系列标记物的变化(图9A)。与Sham相比,SG显著上调了肝细胞中Pcna、Ppara等的表达。在Sham+DR和SG中,肝细胞和胆管上皮细胞中的Pcna表达以及HSCs中的Pdgfrb表达均下调。此外,使用细胞轨迹分析模型评估了细胞分化情况,结果表明表明Sham + DR和SG组中Pcna、Cyp2e1和Ppara的表达高于Sham组,而表达量随细胞轨迹的变化而明显变化(图9B)。CK7和白细胞介素(IL)-17A+细胞的免疫染色揭示了导管反应的发生,通常与肝纤维化相关。CK7+细胞因脂肪变性诱导而显著增加,而Sham+DR中则减轻(图9C和D)。同时,高脂喂养显著增加了IL-17A+细胞数量,但在Sham+DR和SG中没有增加(图 9C 和 D)。
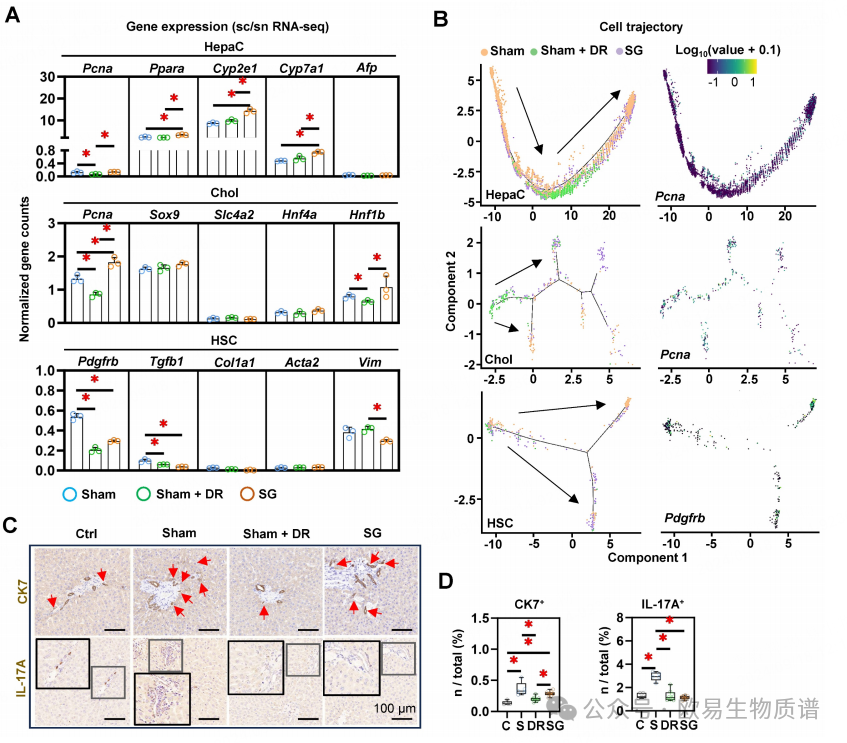
图9 饮食限制和袖状胃切除术c细胞和肝星状细胞的细胞分化
鉴于细胞轨迹明显,且表型标记表达各异,作者假设肝细胞亚型存在不同的特征性改变。因此,根据sc/snRNA-seq结果将肝细胞进一步分解成亚群(图 10A)。代谢相关功能富集分析显示了两个不同的组:代谢一组(Met1,包括cluster 6、7 和 10)富集了糖酵解、脂类和药物的代谢过程,而代谢二组(Met2,包括cluster 1、2、3、4、5、8和9)富集了脂肪酸的生物合成(图 10B)。而Met1组中有更多的门脉区肝细胞,而Met2组中有更多的中心区肝细胞(图10C和D)。细胞轨迹分析表明了这两个代谢组的明确分化状态(图 10E)。在Sham组和SG组中,门脉周围表型占肝细胞总数的15-20%,但在Sham + DR组中几乎不存在,这表明DR诱导了肝细胞的表型重塑(图 10F)。SG组肝脏组织中的增殖细胞(Ki67+)多于其他组,这表明SG有很强的肝脏再生潜力(图 10G)。CYP2E1和CYP7A1在Ctrl组、Sham组和SG组中更多地富集在中央区,但在Sham + DR组中分布均匀(图10G和H)。
此外,在Sham和SG组中,脂肪酸、胆汁酸和鞘脂代谢物的空间分布似乎富集在肝门周围区域,但在Sham + DR组中则分布广泛(图 10I)。总而言之,与SG相比,DR可能通过重塑肝脏代谢能力,表现为肝细胞的分区特征的改变,这可能会长远地影响脂肪肝的代谢和再生能力。
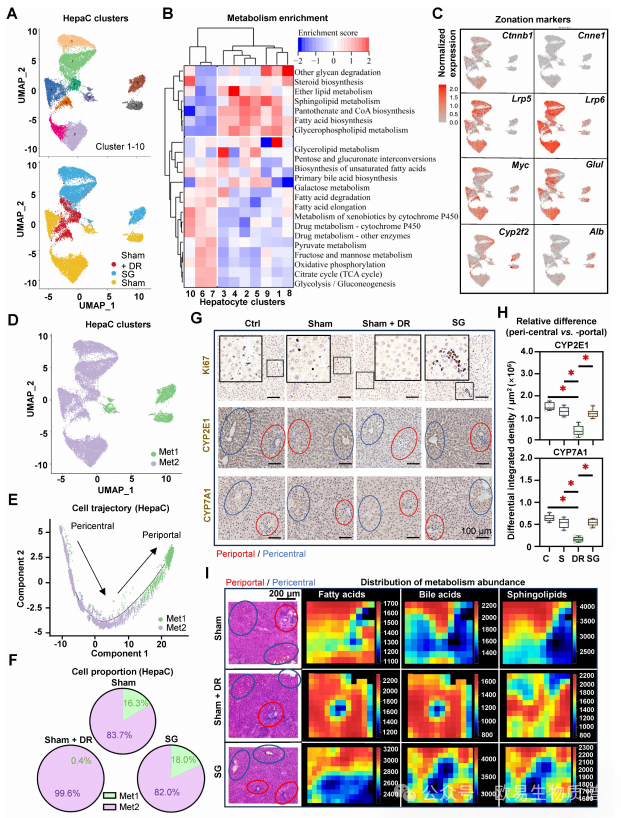
图10 饮食限制会损害肝脏周围细胞的分区特征
研究结论
总之,本研究利用多组学方法探究了手术治疗以及饮食限制在肥胖相关参数和肝脏脂肪变性方面的作用,SG改善了肥胖状态以及机体的糖脂代谢。DR和SG均减轻了大鼠的肝细胞脂肪变性和纤维化。并通过单细胞转录组和空间代谢组分析揭示了肝细胞和免疫细胞的脂质代谢增强以及肝区间液代谢变化的相关机制。在胆管上皮细胞、单核细胞、巨噬细胞和中性粒细胞中,SG广泛上调了脂质代谢。SG促进了肝脏中的髓系细胞积聚,,并使得浸润区域的肝脏代谢(脂质代谢等)能力增强。此外,该研究还强调了PPAR-α通路、胆汁和肝肠轴这些潜在的关键调控机制,对非酒精性脂肪性肝病的治疗提供了新的思路和方向。
小欧推荐
本研究利用多组学+人工智能算法等方法探究了减重手术以及节食对肥胖及脂肪肝治疗作用,揭示了肝脏髓系细胞浸润以及肝细胞区域特性调控这这条全新的机制。本研究为代谢功能障碍相关性脂肪肝病的治疗提供了重要证据和新的思路。






