前言
2024年10月15日,南昌大学第一附属医院消化科吕农华/祝荫教授课题组在Journal of Advanced Research在线发表了题为“Single-cell transcriptomic profiling uncovers cellular complexity and microenvironment in gastric tumorigenesis associated with Helicobacter pylori”的论文。通过单细胞测序技术构建了幽门螺杆菌引起的从胃炎到胃肠上皮化生再到胃肿瘤进展过程中的单细胞图谱,揭示了胃癌发展过程中的细胞异质性和组织生态的改变,为幽门螺杆菌诱导胃癌中不同细胞类型的分子机制提供了新思路。
南昌大学第一附属医院消化科李年双副研究员、陈思海主治医师和许鑫博博士为本文的共同第一作者,南昌大学第一附属医院消化科祝荫教授、刘健平研究员和吕农华教授为本文通讯作者,欧易生物为单细胞转录组测序及分析提供了技术支持。该研究得到国家自然科学基金、江西省主要学术学科和技术带头人、江西省杰青项目以及消化疾病江西省重点实验室的支持。

发表期刊:Journal of Advanced Research
影响因子:11.4
涉及的欧易生物服务产品:单细胞转录组测序
研究背景
幽门螺杆菌(Helicobacter pylori,HP)是一种能够在胃酸环境中生存的螺旋形细菌。自1983年被发现以来,研究表明其与多种胃肠疾病密切相关,尤其是慢性胃炎、消化性溃疡和胃癌。流行病学数据表明,幽门螺杆菌感染与胃癌的发生密切相关,尤其在高发地区。感染后,幽门螺杆菌可引发慢性炎症,导致胃黏膜的损伤和改变,进而发展为萎缩性胃炎、肠化生等前癌变病变,最后进展为胃癌。深入探讨与幽门螺杆菌相关的胃肿瘤发生机制,有助于了解胃癌的分子机制,发现更有效的诊断和治疗策略。
研究内容
本项研究中,作者采用单细胞转录组测序(scRNA-seq)解释胃癌的进展中细胞异质性和肿瘤的微环境变化,并发现肠细胞在胃肠化生病变中异常丰富,幽门螺杆菌阳性标本表现出丰富的细胞间通讯,具有显著的活性TNF信号网络。采用免疫荧光、免疫组化和qRT-PCR分析在其他胃组织队列进行验证,并对公共TCGA和GEO数据集进行生物信息学分析的验证。
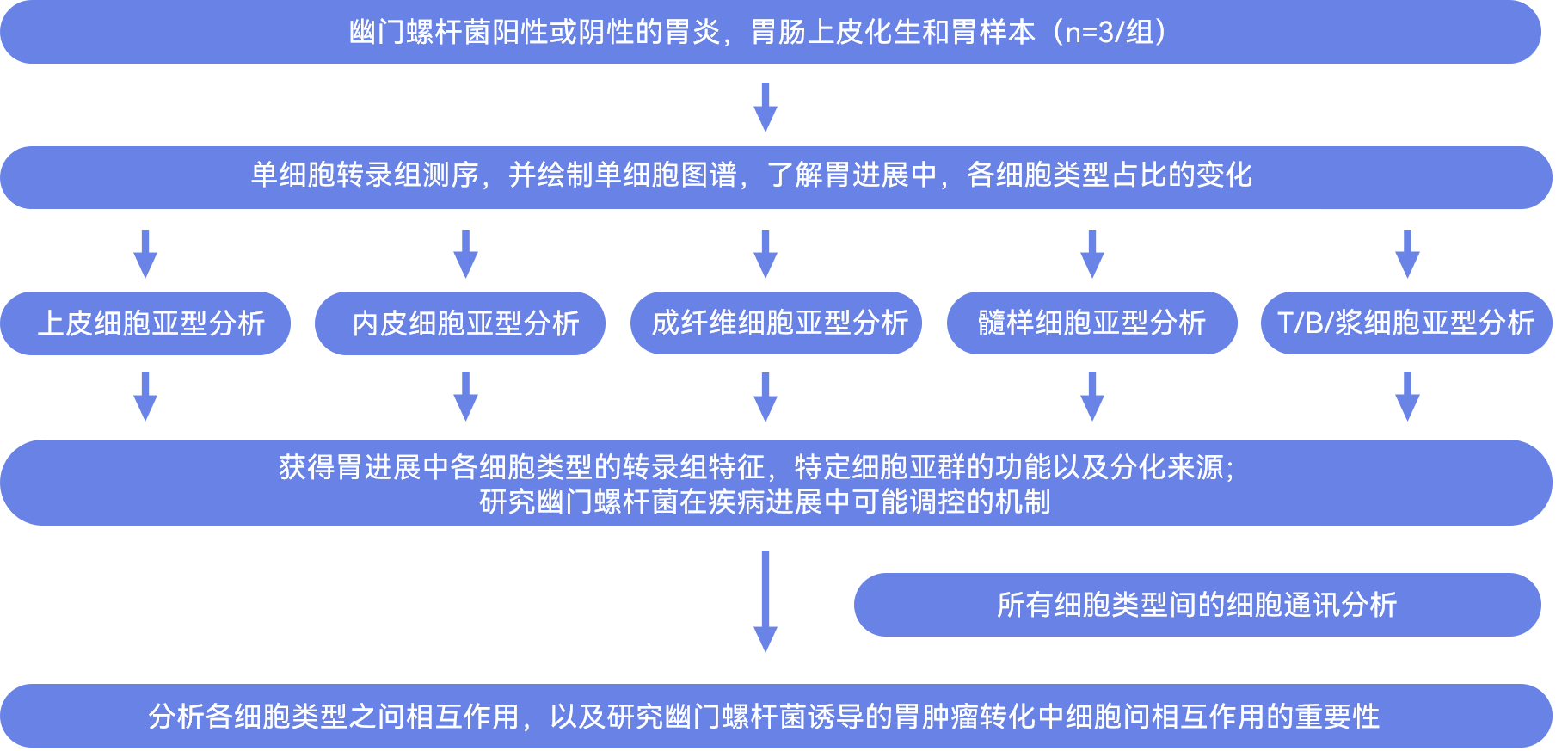
研究结果
1.scRNA-seq图谱揭示胃癌发生过程中的细胞异质性
作者收集了有/无幽门螺杆菌感染的胃炎(GS)、胃肠上皮化生(IM)和胃癌(GC)组织各三例,共18例样本,并采用scRNA-seq技术生成了一个包含18个样本的胃癌发生的单细胞图谱(图1A)。通过对GS,IM以及GC三组样本的细胞类型占比比较,作者发现胃癌进展过程中髓系细胞比例增加,上皮细胞比例减少(图1D)。而与未感染的组织相比,幽门螺杆菌感染的样本中上皮细胞的比例相对较低,而内皮细胞和髓样细胞的占比则相反(图1E)。并通过免疫组化实验,流式以及公共数据库验证上述变化(图1F-I,附图1H,I)。这些证据表明胃肿瘤发生过程中细胞组成显著改变,强调了肿瘤微环境中发生的动态变化。
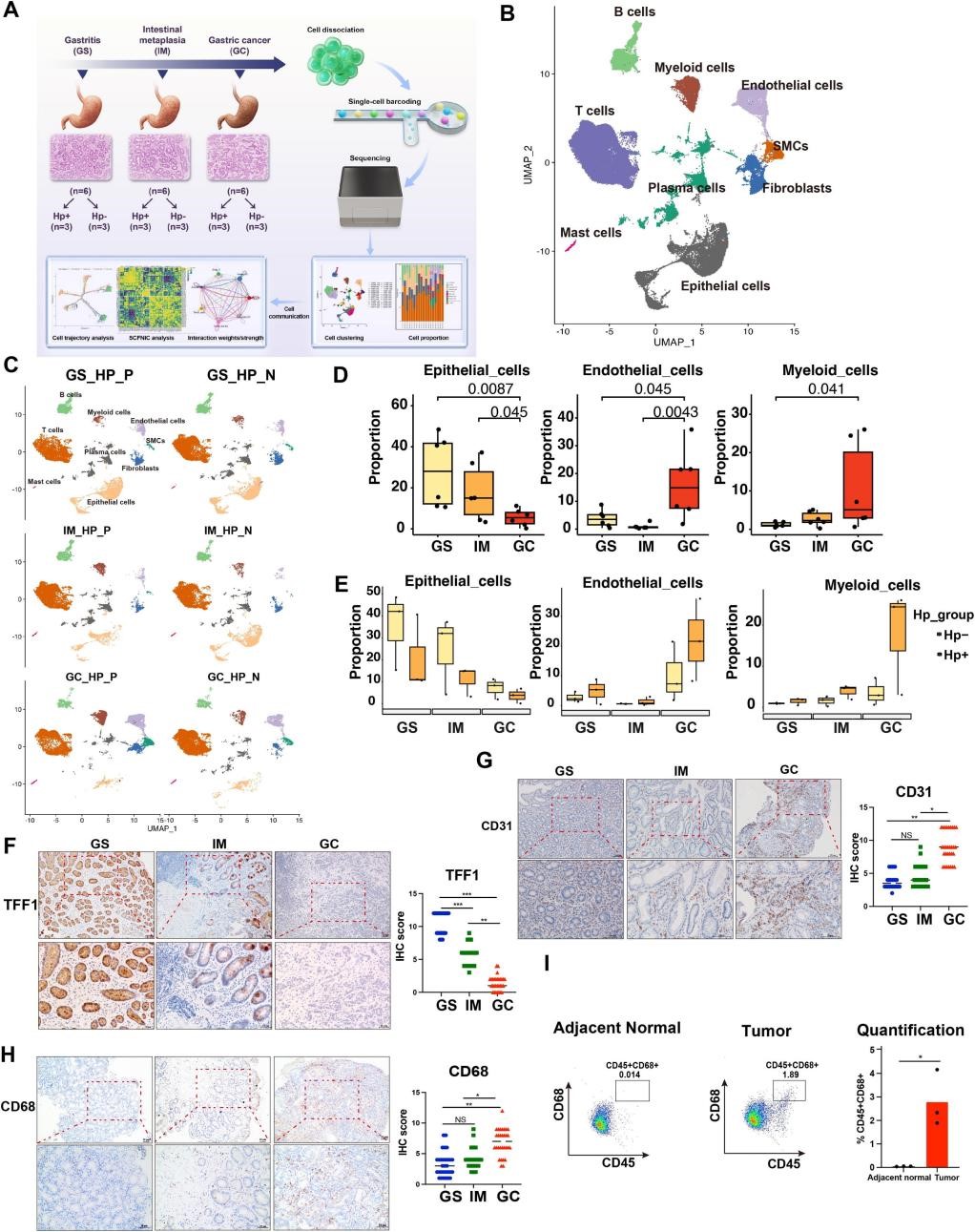
图1 | scRNA-seq图谱发现,在胃癌级联反应中,髓系细胞比例增加,上皮细胞比例减少
2.胃癌发生过程中上皮细胞的不同细胞谱系和转录模式
接下来,作者对胃癌进展中的的所有上皮细胞进行了无监督降维,来分析上皮细胞的谱系状态和转录变化,共出现了19个细胞群。作者将着19群细胞定义为8群(图2A、D),并用CNV评分区分上皮细胞中恶性与非恶性细胞,发现肿瘤样EPCs恶性程度最高(图S2D);并发现与GS或IM组织相比,GC组织,特别是幽门螺杆菌阳性亚组中的CNV评分显著升高(图2B)。胃肿瘤的发生过长中,内分泌细胞比例下降,而肿瘤样EPC在GC组织中占比显著增加;此外,研究还揭示了肠上皮细胞主要来源于IM组织(图2C)。拟时序分析和免疫荧光染色发现,肿瘤样EPCs可能起源于坑状黏液细胞(图2G,H)。后续功能分析和实验验证发现肿瘤样EPCs的上皮间充质转化功能被显著富集,且相关基因KRT17表达水平也显著升高(图2I-N)。这些数据揭示了胃癌发生过程中上皮细胞的多样性和不同的细胞状态,并强调了胃癌组织中丰富的肿瘤样EPCs的致癌转录组特征、功能特征和细胞起源的重要性。
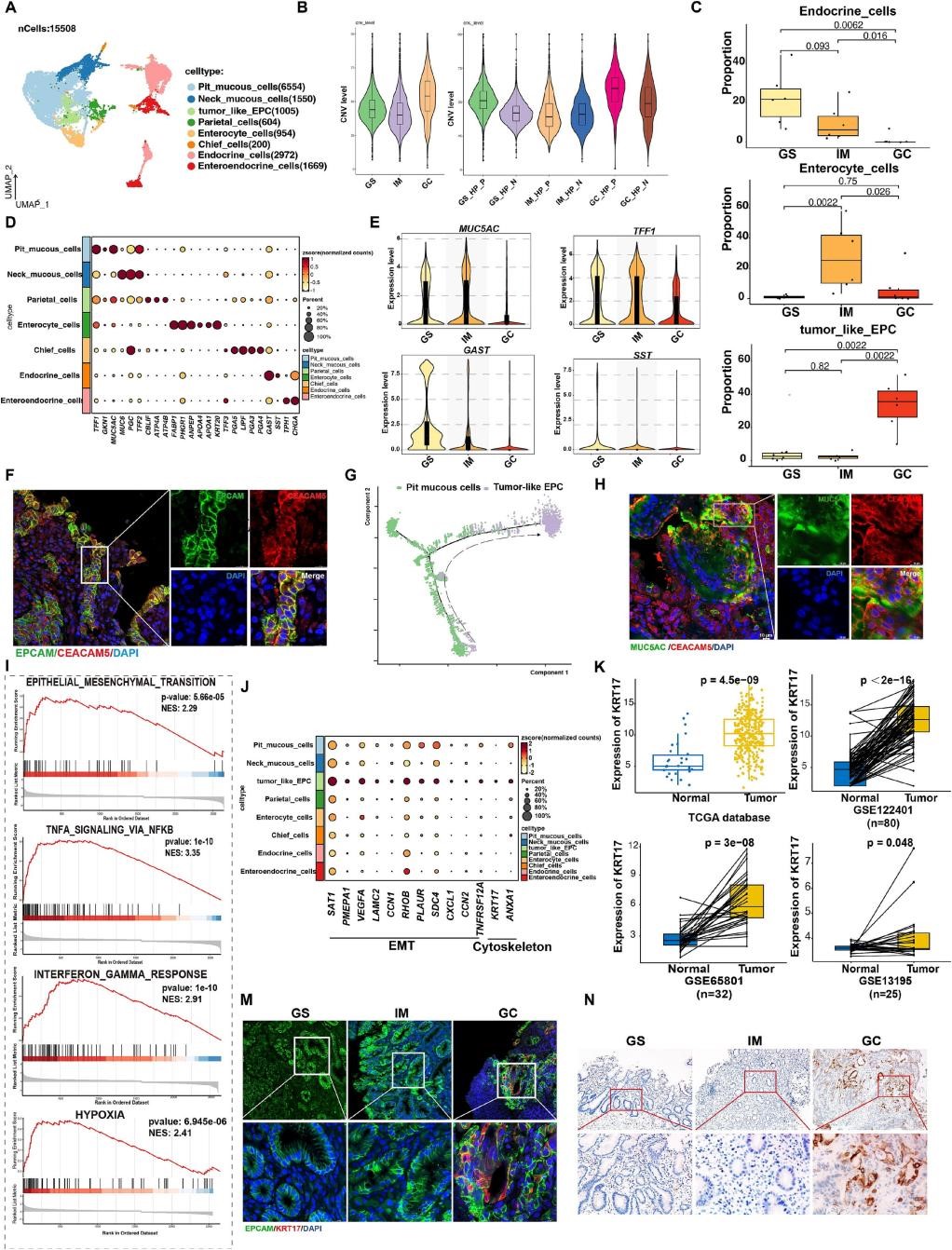
图2 |胃癌发生过程中上皮细胞的不同细胞亚型和转录模式
3.前病变IM中独特上皮细胞群—肠细胞
鉴于胃癌进展中肠细胞主要来源于IM胃组织中,我们针对该细胞群去深入研究,分析其转录模式和富集途径。研究发现与胃肠化生表型相关的基因CDX1和CDX2在肠细胞中特异性高表达,并针对肠细胞的DEGs功能富集,发现糖酵解和脂质代谢功能被显著富集,且通路相关的标记物也显著升高(图3A-H)。此外,SCENIC分析发现,HNF4G及其83个下游靶基因,在肠细胞内表现出特定的表达模式,IM样品中HNF4G水平升高(图3I-K)。这些发现揭示了肠细胞是恶性肠化生病变中不同的上皮亚谱系,而HNF4G是其特异性的转录调节因子。

图3 | IM中独特上皮细胞群—肠细胞的转录模式和功能分析
4.幽门螺杆菌感染引起胃组织中基因表达模式变化
免疫荧光共定位发现幽门螺杆菌偏爱定殖胃上皮黏液层内的窝细胞(图4A),作者鉴定上皮细胞中与幽门螺杆菌相关的DEGs,发现幽门螺杆菌阳性标本中与胃酸和消化酶分泌相关的基因表达减少,而化生病变相关基因和细胞外基质癌基因表达水平升高(图4B-I)。这些结果表明,这些基因可能参与了胃环境中幽门螺杆菌感染的发病机制,突出了它们在胃病理中的意义。
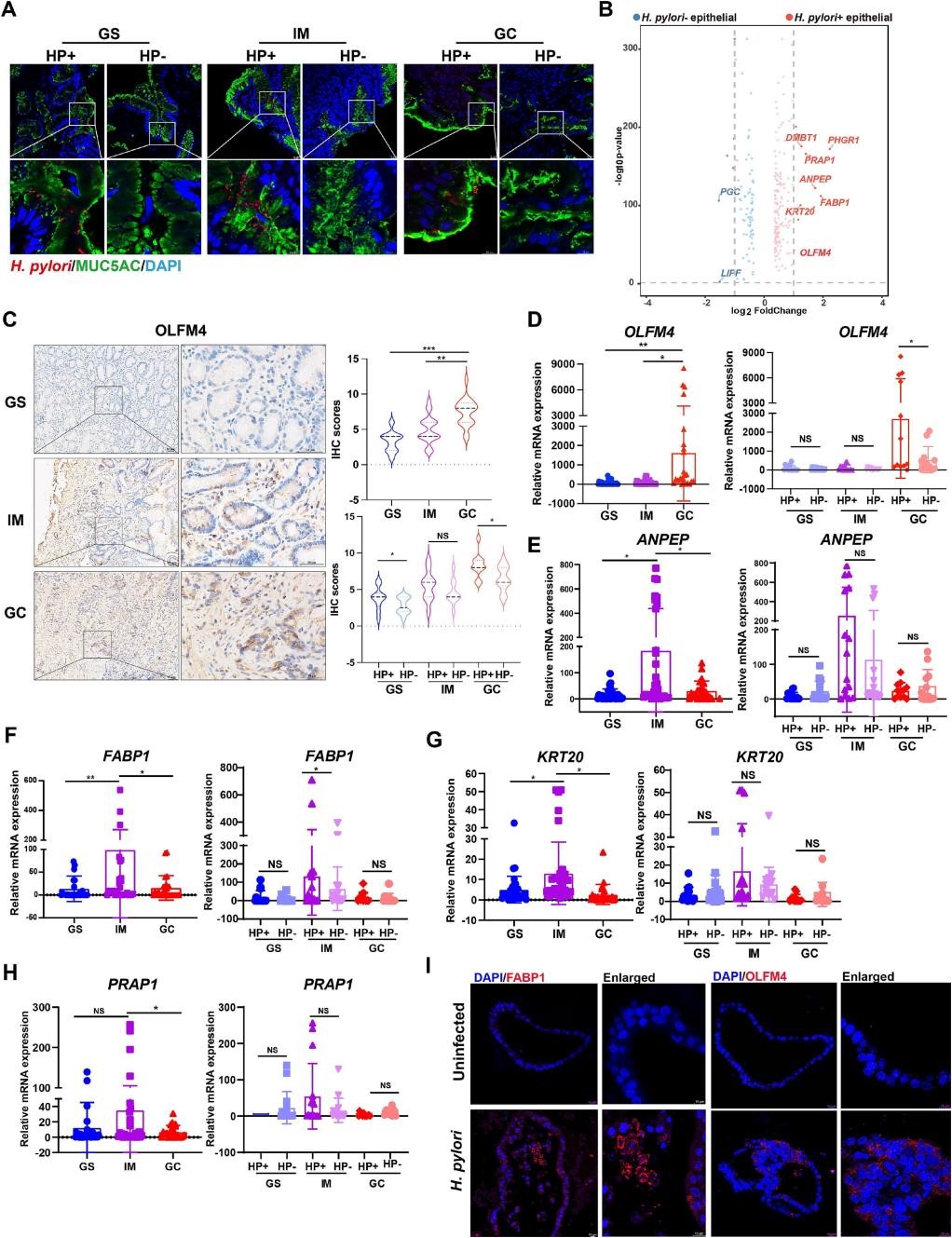
图4 | 幽门螺杆菌感染状态下上皮细胞转录组异质性的研究
5.ECs的亚型分析以及ECs-肿瘤样EPCs相互作用预测
作者对ECs进行无监督降维获得7个细胞群,并将其定义为6群细胞,其中包括一群在GC组织显著增加,且细胞外基质重塑基因高表达的细胞称为肿瘤样ECs(图5A-D)。肿瘤样ECs富集的通路与细胞粘附和PI3K/Akt信号通路相关(图5E,F),特别是在幽门螺杆菌阳性亚组中,这表明幽门螺杆菌感染在促进血管生成方面的潜在作用(图5G)。此外,研究还发现,ECs亚型与肿瘤样EPCs之间存在密切的相互作用,涉及到胶原和VEGF信号通路的激活,并结合公共数据库进行验证(图5I-J,图S5A-D)。总之,这些发现突出了GC组织特异性ECs的分子特征,并进一步揭示了ECs与肿瘤样EPCs之间可能参与胃癌微环境的潜在相互作用。
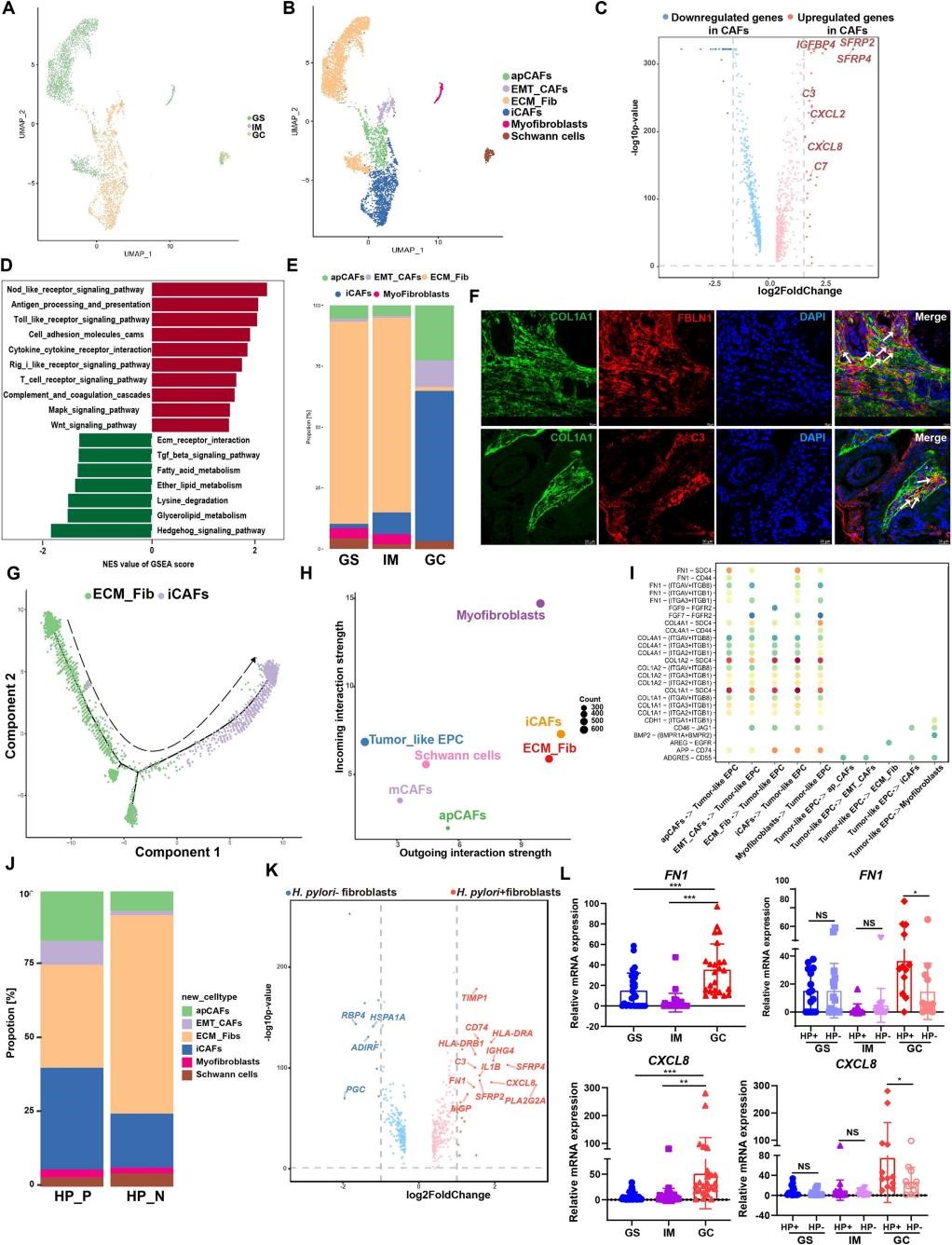
图5 | ECs异质性和ECs亚型-肿瘤样EPCs相互作用组预测
6.胃癌前和癌样中成纤维细胞亚群的特征
作者对成纤维细胞进行无监督降维获得11个细胞群,鉴定出3个癌相关成纤维细胞(CAFs)。功能富集发现,CAFs富含与免疫和炎症相关途径,补体级联和Wnt信号通路相关的基因集。研究还揭示了ECM_Fib亚群向iCAF亚群分化的潜在关系,并推断NFATC1在该过程中起调控作用(与6A-G)。这些发现强调了CAFs在塑造肿瘤免疫微环境中的关键作用。
7.预测成纤维细胞-肿瘤样EPCs之间的相互作用以及鉴定与幽门螺杆菌相关的成纤维细胞中的DEGs
CellChat分析显示成纤维细胞亚群,特别是iCAF,主要通过分泌更多的配体(如COL1A1、COL1A2和FN1)参与外向信号传导,相应的传入受体在肿瘤样EPCs中表达(图6H,I)。进一步针对幽门螺杆菌对成纤维细胞组成的影响研究,作者发现幽门螺杆菌阳性的胃标本中CAFs百分比增加,DEGs(如FN1, C3,IL1B,CXCL8和CD74)显著升高,尤其是幽门螺杆菌阳性的GC组织(图6J-L)。这些发现表明幽门螺杆菌感染可能通过激活FN1信号网络来驱动GC微环境中成纤维细胞和肿瘤样EPCs之间的相互作用。
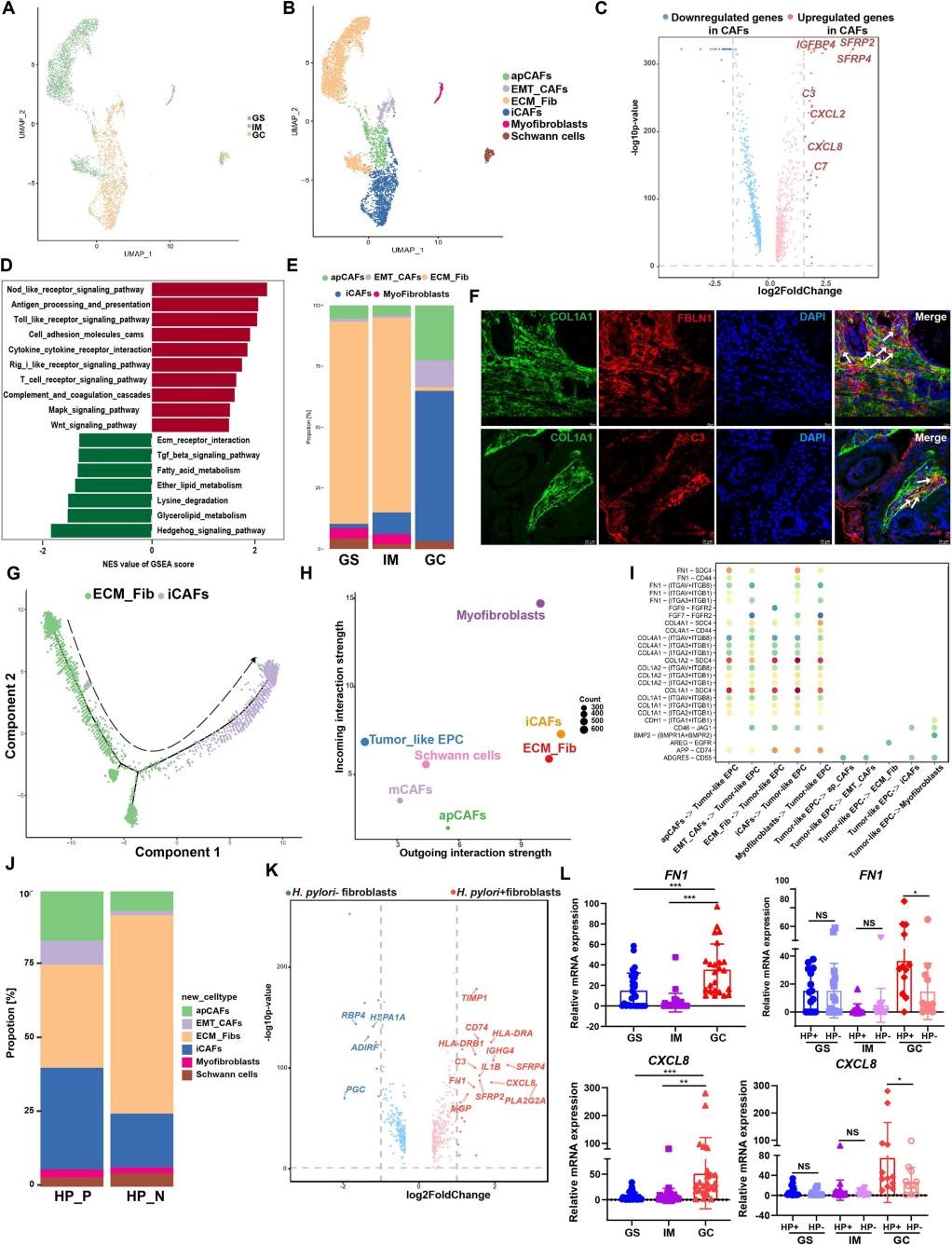
图6 | 幽门螺杆菌相关胃癌前和癌样中成纤维细胞亚群的特征
8.幽门螺杆菌相关胃癌发生中髓样细胞的组织特异性模式
作者基于细胞标志物将胃癌发生中的髓样细胞定义为5种细胞类型,并发现在幽门螺杆菌阳性的GC组织中髓样细胞数目总数显著升高。富集于GC组织中的巨噬细胞定义为肿瘤相关巨噬细胞(TAMs),表现出显性的M2样表型,在肿瘤微环境中具有免疫抑制作用,且来源于GS和IM组织中的巨噬细胞(图7A-F)。进一步针对幽门螺杆菌对髓样细胞的影响研究,幽门螺杆菌阳性组织的髓样细胞显示CXCL3、TIMP1、CD14和CTSL基因的高表达,并用公共数据库和实验数据进行验证(图7G-L)。这些研究结果表明幽门螺杆菌对髓细胞中特异性基因具有调控作用。
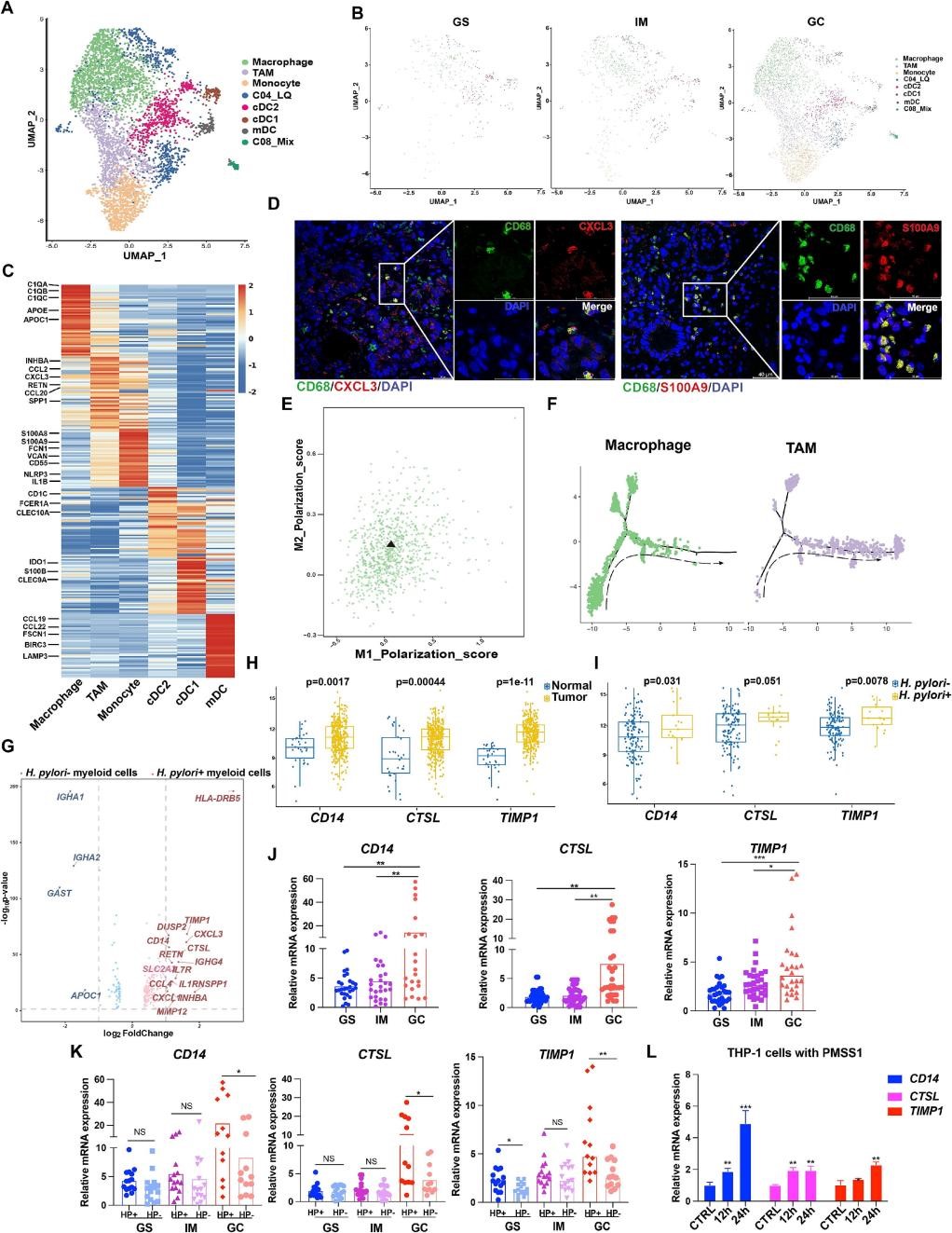
图7 | 幽门螺杆菌相关胃癌发生中髓样细胞的组织特异性
9.T、B细胞和浆细胞聚类及亚型分析
作者对免疫T细胞和B细胞分别进行无监督聚类,获得14个T细胞亚群和6个B细胞亚群。其中Treg细胞在GC中富集,且与不良预后相关。作者还发现,CD4 + T细胞起源于CD4_IL7R细胞,分化为CD4_PDCD1和CD4_Treg细胞,证实IL7R在naïve状态下的持续表达对于所有T亚群的维持和发展至关重要;对于CD8 + T细胞,作者发现GC组织中CD8_MKI67亚群的显著富集,证实T细胞在肿瘤中具有增殖功能(图8)。B细胞和浆细胞的亚群分析,发现IgA + 浆细胞在GS/IM中高度富集,而IgG + 浆细胞亚群在GC样品中富集,尤其是幽门螺杆菌阳性组织中(图S9)。这些发现提示T、B细胞和浆细胞在幽门螺杆菌相关胃肿瘤中潜在的功能作用。
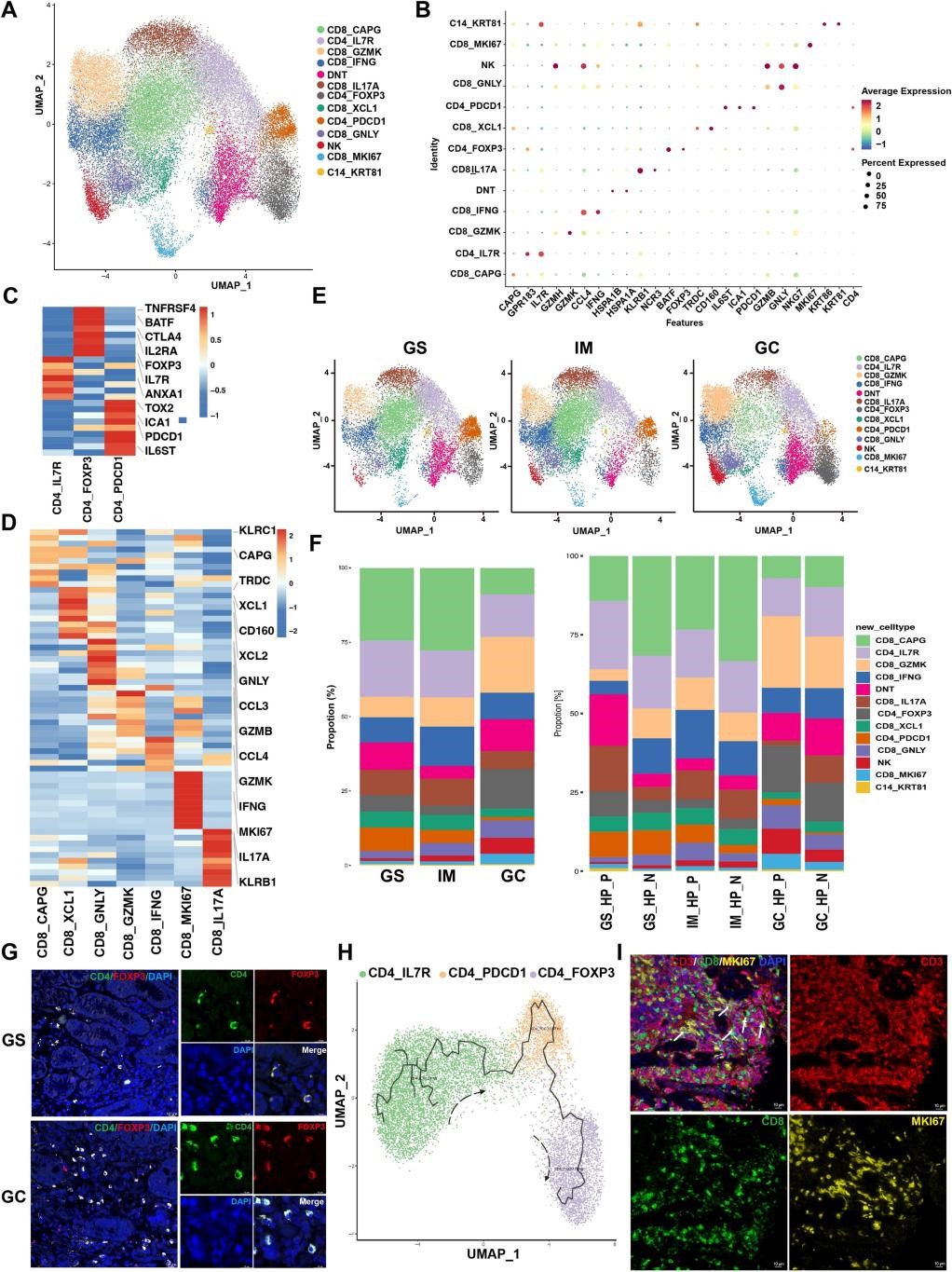
图8 | T细胞亚型的表征
10.多细胞通信网络塑造幽门螺杆菌驱动的致癌微环境
作者针对所有细胞类型(包括上皮细胞、基质细胞和免疫细胞)之间的自分泌和旁分泌信号网络来了解驱动胃癌级联发生的细胞信号通路。作者发现基质细胞是主要的信号发送者,而免疫T细胞和骨髓细胞是受体,iCAFs和髓样细胞(特别是TAMs)之间的相互作用是GC不良预后的重要决定性因素(图9A-C)。作者还发现幽门螺杆菌阳性的胃组织显示出细胞间通讯的数量和强度显著增加,且TNF-TNFRSF1A (TNFR1)高度活跃,这提示我们TNF-TNFR1途径在幽门螺杆菌感染的发病机制中发挥重要作用(图9D-G)。这些发现强调了在幽门螺杆菌诱导的胃肿瘤转化中细胞间相互作用的重要性。
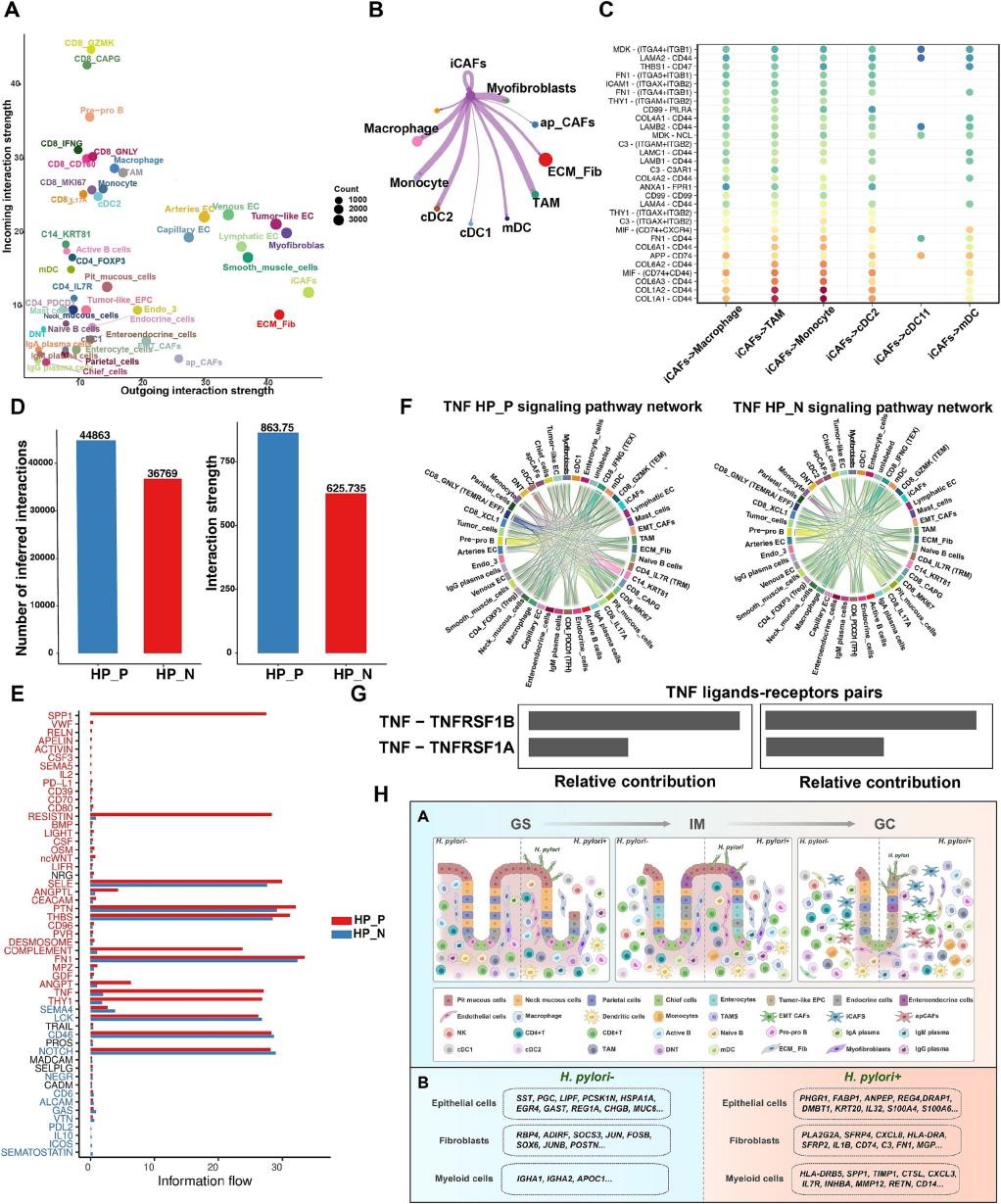
图9 | 多细胞通信网络塑造幽门螺杆菌驱动的致癌微环境
研究结论
本研究全面揭示了与幽门螺杆菌感染相关的从癌前病变到原发性癌症的几乎所有细胞类型的共同和特异性特征;作者首次揭示了幽门螺杆菌感染对胃微环境细胞异质性的影响,这有助于更好地了解幽门螺杆菌的发病机制,并进一步为胃癌的预防和早期诊断提供宝贵的资源;并对参与幽门螺杆菌相关胃肿瘤发生的DEGs和潜在调控网络进行了初步调查。
参考文献:Li N, Chen S, Xu X, et al. Single-cell transcriptomic profiling uncovers cellular complexity and microenvironment in gastric tumorigenesis associated with Helicobacter pylori. J Adv Res. Published online October 15, 2024. doi:10.1016/j.jare.2024.10.012IF: 11.4 Q1






