前言
2024年11月8日,中国科学院分子植物科学卓越创新中心万里团队在Science上发表了题为Activation of a helper NLR by plant and bacterial TIR immune signaling的研究论文。
本研究报道了由拟南芥TNL RPS4的TIR结构域和细菌含TIR效应物HopBY诱导的拟南芥EPA异源三聚体的结构。2'cADPR水解转化为pRib-AMP激活了EPA信号,这表明2'cADPR在调节植物免疫中的积极作用,并可能解释了植物TIR结构域与产生2'cADPR的细菌TIR结构域之间的免疫交叉,揭示了植物和细菌免疫通路交互的分子机理。

发表期刊:Science
影响因子:44.7
涉及的欧易生物服务产品:有参转录组测序
研究背景
植物细胞内核苷酸结合的富含亮氨酸重复序列(NLR)受体与N端Toll/白细胞介素-1受体(TIR)结构域感知病原体效应启动免疫信号。不同生物界的TIR结构域具有NADase活性,可以产生磷酸核糖基腺苷单磷酸/二磷酸(pRib-AMP/ADP)或环ADPR (cADPR)异构体。脂酶样蛋白EDS1和PAD4将来自传感器TIR-NLR的免疫信号转导到辅助型NLR ADR1,后者执行免疫功能。本研究揭示了在拟南芥中由小分子pRib-AMP和蛋白复合体EPA介导的免疫激活新机制,提供了植物病害防控的新型“生物农药”靶标,对我国农业的可持续发展,绿色健康生态环境的维护以及粮食安全的保障具有重要意义。
研究内容
本研究中,作者采用冷冻电镜的手段揭示了EDS1-PAD4-ADR1WHD-LRR异源三聚体的具体结构,并采用凝胶电泳,qPCR等实验验证植物细胞内在响应生物胁迫ETI过程的信号转运过程中,体内具体分子机制的变化,揭示了植物和细菌免疫通路交互的分子机理。并采用RNA-seq揭示2'cADPR诱导的EDS1-PAD4-ADR1依赖的防御信号中主要影响到各种防御通路,下调基因主要富集于光合作用和生长素信号通路。
研究结果
1.植物TIR激活EDS1-PAD4-ADR1WHD-LRR异源三聚体的冷冻电镜结构
为了探究EDS1-PAD4ADR1WHD-LRR异三聚体结构被TIR信号激活的状态,作者通过在昆虫细胞中共表达拟南芥的ADR1WHD-LRR ,EDS1,PAD4 和 TIR 结构域并运用冷冻电镜的手段观察了EDS1-PAD4-ADR1WHD-LRR异源三聚体的具体结构。研究发现全长EDS1-PAD4异源二聚体和ADR1WHD-LRR的明确信号(图1A和B),并在EDS1和PAD4之间鉴定了一个pRib-ADP分子(图1C和图S3A)。异源三聚体中的EDS1-PAD4与先前报道的pRib-ADP结合的EDS1-PAD4异源二聚体的结构(PDB: 7XEY)的结构重叠良好(图S3C)。因此,EDS1-PAD4-ADR1WHD-LRR异三聚体结构代表了该复合物被TIR信号激活的状态。
2.EDS1-PAD4和ADR1之间的相互作用对ADR1的激活至关重要
进一步通过冷冻电镜来研究相互作用是如何从配体结合中产生的。研究发现无配体EDS1-PAD4异源二聚体的界面相互作用间隙无法容纳ADR1的C端螺旋(图1D)。配体结合诱导PAD4 EP结构域旋转约18°,从而在EDS1P-AD4的界面上产生相互作用间隙(图1E)。在异源三聚体中,EDS1-PAD4和ADR1之间存在两个主要的相互作用界面,相互作用界面1 (I-1)主要涉及ADR1 C端环-螺旋区和EDS1、PAD4的EP结构域,相互作用界面2 (I-2)涉及PAD4 EP结构域和ADR1 LRR结构域的极性和疏水的相互作用(图1F-I)。
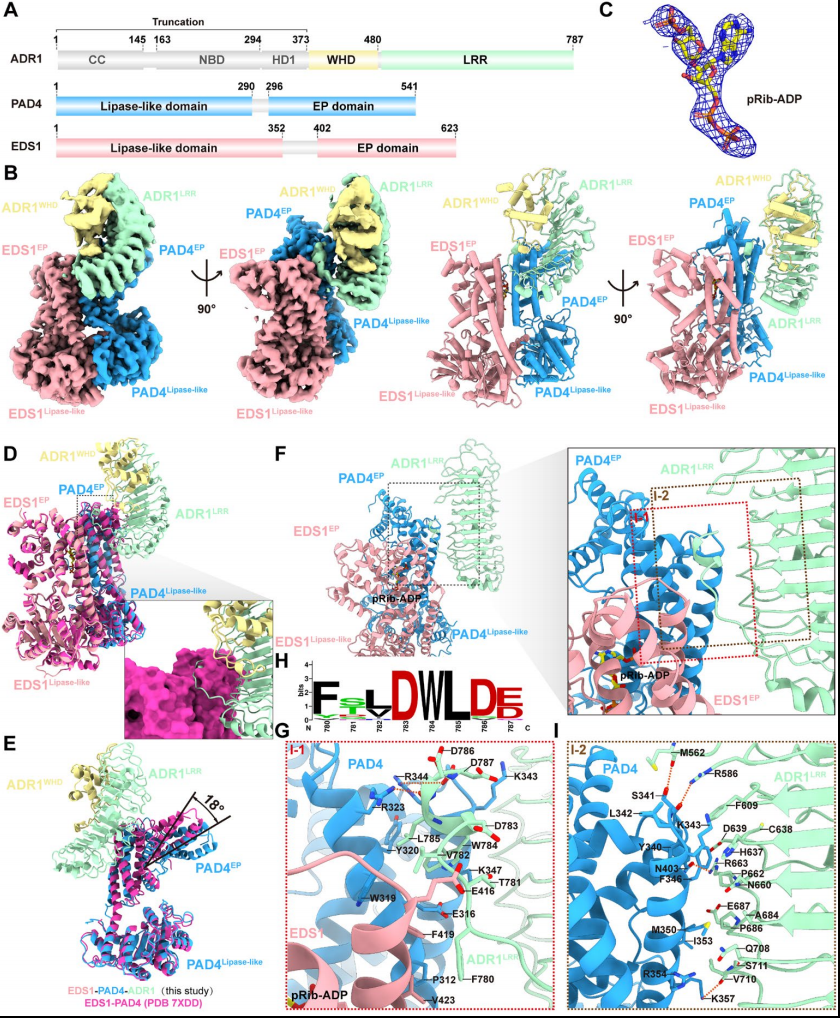
图1 | 被植物RPS4TIR激活的EDS1-PAD4-ADR1WHD-LRR异质三聚体的冷冻电镜结构
昆虫细胞中,除了ADR1的M562A/R586A外,I-1和I-2突变体在与RPS4TIR共表达时,减弱了ADR1WHD-LRR结合EDS1-PAD4异源二聚体的能力(图2A和B)。拟南芥EDS1、PAD4和ADR1-L1的共表达触发了XopQ依赖性细胞死亡,I-1中所有相应突变体在与EDS1和PAD4共表达时都消除了XopQ激活的ADR1-L1的细胞死亡表型(图2C)。除了M590A/R614A外,I-2中对应突变体在与EDS1和PAD4共表达时都消除或减弱了XopQ激活的ADR1L1的细胞死亡表型(图2D)。
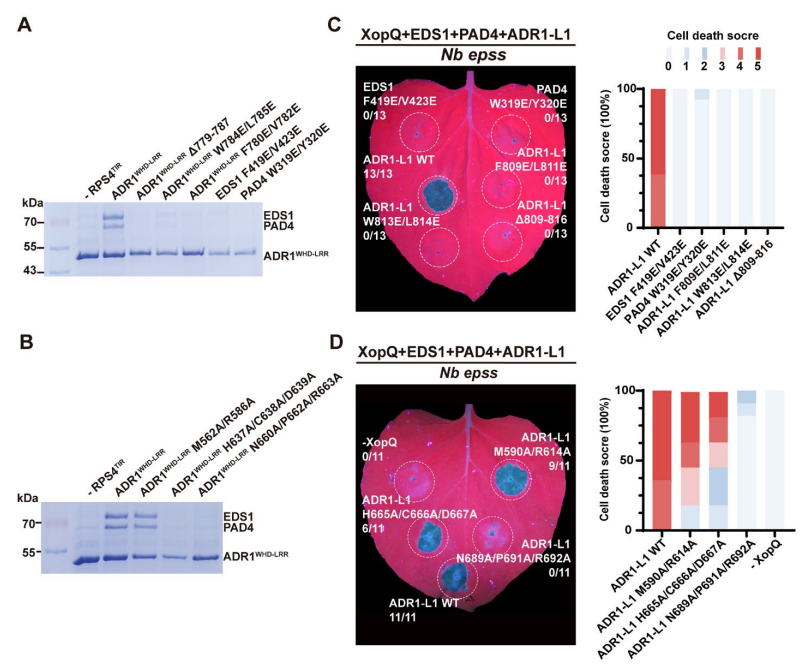
图2 | EDS1-PAD4与ADR1之间的相互作用对其功能至关重要
3.产生2'cADPR的细菌TIR结构域诱导EPA异源三聚化并激活其功能
为了研究细菌TIR结构域是否交叉激活植物EDS1通路,研究者在昆虫细胞中与含有TIR的细菌蛋白共表达EDS1-PAD4-ADR1WHD-LRR或EDS1-SAG101-NRG1A L134E的组分。研究发现产生2 ' cADPR的细菌TIR特异性诱导EDS1-PAD4-ADR1WHD-LRR异源三聚体的形成(图3A和B)。细菌TIR蛋白通过EDS1-PAD4-ADR1-L1模块触发细胞死亡(图3C);AbTirTIRW204A是一种先前表征的突变体,其产生2'cADPR的能力受损,引发细胞死亡减弱(图3D);HopBY和AbTirTIR在Nb-epss中与EDS1和PAD4共表达时,依赖于它们的催化活性触发ADR1-L1的寡聚化,而不是HopAM1或AaTirTIR,HopBY和AbTirTIR都积累了2'cADPR(图3E和F)。综上所述,细菌产生2'cADPR的TIR蛋白特异性激活植物EDS1-PAD4- ADR1免疫信号,其激活与其产生2'cADPR的能力相关。
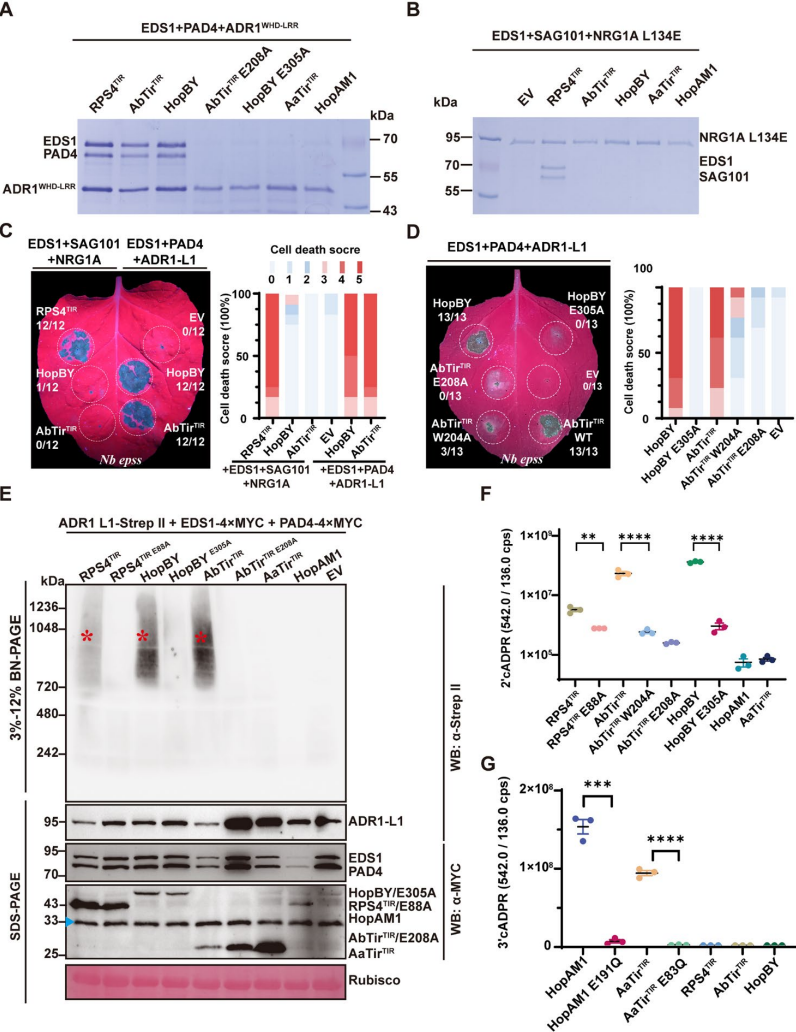
图3 | 产生2'cADPR的细菌TIR诱导EPA复合物并激活功能
4.产生2'cADPR的细菌TIR结构域使用pRib-AMP激活EPA复合物
为了进一步研究细菌TIR产生的信号分子,研究者纯化并变性了由RPS4TIR、HopBY或AbTirTIR诱导的EDS1-PAD4-ADR1WHD-LRR异源三聚体蛋白,并用质谱法对其进行了分析。作者发现,在任何TIR诱导的异源三聚体蛋白中均未检测到2'cADPR(图4A),在这三种情况下均检测到信号分子pRib-AMP(图4B)。冷冻电镜发现HopBY和RPS4TIR诱导的EDS1-PAD4-ADR1WHD-LRR异源三聚体的结构叠加良好,在HopBY诱导的EDS1-PAD4-ADR1WHD-LRR异三聚体结构中,在EDS1和PAD4之间发现了一个pRib-AMP分子,而在RPS4TIR诱导的EDS1-PAD4-ADR1WHD-LRR异三聚体结构中发现了一个pRib-ADP分子(图4D)。这些结果表明植物和细菌的TIRs都使用pRib-AMP/ADP作为信号分子来激活植物EDS1-PAD4-ADR1信号。
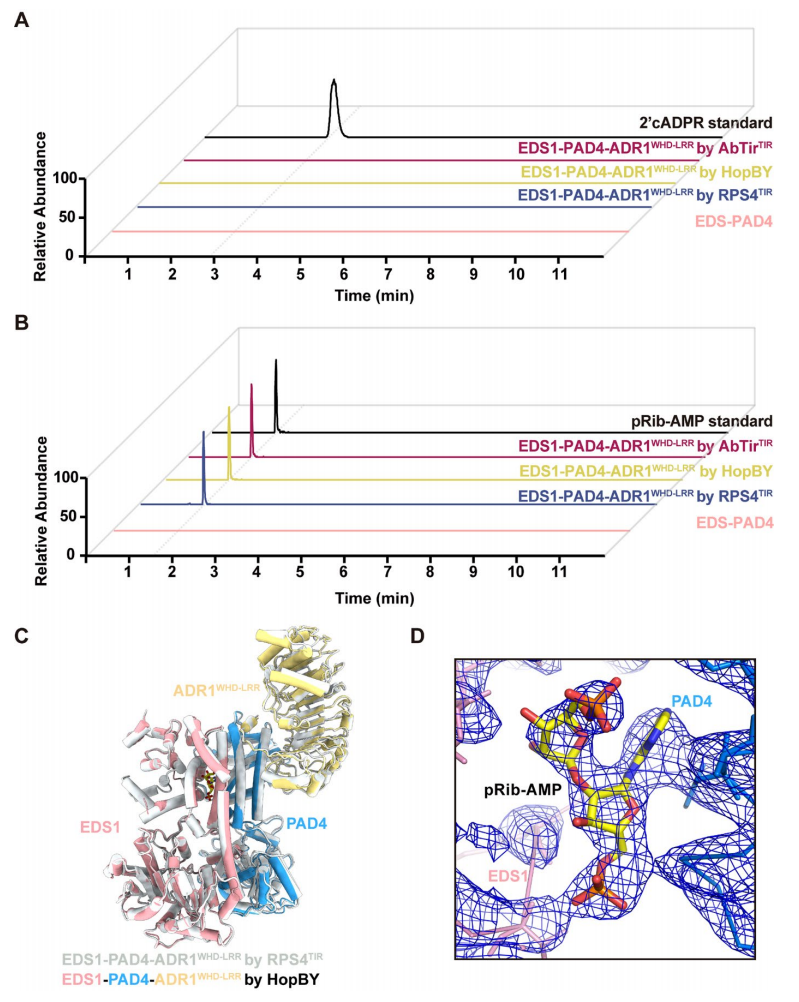
图4 | HopBY和AbTirTIR利用pRib-AMP作为信号分子,诱导EDS1-PAD4-ADR1WHD-LRR异源三聚体的形成
5.2'cADPR水解转化为pRib-AMP可诱导EPA依赖性防御信号
鉴于2'cADPR和pRib-AMP是结构上相关的分子,2'cADPR通过焦磷酸键水解产生pRib-AMP(图5A),作者进一步研究了2'cADPR转化为pRib-AMP的过程。2'cADPR与拟南芥Col-0叶片蛋白提取物孵育后,用纯化的EDS1-PAD4异源二聚体蛋白保护后检测到pRib-AMP(图5B和C)。作者还发现2'cADPR依赖于EDS1-PAD4-ADR1模块强烈诱导致病相关蛋白1(PR1)的表达(图5D和E)。之后作者对2'cADPR处理的Col0和PAD-1叶片样本进行了RNA-seq实验,研究发现Col-0中有2593个上调基因和3453个下调基因(图5F和图S15B和C),GO分析显示,上调基因主要富集于各种防御通路,下调基因主要富集于光合作用和生长素信号通路(图S15D和E)。这些结果与之前关于ETI中光合作用抑制的研究结果以及防御-生长权衡的概念一致。

图5 | 将2'cADPR水解转化为pRib-AMP,可诱导EDS1-PAD4-ADR1依赖的防御信号
研究结论
本研究发现TIR信号的激活导致EDS1-PAD4-ADR1和EDS1-SAG101-NRG1的异源三聚体形成,并最终导致NRG1和ADR1的寡聚,还证实了2'cADPR在正向调节植物免疫中的作用,并首次提出2'cADPR作为pRib-AMP的一种存储形式来激活EDS1PAD4-ADR1信号。
参考文献:Yu H, Xu W, Chen S, et al. Activation of a helper NLR by plant and bacterial TIR immune signaling. Science. Published online November 7, 2024. doi:10.1126/science.adr3150IF: 44.7 Q1






