结直肠癌(Colorectal Cancer, CRC)是全球第三大常见恶性肿瘤,也是癌症相关死亡的第二大原因。约 70% 的 CRC 患者会发生肝转移,且肝转移是导致 CRC 患者死亡的主要原因。尽管目前已有多种治疗方法,但预后仍然较差。肝脏在 CRC 肝转移过程中起着关键作用,然而肝脏如何通过细胞间通讯影响 CRC 肝转移的具体机制尚不清楚。本研究聚焦于高尔基蛋白 73(Golgi Protein 73, GP73),探索其在 CRC 肝转移中的作用机制,为 CRC 肝转移的治疗提供了新的靶点。
2025 年 5 月27日,军事医学研究院魏从文教授团队在国际TOP级肿瘤学期刊Molecular Cancer(IF:27.7)发表了题为 “GP73-dependent regulation of exosome biogenesis promotes colorectal cancer liver metastasis”的研究成果,首次揭示了 GP73 通过调控外泌体生成促进结直肠癌肝转移的分子机制,为 CRC 肝转移的治疗提供了新的思路。欧易生物为本研究提供超微量外泌体蛋白质组服务。

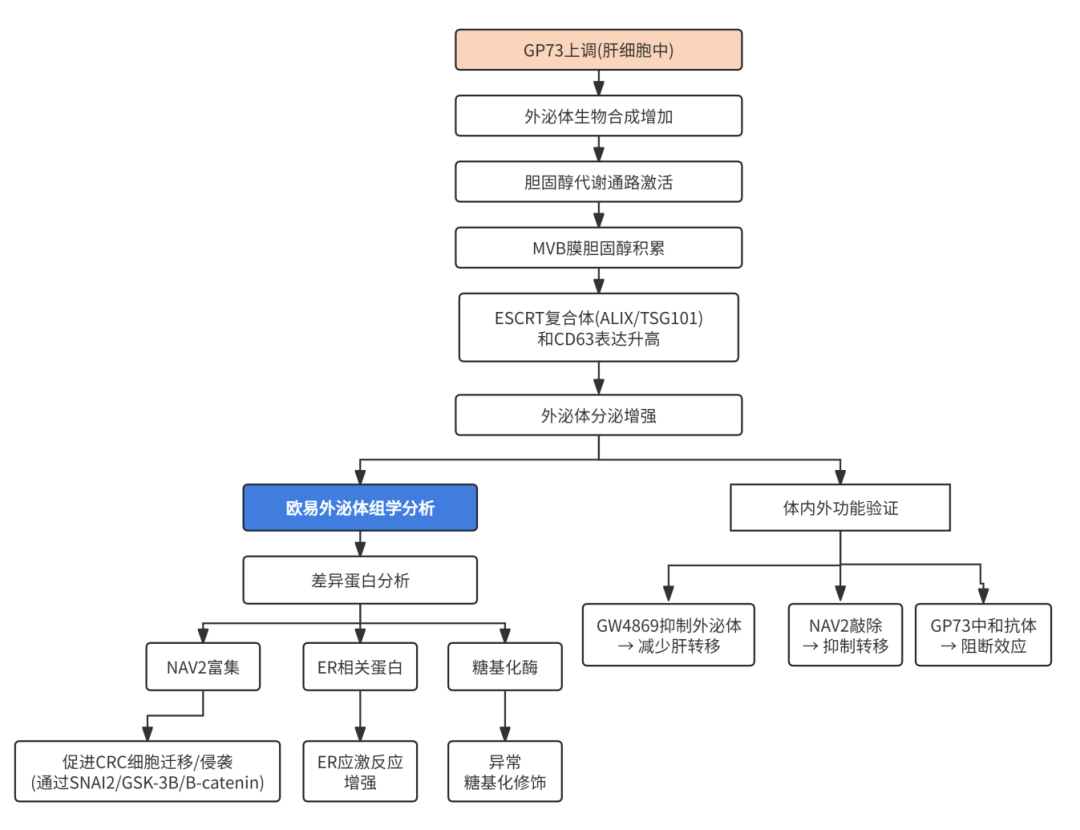
1. GP73 在 CRC 肝转移中的表达水平
研究团队首先检测了健康人群、无肝转移的 CRC 患者(CRNLM)以及有肝转移的 CRC 患者(CRLM)的血清 GP73 水平。结果显示,与健康人群相比,CRC 患者血清中的 GP73 水平显著升高,而在 CRLM 患者中 GP73 表达水平最高(图1A)。进一步的免疫荧光实验表明,CRLM 患者肝脏中 GP73 在肝细胞中的表达显著增强,并且主要与白蛋白共定位(图1B-C)。这些结果表明,GP73 的高表达与 CRC 肝转移的发生密切相关。
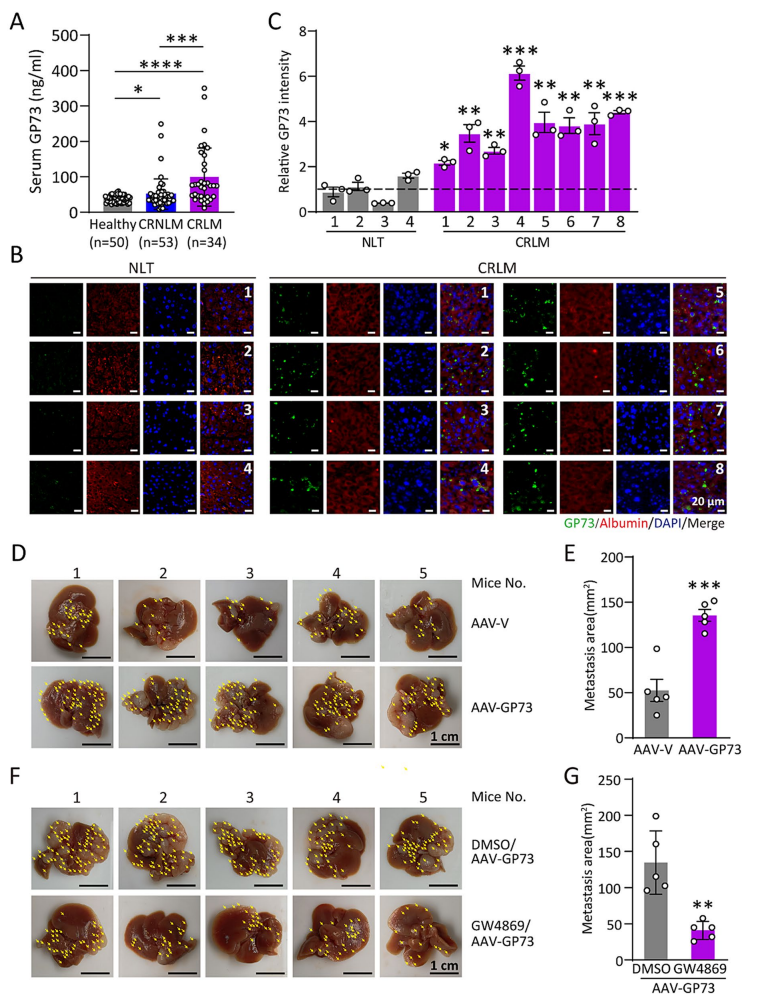
图1 GP73 在 CRC 肝转移中的表达水平
2. GP73 通过外泌体促进 CRC 肝转移
研究团队进一步研究了 GP73 在 CRC 肝转移中的作用机制。他们构建了高表达 GP73 的小鼠模型,并通过尾静脉注射 CRC 细胞来模拟肝转移。结果显示,高表达 GP73 的小鼠肝脏中 CRC 肝转移灶的面积、数量和比例显著增加(图2D-E)。此外,通过抑制外泌体生成的药物 GW4869 处理后,肝转移灶的生长被部分阻断(图2F-G),表明 GP73 通过外泌体依赖的方式促进 CRC 肝转移。
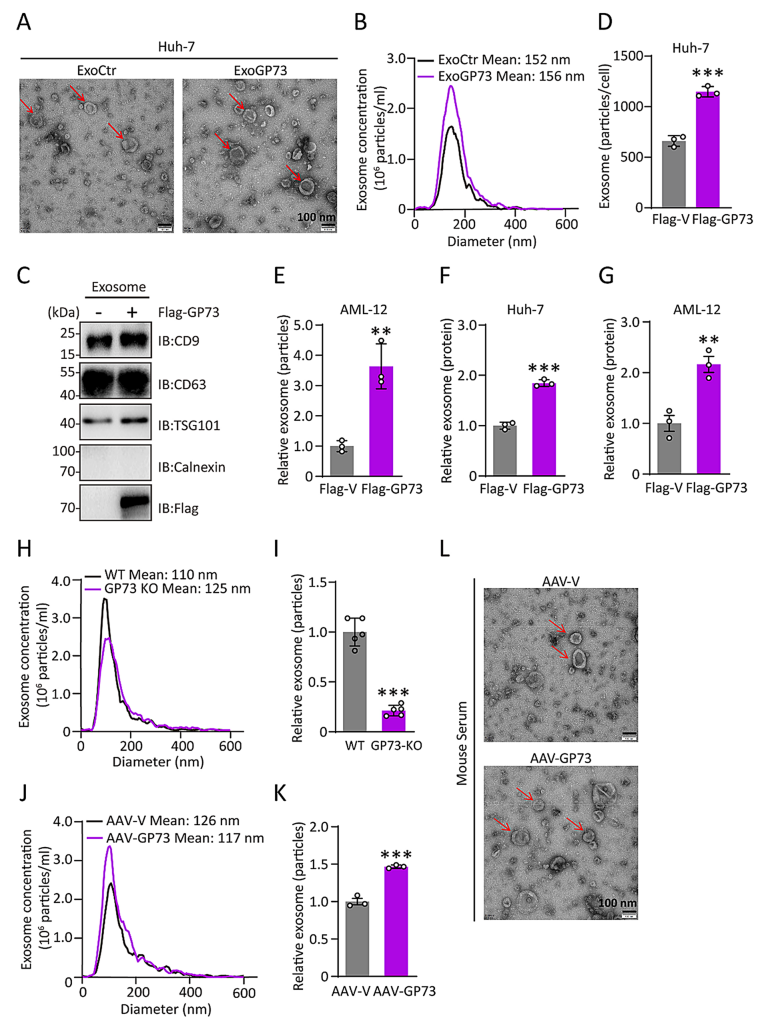
图2 GP73 通过外泌体促进 CRC 肝转移
3. GP73 促进外泌体生成的机制
研究团队进一步研究了 GP73 促进外泌体生成的机制。通过细胞实验发现,GP73 过表达的细胞分泌的外泌体数量和蛋白含量显著增加(图3D-F)。此外,GP73 还能够与胆固醇结合,并通过调节内体中的胆固醇含量来促进外泌体的生成(图3E-H)。GP73 与多泡体(MVBs)重叠,并增加 MVBs 的数量(图3F-H),从而促进外泌体的分泌。
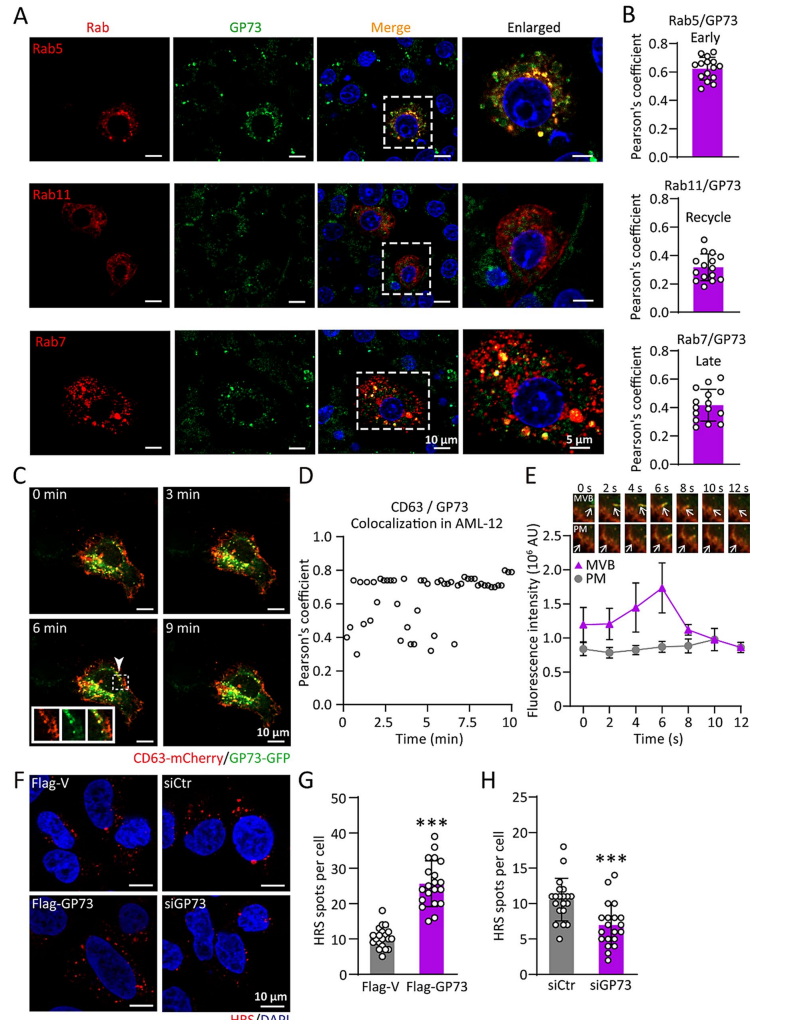
图3 GP73 促进外泌体生成的机制
4. GP73 高表达肝细胞分泌的外泌体对癌细胞的影响
研究团队进一步研究了 GP73 高表达肝细胞分泌的外泌体对癌细胞的影响。实验结果表明,与对照组外泌体相比,GP73 高表达肝细胞分泌的外泌体能够显著增强癌细胞的迁移和侵袭能力(图4G-I)。此外,这些外泌体还能够通过调节细胞内的信号通路来促进癌细胞的上皮 - 间质转化(EMT),从而增强其转移能力。
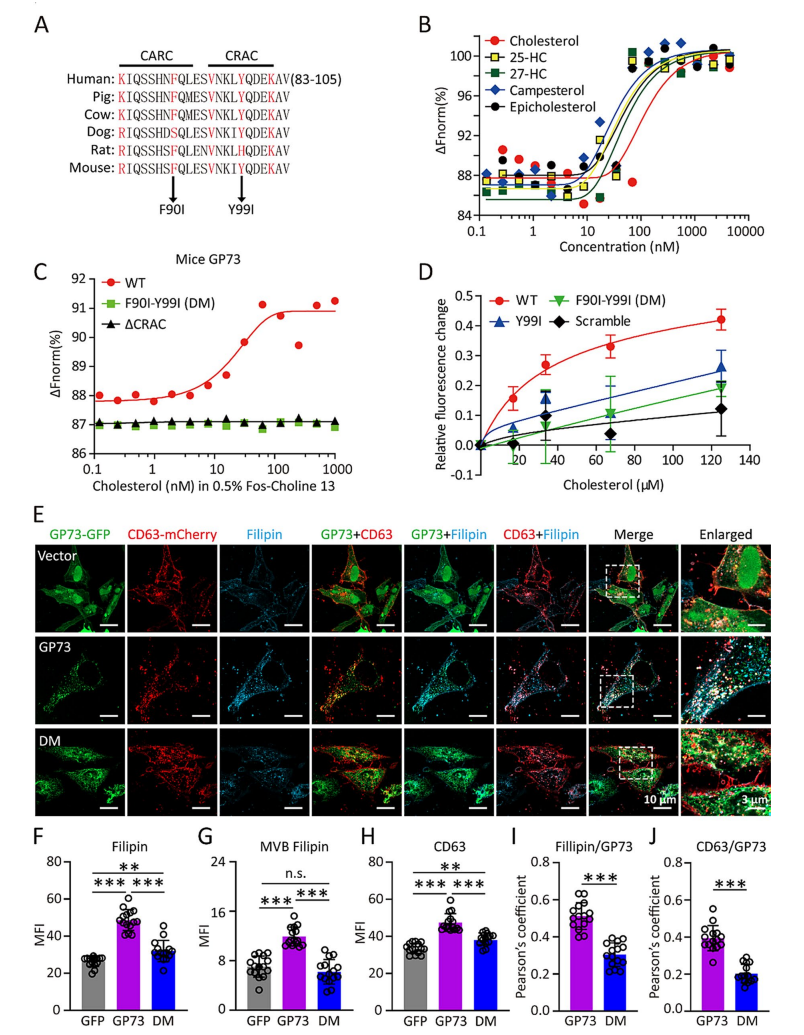
图4 GP73 高表达肝细胞分泌的外泌体对癌细胞的影响
5. GP73 与 NAV2 的关系
通过外泌体蛋白质组学分析,研究团队发现 GP73 高表达肝细胞分泌的外泌体中富含 NAV2 蛋白(图5A)。进一步的实验验证了 GP73 与 NAV2 的相互作用,并发现 GP73 通过促进 NAV2 的外泌体分泌来增强癌细胞的转移能力(图5E-G)。此外,研究还发现,血清中 GP73 水平与外泌体中 NAV2 水平呈正相关,且在 CRC 肝转移患者中更为显著(图5H)。
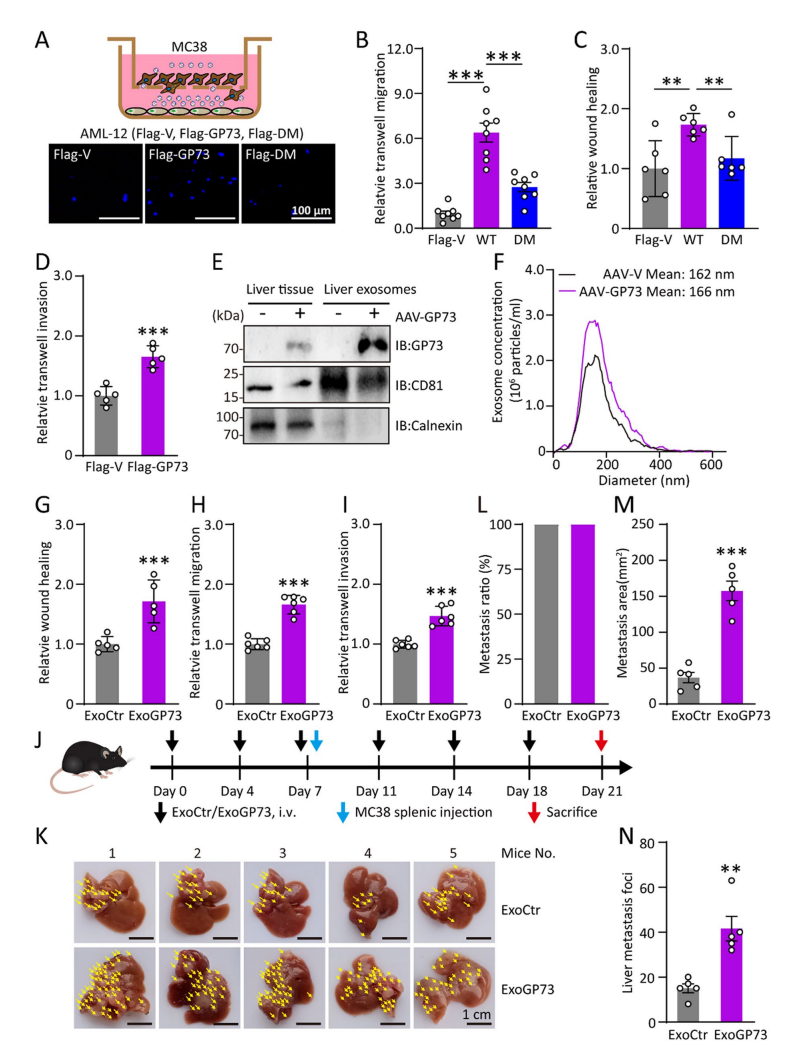
图5 GP73 与 NAV2 的关系
6. GP73 阻断对 CRC 肝转移的抑制作用
基于上述发现,研究团队进一步探讨了 GP73 阻断对 CRC 肝转移的抑制作用。实验结果表明,通过注射 GP73 中和抗体或 siRNA 干扰 GP73 表达,能够显著抑制 GP73 诱导的非肥胖小鼠和高脂饮食或高果糖饮食诱导的肥胖小鼠的 CRC 肝转移(图6L-Q)。
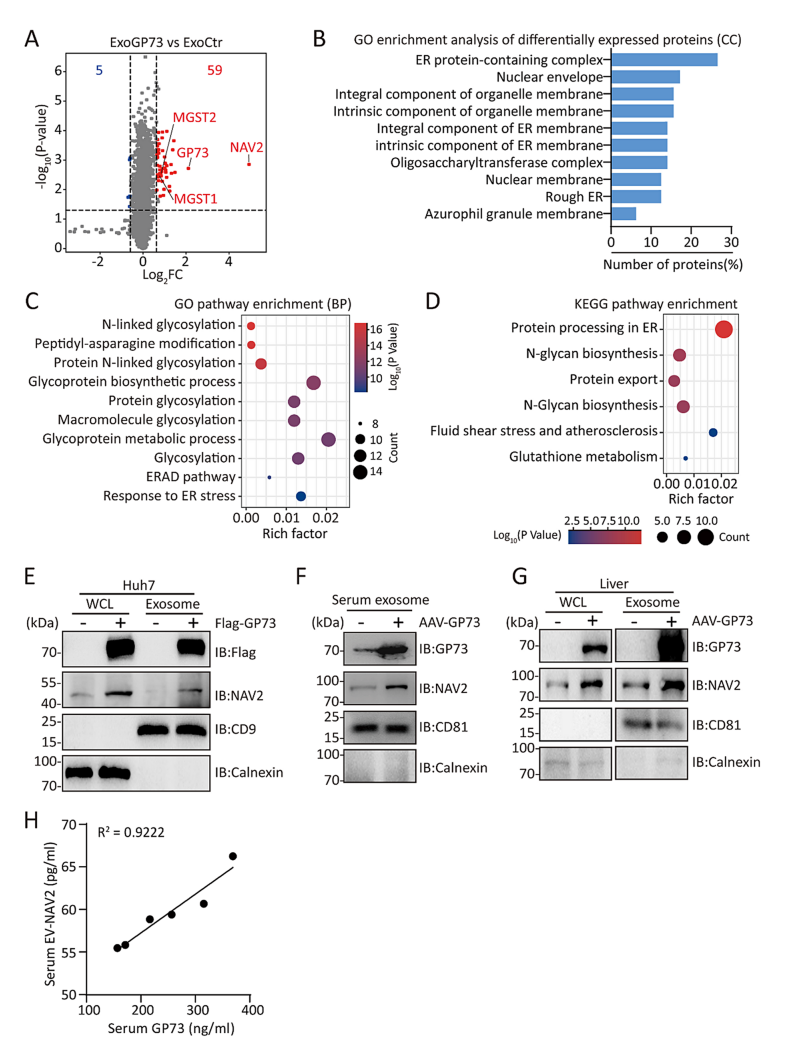
图6 GP73 阻断对 CRC 肝转移的抑制作用
7. GP73 阻断对 CRC 肝转移的抑制作用在肥胖小鼠模型中的验证
研究团队进一步在肥胖小鼠模型中验证了 GP73 阻断对 CRC 肝转移的抑制作用。结果显示,高脂饮食(HFD)或高果糖饮食(HFrD)诱导的肥胖小鼠中,GP73 表达显著增加,且这些小鼠更容易发生 CRC 肝转移(图7A)。通过注射 GP73 中和抗体或 siRNA 干扰 GP73 表达,能够显著减少肥胖小鼠的 CRC 肝转移(图7B-G)。此外,GP73 阻断还显著降低了转移瘤中 NAV2 的表达(图7H-I),并减少了转移瘤细胞的增殖(图7J)。
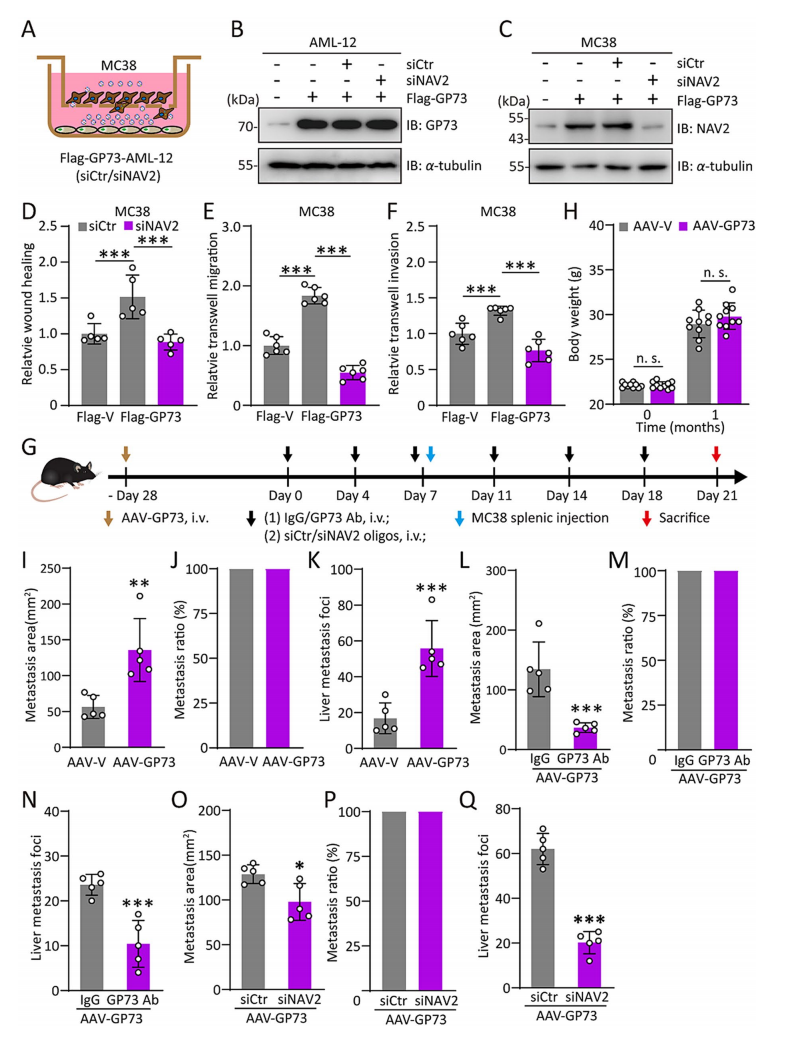
图7 GP73 阻断对 CRC 肝转移的抑制作用在肥胖小鼠模型中的验证
本研究揭示了 GP73 在 CRC 肝转移中的关键作用,并阐明了其通过调控外泌体生成和 NAV2 分泌促进 CRC 肝转移的分子机制。这些发现不仅为理解 CRC 肝转移的分子机制提供了新的视角,还为开发针对 CRC 肝转移的新型治疗策略提供了潜在的靶点。
本项目欧易生物提供超微量外泌体蛋白组服务,采用微量外泌体分离平台+超微量蛋白质组检测,即可对微量样本进行高深度的外泌体蛋白质组检测。具体优势为:提取-表征-组学检测一站式服务;外泌体微量分离;超微量蛋白质组检测。






