伤寒沙门氏菌(Salmonella Typhi)病原体对人类具有致命性,却只能在小鼠中引发轻微感染,这种跨物种易感性差异的机制尚不明确。本研究采用多组学整合策略(转录组+蛋白组+代谢组),旨在系统解析小鼠模型中宿主的抗感染机制,揭示代谢重编程如何通过调控宿主免疫决定感染结局,为人类伤寒的代谢靶向治疗提供新视角。
2025年5月,兰州大学第二医院(第二临床医学院)孙辉教授、杨靖副研究员在Journal of Advanced Research(IF:11.4)发表题为“Multi-omics analysis of glycolytic reprogramming and ROS dynamics in host-specific responses to Salmonella Typhi infection in mice”的研究成果,利用DIA蛋白组学+LC-MS全谱代谢组学+转录组学多个技术研究了感染伤寒沙门氏菌的脾脏组织,发现伤寒沙门氏菌感染小鼠导致了显著的代谢重组,主要表现为糖酵解途径增强,促进葡萄糖向丙酮酸的转化,同时三羧酸循环活性降低。欧易生物提供了DIA蛋白组学、LC-MS全谱代谢组学、转录组学服务。此外,本研究的生信分析及图表绘制均在欧易云平台完成。

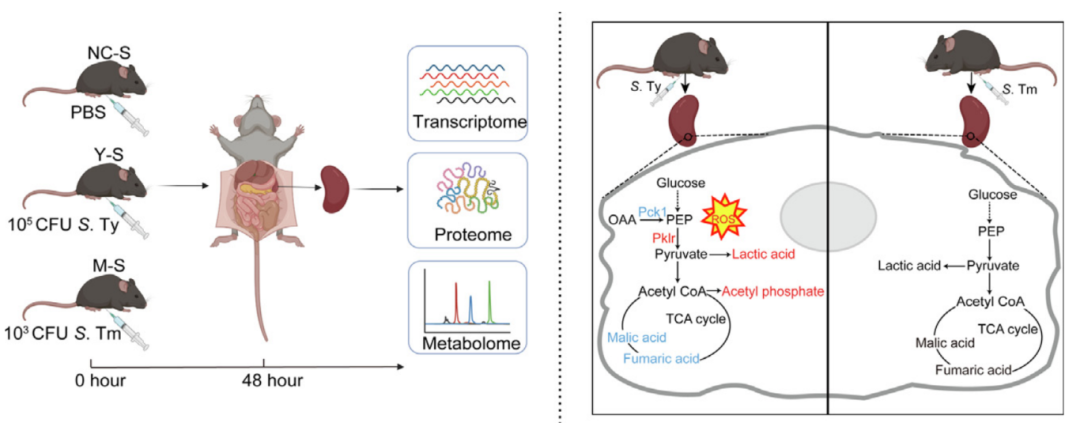
1、伤寒沙门氏菌具有宿主特异性,无法在小鼠体内建立有效的全身性感染
为了确认伤寒沙门氏菌是否具有跨物种感染能力,作者建立了正常对照组(NC)伤寒沙门氏菌感染组(Y)和鼠伤寒沙门氏菌感染组(M)三个动物模型。结果发现鼠伤寒沙门氏菌在野生型小鼠中表现出强致病性(高致死率、生理损伤、脾病理破坏及细菌大量增殖),而伤寒沙门氏菌对小鼠几乎无致病性,证明了其严格的宿主特异性(以人为专一宿主)。
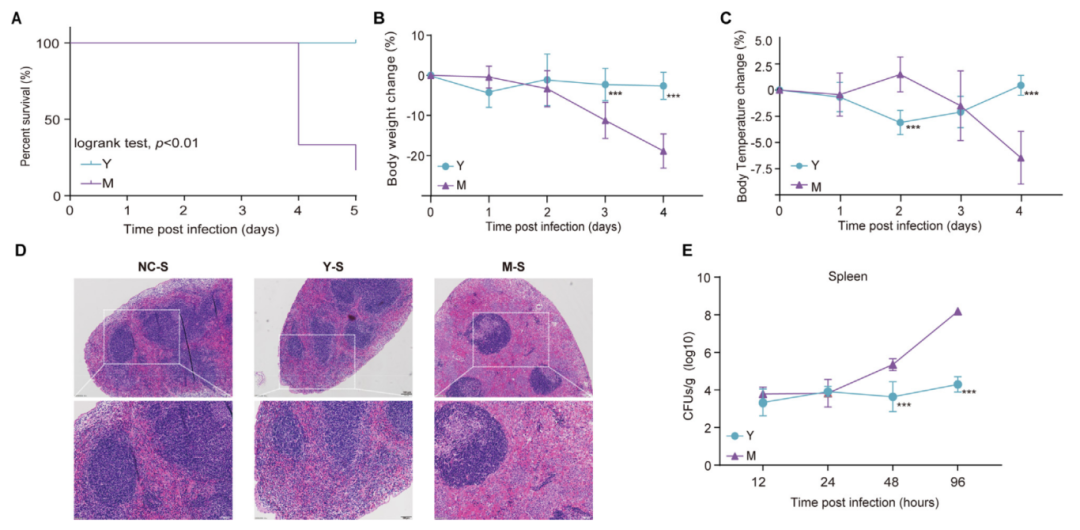
图1 小鼠对伤寒沙门氏菌的感染具有抵抗力
为了了解两种不同沙门氏菌感染小鼠后的免疫反应特征,作者对NC、Y、M组别做了血清的细胞因子检测。伤寒沙门氏菌仅轻微激活免疫系统,使抗炎因子IL-10和趋化因子CCL5小幅升高3-5倍。鼠伤寒沙门菌则引爆全面免疫:炎症因子IL-6飙升194倍,干扰素γ暴涨1154倍,12种关键免疫信号(TNF-α/IL-1β等)同时失控,掀起致命“细胞因子风暴”。
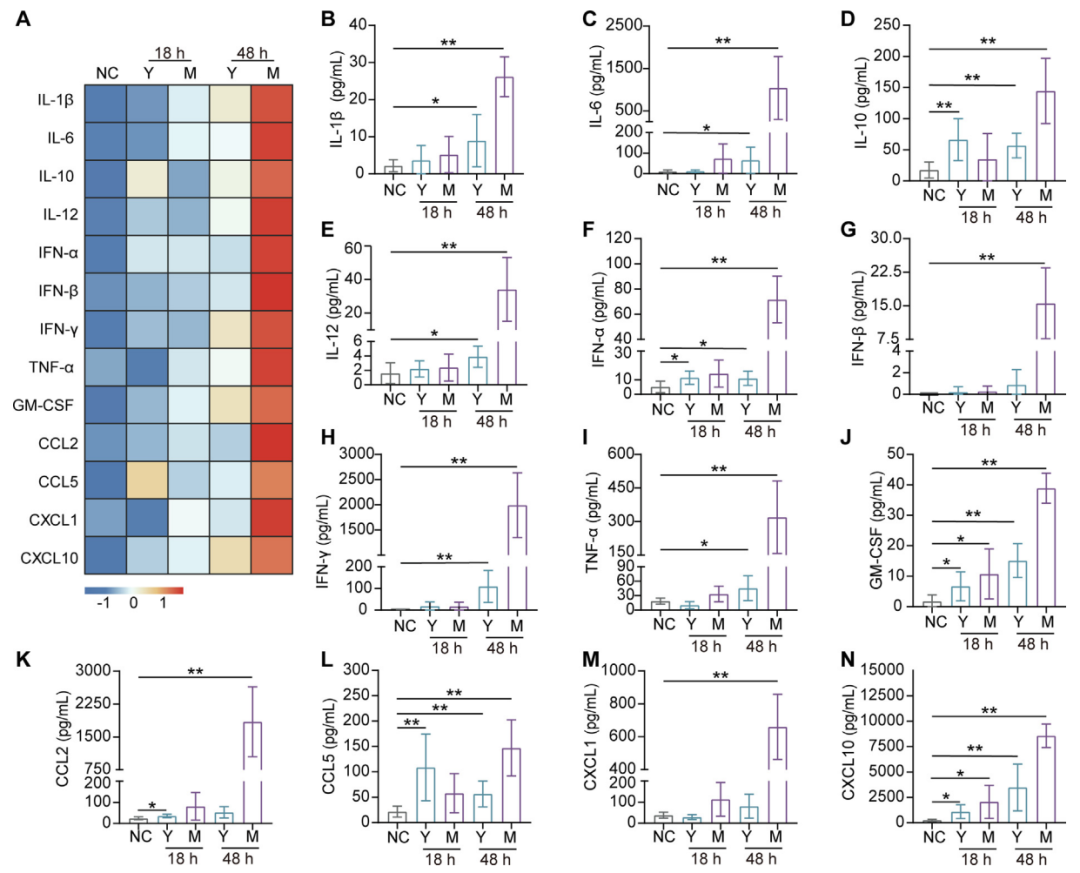
图2 血清中的细胞因子水平能够反映出感染期间免疫反应的差异
2、DIA蛋白组学+LC-MS全谱代谢组学+转录组学数据的质控分析
为了破解沙门氏菌的“物种壁垒”,作者通过转录组+蛋白组+代谢组三组学联用对小鼠脾脏组织进行研究试验。三个组学的PCA分析显示两种沙门氏菌感染组分子图谱截然分离,说明宿主特异性存在深层机制差异。每个处理组生物学重复的平均Pearson相关系数超过0.9。这些质控数据证实了多组学数据的可靠性和稳健性,为进一步探索伤寒沙门氏菌和鼠伤寒沙门氏菌感染中驱动宿主与病原体相互作用的分子机制提供了坚实的基础。
3、不同沙门氏菌血清型感染小鼠脾脏的比较转录组学特征分析
转录组测序分析结果显示伤寒沙门氏菌仅诱导311个差异表达基因(DEGs),而鼠伤寒沙门氏菌则激活高达2,442个DEGs。尽管二者均靶向下调CD207这个关键免疫枢纽,直接削弱树突细胞的病原识别能力,暴露了沙门氏菌共有的免疫逃逸策略。但鼠伤寒沙门氏菌额外抑制了抗原呈递受体CD209c和T细胞调控因子Vsig4,具备更强的宿主免疫系统破坏力。
在宿主防御层面,两组均出现抗感染基因的同步防御机制。炎症警报蛋白Ptx3和应激反应因子Saa3的均显著上调。然而进一步的KEGG通路富集分析揭示了二者的不同,伤寒沙门氏菌通过富集细胞周期调控通路(如p53信号)和代谢重编程通路(糖酵解/精氨酸合成),悄然篡改宿主细胞的增殖与营养供应程序,营造潜伏感染环境;鼠伤寒沙门氏菌则激活TNF/NF-κB炎症通路,并放大IL-17介导的组织损伤信号,驱动全身炎症级联反应,通过过度免疫激活引发宿主自体损伤,为菌体持续定植创造条件。
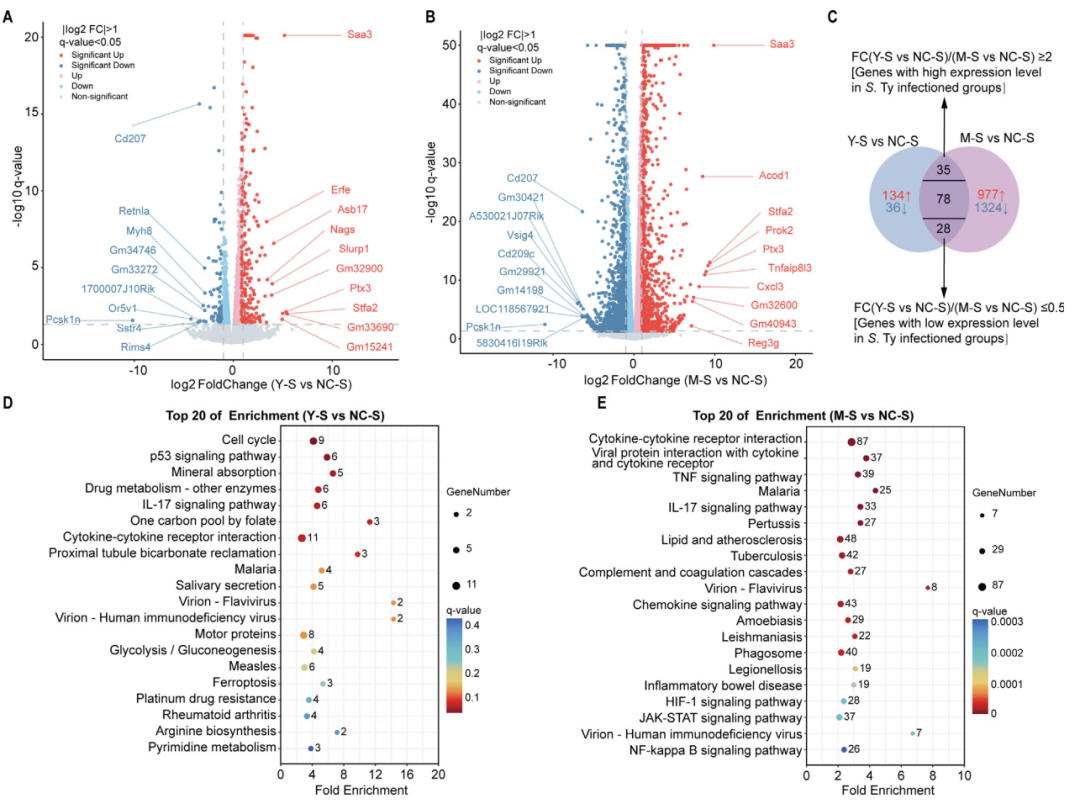
图3 小鼠脾脏组织的转录组学变化
4、不同沙门氏菌血清型感染小鼠脾脏的蛋白质组学比较分析
蛋白组学研究显示两种沙门氏菌在小鼠体内不同的生存模式。伤寒沙门氏菌仅扰动263个差异蛋白(DEPs),而鼠伤寒沙门氏菌则引发581个DEPs的显著变化,反映出二者对宿主分子网络的干预强度存在量级差异(图4A-B)。值得注意的是,121个核心DEPs在两组中同步变化,暴露了沙门氏菌共有的逃逸机制。其中鼠伤寒沙门氏菌特有的免疫抑制节点(如KLF2、CLMN)的普遍下调削弱了宿主免疫监视能力,同时离子通道与泛素化调控因子(如SCN1A、HECW1)的抑制暗示病原体通过干扰信号传导和蛋白降解实现潜伏。在防御层面,阴离子转运体SLC26A3和转录因子ZFHX3的共同上调,标志着宿主为维持稳态作出的适应性抵抗。
蛋白组学KEGG通路富集分析结果与转录组学一致,伤寒沙门氏菌显著富集在亚油酸代谢、色氨酸分解、组氨酸代谢等通路,主要通过重塑脂肪酸供给和必需氨基酸平衡,为自身营造低炎症的生存微环境。鼠伤寒沙门氏菌主要激活补体级联、NETosis(中性粒细胞胞外诱捕网)、NOD样受体通路,诱导免疫和感染相关途径。
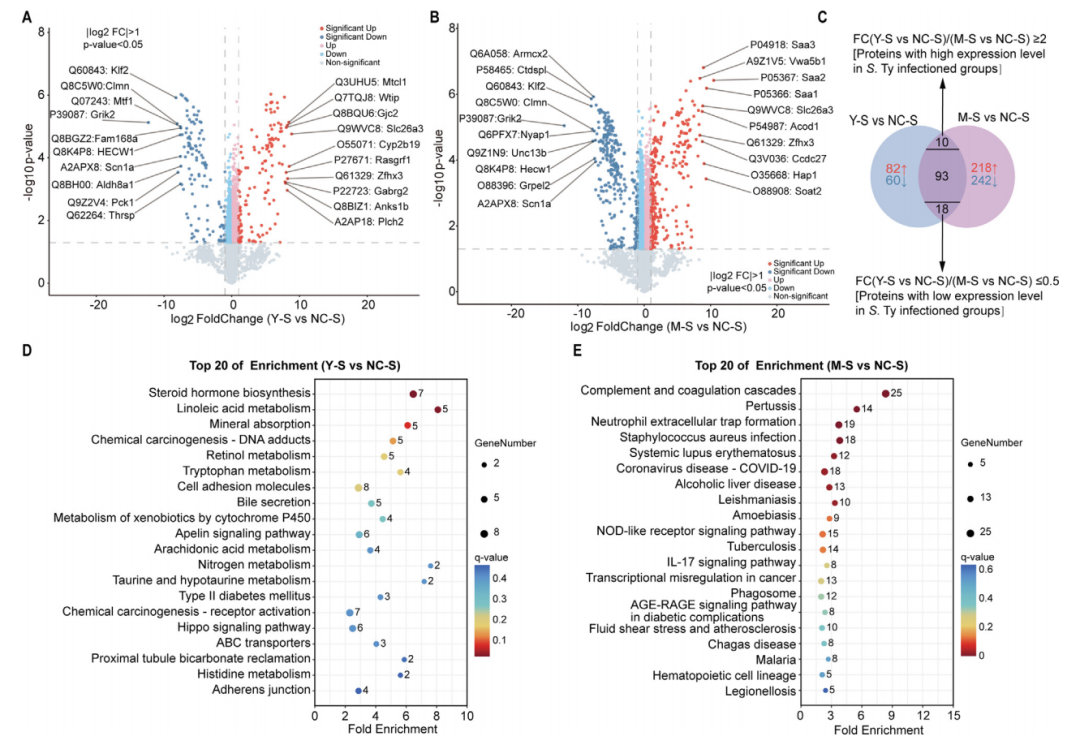
图4 小鼠脾脏组织的蛋白质组学变化
5、不同沙门氏菌血清型感染小鼠脾脏的代谢组学比较分析
伤寒沙门氏菌感染组的代谢组学结果中观察到几个关键的KEGG代谢途径发生显著变化,包括甘油磷脂代谢、烟酸和烟酰胺代谢以及丙酮酸代谢(图5D)。相反,在鼠伤寒沙门氏菌感染组中发现主要与信号转导和感染相关的KEGG通路受到调节,特别是FoxO信号通路、PI3K-Akt信号通路和mTOR信号通路。总之,在代谢组学中的发现,与蛋白组和转录组结果一致,伤寒沙门氏菌感染主要是改变了能量代谢相关的通路,而伤寒沙门氏菌感染主要是过度激活免疫相关通路。
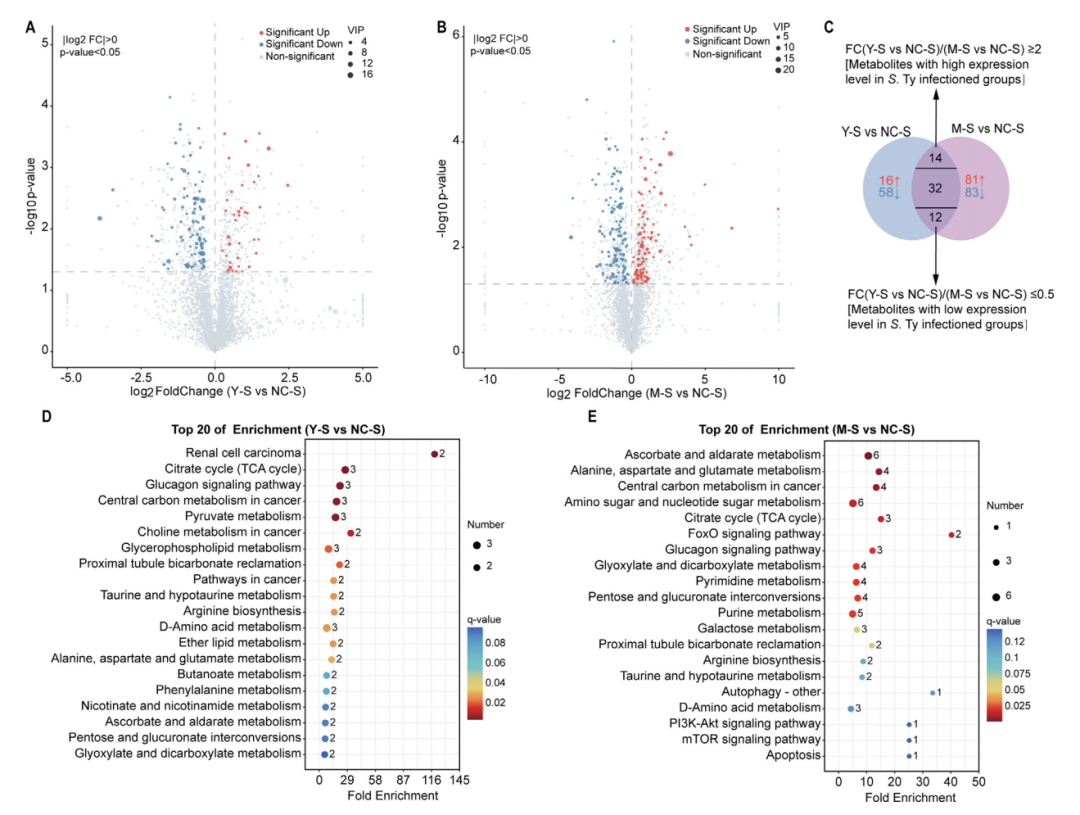
图5 小鼠脾脏组织的代谢组学变化
6、在转录组学、蛋白质组学和代谢组学数据集中全面整合常见的DEGs、DEP和DEM
为了评估多组学数据的连贯性和整合质量,应用了DIABLO框架整合和分析转录组学、蛋白质组学和代谢组学数据集。样本投影图显示各实验组之间有明显的分离,各个样本在所有组学层面上的投影都表现出高度的一致性。
伤寒沙门氏菌组发现有13个基因(12个上调+1个下调)在转录与蛋白层面同步变化,且KEGG通路富集于糖酵解、TCA循环、氨基酸代谢。鼠伤寒沙门氏菌有187个基因(129↑+58↓)在转录和蛋白层面同步变化,均爆发性激活补体级联、NETosis等免疫反应通路。转录组与代谢组、蛋白组与代谢组分别取交集后,伤寒沙门氏菌(相对于鼠伤寒沙门氏菌)特有的关键通路均有9条,包括丙酮酸代谢、苯丙氨酸代谢等。
为了证实多组学联合分析结果,使用qRT-PCR进一步验证了免疫和代谢相关基因的表达。qRT-PCR分析与多组学数据集中确定的趋势显著一致,从而证实了在伤寒沙门氏菌和鼠伤寒沙门氏菌感染中观察到的差异表达模式的真实性。
对转录组学、蛋白质组学和代谢组学数据集的综合分析表明,伤寒沙门氏菌感染与重要宿主代谢途径的重大改变有关,导致旨在抑制细菌持久性的代谢重构。相反,鼠伤寒沙门氏菌主要调节免疫和炎症机制,以促进其持久性并规避宿主防御反应,这说明了两种沙门氏菌的不同感染策略。
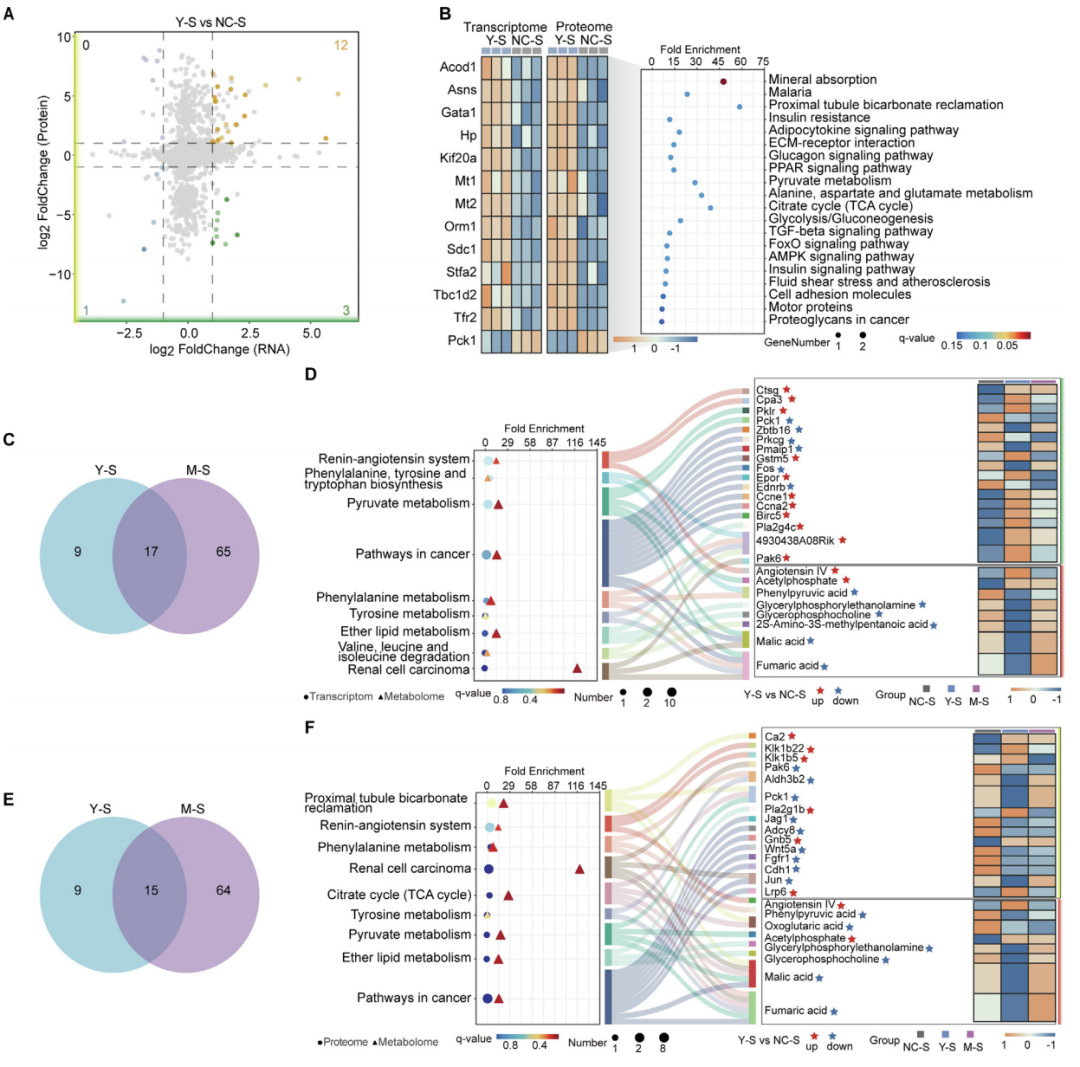
图6 对小鼠脾脏组织的转录组学、蛋白质组学和代谢组学数据进行综合分析
7、伤寒感染依赖于糖酵解重编程和活性氧含量增加
活性氧(ROS)的生成与宿主的代谢重编程密切相关,并且是针对病原微生物的免疫反应中不可或缺的组成部分。在本研究中,为了评估小鼠脾细胞中的活性氧水平,使用了DCFH-DA探针。在感染沙门氏菌或鼠伤寒沙门氏菌48小时后,收集脾脏组织,并对活性氧浓度进行定量测定。伤寒沙门氏菌感染后脾脏菌载量极低(10³ CFU/g),但ROS水平显著高于高载菌的鼠伤寒沙门氏菌组(10⁸ CFU/g),提示ROS可能是独立于菌量的主动防御信号。为了研究ROS在伤寒沙门氏菌感染中的功能,采用ROS清除剂NAC来抑制ROS的产生导致菌量激增10倍(图7D,p < 0.05),直接证明ROS对限制感染的关键作用。
为了进一步确认ROS的来源,作者使用MitoSOX探针未检测到线粒体ROS的显著增加,说明ROS主要来源于细胞质。此外,作者对乳酸/丙酮酸比值做了检测。实验显示,乳酸/丙酮酸比值的增加先于ROS水平的显著升高,表明代谢重编程可能是导致ROS生成的上游机制。总之,这些发现表明伤寒感染诱导显著的代谢重编程,主要通过中性粒细胞介导的氧化应激(ROS产生)增强宿主的限制性免疫反应。
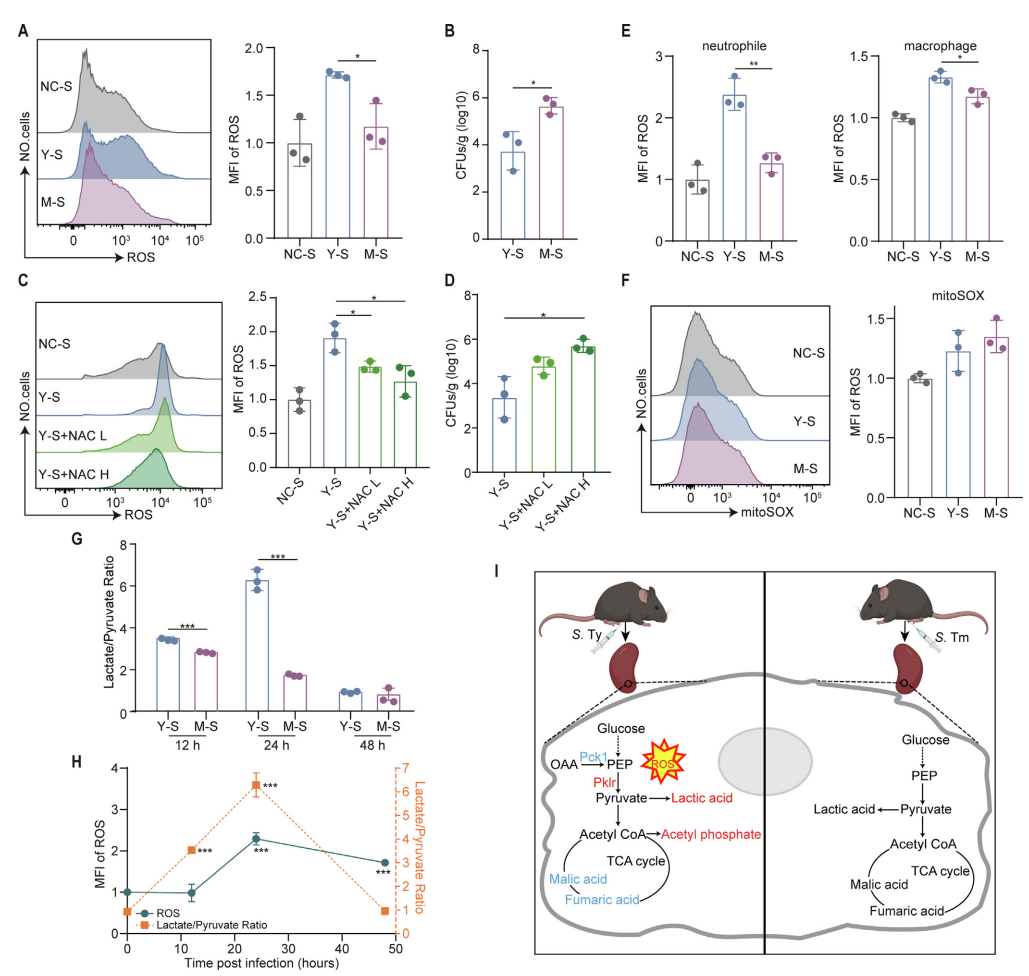
图7 小鼠脾脏中的氧化还原状态水平以及糖酵解重编程与对伤寒沙门氏菌感染的抵抗力有关
本文通过对小鼠脾脏组织的转录组、蛋白质组和代谢组变化进行综合分析。结果显示伤寒沙门氏菌感染小鼠会引发显著的代谢重编程,其主要特征是糖酵解途径的增强以及葡萄糖向丙酮酸的转化的促进,同时降低了三羧酸循环的活性。伤寒沙门氏菌感染的脾组织中乳酸产生增加,随后驱动增强ROS生成,这是一种基本的抗菌防御机制。这些观察结果为伤寒沙门氏菌感染期间的宿主代谢重编程提供了新的视角,并强调了代谢改变在调节宿主免疫防御中的潜在意义。
本项目欧易生物提供转录组、DIA蛋白组、LC-MSMS全谱代谢服务,通过对多个组学数据的总和分析,最终找到伤寒感染诱导宿主的分子机制。这些发现为伤寒沙门氏菌采用的宿主特异性策略提供了新的见解。
原文链接:https://doi.org/10.1016/j.jare.2025.05.027






