2025年6月16日,上海交通大学医学院附属第一人民医院王宏林团队在《Immunity》杂志上在线发表题为“Nociceptor-derived CGRP enhances dermal type I conventional dendritic cell function to drive autoreactive CD8+ T cell responses in vitiligo”的研究文章。本研究主要揭示了白癜风中黑素细胞被自身反应性CD8+ T细胞杀伤的关键机制:痛觉神经元释放的降钙素基因相关肽(CGRP)通过CALCRL受体增强1型常规树突细胞(cDC1)功能,进而强化CD8+ T细胞自身免疫反应。
本研究通过整合单细胞/空间转录组、遗传模型和临床试验,首次解析“痛觉感受器-CGRP-cDC1-CD8+T细胞”轴在白癜风中的驱动机制,为白癜风患者提供安全高效的疗法提供了新策略。
欧易生物参与了该项目空间转录组测序实验和分析工作。

发表期刊:Immunity
影响因子:26.3
方法:10x Genomics单细胞转录组测序、10×Genomics空间转录组
材料:
白癜风患者:4例未经治疗的白癜风皮损组织(病灶皮肤)
健康对照:4例健康人正常皮肤组织(来自整形手术残留样本)
每例样本分离表皮(Epidermis)和真皮(Dermis),分别进行单细胞测序;
额外3例白癜风患者皮肤进行空间转录组测序
白癜风是一种常见的自身免疫性皮肤病,其特征是皮肤上出现白斑,浸润皮损的CD8⁺ T细胞分泌IFN-γ,诱导角质形成细胞产生CXCL9/10,招募更多CXCR3⁺CD8⁺ T细胞,形成炎症放大环路。
JAK抑制剂(如鲁索替尼乳膏)通过阻断IFN-γ信号成为首个获批药物,但临床应答率仅30%,传统免疫抑制剂疗效有限且安全性差,亟需针对新靶点的新疗法。

Result 1 CGRP+痛觉感受器与真皮层cDC1细胞间的相互作用在白癜风病变皮肤中的研究
作者对来自4名白癜风患者和4名健康受试者的个体表皮和真皮细胞进行了单细胞RNA测序(scRNA-seq),鉴定出12个免疫细胞亚群(图1A)。发现白癜风皮损中CD8⁺组织驻留记忆T细胞(CD8⁺ TRM)显著富集,其增殖评分高而细胞毒性/耗竭评分低,呈现"干细胞样"特性。拟时序轨迹分析进一步揭示了从初始状态的干细胞样CD8⁺ TRM细胞,到中间状态的CD8⁺ TEM_1细胞,再到终末状态的耗竭CD8⁺ TEM_2细胞的发展轨迹。
自身反应性 CD8⁺ T 细胞的激活需要由主要组织相容性复合物 (MHC)-肽复合物和APCs表面表达的共刺激分子触发。尽管之前的研究表明CD11c⁺ DCs 在人类和小鼠模型中对白癜风的进展至关重要,但确切的亚群和潜在调节因子仍未确定。基于单细胞数据,作者在白癜风和健康皮肤中检测到三个常规 DC 亚群:cDC1 (CLEC9A⁺/PRF3⁺)、CCR7⁺ cDC (CCR7⁺/IL1B⁺) 和 cDC2 (CLEC10A⁺/CD1E⁺)。为了确定哪个亚群主要负责启动 CD8⁺ T 细胞反应,进行了空间转录组分析,以可视化来自三名白癜风患者的皮肤切片上的 cDC-CD8⁺ T 细胞相互作用(图 1A )。空间转录组学证实cDC1(CLEC9A⁺/XCR1⁺)与IFNG⁺CD8⁺ T细胞共定位率(78.3%)显著高于CCR7⁺ cDC(21.4%)和cDC2(9.1%)。白癜风cDC1高表达DC成熟基因和CGRP受体复合物CALCRL-RAMP1,而CGRP基因(CALCA/CALCB)在免疫细胞中低表达(图 1C, D)。
先前的研究报告称,支配皮肤的痛觉感受器是 CGRP 的主要来源。这些痛觉感受器可以通过分泌神经肽 CGRP 靶向局部巨噬细胞、真皮 DCs (dDCs) 和中性粒细胞来调节皮肤感染和炎症。然而,痛觉感受器衍生的 CGRP 在白癜风发病机制中的作用尚未确定。作者通过全组织包埋染色分析了白癜风受累皮肤和健康对照中的 CGRP⁺ 神经纤维和 cDC1s,结果显示,CGRP⁺ 神经纤维和 cDC1s 在白癜风受累皮肤中均显著富集,并且在 CGRP⁺ 神经末梢附近观察到真皮 cDC1s,这突显了可能的神经免疫交流(图 1G–J)。
总的来说,以上发现表明 CGRP⁺ 痛觉感受器可能靶向真皮 cDC1s 来调节白癜风中的自身反应性 CD8⁺ T 细胞反应。
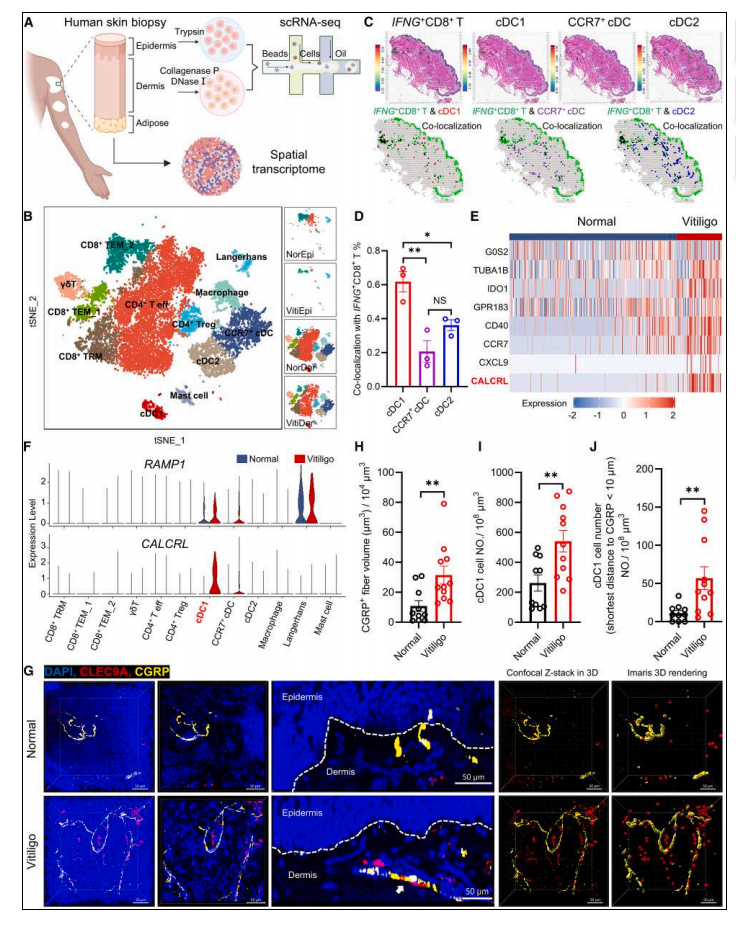
图1.CGRP+痛觉感受器与真皮cDC1在白癜风病变皮肤中的相互作用
Result 2白癜风诱导小鼠中 CGRP⁺痛觉感受器和真皮 cDC1s增加
为了研究痛觉感受器在白癜风中的潜在作用,作者建立了一个重现白癜风患者病理学的黑色素瘤诱导小鼠模型:在白癜风诱导程序后,小鼠逐渐出现白毛和尾部皮肤脱色,并伴有显著的 CD8⁺ T 细胞浸润和表皮黑色素细胞破坏。作者利用 Naᵥ1.8-tdTomato (Naᵥ1.8-tdT) 感觉神经元报告小鼠来标记支配皮肤的痛觉感受器。体内荧光成像显示白癜风皮肤中的 tdTomato 信号强度显著增加(图2A,B),全组织成像证实Naᵥ1.8⁺/CGRP⁺痛觉感受器在背根神经节(DRG)、背部和尾部皮肤富集(图2C–F)。离体培养的DRG神经元和皮肤外植体中CGRP释放增加(图2 G–I)。流式分析显示白癜风小鼠真皮cDC1数量显著高于对照组,与患者数据一致(图2J)。
综上,表明白癜风诱导小鼠中 CGRP⁺痛觉感受器和真皮 cDC1s 增加。
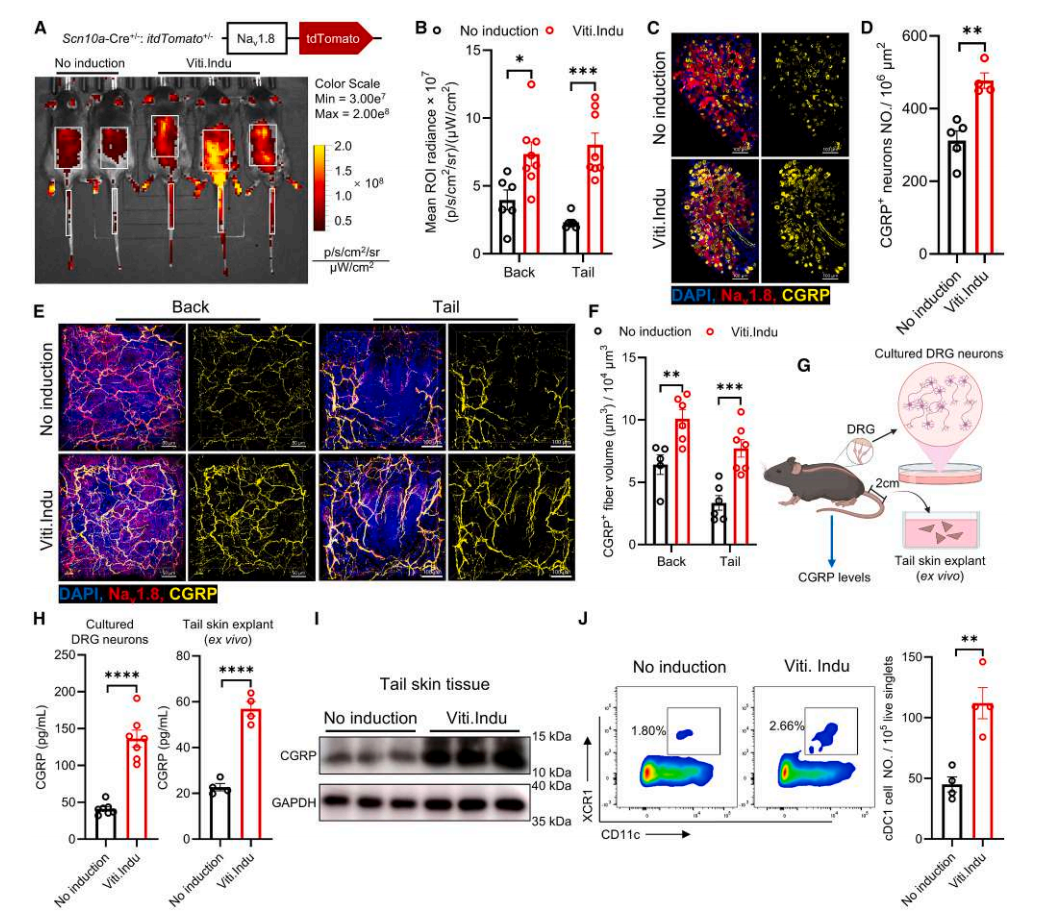
图2. 白癜风诱导小鼠中 CGRP⁺痛觉感受器和真皮 cDC1s 增加
Result 3 痛觉感受器衍生的 CGRP 是小鼠驱动白癜风所必需的
为了研究 CGRP⁺ 痛觉感受器是否在小鼠白癜风的发展起作用,作者将 Naᵥ1.8-tdT 小鼠与Rosa26-iDTR 小鼠杂交,以产生 Naᵥ1.8-tdT-DTR 小鼠(图 3A)。Naᵥ1.8⁺ 痛觉感受器通过随后腹腔注射白喉毒素 (DT) 被消融。接下来对 Naᵥ1.8-tdT-DTR 小鼠和 Naᵥ1.8-tdT 同窝小鼠进行 DT 注射的白癜风诱导程序,通过体内荧光成像和全组织成像证实了产生 CGRP 的 Naᵥ1.8⁺ 痛觉感受器的消融(图3B,C)。作者观察到去神经支配后培养的 DRG 神经元和尾部皮肤外植体(离体)中 CGRP 释放显著减少(图3D),这进一步证实了CGRP 来源于支配皮肤的痛觉感受器。在相同的白癜风诱导程序后,Naᵥ1.8-tdT-DTR 小鼠表现出尾部皮肤脱色减轻,伴有减弱的 CD8⁺ T 细胞浸润和黑色素细胞破坏(图 3E-G)。同时,Naᵥ1.8-tdT-DTR 小鼠尾部真皮 cDC1s 的数量显著减少,表明痛觉感受器对真皮 cDC1s 的扩增具有潜在的控制作用(图 3H)。
为了进一步证实痛觉感受器衍生的 CGRP 在白癜风发展中的作用,作者用外源性 CGRP 肽处理痛觉感受器消融的小鼠(图 3I)。结果显示,给予 CGRP 后,小鼠的白癜风特征得以恢复(图 3J-M)。
总之,以上数据揭示了在黑色素瘤诱导的白癜风小鼠模型中痛觉感受器可能是通过分泌 CGRP 来促进真皮 cDC1s 的扩增和功能驱动自身免疫反应。
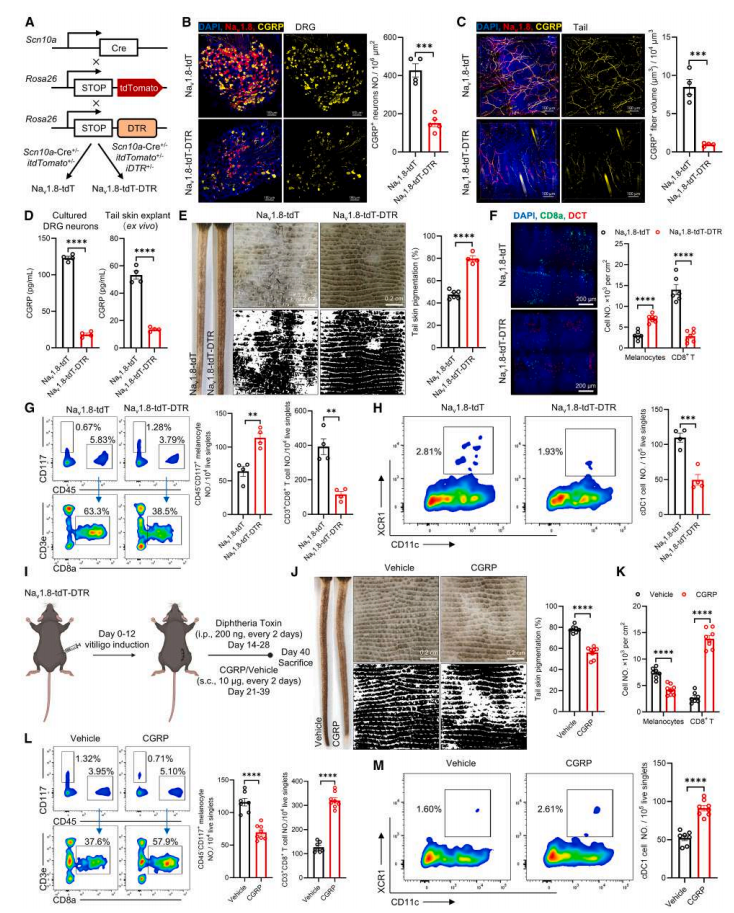
图3. CGRP 是小鼠驱动白癜风所必需的
Result 4 真皮 cDC1s 是触发小鼠自身反应性 CD8⁺T细胞反应所必需的
为了研究白癜风中的真皮 cDC1s在白癜风发展中的作用,作者将 Xcr1-Cre 小鼠与 Cre 依赖的 Rosa26-itdTomato 小鼠杂交,以产生 cDC1 报告 (Xcr1-tdTomato) 小鼠(图 4A)。在黑色素瘤诱导的白癜风小鼠模型的第 40 天,全组织图像显示真皮 cDC1s 增加并显示出更大的体积和树突状形态(图 4B,C)。这些过度活跃的 cDC1s 在尾部和背部皮肤中靠近 CGRP⁺ 神经纤维,这表明在白癜风诱导小鼠中存在 CGRP⁺ 痛觉感受器与真皮 cDC1s 之间的功能性交流(图4D)。
接下来进一步探究 cDC1 消融或扩增是否会导致白癜风进展的变化,结果显示,cDC1s 的缺失显著消除了 CD8⁺ T 细胞浸润,且减弱了黑色素瘤诱导的白癜风小鼠模型中的皮肤脱色(图4E-I)。
以上数据表明,在黑色素瘤诱导的白癜风小鼠模型中,真皮 cDC1s 是自身反应性 CD8⁺ T 细胞反应的有效触发者。
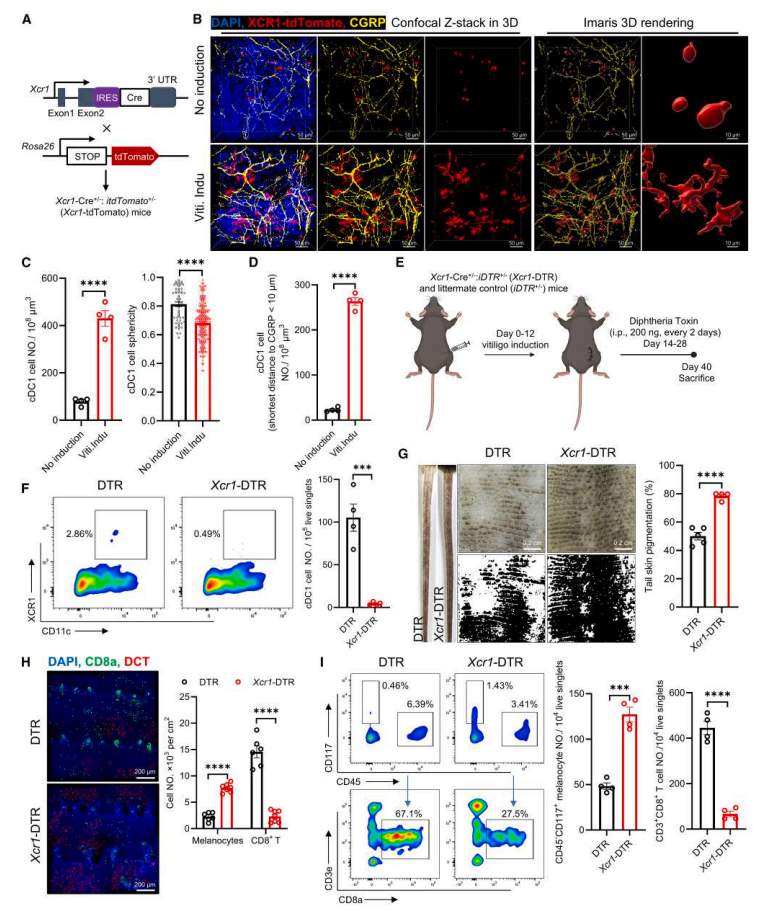
图4.真皮cDC1s是触发小鼠自身反应性CD8+T 细胞反应所必需的
Result 5 真皮 cDC1s 通过 CGRP-CALCRL 轴受痛觉感受器调控
由于CGRP⁺神经纤维在人类和白癜风小鼠的真皮 cDC1s 附近非常接近,作者假设痛觉感受器可能通过神经肽 CGRP 直接向 cDC1s 发出信号,以促进 cDC1-CD8⁺ T 细胞相互作用。通过转录组数据分析以及免疫染色进一步证实CALCRL 和 RAMP1 蛋白主要在白癜风诱导小鼠和白癜风患者的皮肤真皮 cDC1s 中表达(图 5A, B)。揭示了真皮 cDC1s 表达 CGRP 受体的两个组分 CALCRL 和 RAMP1,并且可以被 CGRP⁺ 痛觉感受器调节。
作者接下来将 Calcrl fl/fl 小鼠与 Xcr1-Cre小鼠杂交,以特异性消融 cDC1 中的 CALCRL (Xcr1-Cre⁺/⁻: Calcrl fl/fl,cKO 小鼠)(图5D),在相同的白癜风诱导程序后,与 Flox 小鼠相比,cKO 小鼠具有更少的表皮 CD8⁺ T 细胞、更多的表皮黑色素细胞和更少的真皮 cDC1s,这通过尾部皮肤较轻微的脱色得到证实(图5 E-H)。
基于这些结果,作者得出结论:痛觉感受器通过 CGRP-CALCRL 轴靶向 cDC1s 以驱动白癜风中的自身免疫反应。
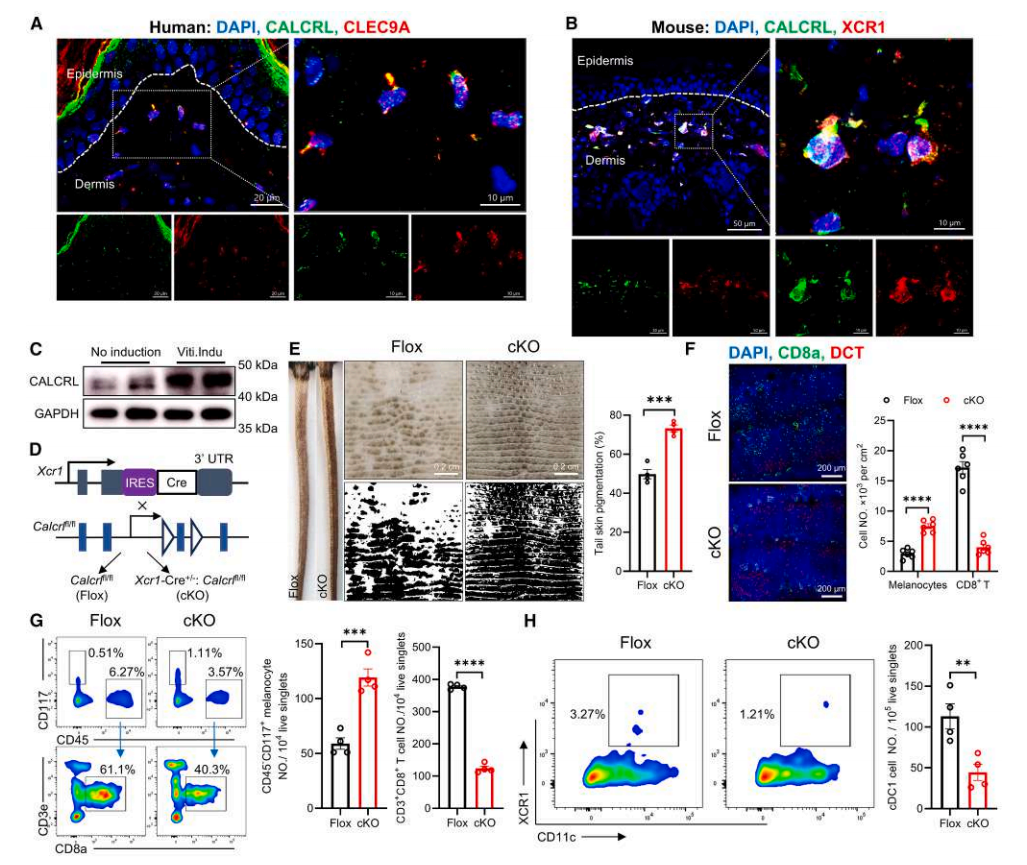
图5.真皮 cDC1s 通过 CGRP-CALCRL 轴受痛觉感受器调控
Result 6 痛觉感受器衍生的 CGRP 信号传导增强 cDC1-CD8⁺ T 细胞相互作用
接下来作者做了一系列实验探索痛觉感受器衍生的 CGRP 对 cDC1s的影响,结果显示,痛觉感受器共培养和 CGRP 处理都增强了 cDC1s 激活初始 CD8⁺ T 细胞的能力,表明 cDC1s 的抗原呈递增强(图6B, C)。通过对cDC1s进行痛觉感受器共培养或 CGRP 处理,探讨其对 IFN-γ⁺CD8⁺ T 细胞 (Tc1) 分化的直接影响,发现与未经处理的 cDC1s 相比,痛觉感受器共培养和 CGRP 处理的 cDC1s 都显著增加了 Tc1 的百分比(图6D, E)。
总之,这些数据支持 CGRP 是主要的痛觉感受器衍生信号,可增强 cDC1s 的功能以启动和扩增细胞毒性 CD8⁺ T 细胞反应。
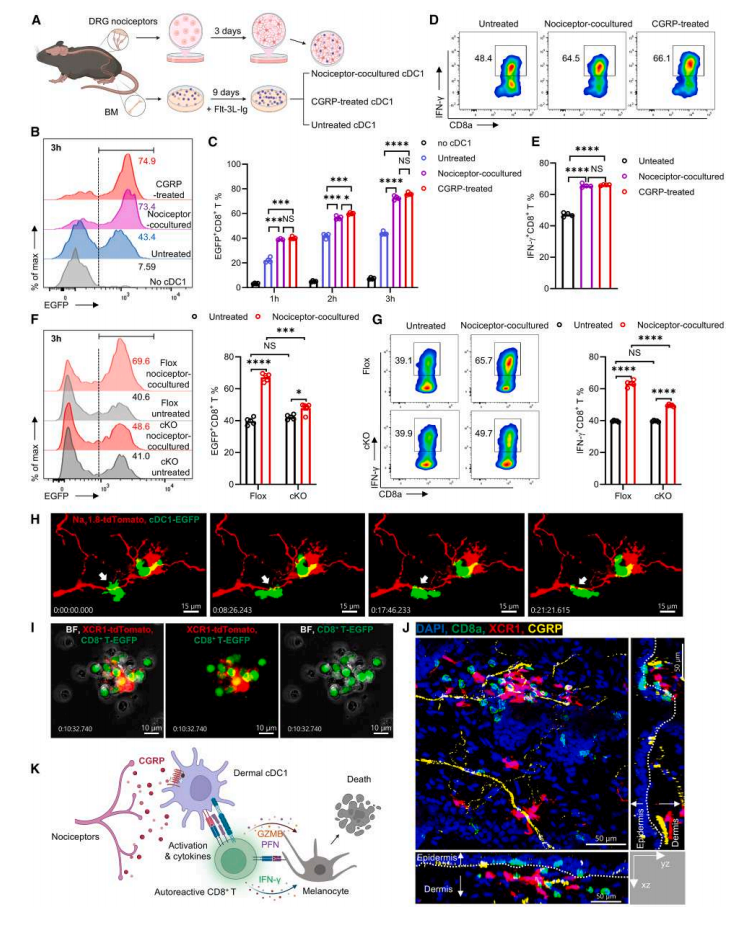
图6.CGRP信号增强了cDC1-CD8+ T细胞的相互作用
Result 7 CGRP 受体拮抗剂治疗减轻白癜风诱导小鼠和白癜风患者的皮肤脱色
接下来,作者进一步验证了CGRP与白癜风发展的相关性。使用CGRP受体拮抗剂rimegepant或JAK抑制剂鲁索替尼治疗均减轻了小鼠白癜风,rimegepant更加显著的降低了真皮cDC1数量。初步临床试验(57例患者)显示:0.1% rimegepant软膏单用(A组)或联用窄谱UVB(B/C组)6-12周后,面部/躯干皮损复色率显著优于安慰剂,且无不良反应(图7A-L)。
这些临床数据表明,局部应用 CGRP 受体拮抗剂 (rimegepant) 可以缓解白癜风患者的皮肤脱色。结合小鼠模型实验和初步研究,证明了 CGRP 受体拮抗剂代表了一种安全且有靶向性的白癜风治疗候选药物。
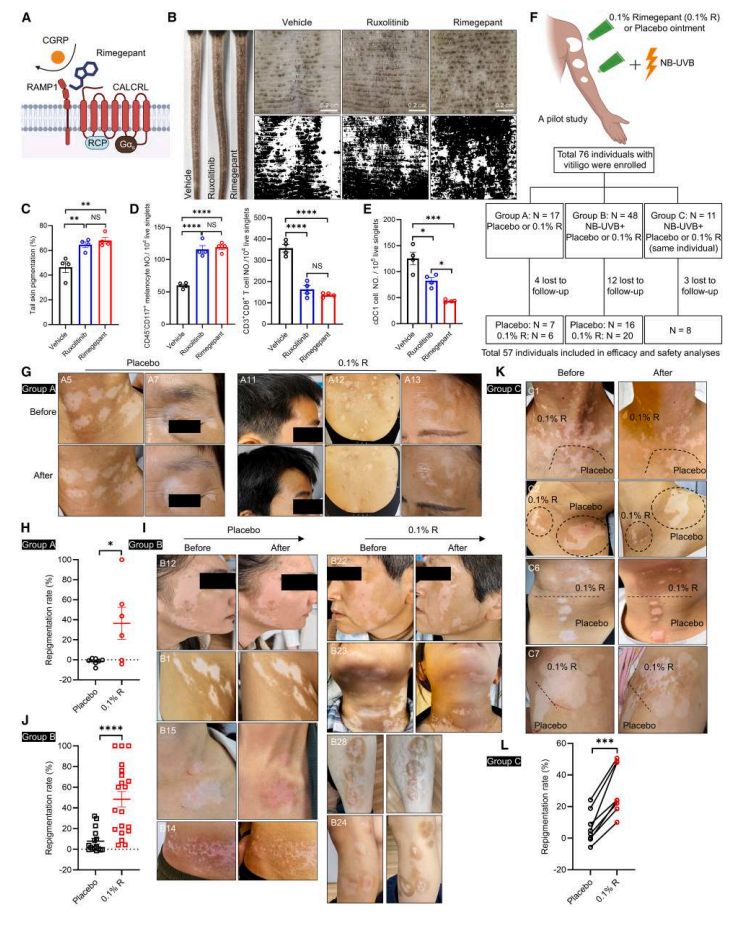
图7.CGRP受体拮抗剂治疗可减轻小鼠和人类的白癜风
这篇文章的核心内容集中在揭示痛觉感受器-树突状细胞-免疫轴在白癜风发病中的关键作用:皮肤痛觉感受器分泌神经肽CGRP,通过结合真皮cDC1细胞(1型经典树突状细胞)的CALCRL-RAMP1受体,增强其抗原呈递功能,进而激活自身反应性CD8⁺T细胞杀伤黑色素细胞。靶向CGRP受体可阻断该通路,为白癜风治疗提供新策略。
以下是主要的研究总结:
1. 单细胞转录组和空间转录组揭示白癜风皮损中I 型常规树突状细胞 (cDC1s) 激活了 CD8⁺T细胞,且与CGRP⁺神经纤维共定位;
2. 痛觉感受器通过 CGRP-CALCRL 轴增强真皮 cDC1 功能;
3. CGRP 信号传导增强 cDC1-CD8⁺ T 细胞相互作用;
4. 阻断神经元 CGRP 信号传导可缓解白癜风。
参考文献:
Yang X, Ding W, Lou F, Xu H, Sheng A, Sun Y, Cai X, Zhou M, Lin F, Jin R, Zheng X, Wang Z, Deng S, Xu Z, Zhang T, Cheng J, Zheng X, Xu A, Wang H. Nociceptor-derived CGRP enhances dermal type I conventional dendritic cell function to drive autoreactive CD8+ T cell responses in vitiligo. Immunity. 2025 Jun 10:S1074-7613(25)00239-0.
doi: 10.1016/j.immuni.2025.05.018. Epub ahead of print. PMID: 40527324.
【欧易生物点评】
本研究基于单细胞和空间转录组揭示痛觉感受器-树突状细胞-免疫轴在白癜风发病中的关键作用:皮肤痛觉感受器分泌神经肽CGRP,通过结合真皮cDC1细胞的CALCRL-RAMP1受体,增强其抗原呈递功能,进而激活自身反应性CD8⁺T细胞杀伤黑色素细胞。
此文逻辑严谨,基于组学数据的挖掘与探索找到关键机制,后结合大量的湿实验验证结论,最后落脚于实际临床,为白癜风治疗提供了新策略。






