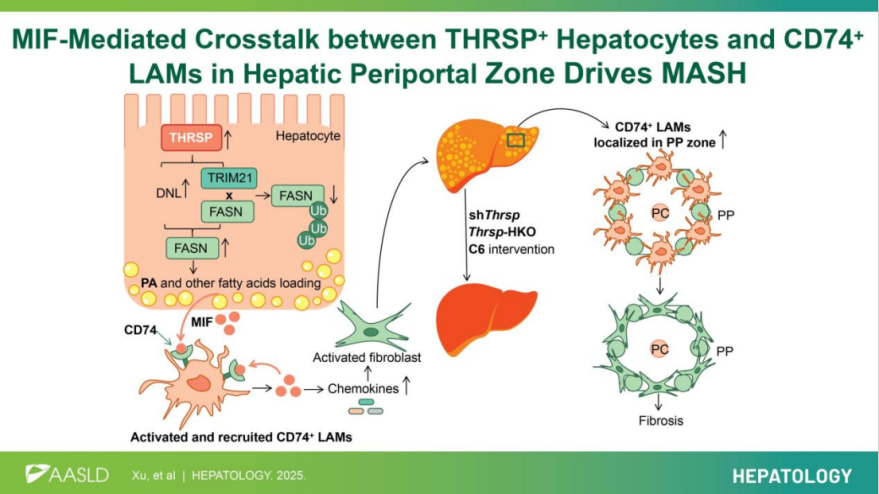
2025年7月1日,上海交通大学医学院附属第六人民医院耳鼻咽喉头颈外科殷善开和刘峰团队在Hepatology(IF 15.8 )上发表了题为“MIF-mediated crosstalk between THRSP+ hepatocytes and CD74+ lipid-associated macrophages in hepatic periportal zone drives MASH”的研究论文。作者利用多组学方法(空间转录组(ST)、单核RNA测序(snRNA-seq)及脂质组学)描绘了MAFL向MASH进展中肝脏的空间分区,并确定THRSP是其核心驱动因素。该研究揭示了肝细胞-巨噬细胞互作的空间特异性机制,为MASH的精准治疗提供了新靶点。欧易生物提供了单细胞核转录组测序。

发表期刊:Hepatology
影响因子:15.8
涉及的欧易生物服务产品:单细胞核转录组测序
代谢功能障碍相关脂肪性肝病 (MASLD) 作为代谢综合征在肝脏的主要临床表现,已成为全球发病率最高的慢性肝病。该疾病涵盖从非进展性的肝脂肪变性(MAFL)到进展性脂肪性肝炎(MASH)的病理组织学谱系。与MAFL相比,MASH显著增加肝病相关死亡和心血管事件风险。脂肪变性的空间位置与MASH的进展密切相关,有研究指出脂质相关巨噬细胞(LAMs)促进了MASH的进展,但其潜在机制仍不清楚。该研究揭示了THRSP驱动MASH进展的新机制,创新性地提出巨噬细胞迁移抑制因子(MIF)介导的肝脏门管区THRSP+肝实质细胞与CD74+脂质相关巨噬细胞(LAMs)间细胞通讯驱动MASH。
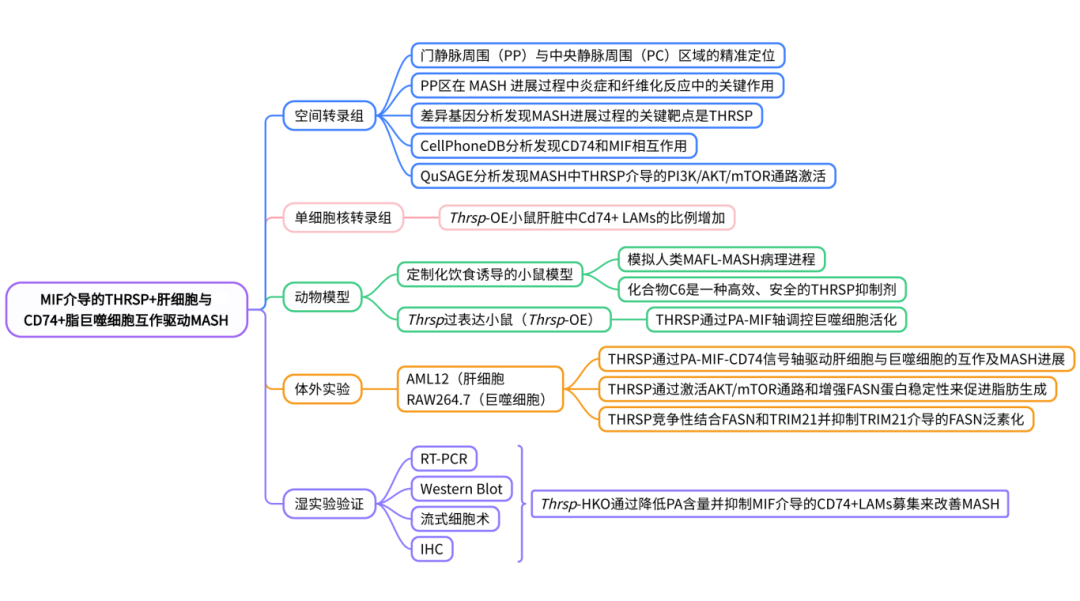
本研究通过构建了定制化饮食诱导的小鼠模型,成功模拟人类MAFL向MASH进展的病理特征。利用多组学方法(ST、snRNA-seq及脂质组学)系统描绘了肝脏在MAFL-MASH进程中的空间异质性,并鉴定出THRSP作为关键驱动因子。机制研究表明,THRSP通过促进棕榈酸(PA)诱导的MIF分泌(尤其是在肝门静脉周围PP区)募集CD74+LAMs,从而通过肝细胞-巨噬细胞串扰驱动脂肪性肝炎进展。这一PP区特异性的THRSP-MIF-CD74调控轴的发现,为MASH的精准靶向治疗提供了新策略。
Result 1 MAFL和MASH小鼠肝脏的分区特征
研究者构建了定制化饮食诱导的小鼠模型,成功模拟人类MAFL-MASH病理进程。通过10x Visium空间转录组学分析了两个疾病阶段的新鲜肝脏组织(图 1A),结合单核RNA测序数据(GSE192742)进行细胞空间定位分析(cell2location),降维分析得到11 个具有疾病阶段特异性的肝细胞亚群(图 1B-C)。利用经典标记基因(PC区:Oat;PP区:Sds)实现门静脉周围(PP)与中心脉周围(PC)区域的精准定位(图1D)。差异基因表达分析表明,MASH 组显著上调抗原加工/呈递(Cd74、H2-Aa、H2-Ab1)、脂质相关巨噬细胞(LAMs)(Trem2、Cd9、Gpnmb)、脂质代谢(Lpl、Pltp、Fabp7)和纤维化(Mmp12)相关的标记基因(图1E)。QuSAGE通路分析表明MASH的PP区特异性富集DNL、纤维化、炎症反应和PI3K/AKT信号通路(图1F)。此外,ST数据分析表明,在MASH的PP区髓系细胞浸润增加(单核细胞及其衍生细胞、库普弗细胞)(图 1G),LAMs标志物(Trem2、Gpnmb、Spp1)和肝星状细胞标志物Col3a1表达也显著上调(图 1H-I)。这些结果表明PP区作为MASH进程中炎症-纤维化网络调控的核心区域。
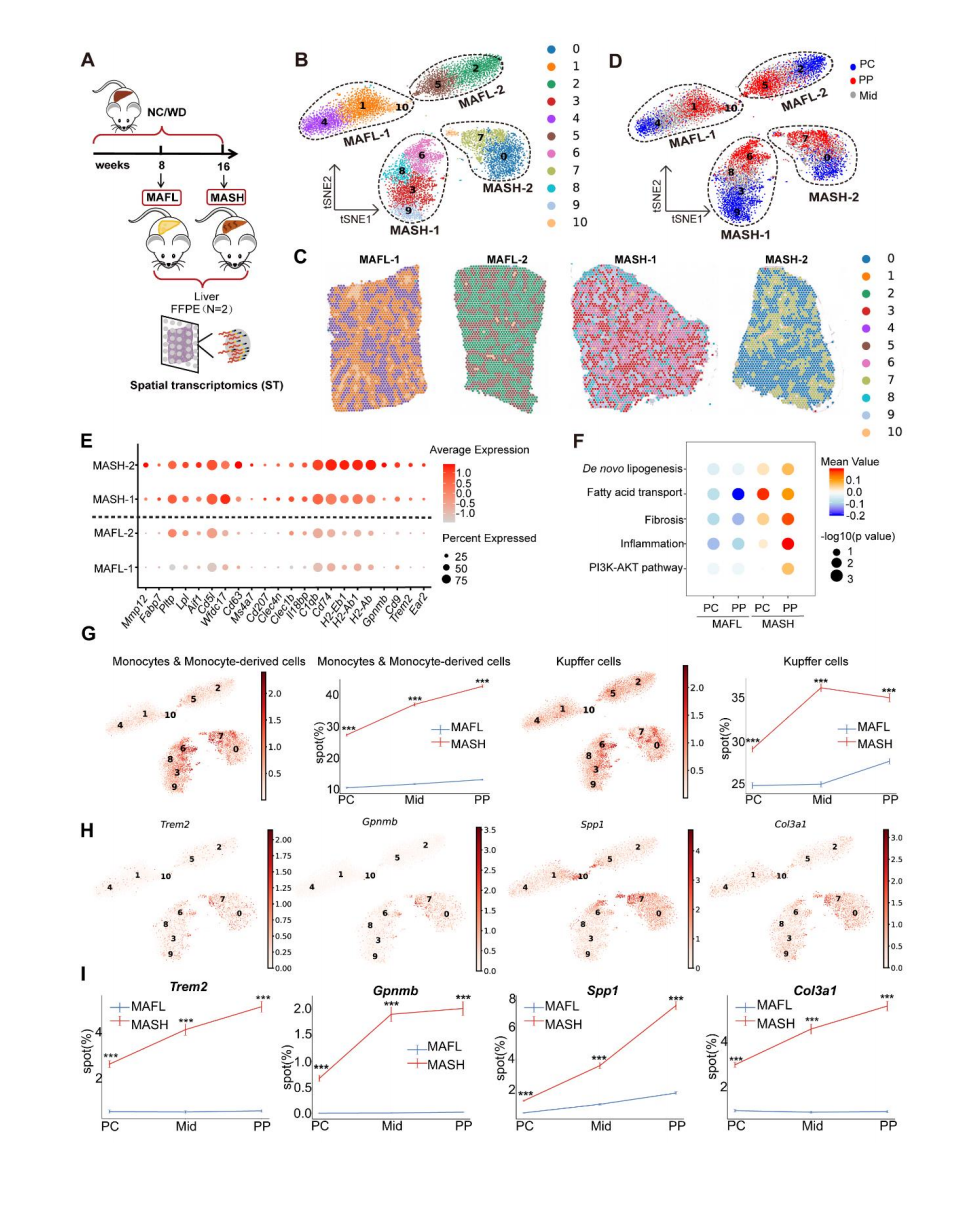
图1 MAFL和MASH小鼠肝脏的分区特征
Result 2 THRSP上调驱动CD74+ LAMs向PP区的募集并促进MASH进展
MAFL和MASH组的差异基因分析发现,Thrsp因其在肝脏脂肪生成中的关键作用被确定为潜在调控靶点(图2A)。ST数据分析表明,与MAFL相比,MASH肝脏中Thrsp的表达显著升高(图2B),并通过RT-qPCR和免疫印迹验证(图2C-E)。进一步对临床样本进行组织学分析(NAS评分,图2G)发现,MASH患者的THRSP蛋白水平显著增加(图2F,H),表明THRSP在人类MASH进展中发挥关键作用。
为了解析THRSP驱动MASH的分子机制,作者聚焦于Thrsp高表达区域(Cluster 0和Cluster 7),CellPhoneDB互作分析发现,Cluster 0(配体)与Cluster 7(受体)之间存在显著的MIF-CD74信号轴(图2I),且MIF(配体)与CD74(受体)在MASH的PP区共表达增强。Thrsp高表达区与LAMs标志物(Trem2、Gpnmb)及肝星状细胞标志物Col3a1呈现空间共定位(图2J-L)。mIHC及定量分析进一步证实,MASH肝脏中CD74与THRSP表达增加,CD74+巨噬细胞在脂质滴周围形成特征性“冠状结构”(图2M-N)。结果表明THRSP通过脂质代谢重编程介导CD74+ LAMs向PP区募集,进而驱动MASH进展。
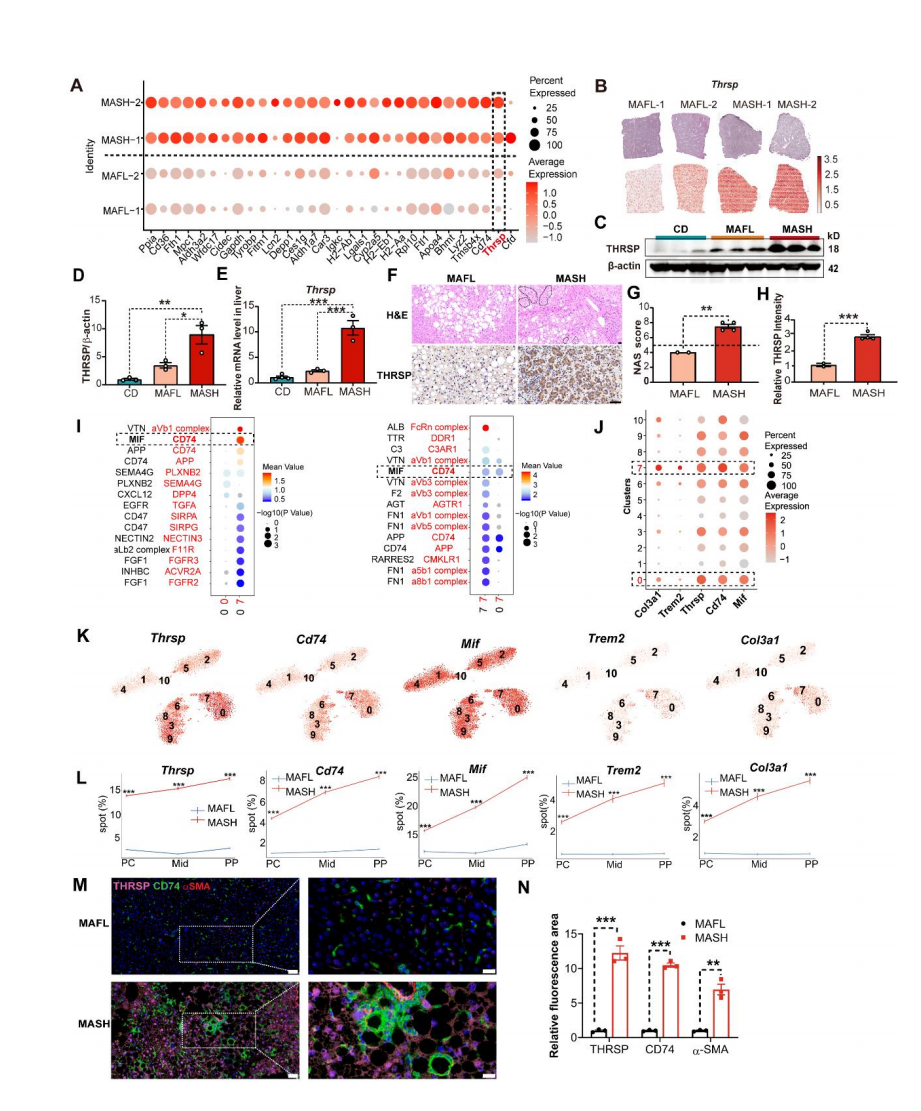
图2 THRSP在MASH肝脏中过表达并招募CD74+ LAMs至门静脉周围
Result 3 THRSP通过PP区PA的积累和MIF驱动CD74+LAMs的募集来加剧MASH
作者构建了肝细胞特异性Thrsp过表达小鼠(Thrsp-OE),探究其对MASH进展的直接影响。AAV8-Thrsp注射后,WB和RT-qPCR证实肝脏中Thrsp表达显著升高(图3A-B)。与对照组相比,Thrsp-OE小鼠的肝重量、肝体重比和胰岛素抵抗显著增加(图3C-E),脂质积累、炎症浸润、纤维化和肝损伤也显著升高(图3F-K)。代谢组学分析显示,Thrsp-OE小鼠在WD诱导的MASH中长链脂肪酸(LCFAs)水平升高,其中棕榈酸(PA)的积累最为显著(图3L-M),此外,Thrsp-OE促进血清MIF释放(图3N),snRNA-seq揭示Thrsp-OE小鼠肝脏中LAMs及CD74+ LAMs比例增加(图3O),mIHC证实Thrsp-OE小鼠PP区CD74+ LAMs浸润及纤维化加剧(图3P),表明THRSP通过PA-MIF轴调控巨噬细胞活化。
为验证PA是否直接参与THRSP依赖的巨噬细胞活化,作者建立了AML12(肝细胞)-RAW264.7(巨噬细胞)共培养体系(图3Q),Thrsp-OE AML12的条件培养基(CM)可上调肝细胞和巨噬细胞中MIF的释放,且PA刺激进一步强化该效应(图3S)。在Thrsp敲低模型中,外源PA可恢复Thrsp敲低引起的肝细胞和巨噬细胞的MIF分泌水平(图3R, T),证实PA是THRSP-CD74+ LAMs互作的关键介质。研究表明THRSP通过PA-MIF-CD74信号轴驱动肝细胞与巨噬细胞的互作,从而促进MASH的炎症及纤维化进程。
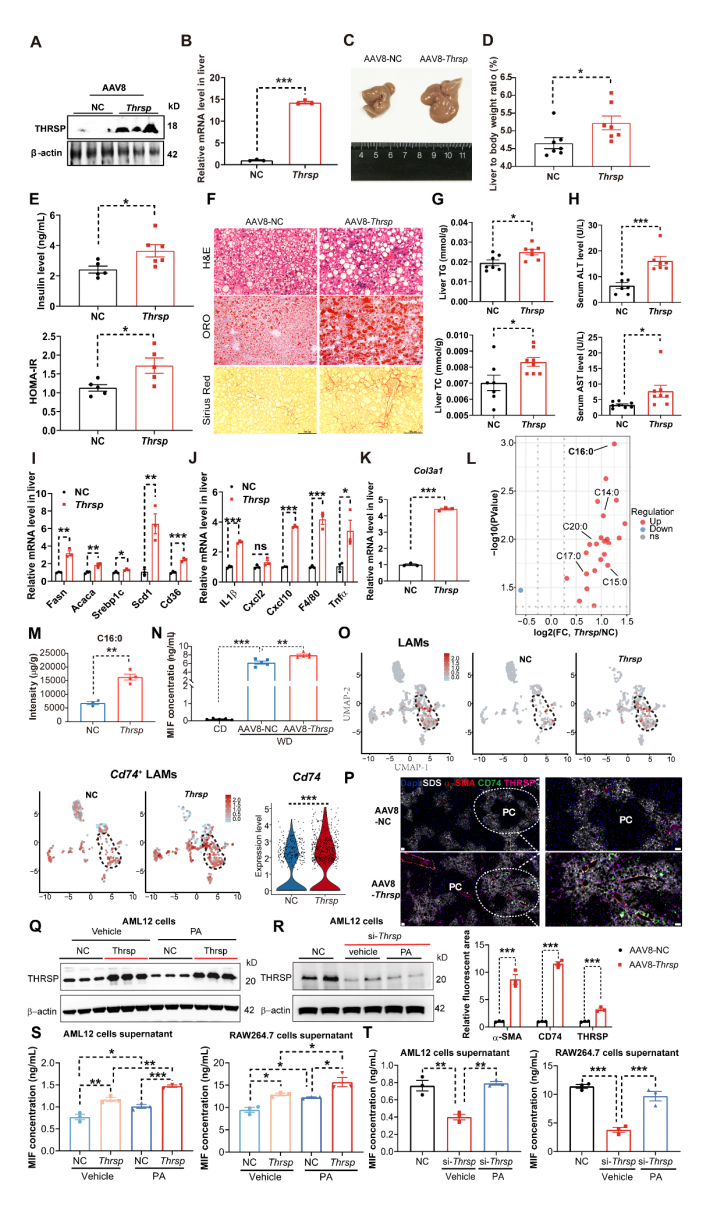
图3 Thrsp-OE 通过PA的积累和MIF驱动CD74+LAMs的募集加剧MASH
Result 4 MASH中THRSP介导的PI3K/AKT/mTOR通路激活促进胰岛素应答
基于MAFL和MASH小鼠肝脏转录组数据,通过KEGG数据库进行QuSAGE富集分析发现,MASH小鼠肝脏中与PI3K/AKT/mTOR通路、DNL、炎症反应和纤维化相关的基因集均显著富集(图4A)。通过激素调控网络发现,甲状腺激素信号通路、胰岛素信号通路、PI3K/AKT/mTOR通路以及抗原呈递相关基因集表现出显著的协同激活特征(图4B-D)。WB实验进一步证实PI3K/AKT/mTOR通路关键蛋白的磷酸化水平和纤维化相关蛋白水平均显著升高(图4E-H)。在AML12细胞系中检测了胰岛素刺激对THRSP表达的影响,发现胰岛素处理以剂量和时间依赖性方式显著上调了THRSP、FASN和p-AKT的水平(图4I-L)。这些结果表明,胰岛素可通过激活PI3K/AKT/mTOR通路促进THRSP表达,而THRSP与DNL关键酶在MASH进程中存在协同上调。
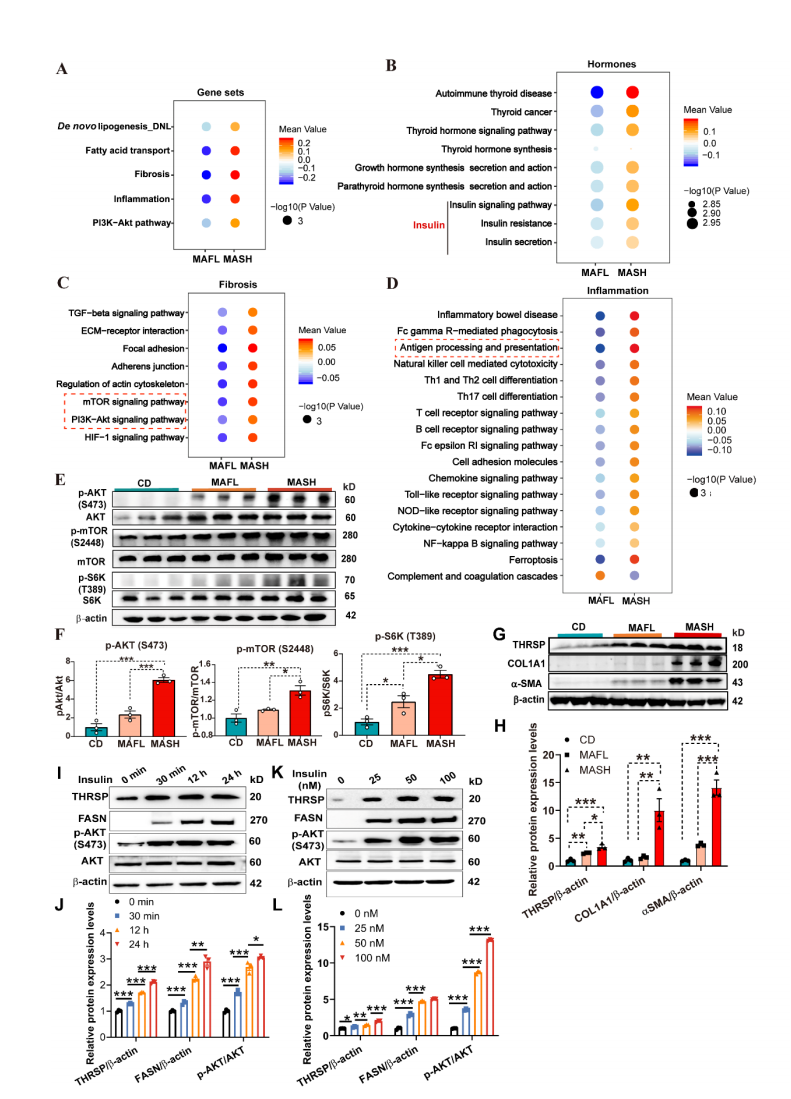
图4 MASH中THRSP介导的PI3K/AKT/mTOR通路激活促进胰岛素应答
Result 5 THRSP通过激活AKT/mTOR通路和增强FASN蛋白稳定性来促进脂肪生成
为了明确THRSP在脂肪生成中的作用,作者在小鼠原代肝细胞中进行功能获得和功能丧失实验。油红O(ORO)染色显示,Thrsp-OE促进脂质积累,而si-Thrsp则抑制脂肪生成(图5A-B)。在AML12细胞中,稳定过表达Thrsp可激活AKT/mTOR信号通路并上调FASN表达,且这一作用不依赖于胰岛素。相反,AKT抑制剂可显著抑制mTOR信号、FASN表达及THRSP自身水平(图5C-F),表明THRSP通过胰岛素依赖性和非依赖性双重机制调控脂肪生成。
为进一步探究THRSP如何通过非胰岛素依赖途径促进FFA合成,首先在体内评估THRSP与FASN的相互作用。免疫荧光分析显示,在Thrsp-OE MASH小鼠肝脏中,THRSP与FASN的共定位显著增强(图5G-H)。Co-IP实验进一步证实,THRSP可直接结合FASN,且结合强度随THRSP过表达增加而增强,但受AKT抑制而减弱(图5I)。在AML12细胞中转染Thrsp-Flag或空载体并使用CHX处理后发现,THRSP过表达可显著延缓FASN降解(图5J)。在Thrsp过表达的细胞中,FASN蛋白半衰期明显延长(图5K),表明THRSP可能通过结合并稳定FASN,促进FFA合成。
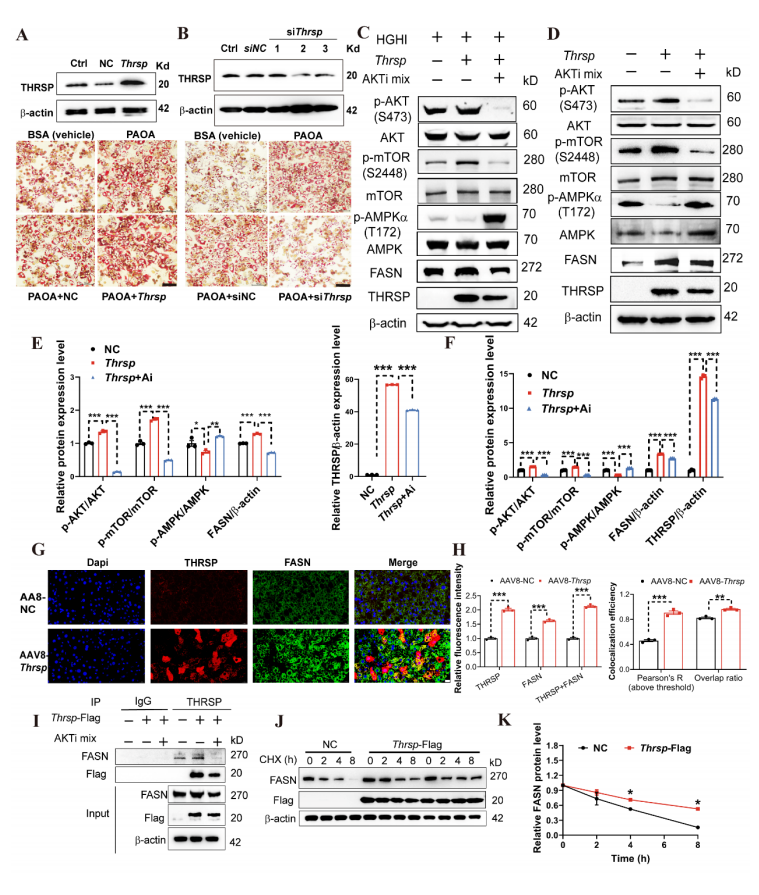
图5 THRSP通过激活AKT/mTOR通路和增强FASN蛋白稳定性来促进脂肪生成
Result 6 THRSP竞争性结合FASN/TRIM21并破坏其相互作用,从而增强FASN稳定性
在Thrsp-OE AML12细胞中进行了抗THRSP的免疫沉淀-质谱联用分析(IP-MS),在筛选出的候选蛋白中,E3泛素连接酶TRIM21尤为突出(图6A)。进一步探究了THRSP、FASN与TRIM21之间的相互作用,Co-IP实验结果表明,Thrsp-OE显著降低了FASN的泛素化水平,增强了THRSP-FASN和THRSP-TRIM21的结合(图6B-G)。用蛋白酶体抑制剂MG132处理后,发现FASN明显积累(图6H),而自噬抑制剂氯喹CQ处理后则未发现变化(图6I),综上,THRSP通过竞争性结合TRIM21,抑制其介导的FASN泛素化-蛋白酶体降解途径,从而增强FASN蛋白稳定性。
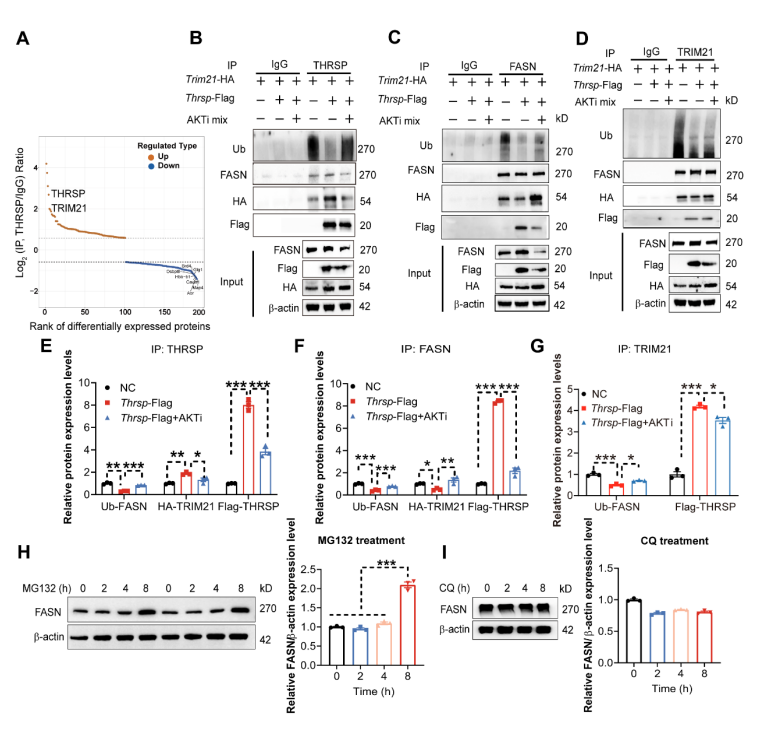
图6 THRSP竞争性结合FASN和TRIM21并抑制TRIM21介导的FASN泛素化
Result 7 Thrsp-HKO通过减少肝脏PA积累和PP区MIF介导的CD74+ LAMs募集来改善MASH
通过WB检测证实了肝脏组织中Thrsp的敲除(图7A-B),Thrsp-HKO显著降低了肝重量和肝体重比,减少了脂质沉积、炎症浸润、纤维化程度和肝损伤,改善了糖耐量(图7C-M),而血清中MIF含量显著降低(图7N)。流式细胞术结果表明,Thrsp-HKO显著降低了肝脏单核细胞中PA含量和CD74+细胞比例(图7O-P)。IHC进一步证实,Thrsp-HKO显著降低了肝脏中THRSP和CD74蛋白水平(图7Q-R)。结果表明,Thrsp-HKO通过改善MASH来降低肝脏PP区PA含量并抑制MIF介导的CD74+LAMs募集。
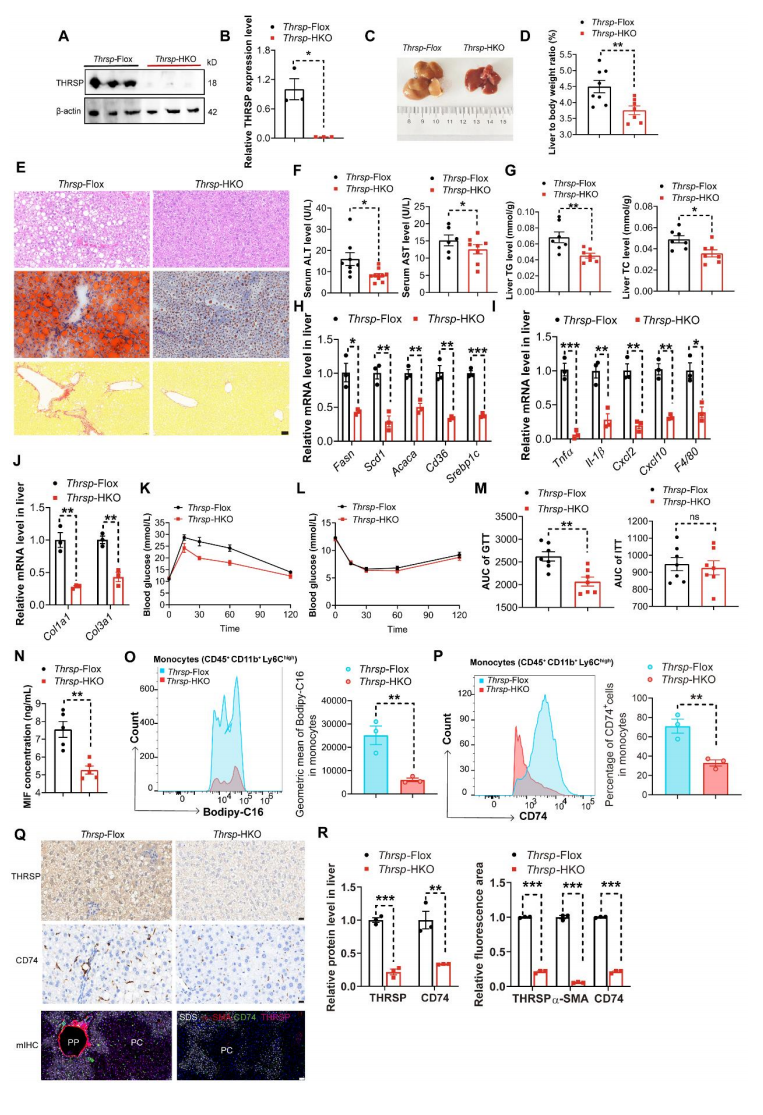
图7 Thrsp-HKO通过降低PA含量并抑制MIF介导的CD74+LAMs募集来改善MASH
Result 8 化合物C6改善小鼠WD饮食诱导的MASH
通过高通量虚拟筛选从71,100个小分子中鉴定出6个候选化合物(图8A),其中化合物C6显著降低了THRSP蛋白水平(图8B),且在AML12细胞中无细胞毒性(图8C)。分子对接分析揭示了C6与THRSP的特异性结合模式(图8D),CETSA和WB进一步验证了C6作为THRSP稳定配体的作用机制(图8E)。在WD诱导的MASH小鼠模型中,C6和Resmetirom(Res)治疗显著降低了THRSP蛋白水平(图8F),同时改善了糖代谢和脂代谢水平(图8G-I),降低了肝体重比和体重(图8J-K)。H&E/Sirius Red染色表明,C6和Res治疗显著缓解了脂肪变性、炎症和纤维化,并下调了肝组织中THRSP和CD74的表达水平(图8L)。值得注意的是,C6的疗效呈现剂量依赖性,特别是在改善体重、肝脏TC和胰岛素敏感性方面。安全性评估显示,C6治疗组血清ALT、AST和肌酐水平均正常,表明其具有良好的肝肾功能安全性(图8M)。综上所述,本研究首次证实THRSP作为MASH治疗靶点的潜力,并发现C6是一种高效、安全的THRSP抑制剂,为MASH治疗提供了新的候选药物。
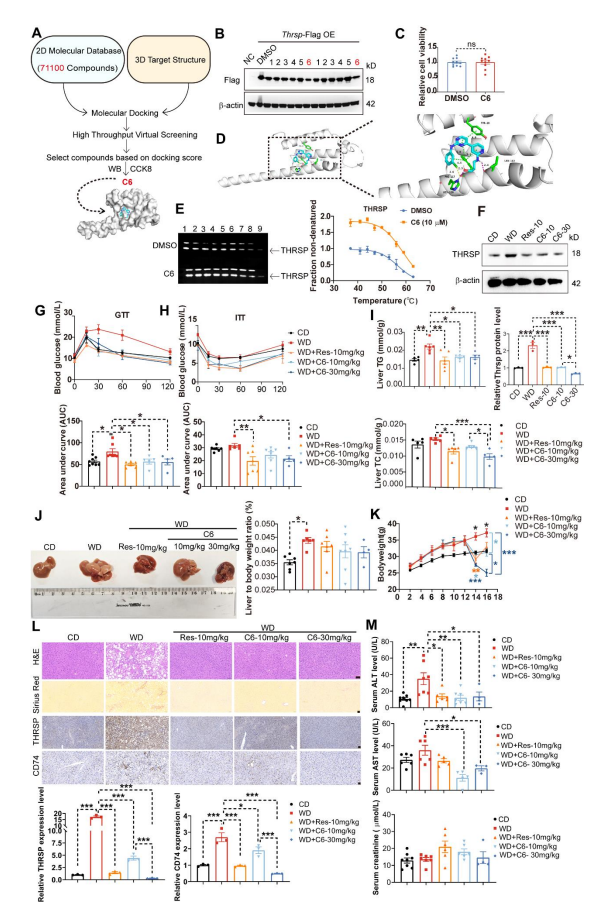
图8 化合物C6通过靶向THRSP显著改善MASH
本研究通过空间转录组、单核RNA测序及脂质组学技术,结合定制化饮食诱导的小鼠模型,系统解析了MAFL向MASH 进展中肝脏的空间异质性特征,并确定THRSP作为疾病进展的核心调控因子。研究发现THRSP通过PP区特异性机制驱动MASH进展,首次揭示PP区脂质生成肝细胞与LAMs的空间特异性互作是驱动MASH的关键病理基础。成功筛选出具有治疗潜力的新型THRSP抑制剂,为靶向干预提供候选化合物。本研究将THRSP确立为MASH治疗的新靶点,通过PA-MIF-CD74轴协调肝脏代谢-免疫串扰,其中肝细胞产生的PA促使MIF分泌,从而募集CD74+LAMs至PP区,为开发精准治疗方案提供了理论依据。
参考文献:DOI: 10.1097/HEP.0000000000001429