2025年7月16日,南京市妇幼保健院遗传医学中心胡平教授、许争峰教授、王艳主任和南京医科大学生殖医学与子代健康全国重点实验张军教授团队在Clinical and Translational Medicine(IF=6.8)上发表题为“From iPSCs to myotubes: Identifying potential biomarkers for human FSHD by single-cell transcriptomics”的研究论文。作者通过单细胞转录组分析患者来源iPSC分化的肌管模型,揭示了FSHD中DUX4基因异常表达的时空特异性及其下游靶基因网络,为疾病机制研究和治疗靶点开发提供了新见解。本项目由欧易生物提供单细胞转录组测序等服务内容。
发表期刊:Clinical and Translational Medicine
影响因子:6.8
涉及的欧易生物服务产品:10x Genomics单细胞测序
单细胞测序样本:由iPSCs分化得到的肌源性祖细胞和肌管细胞(第3天和第5天)
样本来源:
①2例FSHD1患者:26岁男性(4q35 D4Z4重复单元=4),6岁确诊女性(严重型,D4Z4重复单元=2)
②性别/年龄匹配的健康对照
面肩肱型肌营养不良症(FSHD)是一种常染色体显性遗传的神经肌肉疾病,主要分为FSHD1和FSHD2两种亚型。FSHD1占95%的病例,由4q35染色体上D4Z4大卫星重复序列的致病性缩短引起;而FSHD2则与染色质修饰基因(如SMCHD1、DNMT3B和LRIF1)的功能丧失突变相关。这两种亚型最终均导致D4Z4区域的低甲基化,解除对DUX4基因的表观遗传抑制,使其在成熟肌肉细胞中异常表达,进而引发肌细胞凋亡、炎症反应和肌肉退化。然而,DUX4的表达极低且短暂,加上活体肌肉活检的局限性,使得研究FSHD的病理机制面临重大挑战。
为解决这一问题,本研究利用患者来源的诱导多能干细胞(iPSCs)构建体外模型。iPSCs能够保留患者的遗传和表观遗传特征,并可分化为肌源性祖细胞和肌管细胞,从而模拟FSHD的病理过程。通过单细胞转录组测序(scRNA-seq)技术,研究人员深入分析了iPSC衍生的肌管细胞,旨在解析FSHD中肌分化的异常机制,并鉴定与DUX4相关的生物标志物。本研究不仅揭示了DUX4靶基因的异常激活,还建立了可靠的体外模型,为深入理解FSHD的发病机制和开发靶向治疗策略提供了重要工具。这一成果为未来探索精准医疗干预措施奠定了基础。
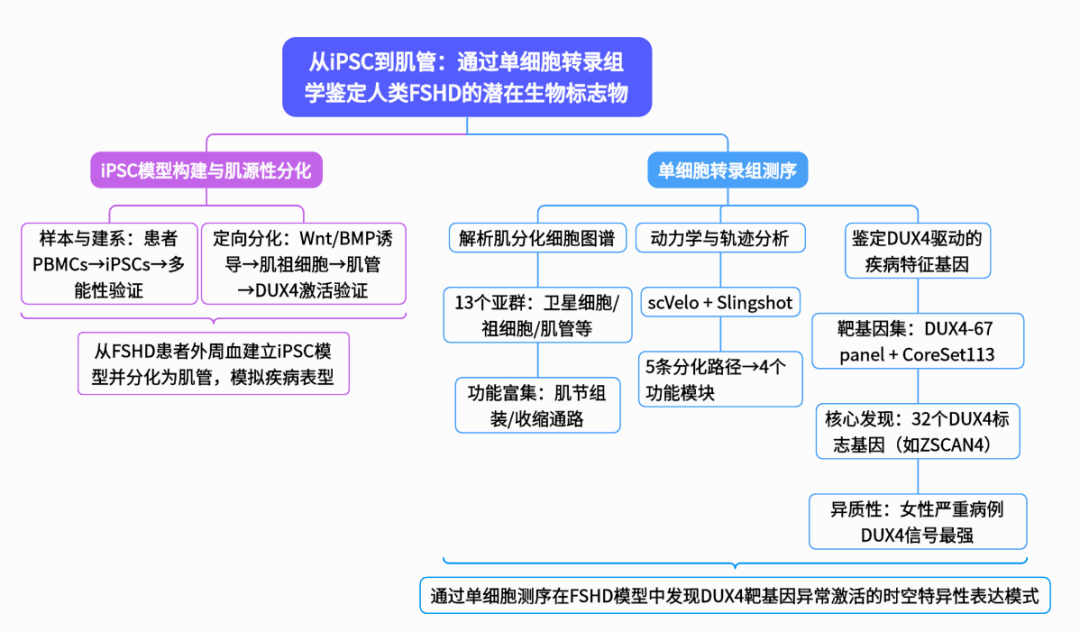
1.从诱导多能干细胞(iPSCs)到肌管细胞的体外分化过程及其在FSHD研究中的应用
首先,研究者通过仙台病毒载体将外周血单核细胞(PBMCs)重编程为iPSCs,并验证其多能性标志物OCT4和NANOG的表达(图1B)。随后,使用特定分化培养基将iPSCs分化为PAX7+/MYOD1+肌源性祖细胞(图1C),最终形成表达骨骼肌标志物MF20/α-actinin的多核肌管(图1D)。流式细胞术分析显示,FSHD1患者与健康对照组的肌源性祖细胞在CD82、CD56表达及肌管成熟度(MF20+)上无显著差异(图1E-G)。然而,qPCR检测证实FSHD1肌管中DUX4及其靶基因(MBD3L2、ZSCAN4、TRIM43)特异性上调(图1H-I),成功模拟了FSHD的关键病理特征。该实验体系为FSHD机制研究提供了可靠的体外模型。
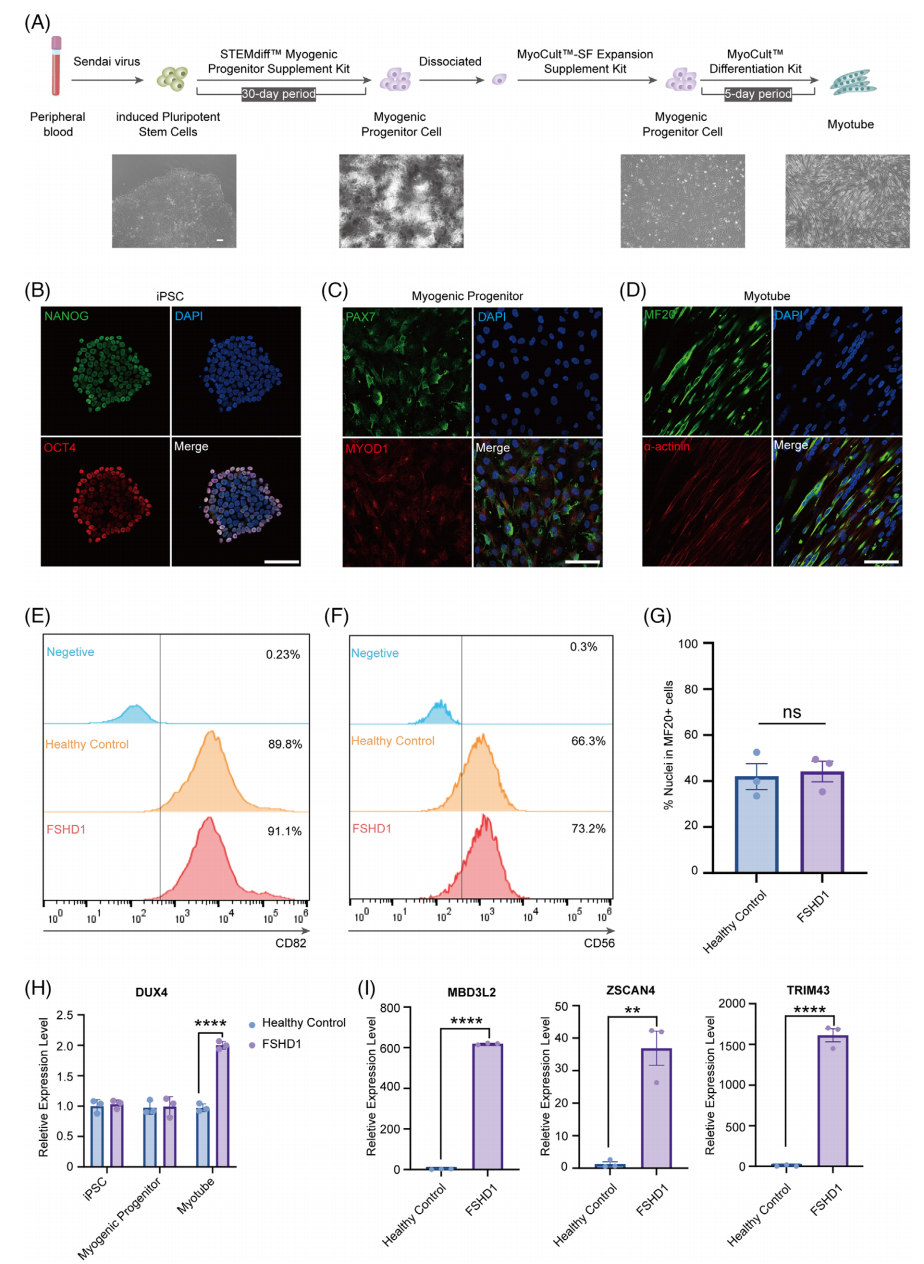
图1 诱导多能干细胞(iPSCs)在体外分化为肌源性祖细胞和肌管细胞
2.单细胞转录组测序全面解析iPSC分化到肌源性细胞过程中的细胞异质性和分子特征
研究对132,482个细胞(健康对照65,266个,FSHD1患者67,216个)进行分析,鉴定出13个主要细胞亚群(图2A),包括:肌肉卫星细胞(CDCP1+)、PAX3+/PAX7+肌源性祖细胞、增殖性祖细胞(MKI67+)、成肌细胞(MYOD1+/MYOG+)、含神经元细胞(ELAVL4+)以及三类肌管细胞亚型(MYH2+/MYH7+、MYMKhigh/MYMXhigh、MYMKlow/MYMXlow)。肌管细胞亚型表现出阶段特异性标志:MYH2/MYH7对应成熟肌管,而MYMK/MYMX动态变化反映肌管融合的不同阶段(图2B)。
GO分析揭示了各亚群的特异功能(图2C):肌肉卫星细胞和PAX3+祖细胞富集细胞黏附和ECM组织相关通路;增殖性祖细胞主要参与细胞周期调控;肌管群体则显著富集肌节组织和肌肉收缩等骨骼肌分化功能。值得注意的是,第11群表现出神经系统发育特征,这与既往报道中肌源性分化体系可能伴随神经细胞分化的现象一致。
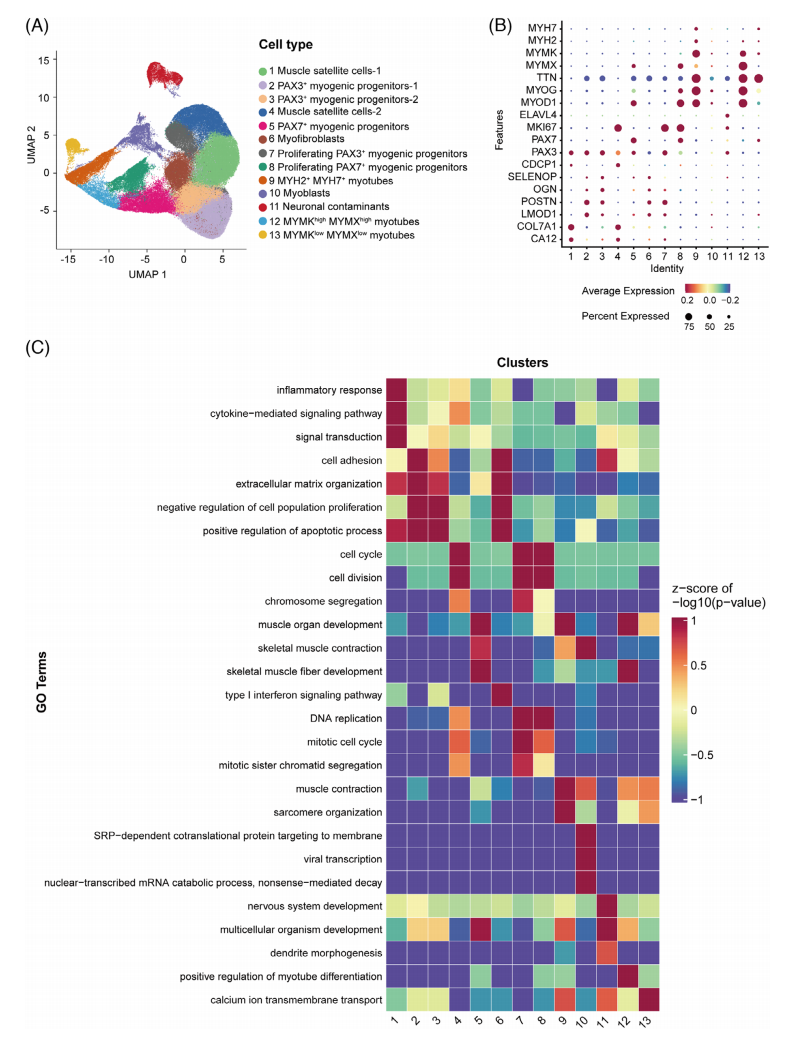
图2 单细胞转录组解析iPSC肌源性分化过程中的细胞异质性与功能特征
3.拟时序分析揭示iPSC肌源性分化的多轨迹调控网络及分子模块
整合RNA速率分析(scVelo)和轨迹推断算法(Slingshot),系统解析了iPSC衍生肌生成过程的动态调控机制。研究揭示了五个关键分化路径:①卫星细胞向PAX3+祖细胞转化;②PAX3+向PAX7+祖细胞扩增;③卫星细胞直接形成增殖性PAX3+祖细胞;④成肌细胞向肌管(D3)分化;⑤终末肌管(D5)成熟过程(图3A)。伪时间分析显示,该过程受有丝分裂驱动因子(FGFR4、CENPF、AURKA)和肌分化调控因子(ARPP21、TNNT1、BIN1)的阶段性调控。
Slingshot分析进一步识别出六条分化轨迹,其中曲线5最能代表肌生成进程(图3B)。通过Monocle伪时间排序,该轨迹被划分为三个生物学状态:早期(卫星细胞和PAX3+祖细胞)、过渡期(成肌细胞)和终末期(成熟肌管)(图3C)。基因共表达分析鉴定出四个核心模块(图3D-F):模块1(TTN、MYH7等)调控肌节组装;模块2(CNTNAP2、MYOCD等)参与肌管形态发生;模块3(SOX2等)表征多能性退出;模块4(MYL1、TNNC1等)介导收缩功能成熟。这些发现不仅绘制了体外肌分化的分子路线图,更为理解FSHD中肌成熟障碍提供了参照框架。
图3 iPSC肌分化的单细胞动力学轨迹
4.通过单细胞转录组深度解析FSHD患者肌管细胞中DUX4靶基因的异常激活模式
研究首先在67,216个FSHD1细胞中筛查67个已知DUX4生物标志物(DUX4-67 panel),发现仅6个细胞(来自女性FSHD患者肌管D3样本)达到DUX4活性阈值(≥5个标志物共表达)(图4A-B)。进一步分析显示,这些DUX4阳性细胞特异性高表达32个核心标志基因(如ZSCAN4、TRIM43等),与已报道的FSHD肌肉活检特征高度一致(图4C)。差异基因分析鉴定出36个FSHD差异表达基因,包括2个FSHD特异性基因(如MBD3L2)和34个差异表达核心基因集113(DiffExpr-CoreSet113)(图4C)。值得注意的是,DUX4信号呈现明显的患者异质性:携带严重等位基因(D4Z4重复单元≤2)的女性患者(FF2)表现出最强的DUX4靶基因激活,而男性患者(4个重复单元)和健康对照组均未检测到显著信号。这种差异可能与D4Z4收缩程度和性别特异性表观遗传调控相关。该发现不仅验证了iPSC模型重现FSHD分子特征的能力,更揭示了DUX4表达的时空特异性,为开发基于DUX4活性检测的精准治疗策略提供了关键依据。
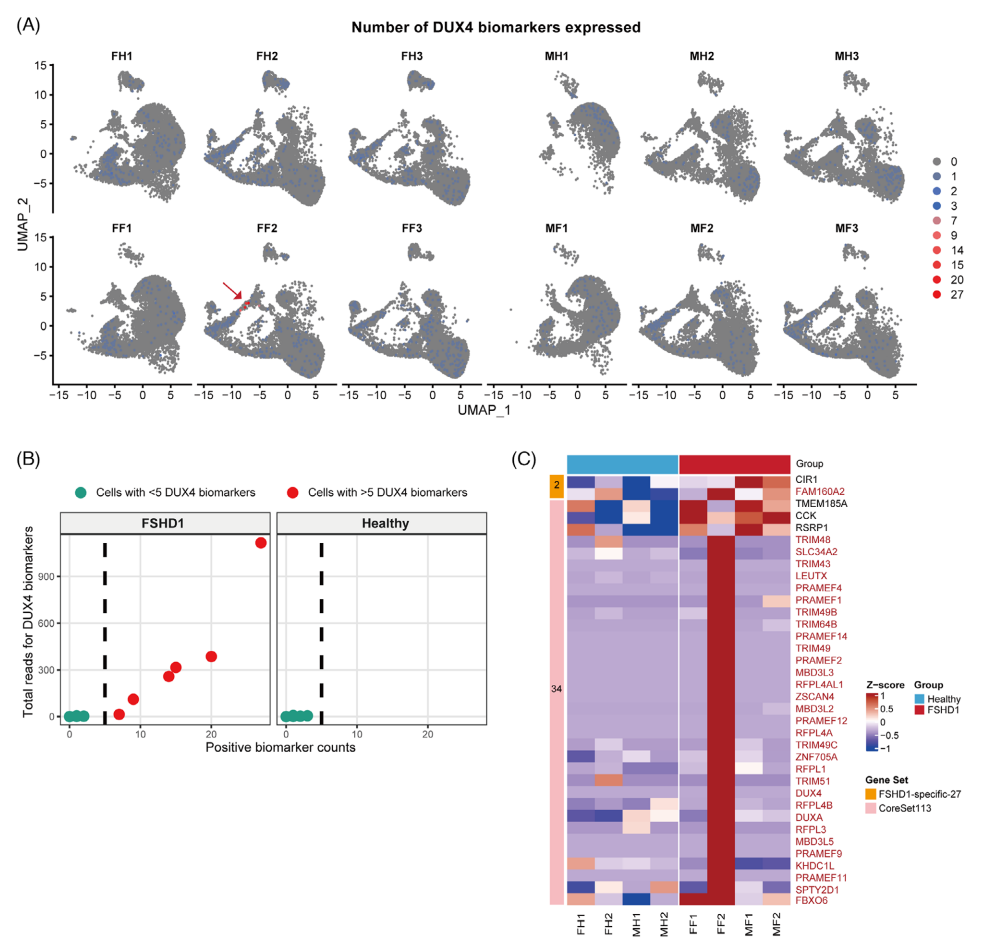
图4 单细胞转录组鉴定FSHD1肌管细胞中DUX4靶基因的异质性激活模式
本研究利用患者特异性iPSC构建肌管细胞模型,通过单细胞测序揭示了FSHD的关键致病机制。研究发现FSHD1肌管特异性高表达DUX4及其靶基因(MBD3L2/ZSCAN4/TRIM43),绘制出13个肌分化亚群的动态图谱,并鉴定出4个调控肌管成熟的功能模块。研究首次在单细胞水平发现DUX4激活具有时空特异性,且严重等位基因(D4Z4≤2)女性患者表现出最强的DUX4信号。这些发现不仅阐明了FSHD的分子机制,建立的iPSC模型和鉴定的32个DUX4标志基因也为疾病诊断和治疗提供了重要工具和靶点。该研究为开发靶向DUX4的治疗策略奠定了理论基础。
该研究由南京市妇幼保健院遗传医学中心胡平教授、许争峰教授、王艳主任和南京医科大学生殖医学与子代健康全国重点实验张军教授团队共同完成,南京市妇幼保健院遗传医学中心刘雯雯副研究员、南京医科大学硕士研究生陈昊和焦娇为论文共同第一作者。南京市妇幼保健院遗传医学中心张沁欣副研究员、梁栋副研究员、霍海芹、季修庆、黄明涛、吴思惠等人参与了该项目研究。南京市妇幼保健院医学研究中心侯晓静副研究员和曹彦副研究员对本研究工作的开展提供了重要帮助。
参考文献:doi: 10.1002/ctm2.70423






